Strategies for the Management of Spike Protein-Related Pathology https://doi.org/10.3390/microorganisms11051308 – https://www.mdpi.com/2076-2607/11/5/1308

Abstracto
A raíz de la crisis de la COVID-19, ha surgido la necesidad de prevenir y tratar dos afecciones relacionadas, la lesión por la inyección contra la COVID-19 y la COVID-19 prolongada, las cuales pueden rastrear al menos parte de su etiología hasta la proteína espiga (spike), que puede causar daño a través de varios mecanismos.
Un mecanismo significativo de daño es vascular, y está mediado por la proteína espiga o spike, un elemento común de la enfermedad COVID-19, y está relacionado con recibir una inyección COVID-19.
Dada la cantidad significativa de personas que experimentan estas dos afecciones relacionadas, es imperativo desarrollar protocolos de tratamiento, así como considerar la diversidad de personas que experimentan lesiones prolongadas por COVID-19 e inyecciones.
Esta revisión resume las opciones de tratamiento conocidas para la lesión por COVID-19 prolongado y por la inyección, sus mecanismos y su base probatoria.
Palabras clave: largo COVID ; lesión por vacuna COVID-19 ; proteína de espiga ; trombosis ; inflamación ; medicamento reutilizado ; autofagia; spike; prolongado
1. Introducción
Según los datos disponibles, al 30 de septiembre de 2022, el 68 % de la población mundial había recibido al menos una dosis de la inyección contra la COVID-19 y se habían administrado 12.740 millones de dosis [ 1 ] . Las inyecciones administradas con más frecuencia fueron Comirnaty (Pfizer/BioNTech), Covishield (Astrazeneca), CoronaVac (Sinovac), Spikevax (Moderna) y Jcovden (Johnson & Johnson) [2 ] .
De estos, aproximadamente el 30 % de las dosis producidas hasta el 22 de enero de 2022 tenían la forma de una nueva inyección con un ARNm pseudoiridinilado de N1-metil sintético encapsulado en una nanopartícula lipídica (LNP) [3 ] .
Los LNP son una nueva tecnología que no se usó en la administración de inyecciones hasta la autorización de uso de emergencia (EUA) de las inyecciones Pfizer/BioNTech BNT162b2 y Moderna mRNA-1273 COVID-19 [ 4 ] . Esto tampoco tuvo precedentes en el proceso de aprobación, siendo el más rápido para cualquier inyección génica o vacuna [ 5 ], dejando muchas preocupaciones con respecto a la seguridad a largo plazo [ 6 ], que fue difícil de evaluar debido a que los ensayos clínicos iniciales no fueron enmascarados [ 7 ] .
Si bien la tecnología de administración de LNP se ha utilizado anteriormente para administrar moléculas pequeñas, solo recientemente se ha utilizado para administrar ARN. Los LNP son ventajosos para dirigirse al tejido cerebral, ya que pueden cruzar la barrera hematoencefálica (BBB) [ 8 , 9 ].
El primer fármaco utilizado y LNP para administrar ARN fue un pequeño fármaco basado en ARN de interferencia (siRNA), conocido como Onpattro (Alnylam Pharmaceuticals), aprobado por primera vez en 2018 para el tratamiento de polineuropatías [10 ] .
Dada la novedad de la tecnología y la escasez de datos en los que se basó la aprobación (que también estaba sujeta a problemas de integridad de datos [ 11 ] ), no se pueden descartar definitivamente los efectos a largo plazo, especialmente porque muchas de las afirmaciones fundamentales en las que se basan la aprobación en la que se basó ha sido impugnada por experimentos recientes [ 12 , 13 , 14 ].
Por ejemplo, en contraste con las afirmaciones de que la inyección permaneció en el lugar de la inyección [ 15 ], y que la proteína espiga solo se expresaría durante un corto período de tiempo (basado en la labilidad del ARN no pseudouridilado [ 16 ]), el contenido y los productos de las inyecciones COVID-19 se han encontrado en el torrente sanguíneo de la mayoría de los vacunados estudiados en cuestión de horas o días [12].
La primera afirmación se basó en la administración intramuscular [ 15 ], y la segunda afirmación se basó en la labilidad del ARN [ 17 ], con una vida media típica del ARN de minutos [ 18 ]; sin embargo, los estudios de biodistribución han encontrado una expresión significativa de picos en otros tejidos y órganos [ 12 ], y los investigadores han encontrado tanto el ARNm de la vacuna como la proteína pico o spike (que está codificada por la secuencia de la inyección) dos meses después de la administración [ 14 ], e incluso más. a cuatro meses después de la vacunación [ 13 ].
Un estudio preliminar de personas con SARS-CoV-2 negativo después de la vacunación. Los síntomas largos similares a los de COVID-19 mostraron una persistencia de la proteína pico o spike, en promedio, 105 días después de la vacunación [ 19].
Los pacientes con COVID-19 prolongado (después de la infección por SARS-CoV-2) muestran una persistencia de la proteína pico de hasta 15 meses [ 20 ]. Otro estudio mostró la persistencia de la proteína pico en el intestino de pacientes con COVID-19 de larga duración, pero no en el torrente sanguíneo.
Las proteínas espiga, pico o spike se pueden empaquetar en exosomas [ 13 ], lo que posiblemente provoque inflamación y activación inmunitaria [ 21 , 22 ] en órganos y tejidos distantes del lugar de la inyección [ 13 ]. Las vesículas extracelulares son capaces de cruzar la barrera hematoencefálica [ 23 ], y las LNP, así como los exosomas, se intercambiarán más fácilmente en vasos de pequeño diámetro con caudales bajos (es decir, capilares y vasos pequeños) [24 ] .
Es importante destacar que la proteína espiga parece tener un impacto adicional en la permeabilidad de la barrera hematoencefálica [ 25 , 26 ].
Estos resultados desafían el fundamento mecanicista inicial del que depende la presunción de seguridad. En comparación con otras vacunas, las inyecciones contra la COVID-19 tienen una tasa de eventos adversos mucho mayor [ 27 ].
Los hallazgos histopatológicos y las autopsias de los que mueren después de la vacunación respaldan el papel causal de la inyección en las muertes [ 28 ], más comúnmente por eventos relacionados con el sistema vascular.
Los programas de farmacovigilancia en varios países han observado una señal de seguridad para la miocarditis en la población vacunada contra el COVID-19 [ 29 , 30 , 31 ].
Una encuesta en EE. UU. encontró que el 19 % de los casos de miocarditis no se habían recuperado a los 90 días después del inicio [ 32]. Además, la evaluación de los niños de 13 a 18 años que recibieron la inyección BNT162b2 en un estudio tailandés reveló que el 2,3 % de los niños tenían al menos un biomarcador cardíaco elevado o una evaluación de laboratorio positiva, y el 29 % tenía al menos una manifestación cardíaca, como taquicardia , palpitaciones o miopericarditis [ 33 ].
Dada esta información, y dado el uso ubicuo de las inyecciones contra la COVID-19, es posible que exista un daño subclínico generalizado en la población vacunada contra la COVID-19. Estructuralmente, la proteína espiga o spike, particularmente el dominio de unión al receptor (RBD) de la subunidad S1, ha atraído mucha atención, ya que es el aspecto más prominente de la cápside viral [34] .] (Consiste en glicoproteínas de espiga (S) y nucleocápside (N)).
La entrada celular está mediada por la unión de Spike RBD a la enzima convertidora de angiotensina II (ACE2) [ 35 ]. Por lo tanto, al evitar esta unión a través de la inhibición alostérica, es posible evitar la entrada de viriones de SARS-CoV-2 en la célula y la posterior infección [ 36 ].
Se ha empleado una estrategia para inhibir la unión de S1 RBD a ACE2 en el desarrollo de vacunas contra el SARS-CoV-2 [ 37 ]. Las inyecciones de ARNm codifican exclusivamente proteínas pico o spike, y la orientación monoantigénica puede crear oportunidades para el escape inmunológico por variantes [ 38 ], dado que las inyecciones de ARNm no detienen la transmisión [ 39 ].
La presión de selección positiva se observa en los residuos de la proteína pico debido a la vacunación generalizada, aunque estos no pueden relacionarse causalmente de forma definitiva [ 40 , 41 ].
Este artículo se propone describir primero los mecanismos de la patología relacionada con la proteína espiga o spike y los factores que los afectan (por ejemplo, las características del paciente) y sus biomarcadores y diagnósticos relevantes.
El objetivo, entonces, es introducir terapias prometedoras, basadas en evidencia mecanicista o clínica, y resumir la base de evidencia para cada intervención, para que los médicos y científicos puedan guiarse en el desarrollo terapéutico.
Otros artículos cubren la fisiopatología de la COVID-19 prolongada, además de proporcionar una lista de terapias bajo investigación [ 42 ], y una revisión reciente describe las similitudes entre la COVID-19 prolongada y la lesión por inyección contra la COVID-19 [ 43].
Esta revisión es única porque proporciona una discusión integrada del mecanismo de la enfermedad tanto para el síndrome de vacunación post-COVID-19 como para el COVID-19 prolongado, que son difíciles de distinguir en muchos casos, y resume las modalidades de tratamiento disponibles para quienes experimentan síntomas.
2. Métodos
Esta revisión comienza resumiendo los mecanismos de daño de la proteína espiga o spike, ya sea por la enfermedad de COVID-19 o por la vacunación contra el COVID-19. También cubrimos los aspectos clínicos, que pueden afectar el curso de la enfermedad. Luego, la revisión pasa a los mecanismos terapéuticos, que pueden abordar la proteína espiga a través de diferentes vías.
Para las intervenciones terapéuticas para estas condiciones (COVID-19 prolongado y lesión por inyección) con un mecanismo de acción plausible contra la proteína pico, se muestran en la sección de resultados. Se agregan los ensayos clínicos relevantes, y en la columna de la derecha se incluye cualquier evidencia directa o indirecta de la eficacia (como la eficacia contra la enfermedad original de COVID-19).
Además, incluimos ensayos clínicos sobre lesiones prolongadas por COVID-19 y inyecciones en la Tabla S1 . Una búsqueda de ensayos clínicos para la afección «Largo COVID O Largo COVID-19» en ClinicalTrials.gov reveló 317 estudios.
Una búsqueda de ensayos clínicos sobre eventos adversos de la inyección reveló que un estudio usó rutina y jugo de mora rico en glucósidos para reducir los eventos adversos de la inyección de C19 [ 44 ].
Otros estudios, aunque no tratan específicamente la respuesta inmunitaria, administran la terapia junto con la vacunación para observar los cambios en la respuesta. Estos incluyen:
- espermidina [ 45 ],
- probióticos [ 46 ],
- un suplemento a base de levadura rico en selenio y zinc [ 47 ],
- ésteres de estanoles vegetales [ 48],
- champiñones [ 49 ],
- ejercicios del músculo deltoides (para el dolor en el sitio) [ 50 ],
- tratamiento de manipulación osteopática [ 51 , 52 ],
- metformina [ 53 ],
- hierro [ 54 ],
- ergoferón [ 55 ],
- dieta cetogénica [ 56 ] y
- inmunosupresores [ 57 , 58 ].
Es una tarea difícil evaluar la base probatoria para cada tipo de intervención, ya que se han realizado pocos metanálisis. Por ejemplo, una búsqueda en la Biblioteca de la Colaboración Cochrane para «Post Acute COVID-19» produce una revisión relevante sobre cómo remediar la disfunción olfativa, y encuentra evidencia limitada sobre la utilidad de las terapias propuestas [59 ] .
Además, existen 46 estudios completados relevantes para el término de búsqueda «Largo COVID» en ClinicalTrials.gov (8 de enero de 2023). Dado que existen pocas revisiones sistemáticas, nuestro objetivo es resumir la base probatoria de las intervenciones conocidas actualmente en ensayos clínicos para el tratamiento de lesiones prolongadas por COVID-19 y inyecciones contra COVID-19 que se muestran en la Tabla S1. Se pudo encontrar una sola revisión sobre el tratamiento de la lesión por la vacuna COVID-19, que se incluye en la Tabla S1 .
3. Fisiopatología
3.1. Mecanismos de daño
Como se mencionó anteriormente, aunque se esperaba que los ARNm sintéticos encapsulados en LNP permanecerían en el sitio de inyección y se degradarían rápidamente, existe evidencia sustancial de que ingresan al torrente sanguíneo [ 60 ], se depositan en otros tejidos [ 61 ] e incluso en el leche materna de madres lactantes [ 62 ].
La subunidad S1 de la proteína espiga o spike puede dañar el revestimiento endotelial de los vasos sanguíneos [ 63 , 64 , 65 ]. Las partículas de la vacuna en el torrente sanguíneo pueden causar una respuesta inflamatoria significativa en los vasos sanguíneos [ 66 ].
Existen varias hipótesis sobre los mecanismos de la larga duración de la COVID-19, incluida la desregulación inmunitaria, la autoinmunidad, la disfunción endotelial, la activación de la coagulación y la persistencia viral latente [ 67 , 68 ] , aunque esta revisión se centra en los elementos comunes a la COVID-19 Infección y lesiones por inyecciones.
Las complicaciones cardiovasculares, en particular la formación de microtrombos, se presentan tanto en las etiologías de la COVID-19 prolongada [ 69 , 70 ] como en la lesión por la inyección COVID-19 [ 71 ].La proteína de punta o spike del SARS-CoV-2 (producida por infección o inyección ) puede unirse al receptor ACE2 en las plaquetas, lo que lleva a su activación [ 72 ], y puede causar coágulos de sangre resistentes al fibrinógeno [ 73 ].
Los fragmentos de proteína Spike también pueden ser amiloidogénicos por sí solos [ 74 ]. Varios informes demuestran niveles elevados de troponina en los síntomas cardíacos después de la inyección COVID-19 [ 75 ].
Ontológicamente, tanto la infección como la vacunación expresan la proteína espiga, aunque existen algunas diferencias sutiles entre la proteína espiga generada por la inyección y la generada por la infección.
Es importante señalar que la proteína espiga codificada por las vacunas es estática y no evoluciona, mientras que la proteína espiga producida por la infección evoluciona a medida que evoluciona el virus [ 76 , 77 ].
Hay una excepción a esto, y es cuando se actualiza la inyección, como ocurre con los refuerzos bivalentes de Pfizer y Moderna, que expresan la proteína espiga tanto del sublinaje B.1.1.529 (omicron) BA.5 como del cepa ancestral WA1/2020 [ 78].
La otra distinción importante entre la proteina pico de la vacuna y la proteina pico de la infección es el estado de prefusión estabilizado en la proteina pico de la inyección, lo que da como resultado una mayor afinidad de unión a ACE2 en comparación con las proteínas del pico generadas a través de la infección por SARS-CoV-2 [79 ] .
La diferencia entre la proteína pico del SARS-CoV-2 circulante (en la población) y la proteína pico (ya sea generada por la inyección o la infección) de la impronta inmunitaria inicial tiene implicaciones importantes para el escape inmunitario [ 77 , 80 ] y el daño mediado por el sistema inmunitario [ 81 ].
El escape inmunológico se demuestra en estudios de población que muestran una disminución de la eficacia de la inyección [ 82 ]. En 2021, una investigación exhaustiva reveló alteraciones fisiopatológicas consistentes después de la vacunación con inyecciones COVID-19, incluidas alteraciones de la expresión génica de las células inmunitarias [ 83 ].
3.2. Observaciones Clínicas
Aunque no existe una definición oficial para el «síndrome posterior a la inyección COVID-19», una correlación temporal entre recibir una inyección COVID-19 y el comienzo o el empeoramiento de las manifestaciones clínicas de un paciente es suficiente para hacer el diagnóstico de una inyección COVID-19. lesión inducida cuando los síntomas no se explican por otras causas concurrentes.
Sin embargo, se debe reconocer que existe una superposición significativa entre los síntomas y las características del síndrome prolongado de COVID-19 [ 84 ] y el síndrome posterior a la inyección COVID-19 [ 85 ].
Sin embargo, una serie de características clínicas parecen ser distintivas del síndrome de la inyección post-COVID-19; en particular, los síntomas neurológicos graves (en particular, la neuropatía de fibras pequeñas) parecen ser más comunes después de la vacunación [ 86 ,87 , 88 ].
Para complicar aún más las cosas, los pacientes con COVID-19 prolongado a menudo se vacunan [ 89 ], lo que dificulta la cuestión de la definición. Desafortunadamente, solo el examen post mortem hasta la fecha puede demostrar una relación causal cuando los tejidos dañados demuestran la presencia de proteína pico y ausencia de proteína de nucleocápside (solo SARS-CoV-2) [ 90 ] .
Se desconoce la verdadera magnitud del síndrome posterior a la inyección COVID-19, ya que los datos se limitan a ensayos clínicos de corta duración. De una encuesta de personas vacunadas, aproximadamente el 1 % requirió atención médica inmediatamente después de la vacunación [ 91 ].
Un estudio de cohorte a nivel nacional de veteranos de EE. UU. informó reacciones adversas en el 8,5 % de los que recibieron la inyección de Pfizer y en el 7,9 % de los que recibieron la inyección de Moderna [ 92 ]. Varios factores están asociados con un mayor riesgo de eventos adversos; éstas incluyen:
- Genética: los familiares de primer grado de las personas que han sufrido una lesión por inyección parecen tener un riesgo muy alto de sufrir una lesión por vacuna. Las personas con una mutación del gen de la metilentetrahidrofolato reductasa (MTHFR) [ 93 ] y aquellas con síndromes de tipo Ehlers-Danlos pueden tener un mayor riesgo de lesión. El aumento de los niveles de homocisteína se ha relacionado con peores resultados en pacientes con COVID-19 [ 94 , 95 ]. El aumento de los niveles de homocisteína puede potenciar la lesión microvascular y las complicaciones trombóticas asociadas con la lesión de la vacuna relacionada con la proteína espiga [ 96 , 97 ].
- Carga de ARNm y cantidad de proteína pico producida: esto puede estar relacionado con lotes de inyección específicos que contienen una concentración más alta de ARNm debido a las variaciones en la calidad de fabricación, así como a la heterogeneidad dentro del vial [ 98 ] .
- Tipo y lote de inyección: se observaron variaciones en los niveles de reacciones adversas, según el fabricante de la inyecciones [ 91 ].
- Número de inyecciones administradas: el riesgo de aumento de anticuerpos (ADE) aumenta con cada exposición al virus o una inyección. También se observó una correlación inversa negativa de las dosis administradas, así como de la eficacia [ 99 ].
- Sexo: la mayoría de las personas lesionadas por inyecciones son mujeres [ 100 ], e históricamente las inyecciones tienen efectos específicos del sexo [ 101 ].
- Estado nutricional subyacente y comorbilidades: ciertas condiciones preexistentes probablemente hayan preparado al sistema inmunitario para que sea más reactivo después de la vacunación [ 102 ]. Esto incluye a aquellos con trastornos autoinmunitarios preexistentes [ 103 ].
4. Intervenciones terapéuticas
Existen varios medios no específicos para contrarrestar los efectos de la lesión prolongada por la inyección COVID-19 y posterior a la COVID-19. Estos incluyen apoyo nutricional para la regulación inmunitaria general y para la salud en general [ 104 ], así como terapias más específicas específicas de proteínas de punta.
Las fracciones terapéuticas no específicas incluyen la optimización nutricional, ya que las patologías relacionadas con la dieta, como la obesidad [ 105 ] y la diabetes tipo 2 [ 106 ], se asociaron con peores resultados de la infección por COVID-19.
Además, la glucemia alta facilita varios pasos del ciclo de vida viral y la progresión de la infección [ 107 ], lo que motiva la reducción de la ingesta de azúcar y carbohidratos refinados, que están asociados con aumentos en el azúcar en la sangre.
Además, la adopción de una dieta basada en plantas sin procesar se asocia con una disminución del estrés oxidativo y la inflamación [ 108] y mejores condiciones cardiovasculares.
Estos impactos positivos se atribuyen a sus perfiles de nutrientes, que consisten en antioxidantes, vitaminas, minerales y compuestos fenólicos que contienen fitoquímicos, que pueden ejercer efectos antioxidantes, antiinflamatorios y otros efectos beneficiosos [ 109 , 110 ] .
La microbiota desempeña un papel fundamental en la inducción, el entrenamiento y la función del sistema inmunitario del huésped y, por lo tanto, da forma a las respuestas a sus desafíos [ 111 ].
La composición del microbioma intestinal se alteró significativamente en pacientes con COVID-19 en comparación con personas sin COVID-19, independientemente de si los pacientes habían recibido medicación [ 112].
Los investigadores dijeron que los pacientes con enfermedades graves presentan niveles elevados de citoquinas inflamatorias y marcadores inflamatorios en el plasma sanguíneo. Además, dada la composición alterada de la microbiota intestinal en sujetos infectados con SARS-CoV-2, existe una participación sustancial del tracto GI durante la infección.
Estos resultados sugieren que la composición de la microbiota intestinal está asociada con la magnitud de la respuesta inmune al COVID-19 y el daño tisular subsiguiente y, por lo tanto, podría desempeñar un papel en la regulación de la gravedad de la enfermedad.
Los científicos también descubrieron que, debido a que un pequeño subconjunto de pacientes mostró disbiosis o desequilibrio de la microbiota intestinal, incluso 30 días después de la recuperación, esto podría ser una posible explicación de por qué algunos síntomas persisten durante un período prolongado de COVID-19 [ 113 ] .
Dada la compleja influencia de la microbiota intestinal (GM) en los efectores inmunitarios del huésped y el perfil inflamatorio posterior, la composición y la función de los GM podrían contribuir a explicar la resiliencia/fragilidad individual con respecto al COVID-19 y/o la respuesta a los tratamientos (inyecciones), que merecen más investigación [ 114 ].
La diversidad microbiana se puede mejorar consumiendo muchos prebióticos y probióticos, como el chucrut y el kimchi.
El diseño y el descubrimiento de los inhibidores de la proteína espiga han seguido un proceso típico de reutilización de fármacos. Dada la similitud estructural de la proteína del pico del SARS-CoV-2 con otros coronavirus [ 115 , 116 ], los compuestos que funcionan para estos podrían potencialmente reutilizarse para la inhibición del pico del SARS-CoV-2.
Por lo general, una vez que se ha identificado un posible compuesto para su reutilización, se prueba mediante un ensayo de unión a ligandos (LBA) [ 117 ]. Estos ensayos pueden proporcionar información sobre la cinética y la afinidad de unión, así como sobre las estequiometrías de unión e incluso sobre los efectos cooperativos [ 117 ].
El siguiente nivel de verificación puede ser un ensayo in vitro para la inhibición viral en cultivo celular, donde las células se infectan con un virus y los niveles virales o el título (concentración) se miden contando las placas virales [ 118 ] o midiendo el ácido nucleico viral ( NA ) niveles [ 119 ].
Las células de control se comparan con las células tratadas. Aunque el enfoque tiene limitaciones, al no considerar la dinámica de todo el cuerpo de un virus [ 120 ], puede servir como un punto de partida útil.
Los estudios in vivo son un nivel más de verificación, que muestran el impacto de la intervención en un modelo animal. Más allá de los estudios in vivo, existen estudios clínicos, que suelen ser de dos tipos de diseño: ensayos observacionales y de control aleatorio (ECA) [ 121 ].
Hasta la fecha, las autoridades de salud han brindado poca o ninguna orientación sobre cómo manejar las enfermedades relacionadas con la proteína espiga, dejando el desarrollo en manos de científicos y médicos independientes.
Con respecto al síndrome de trombocitopenia trombótica (TTS) inducido por la inyección COVID-19, una revisión de 2021 hizo sugerencias sobre el manejo, incluida la inmunoglobulina intravenosa, los anticoagulantes y el intercambio de plasma en casos graves [ 122 ] .
Estos compuestos son suplementos nutricionales y productos naturales, con algunos fármacos reutilizados ( Cuadro 1 y Cuadro 2 ). Esta lista señala la evidencia disponible sobre cada terapia y la presenta para una mayor investigación.
Las siguientes terapias funcionan a través de diferentes mecanismos, pero nos enfocamos principalmente en aquellas proteínas que se unen directamente con la proteína espiga para mejorar la eliminación.
Aquí, resumimos estudios con diferentes niveles de evidencia para sus respectivas eficacias, desde predicciones in silico, que pueden basarse en predicciones vinculantes o asociaciones biológicas de sistemas, hasta aquellos que muestran actividad en un ensayo in vitro o libre de células, estudios in vivo, y cualquier evidencia clínica o epidemiológica.
Dadas las muchas incertidumbres en torno a la duración de la producción de proteínas pico y las variables que determinan la producción, parece sensato adoptar un enfoque preventivo, siempre que las intervenciones propuestas sean seguras.
Aún se desconoce si es posible la recuperación total de la lesión por inyección COVID-19. Sin embargo, sugerimos enfocarse en varios procesos diferentes para reducir los síntomas asociados tanto con la lesión por vacuna como con el COVID-19 prolongado. Éstas incluyen:
- (1) Establecer un microbioma saludable
- (2) Inhibir la escisión y la unión de proteínas de punta (detener el daño continuo)
- (3) Limpiar la proteína de pico del cuerpo (limpiar los agentes dañinos)
- (4)Curar el daño causado por la proteína espiga (restaurar la homeostasis y estimular el sistema inmunológico)
Estas categorías no están claramente separadas, ya que los compuestos que se unen a la espiga pueden inactivarla al evitar que se una a ACE2, así como ayudar a eliminarla. Hay muchas vías biológicas a través de las cuales puede ocurrir un efecto dado.
Para inhibir los efectos nocivos de la proteína espiga, es posible atacar la escisión de la furina, ya sea uniéndose directamente al sitio de escisión de la furina [ 123 , 124 , 125 ] o interfiriendo con la reacción de la serina proteasa [ 126 , 127 , 128 ] para bloquear la interacción uniéndose a ACE2 [ 129 ], regulando a la baja la expresión de ACE2 [ 130 ], inhibiendo la transición a la conformación activa de la proteína S [131 ], o unirse al RBD de la proteína de punta e inhibir alostéricamente la interacción con ACE2 [ 132 ] ( Figura 1 ). La eliminación de las proteínas de pico también se puede lograr aumentando la autofagia, que elimina las proteínas y recicla sus aminoácidos [ 133 ].
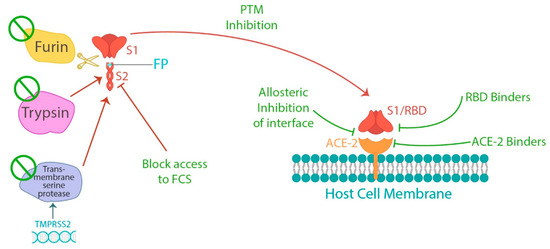
Figura 1. El proceso de escisión de la proteína espiga en las subunidades S1 y S2 y la posterior unión del dominio de unión al receptor (RBD) de S1 al receptor de la enzima convertidora de angiotensión 2 (ACE2) en las células huésped. Cada uno de los diferentes subprocesos presenta oportunidades para la interferencia en la unión de la espiga a ACE2, así como un medio potencial para tratar la patología relacionada con la proteína espiga.
4.1. Establecer un microbioma saludable
El estado del microbioma es un criterio esencial para la progresión de la infección aguda por COVID-19, la COVID-19 prolongada y el síndrome posvacunal [ 134 , 135 , 136 , 137 , 138 ] . Los pacientes con síndrome posvacunal suelen tener una disbiosis grave con pérdida de Bifidobacterium [ 139 , 140 , 141 ].
Una dieta basada en plantas sin procesar puede mejorar los resultados en COVID-19 [ 142 , 143 , 144 ], y las personas que siguen dietas basadas en plantas, en promedio, experimentaron síntomas menos graves de COVID-19 [ 145 ].
Las fuentes dietéticas de probióticos incluyen lácteos fermentados [ 146], semillas de chía [ 147 ], glucomanano [ 148 , 149 ] y suplementos [ 150 ].La diversidad y la riqueza del microbioma se pueden mejorar a través de una dieta rica en fibra prebiótica y probióticos, particularmente alimentos fermentados, que posteriormente pueden reducir la inflamación [ 151 ].
4.2. Prevención del daño de la proteína Spike
Inhibición de la escisión de la proteína Spike
El sitio de escisión de furina en el SARS-CoV-2 se ha sugerido como una razón de su mayor infectividad en relación con el SARS-CoV [ 152 ], que tenía una tasa de mortalidad más alta, que era mucho menos infecciosa [ 153 ]. La escisión de la proteína espiga de longitud completa en las subunidades S1 y S2 es esencial para la entrada del SARS-CoV-2 en las células pulmonares humanas [ 126 , 154 , 155 , 156 ].
El pico de longitud completa está presente tanto en la infección por SARS-CoV-2 como en la vacunación, y es la única proteína común a la infección y vacunación por SARS-CoV-2 (es la única proteína presente en la vacunación) [ 157 ] .
La proteina pico producida por la inyección tiene una diferencia importante en comparación con la spike del SARS-CoV-2: la inclusión de dos mutaciones de prolina para estabilizar el estado previo a la fusión de la proteína pico.
Estos están relacionados con BNT162b2 de Pfizer [ 158 ], mRNA-1273 de Moderna [ 159 ], Ad26.COV2.S de Johnson & Johnson [ 160 ] y NVAX-CoV2373 de NovaVax [ 161 ].
Esto se descubrió por primera vez en el contexto de MERS [ 162 ]. Aparentemente, otras vacunas codifican la proteína espiga de tipo salvaje de longitud completa, incluidas ChAdOx1 de AstraZeneca [ 163 ] y CoronaVac de SinoVac [ 164 ].
Estas mutaciones duales de prolina que aparecen en las inyecciones de ARNm estabilizan el estado previo a la fusión, aunque todavía se produce cierta escisión [ 162 , 165 , 166 ] y, curiosamente, las mutaciones producen un producto de escisión desconocido de 40 kDa, donde los productos de escisión típicos para el la proteína espiga de tipo salvaje es de 80 kDa [ 166 ].
Como tal, es probable que apuntar a la escisión de la proteína espiga marque la diferencia en la COVID prolongada, así como en el daño de la vacuna de las vacunas que codifican la proteína espiga de tipo salvaje de longitud completa (AstraZeneca, SinoVac y otras), aunque esto puede tener menos de un impacto en las vacunas que codifican la proteína espiga estabilizada antes de la fusión (Pfizer, Moderna, Johnson & Johnson, NovaVax y otras).En particular, la escisión dirigida también se ha identificado como una modalidad terapéutica en el contexto de la COVID-19 aguda [ 167 , 168 ], que puede tener lugar a través de al menos tres vías distintas: escisión por furina, tripsina o serina proteasa transmembrana [ 167 , 168 , 169 ].
4.3. Inhibición de la unión a proteínas de pico
Uno de los mecanismos terapéuticos más directos es buscar compuestos que interrumpan la interfaz ACE2/Spike, ya sea uniendo ACE2 o Spike de forma aislada, o interrumpiendo la propia interfaz. Este problema es estérico y conformacional, para el cual la predicción computacional utilizando modelos estructurales es altamente susceptible.
Se han realizado muchos estudios computacionales de la proteína espiga y los compuestos de unión a ACE2, y algunos de estos éxitos se han desarrollado aún más a través de LBA, estudios in vitro, estudios in vivo en modelos animales y, por último, ensayos clínicos con sujetos humanos.
Pocos de los compuestos alcanzan la etapa final, aunque se han investigado varios con este mecanismo de acción. Los más prometedores fueron la ivermectina y la quercetina, ya que la predicción computacional mostró que se unen al pico.
De manera similar, los compuestos que se unen al receptor ACE2 también pueden competir de forma antagonista con la proteína espiga por un número limitado de sitios receptores. Por ejemplo, el medicamento para la diabetes metformina ha sido identificado como un posible agente terapéutico prolongado para la COVID-19 debido a este mecanismo de acción. La disminución del nivel de pico que se une activamente a ACE2 tiene implicaciones terapéuticas.
4.4. Proteína de pico de limpieza
Hasta ahora, hemos discutido formas de inhibir los impactos de la proteína espiga en el sistema del huésped. Es importante destacar que, para progresar más allá de esto, es necesario eliminar la proteína de pico. Esto se puede lograr a través de la regulación positiva de las vías de degradación de proteínas en el cuerpo a través de la regulación positiva de la autofagia. La autofagia se puede regular positivamente mediante el ayuno [ 170 ] y la restricción calórica [ 171 ], especialmente si se reducen las proteínas [ 172 ].
La autofagia en muchos casos no requiere el cese completo de la ingesta de alimentos (los protocolos están disponibles en https://COVID19criticalcare.com/treatment-protocols/ , consultado el 15 de abril de 2023).
La disminución drástica de la ingesta de proteínas puede regular al alza las vías de autofagia [ 173], y esto se puede lograr sin dejar de comer, lo que lo hace más accesible como protocolo.
El ayuno regular también se asoció con mejores resultados de la COVID-19 aguda [ 174 ].
La espermidina, un compuesto de polianión que se encuentra en altas concentraciones en el germen de trigo [ 175 ], puede estimular de manera potente la autofagia [ 176 ].
Otros factores que influyen en la autofagia son la exposición aguda al calor, como la que se experimenta en una sauna [ 177 , 178 ], el consumo de flavonoides [ 179 ], los compuestos fenólicos [ 180 , 181 ] y el café [ 182 ].
El resveratrol también puede inducir el ayuno, ya que actúa como un mimético de la restricción de proteínas [ 183 ], y la metformina, un medicamento para la diabetes, puede influir en la señalización de la autofagia [ 184 ].
Sorprendentemente, la exposición al frío, además de la exposición al calor, también aumenta la autofagia [ 185, 186 ]. El oxígeno hiperbárico [ 187 ] y la ozonoterapia [ 188 ] también pueden estimular la autofagia.
4.5. Curando el Daño
Una vez atenuado el proceso de daño, es necesario curar el daño que se ha producido. La etapa de curación requiere normalizar la respuesta inmunitaria, reducir la inflamación persistente (por ejemplo, dirigiéndose a la interleucina 6 [ 189 ]) y abordar cualquier daño agudo en los tejidos afectados, en particular el daño cardiovascular [ 69 , 70 , 71 ].
La reducción del daño también puede significar reducir el nivel de coagulación de la sangre si hay coagulación y reparar cualquier daño orgánico, si corresponde. La etapa de curación requiere normalizar la respuesta inmunitaria, reducir la inflamación persistente (por ejemplo, dirigiéndose a la interleucina 6 [ 189]), y atender cualquier daño agudo en cualquiera de los tejidos afectados, que, para nuestros propósitos, incluye la sangre.
Los microcoágulos son un posible factor etiológico en la larga duración de la COVID-19 [ 190 , 191 , 192 ], así como en la lesión por la inyección de la COVID-19 [ 193 ]. La reducción del daño también puede significar reducir el nivel de coagulación de la sangre si hay coagulación y reparar cualquier daño orgánico, si corresponde.
Se ha descubierto que las personas que padecen COVID-19 prolongado tienen una respuesta inflamatoria más alta a la infección inicial por COVID-19 que aquellas que se recuperan por completo de COVID-19 [ 194 ], por lo que se han identificado medicamentos antiinflamatorios e inmunomoduladores como posibles terapéuticos a infecciones prolongadas por COVID- 19 .
Los medicamentos anticoagulantes, como la aspirina, pueden ser útiles para aliviar las complicaciones cardiovasculares de la COVID-19 [ 195 , 196 ], ya que tienen un largo historial de uso para mejorar el flujo sanguíneo y reducir las coagulopatías [ 197 , 198 , 199 ].
Otro compuesto útil para romper los coágulos de sangre es la nattoquinasa, que es un fibrinolítico que se encuentra en la soja fermentada (especies bacterianas Bacillus subtilis var. natto ) [ 200 , 201 ]. Los experimentos han demostrado que degrada potentemente la proteína de punta o spike [ 202 , 203 ], lo cual es un beneficio adicional además de sus propiedades fibrinolíticas y anticoagulantes [ 204 ].
4.6. Terapéuticas potenciales
En la Tabla 1 , agrupamos las terapias por mecanismo y etapa (según nuestras definiciones anteriores) e incluimos información sobre sus orígenes. Nuestra categorización de fuentes se basa en la clasificación de productos naturales (NP) o fármacos (PD). Para los productos naturales, incluimos los organismos de origen más comunes en función de su nombre científico para mantener la coherencia.Los compuestos farmacéuticos con aplicabilidad plausible para el tratamiento de la COVID-19 prolongada y el síndrome posvacunal se enumeran en la Tabla 1 .Tabla 1. Compuestos farmacéuticos con mecanismos de acción plausibles contra patologías relacionadas con la proteína espiga.
Tabla 1. Compuestos farmacéuticos con mecanismos de acción plausibles contra patologías relacionadas con la proteína espiga.
| COMPUESTO | MECANISMO | REFERENCIA | ENSAYOS CLÍNICOS | RESULTADOS |
|---|---|---|---|---|
| ivermectina | Unión múltiple de proteína espiga | [205,206,207,208,209] | ||
| corticosteroides | Reducción de la respuesta inflamatoria | [210,211] | NCT05350774 | Proxy: disminución significativa de la disnea [ 212 ] |
| Antihistamínicos | Inflamación reducida | [213,214,215] | ||
| Aspirina | Anticoagulante | [216] | ||
| Naltrexona de dosis baja (LDN) | inmunomodulador | [217,218] | NCT05430152 NCT04604704 | Mejora significativa [ 218 ] |
| colchicina | Reduce la inflamación | [219,220,221] | Reducción de infarto de miocardio, accidente cerebrovascular y muerte cardiovascular (no relacionados con COVID-19 o vacunas) [ 222 ] | |
| metformina | Varios | [223] | NCT04510194 | Una cantidad de disminución relativa del 42 % en la incidencia prolongada de COVID después del tratamiento de la infección inicial por C19 [ 224 ] |
Asimismo, en la Tabla 2 se enumeran los compuestos y suplementos naturales con aplicabilidad plausible para el tratamiento del síndrome prolongado de COVID-19 y posvacunal .Tabla 2. Compuestos y suplementos naturales con mecanismos de acción plausibles contra patologías relacionadas con la proteína espiga.
Tabla 2. Compuestos y suplementos naturales con mecanismos de acción plausibles contra patologías relacionadas con la proteína espiga.

| Compuesto | Mecanismo | Referencia | Ensayos clínicos | Resumen de evidencia |
|---|---|---|---|---|
| Vitamina D | inmunomodulador | [225] | NCT05356936 | Proxy (gravedad C19) [ 226 ] |
| Vitamina C | Apoyo inmunológico, antioxidante. | [227] | NCT05150782 | Reducción de la fatiga (no relacionada con la COVID-19 prolongada) [ 227 ] Se observó una oxigenación mejorada, una disminución de los marcadores inflamatorios y una recuperación más rápida en la infección inicial por COVID-19 (medida indirecta para la COVID-19 prolongada) [ 228 ] Mejora en síntomas generales de fatiga cuando se combina con l -arginina [ 229 ] Mejora significativa [ 230 ] |
| vitamina k2 | inmunomodulador | [231] | NCT05356936 | Evidencia indirecta (gravedad de la infección por COVID-19) [ 231 ] |
| N-acetilcisteína (NAC) | Antioxidante, antiinflamatorio, metabolismo celular, bloquea la interfaz S-ACE2 (IS [ 232 ]) | [233,234,235,236] | NCT05371288 NCT05152849 | Evidencia indirecta (gravedad de la infección por COVID-19) [ 234 ] |
| glutatión | Antioxidante, antiinflamatorio, metabolismo celular | [237,238,239] | NCT05371288 | Proxy (gravedad de la infección por COVID-19) [ 239 , 240 ] |
| melatonina | Antioxidante, antiinflamatorio, metabolismo celular | [241] | Proxy (mayor tasa de recuperación, menor riesgo de ingreso en la unidad de cuidados intensivos) [ 242 ] | |
| quercetina | Interacción antiinflamatoria pico-ACE2 [ 243 , 244 ] | [243,245,246,247] | Proxy (tiempo más rápido para la prueba de PCR negativa cuando se combina con vitamina D y curcumina) [ 248 ] | |
| emodina | Bloquea la interacción pico-ACE2 [ 249 ] | [249] | ||
| Extracto de semilla de comino negro (nigella sativa) | Antiinflamatorio | [250,251,252] | ||
| resveratrol | Antiinflamatorio, antitrombótico | [253,254,255] | Proxy (tasas más bajas de hospitalización) [ 256 ] | |
| curcumina | Inhibe la interacción pico-ACE2, inhibe la encapsulación del virus [ 257 ], se une a las proteínas SC2 (IS) [ 258 ] | [259,260,261] | NCT05150782 | Proxy (disminuye las citocinas inflamatorias) [ 261 , 262 ] |
| Magnesio | Apoyo nutricional multifactorial | [263,264] | Proxy (relación magnesio-calcio baja asociada con una mayor mortalidad por C19 [ 265 ], magnesio bajo asociado con un mayor riesgo de infección [ 266 ]) | |
| Zinc | Soporte nutricional | [267,268,269] | NCT04798677* | Proxy (posiblemente mejores resultados agudos de C19 [ 270 ], otro metanálisis no confirmó la eficacia [ 271 ]) |
| Natoquinasa | Anticoagulante, degrada la espiga (IVT) [ 203 ] | [202,203] | Proxy: degrada la proteína espiga in vitro [ 203 ] | |
| Aceite de pescado | Anticoagulante | [272,273,274] | NCT05121766 | Proxy (ingresos hospitalarios y mortalidad reducidos [ 272 ]) |
| luteolina | Disminuye la inflamación [ 275 ] | [275,276,277] | NCT05311852 | Recuperación más rápida de la disfunción olfativa cuando se combina con palmitoiletanolamida ultramicronizada y entrenamiento olfativo [ 278 ] |
| Hierba de San Juan | Disminuir la inflamación [ 279 ] | [279,280] | ||
| Fisetina | Senolítico [ 281 ] Se une a la proteasa principal (IS) del SARS-CoV-2 [ 282 ] Se une a la proteína de punta (IS) [ 283 ] | [281,283,284] | ||
| Incienso | Se une a Furin | [285] | NCT05150782 | Impacto positivo [ 286 ] |
| apigenina | Se une al pico de SARS-CoV-2 (IS [ 244 ]), antioxidante [ 287 ] | [288,289] | ||
| Nuez moscada | Anticoagulante | [290] | ||
| Sabio | Inhibe la replicación (IVT) [ 291 ] | [291,292] | ||
| Rutina | Se une al pico [ 293 ] | [294] | NCT05387252† | |
| limoneno | Antiinflamatorio | [295] | Antiviral en ensayos in vitro como producto de corteza entera [ 296 ] | |
| Algas | Inmunomodulador [ 297 ] | [298,299,300] | NCT05524532 NCT04777981 | |
| Extracto de hoja de diente de león | Bloquea la interacción S1–ACE2 (IS + IVT [ 301 ] | [301] | Proxy (reducción del dolor de garganta en combinación con otros extractos [ 302 ] | |
| Canela | Inmunomodulador [ 303 , 304 ] | [305,306] | ||
| Extracto de cardo mariano (silimarina) | Antioxidante, antiinflamatorio [ 307 ] Protector endotelial (IVO [ 308 ]) Bloquea picos [ 308 ] | [308] | Evidencia del mecanismo, pero no del tratamiento, a partir de octubre de 2022 [ 307 ] | |
| Andrográfico | Se une a ACE2 (IVT), reducción de la carga viral (IVT) [ 309 ] | [310,311] | Proxy (sin disminución de la gravedad de C19 [ 312 ] | |
| prunella vulgaris | Pico de bloques [ 313 ] | [313] | ||
| Regaliz | Inmunomodulador, antiinflamatorio [ 314 ] | [315,316,317,318] | Proxy (inhibe el virus in vitro [ 319 ] ) | |
| Cardamomo | Antiinflamatorio (IVO [ 320 ] | [320] | Proxy (reduce los marcadores inflamatorios) [ 320 ] | |
| Clavos de olor | Antitrombótico, antiinflamatorio [ 321 ], bloquea la interacción S1-ACE2 (IS, CFA) [ 322 ], estimula la autofagia [ 323 ] | [321] | Previene el deterioro cognitivo post-COVID-19 [ 324 ] | |
| Jengibre | Desconocido | Apoderado. Reducción del período de hospitalización en la infección SC2 [ 325 ] | ||
| Ajo | Inmunomodulador [ 326 ] | [326,327,328] | Proxy (recuperación más rápida desde C19) [ 329 ] | |
| Tomillo | Antioxidante, rico en nutrientes, antiinflamatorio [ 330 ] | [331] | Impacto positivo en los niveles de energía [ 289 ] | |
| Propóleos | Vías de señalización ACE2 (IS [ 332 ], IVT, IVO) [ 333 , 334 ] Inmunomodulación [ 335 ] | [333,336,337] | El metanálisis revela que el propóleo y la miel probablemente podrían mejorar los síntomas clínicos de la COVID-19 y disminuir el tiempo de eliminación del virus [ 332 ] |
Los ensayos clínicos se realizaron durante un largo período, a menos que se indique lo contrario. Los ensayos clínicos son para COVID-19 de larga duración, a menos que se indique lo contrario. * Respuesta inmune vacunal. † Reacciones adversas a la vacunación reacción adversa. Bajo mecanismo. ES: en silicio. TVI: in vitro. IVO: en vivo.
5. Discusión
La mejora de los síntomas y la recuperación de un gran número de personas en todo el mundo tanto de la COVID prolongada como del síndrome y las lesiones posteriores a la inyección requiere el uso de terapias integradoras no invasivas que puedan escalarse y administrarse de forma descentralizada.
Es importante difundir este conocimiento al público lego para que pueda mitigar sus riesgos individuales y los de sus seres queridos.
Si bien es difícil enumerar la escala real de los trastornos de la coagulación posteriores a la vacunación o a la COVID, ha habido un aumento apreciable en los incidentes cardíacos [ 29 ], los accidentes cerebrovasculares (hemorragias intercerebrales [ 338 ]) y el exceso de mortalidad no relacionada con la COVID [ 339 , 340].
Un aumento significativo en la mortalidad total debido a una inyección no tiene precedentes, ya que la vacuna DTP administrada en Guineau-Bissau en la década de 1980 aumentó la mortalidad infantil cuatro veces en comparación con la mortalidad no vacunada [ 341 ] .
Si bien no está clara la magnitud del impacto de la lesión o el síndrome de la inyección post-COVID-19 y del COVID-19 prolongado, es importante prepararse para las consecuencias potenciales al tener información lista para su difusión, así como realizar investigaciones sobre tratamientos prometedores. para aliviar el daño causado por la proteína espiga y otros posibles mecanismos de daño, como la integración del ADN [ 342].
Una limitación de este estudio es que se centra en la patología relacionada con la proteína de pico y puede dejar de lado otras posibilidades, como alergias a los componentes de la vacuna u otras etiologías de enfermedades.
El síndrome vacunal largo COVID-19 y post-COVID-19 son trastornos multifacéticos, con manifestaciones muy variadas; como tal, el desarrollo de diagnósticos objetivos es importante en el tratamiento de pacientes.
Las terapias discutidas en esta revisión tienen una base probatoria variable y pueden servir como puntos de partida para el desarrollo de terapias para aliviar las patologías relacionadas con la proteína espiga en los próximos años
La investigación adicional requiere la validación de los tratamientos descritos en esta revisión mediante ensayos controlados aleatorios (ECA), estudios observacionales y estudios de laboratorio del mecanismo biológico.
Además, la integración de la investigación actual sobre los trastornos relacionados con la proteína de punta o spike es útil. Una posibilidad es la aplicación de herramientas de biología de sistemas para describir las perturbaciones de diferentes vías biológicas influenciadas por la proteína espiga.
Cuando existe un modelo de este tipo, es posible tratar las manifestaciones agudas de la enfermedad y al mismo tiempo eliminar la proteína de punta del cuerpo.
Los gobiernos y los servicios nacionales de salud están comenzando a aceptar la magnitud de la tarea que tienen por delante.
Esta revisión describe algunas de las terapias más prometedoras desde una perspectiva mecanicista biológica y probatoria.
Esperamos que este artículo se utilice en la construcción de protocolos de tratamiento para estas condiciones altamente relacionadas en sus múltiples manifestaciones de enfermedad, priorizando no solo la seguridad y la eficacia, sino también el costo y la disponibilidad para un gran número de personas.
Referencias:
- Ritchie, H.; Mathieu, E.; Rodés-Guirao, L.; Appel, C.; Giattino, C.; Ortiz-Ospina, E.; Hasell, J.; Macdonald, B.; Beltekian, D.; Roser, M. Coronavirus Pandemic (COVID-19). Our World in Data 2020. Available online: https://ourworldindata.org/coronavirus (accessed on 1 October 2022).
- Staff, G. COVID-19 Vaccine Production to January 31st 2022. Available online: https://globalcommissionforpostpandemicpolicy.org/covid-19-vaccine-production-to-january-31st-2022/ (accessed on 1 October 2022).
- Halma, M.T.J.; Rose, J.; Lawrie, T. The Novelty of mRNA Viral Vaccines and Potential Harms: A Scoping Review. J 2023, 6, 220–235. [Google Scholar] [CrossRef]
- ARCHIVE: Conditions of Authorisation for COVID-19 Vaccine Pfizer/BioNTech (Regulation 174). Available online: https://www.gov.uk/government/publications/regulatory-approval-of-pfizer-biontech-vaccine-for-covid-19/conditions-of-authorisation-for-pfizerbiontech-covid-19-vaccine (accessed on 1 October 2022).
- Ball, P. The Lightning-Fast Quest for COVID Vaccines—and What It Means for Other Diseases. Nature 2020, 589, 16–18. [Google Scholar] [CrossRef] [PubMed]
- Anand, P.; Stahel, V.P. Review the Safety of COVID-19 MRNA Vaccines: A Review. Patient Saf. Surg. 2021, 15, 20. [Google Scholar] [CrossRef] [PubMed]
- Doshi, P. COVID-19 Vaccines: In the Rush for Regulatory Approval, Do We Need More Data? BMJ 2021, 373, n1244. [Google Scholar] [CrossRef] [PubMed]
- Bondì, M.L.; Di Gesù, R.; Craparo, E.F. Chapter Twelve—Lipid Nanoparticles for Drug Targeting to the Brain. In Methods in Enzymology; Düzgüneş, N., Ed.; Academic Press: Cambridge, MA, USA, 2012; Volume 508, pp. 229–251. [Google Scholar]
- Pottoo, F.H.; Sharma, S.; Javed, M.N.; Barkat, M.A.; Harshita; Alam, M.S.; Naim, M.J.; Alam, O.; Ansari, M.A.; Barreto, G.E.; et al. Lipid-Based Nanoformulations in the Treatment of Neurological Disorders. Drug. Metab. Rev. 2020, 52, 185–204. [Google Scholar] [CrossRef] [PubMed]
- Akinc, A.; Maier, M.A.; Manoharan, M.; Fitzgerald, K.; Jayaraman, M.; Barros, S.; Ansell, S.; Du, X.; Hope, M.J.; Madden, T.D.; et al. The Onpattro Story and the Clinical Translation of Nanomedicines Containing Nucleic Acid-Based Drugs. Nat. Nanotechnol. 2019, 14, 1084–1087. [Google Scholar] [CrossRef] [PubMed]
- Thacker, P.D. COVID-19: Researcher Blows the Whistle on Data Integrity Issues in Pfizer’s Vaccine Trial. BMJ 2021, 375, n2635. [Google Scholar] [CrossRef]
- Ogata, A.F.; Cheng, C.-A.; Desjardins, M.; Senussi, Y.; Sherman, A.C.; Powell, M.; Novack, L.; Von, S.; Li, X.; Baden, L.R.; et al. Circulating Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Vaccine Antigen Detected in the Plasma of MRNA-1273 Vaccine Recipients. Clin. Infect. Dis. 2022, 74, 715–718. [Google Scholar] [CrossRef]
- Bansal, S.; Perincheri, S.; Fleming, T.; Poulson, C.; Tiffany, B.; Bremner, R.M.; Mohanakumar, T. Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer–BioNTech) Vaccination Prior to Development of Antibodies: A Novel Mechanism for Immune Activation by MRNA Vaccines. J. Immunol. 2021, 207, 2405–2410. [Google Scholar] [CrossRef]
- Röltgen, K.; Nielsen, S.C.A.; Silva, O.; Younes, S.F.; Zaslavsky, M.; Costales, C.; Yang, F.; Wirz, O.F.; Solis, D.; Hoh, R.A.; et al. Immune Imprinting, Breadth of Variant Recognition, and Germinal Center Response in Human SARS-CoV-2 Infection and Vaccination. Cell 2022, 185, 1025–1040.e14. [Google Scholar] [CrossRef]
- Spike Protein Behavior. Available online: https://www.science.org/content/blog-post/spike-protein-behavior (accessed on 1 October 2022).
- Schlake, T.; Thess, A.; Fotin-Mleczek, M.; Kallen, K.-J. Developing MRNA-Vaccine Technologies. RNA Biol. 2012, 9, 1319–1330. [Google Scholar] [CrossRef]
- Shyu, A.-B.; Wilkinson, M.F.; van Hoof, A. Messenger RNA Regulation: To Translate or to Degrade. EMBO J. 2008, 27, 471–481. [Google Scholar] [CrossRef]
- Baudrimont, A.; Voegeli, S.; Viloria, E.C.; Stritt, F.; Lenon, M.; Wada, T.; Jaquet, V.; Becskei, A. Multiplexed Gene Control Reveals Rapid MRNA Turnover. Sci. Adv. 2017, 3, e1700006. [Google Scholar] [CrossRef] [PubMed]
- Patterson, B.; Francisco, E.; Yogendra, R.; Long, E.; Pise, A.; Beaty, C.; Osgood, E.; Bream, J.; Kreimer, M.; Heide, R.V.; et al. SARS-CoV-2 S1 Protein Persistence in SARS-CoV-2 Negative Post-Vaccination Individuals with Long COVID/PASC-Like Symptoms. Res. Sq. 2022, Preprint. [Google Scholar] [CrossRef]
- Patterson, B.K.; Francisco, E.B.; Yogendra, R.; Long, E.; Pise, A.; Rodrigues, H.; Hall, E.; Herrera, M.; Parikh, P.; Guevara-Coto, J.; et al. Persistence of SARS CoV-2 S1 Protein in CD16+ Monocytes in Post-Acute Sequelae of COVID-19 (PASC) up to 15 Months Post-Infection. Front. Immunol. 2022, 12, 5526. [Google Scholar] [CrossRef] [PubMed]
- Khan, S.; Shafiei, M.S.; Longoria, C.; Schoggins, J.W.; Savani, R.C.; Zaki, H. SARS-CoV-2 Spike Protein Induces Inflammation via TLR2-Dependent Activation of the NF-ΚB Pathway. Elife 2021, 10, e68563. [Google Scholar] [CrossRef]
- Robles, J.P.; Zamora, M.; Adan-Castro, E.; Siqueiros-Marquez, L.; Martinez de la Escalera, G.; Clapp, C. The Spike Protein of SARS-CoV-2 Induces Endothelial Inflammation through Integrin A5β1 and NF-ΚB Signaling. J. Biol. Chem. 2022, 298, 101695. [Google Scholar] [CrossRef]
- Banks, W.A.; Sharma, P.; Bullock, K.M.; Hansen, K.M.; Ludwig, N.; Whiteside, T.L. Transport of Extracellular Vesicles across the Blood-Brain Barrier: Brain Pharmacokinetics and Effects of Inflammation. Int. J. Mol. Sci. 2020, 21, 4407. [Google Scholar] [CrossRef]
- Chen, Y.Y.; Syed, A.M.; MacMillan, P.; Rocheleau, J.V.; Chan, W.C.W. Flow Rate Affects Nanoparticle Uptake into Endothelial Cells. Adv. Mater. 2020, 32, e1906274. [Google Scholar] [CrossRef]
- Buzhdygan, T.P.; DeOre, B.J.; Baldwin-Leclair, A.; Bullock, T.A.; McGary, H.M.; Khan, J.A.; Razmpour, R.; Hale, J.F.; Galie, P.A.; Potula, R.; et al. The SARS-CoV-2 Spike Protein Alters Barrier Function in 2D Static and 3D Microfluidic in-Vitro Models of the Human Blood-Brain Barrier. Neurobiol. Dis. 2020, 146, 105131. [Google Scholar] [CrossRef]
- Asandei, A.; Mereuta, L.; Schiopu, I.; Park, J.; Seo, C.H.; Park, Y.; Luchian, T. Non-Receptor-Mediated Lipid Membrane Permeabilization by the SARS-CoV-2 Spike Protein S1 Subunit. ACS Appl. Mater. Interfaces 2020, 12, 55649–55658. [Google Scholar] [CrossRef] [PubMed]
- Malhotra, A. Curing the Pandemic of Misinformation on COVID-19 MRNA Vaccines through Real Evidence-Based Medicine—Part 1. J. Insul. Resist. 2022, 5, 8. [Google Scholar] [CrossRef]
- Gill, J.R.; Tashjian, R.; Duncanson, E. Autopsy Histopathologic Cardiac Findings in 2 Adolescents Following the Second COVID-19 Vaccine Dose. Arch. Pathol. Lab. Med. 2022, 146, 925–929. [Google Scholar] [CrossRef] [PubMed]
- Diaz, G.A.; Parsons, G.T.; Gering, S.K.; Meier, A.R.; Hutchinson, I.V.; Robicsek, A. Myocarditis and Pericarditis After Vaccination for COVID-19. JAMA 2021, 326, 1210–1212. [Google Scholar] [CrossRef] [PubMed]
- Karlstad, Ø.; Hovi, P.; Husby, A.; Härkänen, T.; Selmer, R.M.; Pihlström, N.; Hansen, J.V.; Nohynek, H.; Gunnes, N.; Sundström, A.; et al. SARS-CoV-2 Vaccination and Myocarditis in a Nordic Cohort Study of 23 Million Residents. JAMA Cardiol. 2022, 7, 600–612. [Google Scholar] [CrossRef]
- Patone, M.; Mei, X.W.; Handunnetthi, L.; Dixon, S.; Zaccardi, F.; Shankar-Hari, M.; Watkinson, P.; Khunti, K.; Harnden, A.; Coupland, C.A.C.; et al. Risks of Myocarditis, Pericarditis, and Cardiac Arrhythmias Associated with COVID-19 Vaccination or SARS-CoV-2 Infection. Nat. Med. 2022, 28, 410–422. [Google Scholar] [CrossRef]
- Kracalik, I.; Oster, M.E.; Broder, K.R.; Cortese, M.M.; Glover, M.; Shields, K.; Creech, C.B.; Romanson, B.; Novosad, S.; Soslow, J.; et al. Outcomes at Least 90 Days since Onset of Myocarditis after MRNA COVID-19 Vaccination in Adolescents and Young Adults in the USA: A Follow-up Surveillance Study. Lancet Child Adolesc. Health 2022, 6, 788–798. [Google Scholar] [CrossRef]
- Mansanguan, S.; Charunwatthana, P.; Piyaphanee, W.; Dechkhajorn, W.; Poolcharoen, A.; Mansanguan, C. Cardiovascular Manifestation of the BNT162b2 MRNA COVID-19 Vaccine in Adolescents. Trop. Med. Infect. Dis. 2022, 7, 196. [Google Scholar] [CrossRef]
- Tai, W.; He, L.; Zhang, X.; Pu, J.; Voronin, D.; Jiang, S.; Zhou, Y.; Du, L. Characterization of the Receptor-Binding Domain (RBD) of 2019 Novel Coronavirus: Implication for Development of RBD Protein as a Viral Attachment Inhibitor and Vaccine. Cell Mol. Immunol. 2020, 17, 613–620. [Google Scholar] [CrossRef]
- Jackson, C.B.; Farzan, M.; Chen, B.; Choe, H. Mechanisms of SARS-CoV-2 Entry into Cells. Nat. Rev. Mol. Cell Biol. 2022, 23, 3–20. [Google Scholar] [CrossRef]
- Shin, Y.-H.; Jeong, K.; Lee, J.; Lee, H.J.; Yim, J.; Kim, J.; Kim, S.; Park, S.B. Inhibition of ACE2-Spike Interaction by an ACE2 Binder Suppresses SARS-CoV-2 Entry. Angew. Chem. Int. Ed. Engl. 2022, 61, e202115695. [Google Scholar] [CrossRef] [PubMed]
- Martínez-Flores, D.; Zepeda-Cervantes, J.; Cruz-Reséndiz, A.; Aguirre-Sampieri, S.; Sampieri, A.; Vaca, L. SARS-CoV-2 Vaccines Based on the Spike Glycoprotein and Implications of New Viral Variants. Front. Immunol. 2021, 12, 701501. [Google Scholar] [CrossRef] [PubMed]
- Read, A.F.; Baigent, S.J.; Powers, C.; Kgosana, L.B.; Blackwell, L.; Smith, L.P.; Kennedy, D.A.; Walkden-Brown, S.W.; Nair, V.K. Imperfect Vaccination Can Enhance the Transmission of Highly Virulent Pathogens. PLoS Biol. 2015, 13, e1002198. [Google Scholar] [CrossRef] [PubMed]
- Lyngse, F.P.; Kirkeby, C.T.; Denwood, M.; Christiansen, L.E.; Mølbak, K.; Møller, C.H.; Skov, R.L.; Krause, T.G.; Rasmussen, M.; Sieber, R.N.; et al. Household Transmission of SARS-CoV-2 Omicron Variant of Concern Subvariants BA.1 and BA.2 in Denmark. Nat. Commun. 2022, 13, 5760. [Google Scholar] [CrossRef]
- López-Cortés, G.I.; Palacios-Pérez, M.; Zamudio, G.S.; Veledíaz, H.F.; Ortega, E.; José, M.V. Neutral Evolution Test of the Spike Protein of SARS-CoV-2 and Its Implications in the Binding to ACE2. Sci. Rep. 2021, 11, 18847. [Google Scholar] [CrossRef]
- Gupta, D.; Sharma, P.; Singh, M.; Kumar, M.; Ethayathulla, A.S.; Kaur, P. Structural and Functional Insights into the Spike Protein Mutations of Emerging SARS-CoV-2 Variants. Cell Mol. Life Sci. 2021, 78, 7967–7989. [Google Scholar] [CrossRef]
- Davis, H.E.; McCorkell, L.; Vogel, J.M.; Topol, E.J. Long COVID: Major Findings, Mechanisms and Recommendations. Nat. Rev. Microbiol. 2023, 21, 133–146. [Google Scholar] [CrossRef]
- Mumtaz, A.; Sheikh, A.A.E.; Khan, A.M.; Khalid, S.N.; Khan, J.; Nasrullah, A.; Sagheer, S.; Sheikh, A.B. COVID-19 Vaccine and Long COVID: A Scoping Review. Life 2022, 12, 1066. [Google Scholar] [CrossRef]
- Loh, E.-W. Dose-Response Study a Glucoside- and Rutinoside-Rich Crude Material in Relieving Side Effects of COVID-19 Vaccines. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT05387252 (accessed on 30 September 2022).
- University of Oxford. Characterisation of the Effects of Spermidine, a Nutrition Supplement, on the Immune Memory Response to Coronavirus Vaccine in Older People. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT05421546 (accessed on 30 September 2022).
- Université de Sherbrooke. Modulation of Immune Responses to COVID-19 Vaccination by an Intervention on the Gut Microbiota: A Randomized Controlled Trial. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT05195151 (accessed on 30 September 2022).
- AB Biotek. Efficacy and Tolerability of a Nutritional Supplementation With ABBC-1, a Symbiotic Combination of Beta-Glucans and Selenium and Zinc Enriched Probiotics, in Volunteers Receiving the Influenza or the COVID-19 Vaccines. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT04798677 (accessed on 30 September 2022).
- Maastricht University Medical Center. The Effect of Plant Stanol Ester Consumption on the Vaccination Response to a COVID-19 Vaccine. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT04844346 (accessed on 30 September 2022).
- Saxe, G. Multicenter Double-Blind, Placebo-Controlled RCT of Fomitopsis Officinalis/Trametes Versicolor for COVID-19. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT04951336 (accessed on 30 September 2022).
- Engındenız, Z. Evaluation of Deltoid Muscle Exercises on Injection Site and Arm Pain After Pfizer—BioNTech (BNT162b2) COVID-19 Vaccination, A Randomized Controlled Study. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT05157230 (accessed on 30 September 2022).
- Sanchez, J. Augmentation of Immune Response to COVID-19 MRNA Vaccination through Osteopathic Manipulative Treatment Including Lymphatic Pumps. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT04928456 (accessed on 30 September 2022).
- Rowan University. Lymphatic Osteopathic Manipulative Medicine to Enhance COVID-19 Vaccination Efficacy. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT05069636 (accessed on 30 September 2022).
- Bartley, J. Vaccination Efficacy With Metformin in Older Adults: A Pilot Study. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT03996538 (accessed on 30 September 2022).
- Karanja, P.S. Iron and Vaccine-Preventable Viral Disease. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT04912661 (accessed on 30 September 2022).
- Materia Medica Holding. Multicenter, Double-Blind, Placebo-Controlled, Randomized, Parallel-Group Clinical Trial to Evaluate the Efficacy and Safety of Ergoferon as Non-Specific COVID-19 Prevention During Vaccination Against SARS-CoV-2. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT05069649 (accessed on 30 September 2022).
- Gnessi, L. COVID-19 Vaccination in Subjects With Obesity: Impact of Metabolic Health and the Role of a Ketogenic Diet. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT05163743 (accessed on 30 September 2022).
- Wang, A.X. Impact of Immunosuppression Adjustment on the Immune Response to SARS-CoV-2 MRNA Vaccination in Kidney Transplant Recipients (ADIVKT). 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT05060991 (accessed on 30 September 2022).
- University Hospital Inselspital, Berne. Registry Study for COVID19 Vaccination Efficacy in Patients With a Treatment History of Rituximab. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT04877496 (accessed on 30 September 2022).
- Webster, K.E.; O’Byrne, L.; MacKeith, S.; Philpott, C.; Hopkins, C.; Burton, M.J. Interventions for the Prevention of Persistent Post-COVID-19 Olfactory Dysfunction. Cochrane Database Syst. Rev. 2021, 2021, CD013877. [Google Scholar] [CrossRef]
- Fertig, T.E.; Chitoiu, L.; Marta, D.S.; Ionescu, V.-S.; Cismasiu, V.B.; Radu, E.; Angheluta, G.; Dobre, M.; Serbanescu, A.; Hinescu, M.E.; et al. Vaccine MRNA Can Be Detected in Blood at 15 Days Post-Vaccination. Biomedicines 2022, 10, 1538. [Google Scholar] [CrossRef]
- Bahl, K.; Senn, J.J.; Yuzhakov, O.; Bulychev, A.; Brito, L.A.; Hassett, K.J.; Laska, M.E.; Smith, M.; Almarsson, Ö.; Thompson, J.; et al. Preclinical and Clinical Demonstration of Immunogenicity by MRNA Vaccines against H10N8 and H7N9 Influenza Viruses. Mol. Ther. 2017, 25, 1316–1327. [Google Scholar] [CrossRef] [PubMed]
- Hanna, N.; Heffes-Doon, A.; Lin, X.; Manzano De Mejia, C.; Botros, B.; Gurzenda, E.; Nayak, A. Detection of Messenger RNA COVID-19 Vaccines in Human Breast Milk. JAMA Pediatr. 2022, 176, 1268. [Google Scholar] [CrossRef]
- Nuovo, G.J.; Magro, C.; Shaffer, T.; Awad, H.; Suster, D.; Mikhail, S.; He, B.; Michaille, J.-J.; Liechty, B.; Tili, E. Endothelial Cell Damage Is the Central Part of COVID-19 and a Mouse Model Induced by Injection of the S1 Subunit of the Spike Protein. Ann. Diagn. Pathol. 2021, 51, 151682. [Google Scholar] [CrossRef] [PubMed]
- Raghavan, S.; Kenchappa, D.B.; Leo, M.D. SARS-CoV-2 Spike Protein Induces Degradation of Junctional Proteins That Maintain Endothelial Barrier Integrity. Front. Cardiovasc. Med. 2021, 8, 687783. [Google Scholar] [CrossRef] [PubMed]
- Lei, Y.; Zhang, J.; Schiavon, C.R.; He, M.; Chen, L.; Shen, H.; Zhang, Y.; Yin, Q.; Cho, Y.; Andrade, L.; et al. SARS-CoV-2 Spike Protein Impairs Endothelial Function via Downregulation of ACE 2. Circ. Res. 2021, 128, 1323–1326. [Google Scholar] [CrossRef]
- Serviente, C.; Matias, A.; Erol, M.E.; Calderone, M.; Layec, G. The Influence of COVID-19-Based MRNA Vaccines on Measures of Conduit Artery and Microvascular Endothelial Function. FASEB J. 2022, 36. [Google Scholar] [CrossRef]
- Castanares-Zapatero, D.; Chalon, P.; Kohn, L.; Dauvrin, M.; Detollenaere, J.; Maertens de Noordhout, C.; Primus-de Jong, C.; Cleemput, I.; Van den Heede, K. Pathophysiology and Mechanism of Long COVID: A Comprehensive Review. Ann. Med. 2022, 54, 1473–1487. [Google Scholar] [CrossRef]
- Crook, H.; Raza, S.; Nowell, J.; Young, M.; Edison, P. Long Covid-Mechanisms, Risk Factors, and Management. BMJ 2021, 374, n1648. [Google Scholar] [CrossRef]
- Xie, Y.; Xu, E.; Bowe, B.; Al-Aly, Z. Long-Term Cardiovascular Outcomes of COVID-19. Nat. Med. 2022, 28, 583–590. [Google Scholar] [CrossRef]
- Raman, B.; Bluemke, D.A.; Lüscher, T.F.; Neubauer, S. Long COVID: Post-Acute Sequelae of COVID-19 with a Cardiovascular Focus. Eur. Heart J. 2022, 43, 1157–1172. [Google Scholar] [CrossRef]
- Yonker, L.M.; Swank, Z.; Bartsch, Y.C.; Burns, M.D.; Kane, A.; Boribong, B.P.; Davis, J.P.; Loiselle, M.; Novak, T.; Senussi, Y.; et al. Circulating Spike Protein Detected in Post–COVID-19 MRNA Vaccine Myocarditis. Circulation 2023, 147, 867–876. [Google Scholar] [CrossRef]
- Zhang, S.; Liu, Y.; Wang, X.; Yang, L.; Li, H.; Wang, Y.; Liu, M.; Zhao, X.; Xie, Y.; Yang, Y.; et al. SARS-CoV-2 Binds Platelet ACE2 to Enhance Thrombosis in COVID-19. J. Hematol. Oncol. 2020, 13, 120. [Google Scholar] [CrossRef] [PubMed]
- Grobbelaar, L.M.; Venter, C.; Vlok, M.; Ngoepe, M.; Laubscher, G.J.; Lourens, P.J.; Steenkamp, J.; Kell, D.B.; Pretorius, E. SARS-CoV-2 Spike Protein S1 Induces Fibrin(Ogen) Resistant to Fibrinolysis: Implications for Microclot Formation in COVID-19. Biosci. Rep. 2021, 41, BSR20210611. [Google Scholar] [CrossRef] [PubMed]
- Nyström, S.; Hammarström, P. Amyloidogenesis of SARS-CoV-2 Spike Protein. J. Am. Chem. Soc. 2022, 144, 8945–8950. [Google Scholar] [CrossRef]
- Montgomery, J.; Ryan, M.; Engler, R.; Hoffman, D.; McClenathan, B.; Collins, L.; Loran, D.; Hrncir, D.; Herring, K.; Platzer, M.; et al. Myocarditis Following Immunization With MRNA COVID-19 Vaccines in Members of the US Military. JAMA Cardiol. 2021, 6, 1202–1206. [Google Scholar] [CrossRef]
- Chakraborty, C.; Bhattacharya, M.; Sharma, A.R. Present Variants of Concern and Variants of Interest of Severe Acute Respiratory Syndrome Coronavirus 2: Their Significant Mutations in S-Glycoprotein, Infectivity, Re-Infectivity, Immune Escape and Vaccines Activity. Rev. Med. Virol. 2022, 32, e2270. [Google Scholar] [CrossRef]
- Harvey, W.T.; Carabelli, A.M.; Jackson, B.; Gupta, R.K.; Thomson, E.C.; Harrison, E.M.; Ludden, C.; Reeve, R.; Rambaut, A.; Peacock, S.J.; et al. SARS-CoV-2 Variants, Spike Mutations and Immune Escape. Nat. Rev. Microbiol. 2021, 19, 409–424. [Google Scholar] [CrossRef] [PubMed]
- Collier, A.Y.; Miller, J.; Hachmann, N.P.; McMahan, K.; Liu, J.; Bondzie, E.A.; Gallup, L.; Rowe, M.; Schonberg, E.; Thai, S.; et al. Immunogenicity of BA.5 Bivalent MRNA Vaccine Boosters. N. Engl. J. Med. 2023, 388, 565–567. [Google Scholar] [CrossRef] [PubMed]
- Tian, J.-H.; Patel, N.; Haupt, R.; Zhou, H.; Weston, S.; Hammond, H.; Logue, J.; Portnoff, A.D.; Norton, J.; Guebre-Xabier, M.; et al. SARS-CoV-2 Spike Glycoprotein Vaccine Candidate NVX-CoV2373 Immunogenicity in Baboons and Protection in Mice. Nat. Commun. 2021, 12, 372. [Google Scholar] [CrossRef]
- Chakraborty, C.; Sharma, A.R.; Bhattacharya, M.; Lee, S.-S. A Detailed Overview of Immune Escape, Antibody Escape, Partial Vaccine Escape of SARS-CoV-2 and Their Emerging Variants With Escape Mutations. Front. Immunol. 2022, 13, 801522. [Google Scholar] [CrossRef]
- Wan, Y.; Shang, J.; Sun, S.; Tai, W.; Chen, J.; Geng, Q.; He, L.; Chen, Y.; Wu, J.; Shi, Z.; et al. Molecular Mechanism for Antibody-Dependent Enhancement of Coronavirus Entry. J. Virol. 2020, 94, e02015-19. [Google Scholar] [CrossRef] [PubMed]
- Regev-Yochay, G.; Gonen, T.; Gilboa, M.; Mandelboim, M.; Indenbaum, V.; Amit, S.; Meltzer, L.; Asraf, K.; Cohen, C.; Fluss, R.; et al. Efficacy of a Fourth Dose of COVID-19 MRNA Vaccine against Omicron. N. Engl. J. Med. 2022, 386, 1377–1380. [Google Scholar] [CrossRef]
- Liu, J.; Wang, J.; Xu, J.; Xia, H.; Wang, Y.; Zhang, C.; Chen, W.; Zhang, H.; Liu, Q.; Zhu, R.; et al. Comprehensive Investigations Revealed Consistent Pathophysiological Alterations after Vaccination with COVID-19 Vaccines. Cell Discov. 2021, 7, 99. [Google Scholar] [CrossRef]
- Dennis, A.; Cuthbertson, D.J.; Wootton, D.; Crooks, M.; Gabbay, M.; Eichert, N.; Mouchti, S.; Pansini, M.; Roca-Fernandez, A.; Thomaides-Brears, H.; et al. Multi-Organ Impairment and Long COVID: A 1-Year Prospective, Longitudinal Cohort Study. J. R. Soc. Med. 2023, 116, 97–112. [Google Scholar] [CrossRef]
- Mustafa Alhussein, M.; Rabbani, M.; Sarak, B.; Dykstra, S.; Labib, D.; Flewitt, J.; Lydell, C.P.; Howarth, A.G.; Filipchuck, N.; Kealey, A.; et al. Natural History of Myocardial Injury After COVID-19 Vaccine–Associated Myocarditis. Can. J. Cardiol. 2022, 38, 1676–1683. [Google Scholar] [CrossRef] [PubMed]
- Abbott, M.G.; Allawi, Z.; Hofer, M.; Ansorge, O.; Brady, S.; Fadic, R.; Torres, G.; Knight, R.; Calvo, M.; Bennett, D.L.H.; et al. Acute Small Fiber Neuropathy after Oxford-AstraZeneca ChAdOx1-S Vaccination: A Report of Three Cases and Review of the Literature. J. Peripher. Nerv. Syst. 2022, 27, 325–329. [Google Scholar] [CrossRef]
- Khokhar, F.; Khan, A.; Hussain, Z.; Yu, J. Small Fiber Neuropathy Associated With the Moderna SARS-CoV-2 Vaccine. Cureus 2022, 14, e25969. [Google Scholar] [CrossRef]
- Frontera, J.A.; Tamborska, A.A.; Doheim, M.F.; Garcia-Azorin, D.; Gezegen, H.; Guekht, A.; Yusof Khan, A.H.K.; Santacatterina, M.; Sejvar, J.; Thakur, K.T.; et al. Neurological Events Reported after COVID-19 Vaccines: An Analysis of Vaccine Adverse Event Reporting System. Ann. Neurol. 2022, 91, 756–771. [Google Scholar] [CrossRef]
- Ayoubkhani, D.; Bermingham, C.; Pouwels, K.B.; Glickman, M.; Nafilyan, V.; Zaccardi, F.; Khunti, K.; Alwan, N.A.; Walker, A.S. Trajectory of Long Covid Symptoms after COVID-19 Vaccination: Community Based Cohort Study. BMJ 2022, 377, e069676. [Google Scholar] [CrossRef] [PubMed]
- Schwab, C.; Domke, L.M.; Hartmann, L.; Stenzinger, A.; Longerich, T.; Schirmacher, P. Autopsy-Based Histopathological Characterization of Myocarditis after Anti-SARS-CoV-2-Vaccination. Clin. Res. Cardiol. 2023, 112, 431–440. [Google Scholar] [CrossRef]
- Rosenblum, H.G.; Gee, J.; Liu, R.; Marquez, P.L.; Zhang, B.; Strid, P.; Abara, W.E.; McNeil, M.M.; Myers, T.R.; Hause, A.M.; et al. Safety of MRNA Vaccines Administered during the Initial 6 Months of the US COVID-19 Vaccination Programme: An Observational Study of Reports to the Vaccine Adverse Event Reporting System and v-Safe. Lancet Infect. Dis. 2022, 22, 802–812. [Google Scholar] [CrossRef]
- Dickerman, B.A.; Madenci, A.L.; Gerlovin, H.; Kurgansky, K.E.; Wise, J.K.; Figueroa Muñiz, M.J.; Ferolito, B.R.; Gagnon, D.R.; Gaziano, J.M.; Cho, K.; et al. Comparative Safety of BNT162b2 and MRNA-1273 Vaccines in a Nationwide Cohort of US Veterans. JAMA Intern. Med. 2022, 182, 739–746. [Google Scholar] [CrossRef]
- Ponti, G.; Pastorino, L.; Manfredini, M.; Ozben, T.; Oliva, G.; Kaleci, S.; Iannella, R.; Tomasi, A. COVID-19 Spreading across World Correlates with C677T Allele of the Methylenetetrahydrofolate Reductase (MTHFR) Gene Prevalence. J. Clin. Lab. Anal. 2021, 35, e23798. [Google Scholar] [CrossRef] [PubMed]
- Carpenè, G.; Negrini, D.; Henry, B.M.; Montagnana, M.; Lippi, G. Homocysteine in Coronavirus Disease (COVID-19): A Systematic Literature Review. Diagnosis 2022, 9, 306–310. [Google Scholar] [CrossRef] [PubMed]
- Ponti, G.; Roli, L.; Oliva, G.; Manfredini, M.; Trenti, T.; Kaleci, S.; Iannella, R.; Balzano, B.; Coppola, A.; Fiorentino, G.; et al. Homocysteine (Hcy) Assessment to Predict Outcomes of Hospitalized COVID-19 Patients: A Multicenter Study on 313 COVID-19 Patients. Clin. Chem. Lab. Med. 2021, 59, e354–e357. [Google Scholar] [CrossRef] [PubMed]
- Abu-Farha, M.; Al-Sabah, S.; Hammad, M.M.; Hebbar, P.; Channanath, A.M.; John, S.E.; Taher, I.; Almaeen, A.; Ghazy, A.; Mohammad, A.; et al. Prognostic Genetic Markers for Thrombosis in COVID-19 Patients: A Focused Analysis on D-Dimer, Homocysteine and Thromboembolism. Front Pharm. 2020, 11, 587451. [Google Scholar] [CrossRef] [PubMed]
- Karst, M.; Hollenhorst, J.; Achenbach, J. Life-Threatening Course in Coronavirus Disease 2019 (COVID-19): Is There a Link to Methylenetetrahydrofolic Acid Reductase (MTHFR) Polymorphism and Hyperhomocysteinemia? Med. Hypotheses 2020, 144, 110234. [Google Scholar] [CrossRef]
- Bruce Yu, Y.; Taraban, M.B.; Briggs, K.T. All Vials Are Not the Same: Potential Role of Vaccine Quality in Vaccine Adverse Reactions. Vaccine 2021, 39, 6565–6569. [Google Scholar] [CrossRef]
- Shrestha, N.K.; Burke, P.C.; Nowacki, A.S.; Simon, J.F.; Hagen, A.; Gordon, S.M. Effectiveness of the Coronavirus Disease 2019 (COVID-19) Bivalent Vaccine. medRxiv 2023. [Google Scholar] [CrossRef]
- Hoffmann, M.A.; Wieler, H.J.; Enders, P.; Buchholz, H.-G.; Plachter, B. Age- and Sex-Graded Data Evaluation of Vaccination Reactions after Initial Injection of the BNT162b2 MRNA Vaccine in a Local Vaccination Center in Germany. Vaccines 2021, 9, 911. [Google Scholar] [CrossRef]
- Aaby, P.; Benn, C.S.; Flanagan, K.L.; Klein, S.L.; Kollmann, T.R.; Lynn, D.J.; Shann, F. The Non-Specific and Sex-Differential Effects of Vaccines. Nat. Rev. Immunol. 2020, 20, 464–470. [Google Scholar] [CrossRef]
- Desai, A.P.; Desai, A.P.; Loomis, G.J. Relationship between Pre-Existing Allergies and Anaphylactic Reactions Post MRNA COVID-19 Vaccine Administration. Vaccine 2021, 39, 4407–4409. [Google Scholar] [CrossRef] [PubMed]
- Lee, E.-J.; Beltrami-Moreira, M.; Al-Samkari, H.; Cuker, A.; DiRaimo, J.; Gernsheimer, T.; Kruse, A.; Kessler, C.; Kruse, C.; Leavitt, A.D.; et al. SARS-CoV-2 Vaccination and ITP in Patients with de Novo or Preexisting ITP. Blood 2022, 139, 1564–1574. [Google Scholar] [CrossRef] [PubMed]
- Iddir, M.; Brito, A.; Dingeo, G.; Fernandez Del Campo, S.S.; Samouda, H.; La Frano, M.R.; Bohn, T. Strengthening the Immune System and Reducing Inflammation and Oxidative Stress through Diet and Nutrition: Considerations during the COVID-19 Crisis. Nutrients 2020, 12, 1562. [Google Scholar] [CrossRef]
- Nakeshbandi, M.; Maini, R.; Daniel, P.; Rosengarten, S.; Parmar, P.; Wilson, C.; Kim, J.M.; Oommen, A.; Mecklenburg, M.; Salvani, J.; et al. The Impact of Obesity on COVID-19 Complications: A Retrospective Cohort Study. Int. J. Obes. 2020, 44, 1832–1837. [Google Scholar] [CrossRef]
- Apicella, M.; Campopiano, M.C.; Mantuano, M.; Mazoni, L.; Coppelli, A.; Del Prato, S. COVID-19 in People with Diabetes: Understanding the Reasons for Worse Outcomes. Lancet Diabetes Endocrinol. 2020, 8, 782–792. [Google Scholar] [CrossRef] [PubMed]
- Logette, E.; Lorin, C.; Favreau, C.; Oshurko, E.; Coggan, J.S.; Casalegno, F.; Sy, M.F.; Monney, C.; Bertschy, M.; Delattre, E.; et al. A Machine-Generated View of the Role of Blood Glucose Levels in the Severity of COVID-19. Front. Public Health 2021, 9, 695139. [Google Scholar] [CrossRef] [PubMed]
- Holt, E.M.; Steffen, L.M.; Moran, A.; Basu, S.; Steinberger, J.; Ross, J.A.; Hong, C.-P.; Sinaiko, A.R. Fruit and Vegetable Consumption and Its Relation to Markers of Inflammation and Oxidative Stress in Adolescents. J. Am. Diet. Assoc. 2009, 109, 414–421. [Google Scholar] [CrossRef]
- Cheng, Y.-C.; Sheen, J.-M.; Hu, W.L.; Hung, Y.-C. Polyphenols and Oxidative Stress in Atherosclerosis-Related Ischemic Heart Disease and Stroke. Oxidative Med. Cell. Longev. 2017, 2017, 8526438. [Google Scholar] [CrossRef]
- Serino, A.; Salazar, G. Protective Role of Polyphenols against Vascular Inflammation, Aging and Cardiovascular Disease. Nutrients 2018, 11, 53. [Google Scholar] [CrossRef]
- Belkaid, Y.; Hand, T.W. Role of the Microbiota in Immunity and Inflammation. Cell 2014, 157, 121–141. [Google Scholar] [CrossRef] [PubMed]
- Yeoh, Y.K.; Zuo, T.; Lui, G.C.-Y.; Zhang, F.; Liu, Q.; Li, A.Y.; Chung, A.C.; Cheung, C.P.; Tso, E.Y.; Fung, K.S.; et al. Gut Microbiota Composition Reflects Disease Severity and Dysfunctional Immune Responses in Patients with COVID-19. Gut 2021, 70, 698–706. [Google Scholar] [CrossRef]
- Zuo, T.; Liu, Q.; Zhang, F.; Lui, G.; Tso, E.; Yeoh, Y.K.; Chen, Z.; Boon, S.; Chan, F.K.L.; Chan, P.; et al. Depicting SARS-CoV-2 Faecal Viral Activity in Association with Gut Microbiota Composition in Patients with COVID-19. Gut 2021, 70, 276–284. [Google Scholar] [CrossRef] [PubMed]
- Ferreira, C.; Viana, S.D.; Reis, F. Gut Microbiota Dysbiosis–Immune Hyperresponse–Inflammation Triad in Coronavirus Disease 2019 (COVID-19): Impact of Pharmacological and Nutraceutical Approaches. Microorganisms 2020, 8, 1514. [Google Scholar] [CrossRef]
- Wang, C.; van Haperen, R.; Gutiérrez-Álvarez, J.; Li, W.; Okba, N.M.A.; Albulescu, I.; Widjaja, I.; van Dieren, B.; Fernandez-Delgado, R.; Sola, I.; et al. A Conserved Immunogenic and Vulnerable Site on the Coronavirus Spike Protein Delineated by Cross-Reactive Monoclonal Antibodies. Nat. Commun. 2021, 12, 1715. [Google Scholar] [CrossRef]
- Li, F. Structure, Function, and Evolution of Coronavirus Spike Proteins. Annu. Rev. Virol. 2016, 3, 237–261. [Google Scholar] [CrossRef] [PubMed]
- Pollard, T.D. A Guide to Simple and Informative Binding Assays. Mol. Biol. Cell 2010, 21, 4061–4067. [Google Scholar] [CrossRef]
- Baer, A.; Kehn-Hall, K. Viral Concentration Determination Through Plaque Assays: Using Traditional and Novel Overlay Systems. J. Vis. Exp. 2014, 52065. [Google Scholar] [CrossRef]
- Puren, A.; Gerlach, J.L.; Weigl, B.H.; Kelso, D.M.; Domingo, G.J. Laboratory Operations, Specimen Processing, and Handling for Viral Load Testing and Surveillance. J. Infect. Dis. 2010, 201 (Suppl. 1), S27–S36. [Google Scholar] [CrossRef]
- Gillette, J.R. Problems in Correlating InVitro and InVivo Studies of Drug Metabolism. In Pharmacokinetics: A Modern View; Benet, L.Z., Levy, G., Ferraiolo, B.L., Eds.; Springer: Boston, MA, USA, 1984; pp. 235–252. ISBN 978-1-4613-2799-8. [Google Scholar]
- Faraoni, D.; Schaefer, S.T. Randomized Controlled Trials vs. Observational Studies: Why Not Just Live Together? BMC Anesth. 2016, 16, 102. [Google Scholar] [CrossRef]
- Islam, A.; Bashir, M.S.; Joyce, K.; Rashid, H.; Laher, I.; Elshazly, S. An Update on COVID-19 Vaccine Induced Thrombotic Thrombocytopenia Syndrome and Some Management Recommendations. Molecules 2021, 26, 5004. [Google Scholar] [CrossRef]
- Thomas, G.; Couture, F.; Kwiatkowska, A. The Path to Therapeutic Furin Inhibitors: From Yeast Pheromones to SARS-CoV-2. Int. J. Mol. Sci. 2022, 23, 3435. [Google Scholar] [CrossRef]
- Cheng, Y.-W.; Chao, T.-L.; Li, C.-L.; Chiu, M.-F.; Kao, H.-C.; Wang, S.-H.; Pang, Y.-H.; Lin, C.-H.; Tsai, Y.-M.; Lee, W.-H.; et al. Furin Inhibitors Block SARS-CoV-2 Spike Protein Cleavage to Suppress Virus Production and Cytopathic Effects. Cell Rep. 2020, 33, 108254. [Google Scholar] [CrossRef]
- Wu, C.; Zheng, M.; Yang, Y.; Gu, X.; Yang, K.; Li, M.; Liu, Y.; Zhang, Q.; Zhang, P.; Wang, Y.; et al. Furin: A Potential Therapeutic Target for COVID-19. iScience 2020, 23, 101642. [Google Scholar] [CrossRef]
- Mykytyn, A.Z.; Breugem, T.I.; Riesebosch, S.; Schipper, D.; van den Doel, P.B.; Rottier, R.J.; Lamers, M.M.; Haagmans, B.L. SARS-CoV-2 Entry into Human Airway Organoids Is Serine Protease-Mediated and Facilitated by the Multibasic Cleavage Site. eLife 2021, 10, e64508. [Google Scholar] [CrossRef]
- Rosendal, E.; Mihai, I.S.; Becker, M.; Das, D.; Frängsmyr, L.; Persson, B.D.; Rankin, G.D.; Gröning, R.; Trygg, J.; Forsell, M.; et al. Serine Protease Inhibitors Restrict Host Susceptibility to SARS-CoV-2 Infections. mBio 2022, 13, e0089222. [Google Scholar] [CrossRef]
- Shulla, A.; Heald-Sargent, T.; Subramanya, G.; Zhao, J.; Perlman, S.; Gallagher, T. A Transmembrane Serine Protease Is Linked to the Severe Acute Respiratory Syndrome Coronavirus Receptor and Activates Virus Entry. J. Virol. 2011, 85, 873–882. [Google Scholar] [CrossRef]
- Lu, J.; Hou, Y.; Ge, S.; Wang, X.; Wang, J.; Hu, T.; Lv, Y.; He, H.; Wang, C. Screened Antipsychotic Drugs Inhibit SARS-CoV-2 Binding with ACE2 in Vitro. Life Sci. 2021, 266, 118889. [Google Scholar] [CrossRef]
- Su, S.; Chen, J.; Wang, Y.; Wong, L.M.; Zhu, Z.; Jiang, G.; Liu, P. Lenalidomide Downregulates ACE2 Protein Abundance to Alleviate Infection by SARS-CoV-2 Spike Protein Conditioned Pseudoviruses. Signal Transduct. Target. Ther. 2021, 6, 186. [Google Scholar] [CrossRef]
- Ramadan, A.A.; Mayilsamy, K.; McGill, A.R.; Ghosh, A.; Giulianotti, M.A.; Donow, H.M.; Mohapatra, S.S.; Mohapatra, S.; Chandran, B.; Deschenes, R.J.; et al. Inhibition of SARS-CoV-2 Spike Protein Palmitoylation Reduces Virus Infectivity. bioRxiv 2021. [Google Scholar] [CrossRef]
- Rajpoot, S.; Ohishi, T.; Kumar, A.; Pan, Q.; Banerjee, S.; Zhang, K.Y.J.; Baig, M.S. A Novel Therapeutic Peptide Blocks SARS-CoV-2 Spike Protein Binding with Host Cell ACE2 Receptor. Drugs R&D 2021, 21, 273–283. [Google Scholar] [CrossRef]
- Kruse, K.B.; Brodsky, J.L.; McCracken, A.A. Autophagy: An ER Protein Quality Control Process. Autophagy 2006, 2, 135–137. [Google Scholar] [CrossRef]
- De, R.; Dutta, S. Role of the Microbiome in the Pathogenesis of COVID-19. Front. Cell Infect. Microbiol. 2022, 12, 736397. [Google Scholar] [CrossRef]
- Ramakrishnan, R.K.; Kashour, T.; Hamid, Q.; Halwani, R.; Tleyjeh, I.M. Unraveling the Mystery Surrounding Post-Acute Sequelae of COVID-19. Front. Immunol. 2021, 12, 686029. [Google Scholar] [CrossRef]
- Haran, J.P.; Bradley, E.; Zeamer, A.L.; Cincotta, L.; Salive, M.-C.; Dutta, P.; Mutaawe, S.; Anya, O.; Meza-Segura, M.; Moormann, A.M.; et al. Inflammation-Type Dysbiosis of the Oral Microbiome Associates with the Duration of COVID-19 Symptoms and Long COVID. JCI Insight 2021, 6, e152346. [Google Scholar] [CrossRef]
- Proal, A.D.; VanElzakker, M.B. Long COVID or Post-Acute Sequelae of COVID-19 (PASC): An Overview of Biological Factors That May Contribute to Persistent Symptoms. Front. Microbiol. 2021, 12, 698169. [Google Scholar] [CrossRef]
- Hazan, S.; Stollman, N.; Bozkurt, H.S.; Dave, S.; Papoutsis, A.J.; Daniels, J.; Barrows, B.D.; Quigley, E.M.; Borody, T.J. Lost Microbes of COVID-19: Bifidobacterium, Faecalibacterium Depletion and Decreased Microbiome Diversity Associated with SARS-CoV-2 Infection Severity. BMJ Open Gastroenterol. 2022, 9, e000871. [Google Scholar] [CrossRef]
- Gutiérrez-Castrellón, P.; Gandara-Martí, T.; Abreu Y Abreu, A.T.; Nieto-Rufino, C.D.; López-Orduña, E.; Jiménez-Escobar, I.; Jiménez-Gutiérrez, C.; López-Velazquez, G.; Espadaler-Mazo, J. Probiotic Improves Symptomatic and Viral Clearance in Covid19 Outpatients: A Randomized, Quadruple-Blinded, Placebo-Controlled Trial. Gut Microbes 2022, 14, 2018899. [Google Scholar] [CrossRef]
- Chen, Y.; Gu, S.; Chen, Y.; Lu, H.; Shi, D.; Guo, J.; Wu, W.-R.; Yang, Y.; Li, Y.; Xu, K.-J.; et al. Six-Month Follow-up of Gut Microbiota Richness in Patients with COVID-19. Gut 2022, 71, 222–225. [Google Scholar] [CrossRef]
- Zuo, T.; Wu, X.; Wen, W.; Lan, P. Gut Microbiome Alterations in COVID-19. Genom. Proteom. Bioinform. 2021, 19, 679–688. [Google Scholar] [CrossRef]
- Hibino, S.; Hayashida, K. Modifiable Host Factors for the Prevention and Treatment of COVID-19: Diet and Lifestyle/Diet and Lifestyle Factors in the Prevention of COVID-19. Nutrients 2022, 14, 1876. [Google Scholar] [CrossRef]
- Losso, J.N.; Losso, M.N.; Toc, M.; Inungu, J.N.; Finley, J.W. The Young Age and Plant-Based Diet Hypothesis for Low SARS-CoV-2 Infection and COVID-19 Pandemic in Sub-Saharan Africa. Plant Foods Hum. Nutr. 2021, 76, 270–280. [Google Scholar] [CrossRef]
- Brown, R.B. Low Dietary Sodium Potentially Mediates COVID-19 Prevention Associated with Whole-Food Plant-Based Diets. Br. J. Nutr. 2022, 129, 1136–1141. [Google Scholar] [CrossRef]
- Kim, H.; Rebholz, C.M.; Hegde, S.; LaFiura, C.; Raghavan, M.; Lloyd, J.F.; Cheng, S.; Seidelmann, S.B. Plant-Based Diets, Pescatarian Diets and COVID-19 Severity: A Population-Based Case–Control Study in Six Countries. BMJ Nutr. Prev. Health 2021, 4, 257–266. [Google Scholar] [CrossRef]
- Benton, D.; Williams, C.; Brown, A. Impact of Consuming a Milk Drink Containing a Probiotic on Mood and Cognition. Eur. J. Clin. Nutr. 2007, 61, 355–361. [Google Scholar] [CrossRef]
- de Falco, B.; Amato, M.; Lanzotti, V. Chia Seeds Products: An Overview. Phytochem. Rev. 2017, 16, 745–760. [Google Scholar] [CrossRef]
- Mao, Y.-H.; Xu, Y.; Song, F.; Wang, Z.-M.; Li, Y.-H.; Zhao, M.; He, F.; Tian, Z.; Yang, Y. Protective Effects of Konjac Glucomannan on Gut Microbiome with Antibiotic Perturbation in Mice. Carbohydr. Polym. 2022, 290, 119476. [Google Scholar] [CrossRef]
- Zhang, Y.; Zhao, Y.; Yang, W.; Song, G.; Zhong, P.; Ren, Y.; Zhong, G. Structural Complexity of Konjac Glucomannan and Its Derivatives Governs the Diversity and Outputs of Gut Microbiota. Carbohydr. Polym. 2022, 292, 119639. [Google Scholar] [CrossRef]
- Thomas, R.; Aldous, J.; Forsyth, R.; Chater, A.; Williams, M. The Influence of a Blend of Probiotic Lactobacillus and Prebiotic Inulin on the Duration and Severity of Symptoms among Individuals with COVID-19. Infect. Dis. Diagn. Treat. 2021, 5, 1–12. [Google Scholar]
- Wastyk, H.C.; Fragiadakis, G.K.; Perelman, D.; Dahan, D.; Merrill, B.D.; Yu, F.B.; Topf, M.; Gonzalez, C.G.; Treuren, W.V.; Han, S.; et al. Gut-Microbiota-Targeted Diets Modulate Human Immune Status. Cell 2021, 184, 4137–4153.e14. [Google Scholar] [CrossRef]
- Rossi, G.A.; Sacco, O.; Mancino, E.; Cristiani, L.; Midulla, F. Differences and Similarities between SARS-CoV and SARS-CoV-2: Spike Receptor-Binding Domain Recognition and Host Cell Infection with Support of Cellular Serine Proteases. Infection 2020, 48, 665–669. [Google Scholar] [CrossRef]
- Petersen, E.; Koopmans, M.; Go, U.; Hamer, D.H.; Petrosillo, N.; Castelli, F.; Storgaard, M.; Khalili, S.A.; Simonsen, L. Comparing SARS-CoV-2 with SARS-CoV and Influenza Pandemics. Lancet Infect. Dis. 2020, 20, e238–e244. [Google Scholar] [CrossRef]
- Hoffmann, M.; Kleine-Weber, H.; Pöhlmann, S. A Multibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential for Infection of Human Lung Cells. Mol. Cell 2020, 78, 779–784.e5. [Google Scholar] [CrossRef]
- Coutard, B.; Valle, C.; de Lamballerie, X.; Canard, B.; Seidah, N.G.; Decroly, E. The Spike Glycoprotein of the New Coronavirus 2019-NCoV Contains a Furin-like Cleavage Site Absent in CoV of the Same Clade. Antivir. Res. 2020, 176, 104742. [Google Scholar] [CrossRef] [PubMed]
- Hoffmann, M.; Kleine-Weber, H.; Schroeder, S.; Krüger, N.; Herrler, T.; Erichsen, S.; Schiergens, T.S.; Herrler, G.; Wu, N.-H.; Nitsche, A.; et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 2020, 181, 271–280.e8. [Google Scholar] [CrossRef] [PubMed]
- Hansen, T.; Titze, U.; Kulamadayil-Heidenreich, N.S.A.; Glombitza, S.; Tebbe, J.J.; Röcken, C.; Schulz, B.; Weise, M.; Wilkens, L. First Case of Postmortem Study in a Patient Vaccinated against SARS-CoV-2. Int. J. Infect. Dis. 2021, 107, 172–175. [Google Scholar] [CrossRef]
- Polack, F.P.; Thomas, S.J.; Kitchin, N.; Absalon, J.; Gurtman, A.; Lockhart, S.; Perez, J.L.; Pérez Marc, G.; Moreira, E.D.; Zerbini, C.; et al. Safety and Efficacy of the BNT162b2 MRNA COVID-19 Vaccine. N. Engl. J. Med. 2020, 383, 2603–2615. [Google Scholar] [CrossRef]
- Corbett, K.S.; Flynn, B.; Foulds, K.E.; Francica, J.R.; Boyoglu-Barnum, S.; Werner, A.P.; Flach, B.; O’Connell, S.; Bock, K.W.; Minai, M.; et al. Evaluation of the MRNA-1273 Vaccine against SARS-CoV-2 in Nonhuman Primates. N. Engl. J. Med. 2020, 383, 1544–1555. [Google Scholar] [CrossRef]
- Bos, R.; Rutten, L.; van der Lubbe, J.E.M.; Bakkers, M.J.G.; Hardenberg, G.; Wegmann, F.; Zuijdgeest, D.; de Wilde, A.H.; Koornneef, A.; Verwilligen, A.; et al. Ad26 Vector-Based COVID-19 Vaccine Encoding a Prefusion-Stabilized SARS-CoV-2 Spike Immunogen Induces Potent Humoral and Cellular Immune Responses. Npj Vaccines 2020, 5, 91. [Google Scholar] [CrossRef]
- Bangaru, S.; Ozorowski, G.; Turner, H.L.; Antanasijevic, A.; Huang, D.; Wang, X.; Torres, J.L.; Diedrich, J.K.; Tian, J.-H.; Portnoff, A.D.; et al. Structural Analysis of Full-Length SARS-CoV-2 Spike Protein from an Advanced Vaccine Candidate. Science 2020, 370, 1089–1094. [Google Scholar] [CrossRef]
- Pallesen, J.; Wang, N.; Corbett, K.S.; Wrapp, D.; Kirchdoerfer, R.N.; Turner, H.L.; Cottrell, C.A.; Becker, M.M.; Wang, L.; Shi, W.; et al. Immunogenicity and Structures of a Rationally Designed Prefusion MERS-CoV Spike Antigen. Proc. Natl. Acad. Sci. USA 2017, 114, E7348–E7357. [Google Scholar] [CrossRef]
- Watanabe, Y.; Mendonça, L.; Allen, E.R.; Howe, A.; Lee, M.; Allen, J.D.; Chawla, H.; Pulido, D.; Donnellan, F.; Davies, H.; et al. Native-like SARS-CoV-2 Spike Glycoprotein Expressed by ChAdOx1 NCoV-19/AZD1222 Vaccine. ACS Cent. Sci. 2021, 7, 594–602. [Google Scholar] [CrossRef]
- Gao, Q.; Bao, L.; Mao, H.; Wang, L.; Xu, K.; Yang, M.; Li, Y.; Zhu, L.; Wang, N.; Lv, Z.; et al. Development of an Inactivated Vaccine Candidate for SARS-CoV-2. Science 2020, 369, 77–81. [Google Scholar] [CrossRef] [PubMed]
- Lu, M.; Chamblee, M.; Zhang, Y.; Ye, C.; Dravid, P.; Park, J.-G.; Mahesh, K.; Trivedi, S.; Murthy, S.; Sharma, H.; et al. SARS-CoV-2 Prefusion Spike Protein Stabilized by Six Rather than Two Prolines Is More Potent for Inducing Antibodies That Neutralize Viral Variants of Concern. Proc. Natl. Acad. Sci. USA 2022, 119, e2110105119. [Google Scholar] [CrossRef] [PubMed]
- Amanat, F.; Strohmeier, S.; Rathnasinghe, R.; Schotsaert, M.; Coughlan, L.; García-Sastre, A.; Krammer, F. Introduction of Two Prolines and Removal of the Polybasic Cleavage Site Lead to Higher Efficacy of a Recombinant Spike-Based SARS-CoV-2 Vaccine in the Mouse Model. mBio 2021, 12, e02648-20. [Google Scholar] [CrossRef] [PubMed]
- Murza, A.; Dion, S.P.; Boudreault, P.-L.; Désilets, A.; Leduc, R.; Marsault, É. Inhibitors of Type II Transmembrane Serine Proteases in the Treatment of Diseases of the Respiratory Tract—A Review of Patent Literature. Expert. Opin. Pat. 2020, 30, 807–824. [Google Scholar] [CrossRef]
- Rahman, N.; Basharat, Z.; Yousuf, M.; Castaldo, G.; Rastrelli, L.; Khan, H. Virtual Screening of Natural Products against Type II Transmembrane Serine Protease (TMPRSS2), the Priming Agent of Coronavirus 2 (SARS-CoV-2). Molecules 2020, 25, 2271. [Google Scholar] [CrossRef]
- Azouz, N.P.; Klingler, A.M.; Callahan, V.; Akhrymuk, I.V.; Elez, K.; Raich, L.; Henry, B.M.; Benoit, J.L.; Benoit, S.W.; Noé, F.; et al. Alpha 1 Antitrypsin Is an Inhibitor of the SARS-CoV-2-Priming Protease TMPRSS2. Pathog. Immun. 2021, 6, 55–74. [Google Scholar] [CrossRef]
- Longo, V.D.; Mattson, M.P. Fasting: Molecular Mechanisms and Clinical Applications. Cell Metab. 2014, 19, 181–192. [Google Scholar] [CrossRef] [PubMed]
- Bagherniya, M.; Butler, A.E.; Barreto, G.E.; Sahebkar, A. The Effect of Fasting or Calorie Restriction on Autophagy Induction: A Review of the Literature. Ageing Res. Rev. 2018, 47, 183–197. [Google Scholar] [CrossRef] [PubMed]
- Brandhorst, S.; Longo, V.D. Protein Quantity and Source, Fasting-Mimicking Diets, and Longevity. Adv. Nutr. 2019, 10, S340–S350. [Google Scholar] [CrossRef] [PubMed]
- Shuvayeva, G.; Bobak, Y.; Igumentseva, N.; Titone, R.; Morani, F.; Stasyk, O.; Isidoro, C. Single Amino Acid Arginine Deprivation Triggers Prosurvival Autophagic Response in Ovarian Carcinoma SKOV3. Biomed. Res. Int. 2014, 2014, 505041. [Google Scholar] [CrossRef] [PubMed]
- Horne, B.D.; May, H.T.; Muhlestein, J.B.; Le, V.T.; Bair, T.L.; Knowlton, K.U.; Anderson, J.L. Association of Periodic Fasting with Lower Severity of COVID-19 Outcomes in the SARS-CoV-2 Prevaccine Era: An Observational Cohort from the INSPIRE Registry. BMJ Nutr. Prev. Health 2022, 5, 145–153. [Google Scholar] [CrossRef] [PubMed]
- Nishimura, K.; Shiina, R.; Kashiwagi, K.; Igarashi, K. Decrease in Polyamines with Aging and Their Ingestion from Food and Drink. J. Biochem. 2006, 139, 81–90. [Google Scholar] [CrossRef]
- Eisenberg, T.; Knauer, H.; Schauer, A.; Büttner, S.; Ruckenstuhl, C.; Carmona-Gutierrez, D.; Ring, J.; Schroeder, S.; Magnes, C.; Antonacci, L.; et al. Induction of Autophagy by Spermidine Promotes Longevity. Nat. Cell Biol. 2009, 11, 1305–1314. [Google Scholar] [CrossRef]
- Summers, C.M.; Valentine, R.J. Acute Heat Exposure Alters Autophagy Signaling in C2C12 Myotubes. Front. Physiol. 2020, 10, 1521. [Google Scholar] [CrossRef]
- McCormick, J.J.; Dokladny, K.; Moseley, P.L.; Kenny, G.P. Autophagy and Heat: A Potential Role for Heat Therapy to Improve Autophagic Function in Health and Disease. J. Appl. Physiol. 2021, 130, 1–9. [Google Scholar] [CrossRef]
- D’Arcy, M.S. A Review of Biologically Active Flavonoids as Inducers of Autophagy and Apoptosis in Neoplastic Cells and as Cytoprotective Agents in Non-Neoplastic Cells. Cell Biol. Int. 2022, 46, 1179–1195. [Google Scholar] [CrossRef]
- Hasima, N.; Ozpolat, B. Regulation of Autophagy by Polyphenolic Compounds as a Potential Therapeutic Strategy for Cancer. Cell Death Dis. 2014, 5, e1509. [Google Scholar] [CrossRef]
- Lin, S.-R.; Fu, Y.-S.; Tsai, M.-J.; Cheng, H.; Weng, C.-F. Natural Compounds from Herbs That Can Potentially Execute as Autophagy Inducers for Cancer Therapy. Int. J. Mol. Sci. 2017, 18, 1412. [Google Scholar] [CrossRef]
- Pietrocola, F.; Malik, S.A.; Mariño, G.; Vacchelli, E.; Senovilla, L.; Chaba, K.; Niso-Santano, M.; Maiuri, M.C.; Madeo, F.; Kroemer, G. Coffee Induces Autophagy in Vivo. Cell Cycle 2014, 13, 1987–1994. [Google Scholar] [CrossRef]
- Ferraresi, A.; Titone, R.; Follo, C.; Castiglioni, A.; Chiorino, G.; Dhanasekaran, D.N.; Isidoro, C. The Protein Restriction Mimetic Resveratrol Is an Autophagy Inducer Stronger than Amino Acid Starvation in Ovarian Cancer Cells. Mol. Carcinog. 2017, 56, 2681–2691. [Google Scholar] [CrossRef]
- Lu, G.; Wu, Z.; Shang, J.; Xie, Z.; Chen, C.; Zhang, C. The Effects of Metformin on Autophagy. Biomed. Pharmacother. 2021, 137, 111286. [Google Scholar] [CrossRef]
- Guo, J.; Nie, J.; Chen, Z.; Wang, X.; Hu, H.; Xu, J.; Lu, J.; Ma, L.; Ji, H.; Yuan, J.; et al. Cold Exposure-Induced Endoplasmic Reticulum Stress Regulates Autophagy through the SIRT2/FoxO1 Signaling Pathway. J. Cell. Physiol. 2022, 237, 3960–3970. [Google Scholar] [CrossRef]
- Yau, W.W.; Wong, K.A.; Zhou, J.; Thimmukonda, N.K.; Wu, Y.; Bay, B.-H.; Singh, B.K.; Yen, P.M. Chronic Cold Exposure Induces Autophagy to Promote Fatty Acid Oxidation, Mitochondrial Turnover, and Thermogenesis in Brown Adipose Tissue. iScience 2021, 24, 102434. [Google Scholar] [CrossRef]
- Wang, Y.-C.; Zhang, S.; Du, T.-Y.; Wang, B.; Sun, X.-Q. Hyperbaric Oxygen Preconditioning Reduces Ischemia–Reperfusion Injury by Stimulating Autophagy in Neurocyte. Brain Res. 2010, 1323, 149–151. [Google Scholar] [CrossRef] [PubMed]
- Sun, P.; Xu, W.; Zhao, X.; Zhang, C.; Lin, X.; Gong, M.; Fu, Z. Ozone Induces Autophagy by Activating PPARγ/MTOR in Rat Chondrocytes Treated with IL-1β. J. Orthop. Surg. Res. 2022, 17, 351. [Google Scholar] [CrossRef]
- Mojtabavi, H.; Saghazadeh, A.; Rezaei, N. Interleukin-6 and Severe COVID-19: A Systematic Review and Meta-Analysis. Eur. Cytokine Netw. 2020, 31, 44–49. [Google Scholar] [CrossRef] [PubMed]
- Kell, D.B.; Laubscher, G.J.; Pretorius, E. A Central Role for Amyloid Fibrin Microclots in Long COVID/PASC: Origins and Therapeutic Implications. Biochem. J. 2022, 479, 537–559. [Google Scholar] [CrossRef] [PubMed]
- Pretorius, E.; Vlok, M.; Venter, C.; Bezuidenhout, J.A.; Laubscher, G.J.; Steenkamp, J.; Kell, D.B. Persistent Clotting Protein Pathology in Long COVID/Post-Acute Sequelae of COVID-19 (PASC) Is Accompanied by Increased Levels of Antiplasmin. Cardiovasc. Diabetol. 2021, 20, 172. [Google Scholar] [CrossRef]
- Pretorius, E.; Venter, C.; Laubscher, G.J.; Kotze, M.J.; Oladejo, S.O.; Watson, L.R.; Rajaratnam, K.; Watson, B.W.; Kell, D.B. Prevalence of Symptoms, Comorbidities, Fibrin Amyloid Microclots and Platelet Pathology in Individuals with Long COVID/Post-Acute Sequelae of COVID-19 (PASC). Cardiovasc. Diabetol. 2022, 21, 148. [Google Scholar] [CrossRef]
- Chang, J.C.; Hawley, H.B. Vaccine-Associated Thrombocytopenia and Thrombosis: Venous Endotheliopathy Leading to Venous Combined Micro-Macrothrombosis. Medicina 2021, 57, 1163. [Google Scholar] [CrossRef] [PubMed]
- Mainous, A.G.; Rooks, B.J.; Orlando, F.A. The Impact of Initial COVID-19 Episode Inflammation Among Adults on Mortality Within 12 Months Post-Hospital Discharge. Front. Med. 2022, 9, 891375. [Google Scholar] [CrossRef]
- Aydınyılmaz, F.; Aksakal, E.; Pamukcu, H.E.; Aydemir, S.; Doğan, R.; Saraç, İ.; Aydın, S.Ş.; Kalkan, K.; Gülcü, O.; Tanboğa, İ.H. Significance of MPV, RDW and PDW with the Severity and Mortality of COVID-19 and Effects of Acetylsalicylic Acid Use. Clin. Appl. Thromb. Hemost. 2021, 27, 10760296211048808. [Google Scholar] [CrossRef]
- Bianconi, V.; Violi, F.; Fallarino, F.; Pignatelli, P.; Sahebkar, A.; Pirro, M. Is Acetylsalicylic Acid a Safe and Potentially Useful Choice for Adult Patients with COVID-19 ? Drugs 2020, 80, 1383–1396. [Google Scholar] [CrossRef]
- Clissold, S.P. Aspirin and Related Derivatives of Salicylic Acid. Drugs 1986, 32, 8–26. [Google Scholar] [CrossRef] [PubMed]
- Storstein, O.; Nitter-Hauge, S.; Enge, I. Thromboembolic Complications in Coronary Angiography: Prevention with Acetyl-Salicylic Acid. Acta Radiol. Diagn. 1977, 18, 555–560. [Google Scholar] [CrossRef] [PubMed]
- Østerud, B.; Brox, J.H. The Clotting Time of Whole Blood in Plastic Tubes: The Influence of Exercise, Prostacyclin and Acetylsalicylic Acid. Thromb. Res. 1983, 29, 425–435. [Google Scholar] [CrossRef]
- Fujita, M.; Nomura, K.; Hong, K.; Ito, Y.; Asada, A.; Nishimuro, S. Purification and Characterization of a Strong Fibrinolytic Enzyme (Nattokinase) in the Vegetable Cheese Natto, a Popular Soybean Fermented Food in Japan. Biochem. Biophys. Res. Commun. 1993, 197, 1340–1347. [Google Scholar] [CrossRef]
- Hsu, R.-L.; Lee, K.-T.; Wang, J.-H.; Lee, L.Y.-L.; Chen, R.P.-Y. Amyloid-Degrading Ability of Nattokinase from Bacillus Subtilis Natto. J. Agric. Food Chem. 2009, 57, 503–508. [Google Scholar] [CrossRef]
- Oba, M.; Rongduo, W.; Saito, A.; Okabayashi, T.; Yokota, T.; Yasuoka, J.; Sato, Y.; Nishifuji, K.; Wake, H.; Nibu, Y.; et al. Natto Extract, a Japanese Fermented Soybean Food, Directly Inhibits Viral Infections Including SARS-CoV-2 in Vitro. Biochem. Biophys. Res. Commun. 2021, 570, 21–25. [Google Scholar] [CrossRef]
- Tanikawa, T.; Kiba, Y.; Yu, J.; Hsu, K.; Chen, S.; Ishii, A.; Yokogawa, T.; Suzuki, R.; Inoue, Y.; Kitamura, M. Degradative Effect of Nattokinase on Spike Protein of SARS-CoV-2. Molecules 2022, 27, 5405. [Google Scholar] [CrossRef] [PubMed]
- Kurosawa, Y.; Nirengi, S.; Homma, T.; Esaki, K.; Ohta, M.; Clark, J.F.; Hamaoka, T. A Single-Dose of Oral Nattokinase Potentiates Thrombolysis and Anti-Coagulation Profiles. Sci. Rep. 2015, 5, 11601. [Google Scholar] [CrossRef] [PubMed]
- Behera, P.; Patro, B.K.; Singh, A.K.; Chandanshive, P.D.; Ravikumar, S.R.; Pradhan, S.K.; Pentapati, S.S.K.; Batmanabane, G.; Mohapatra, P.R.; Padhy, B.M.; et al. Role of Ivermectin in the Prevention of SARS-CoV-2 Infection among Healthcare Workers in India: A Matched Case-Control Study. PLoS ONE 2021, 16, e0247163. [Google Scholar] [CrossRef] [PubMed]
- Zaidi, A.K.; Dehgani-Mobaraki, P. The Mechanisms of Action of Ivermectin against SARS-CoV-2—An Extensive Review. J. Antibiot. 2022, 75, 60–71. [Google Scholar] [CrossRef]
- Caly, L.; Druce, J.D.; Catton, M.G.; Jans, D.A.; Wagstaff, K.M. The FDA-Approved Drug Ivermectin Inhibits the Replication of SARS-CoV-2 in Vitro. Antivir. Res. 2020, 178, 104787. [Google Scholar] [CrossRef]
- Bryant, A.; Lawrie, T.A.; Dowswell, T.; Fordham, E.J.; Mitchell, S.; Hill, S.R.; Tham, T.C. Ivermectin for Prevention and Treatment of COVID-19 Infection: A Systematic Review, Meta-Analysis, and Trial Sequential Analysis to Inform Clinical Guidelines. Am. J. Ther. 2021, 28, e434–e460. [Google Scholar] [CrossRef]
- Kory, P.; Meduri, G.U.; Varon, J.; Iglesias, J.; Marik, P.E. Review of the Emerging Evidence Demonstrating the Efficacy of Ivermectin in the Prophylaxis and Treatment of COVID-19. Am. J. Ther. 2021, 28, e299–e318. [Google Scholar] [CrossRef]
- Griesel, M.; Wagner, C.; Mikolajewska, A.; Stegemann, M.; Fichtner, F.; Metzendorf, M.-I.; Nair, A.A.; Daniel, J.; Fischer, A.-L.; Skoetz, N. Inhaled Corticosteroids for the Treatment of COVID-19. Cochrane Database Syst. Rev. 2022, 3, CD015125. [Google Scholar] [CrossRef]
- van Paassen, J.; Vos, J.S.; Hoekstra, E.M.; Neumann, K.M.I.; Boot, P.C.; Arbous, S.M. Corticosteroid Use in COVID-19 Patients: A Systematic Review and Meta-Analysis on Clinical Outcomes. Crit. Care 2020, 24, 696. [Google Scholar] [CrossRef]
- Goel, N.; Goyal, N.; Nagaraja, R.; Kumar, R. Systemic Corticosteroids for Management of ‘Long-COVID’: An Evaluation after 3 Months of Treatment. Monaldi Arch. Chest Dis. 2022, 92. [Google Scholar] [CrossRef]
- Morán Blanco, J.I.; Alvarenga Bonilla, J.A.; Homma, S.; Suzuki, K.; Fremont-Smith, P.; Villar Gómez de las Heras, K. Antihistamines and Azithromycin as a Treatment for COVID-19 on Primary Health Care—A Retrospective Observational Study in Elderly Patients. Pulm. Pharmacol. Ther. 2021, 67, 101989. [Google Scholar] [CrossRef]
- Pinto, M.D.; Lambert, N.; Downs, C.A.; Abrahim, H.; Hughes, T.D.; Rahmani, A.M.; Burton, C.W.; Chakraborty, R. Antihistamines for Postacute Sequelae of SARS-CoV-2 Infection. J. Nurse Pract. 2022, 18, 335–338. [Google Scholar] [CrossRef]
- Reznikov, L.R.; Norris, M.H.; Vashisht, R.; Bluhm, A.P.; Li, D.; Liao, Y.-S.J.; Brown, A.; Butte, A.J.; Ostrov, D.A. Identification of Antiviral Antihistamines for COVID-19 Repurposing. Biochem. Biophys. Res. Commun. 2021, 538, 173–179. [Google Scholar] [CrossRef]
- Tantry, U.S.; Bliden, K.P.; Gurbel, P.A. Further Evidence for the Use of Aspirin in COVID-19. Int. J. Cardiol. 2022, 346, 107–108. [Google Scholar] [CrossRef]
- Choubey, A.; Dehury, B.; Kumar, S.; Medhi, B.; Mondal, P. Naltrexone a Potential Therapeutic Candidate for COVID-19. J. Biomol. Struct. Dyn. 2022, 40, 963–970. [Google Scholar] [CrossRef] [PubMed]
- O’Kelly, B.; Vidal, L.; McHugh, T.; Woo, J.; Avramovic, G.; Lambert, J.S. Safety and Efficacy of Low Dose Naltrexone in a Long Covid Cohort; an Interventional Pre-Post Study. Brain. Behav. Immun. Health 2022, 24, 100485. [Google Scholar] [CrossRef]
- Karatza, E.; Ismailos, G.; Karalis, V. Colchicine for the Treatment of COVID-19 Patients: Efficacy, Safety, and Model Informed Dosage Regimens. Xenobiotica 2021, 51, 643–656. [Google Scholar] [CrossRef] [PubMed]
- Chiu, L.; Lo, C.-H.; Shen, M.; Chiu, N.; Aggarwal, R.; Lee, J.; Choi, Y.-G.; Lam, H.; Prsic, E.H.; Chow, R.; et al. Colchicine Use in Patients with COVID-19: A Systematic Review and Meta-Analysis. PLoS ONE 2021, 16, e0261358. [Google Scholar] [CrossRef]
- Rabbani, A.B.; Parikh, R.V.; Rafique, A.M. Colchicine for the Treatment of Myocardial Injury in Patients With Coronavirus Disease 2019 (COVID-19)—An Old Drug With New Life? JAMA Netw. Open 2020, 3, e2013556. [Google Scholar] [CrossRef] [PubMed]
- Fiolet, A.T.L.; Opstal, T.S.J.; Mosterd, A.; Eikelboom, J.W.; Jolly, S.S.; Keech, A.C.; Kelly, P.; Tong, D.C.; Layland, J.; Nidorf, S.M.; et al. Efficacy and Safety of Low-Dose Colchicine in Patients with Coronary Disease: A Systematic Review and Meta-Analysis of Randomized Trials. Eur. Heart J. 2021, 42, 2765–2775. [Google Scholar] [CrossRef]
- Ibrahim, S.; Lowe, J.R.; Bramante, C.T.; Shah, S.; Klatt, N.R.; Sherwood, N.; Aronne, L.; Puskarich, M.; Tamariz, L.; Palacio, A.; et al. Metformin and Covid-19: Focused Review of Mechanisms and Current Literature Suggesting Benefit. Front. Endocrinol. 2021, 12, 587801. [Google Scholar] [CrossRef] [PubMed]
- Bramante, C.T.; Buse, J.B.; Liebovitz, D.M.; Nicklas, J.L.; Puskarich, M.A.; Cohen, K.; Belani, H.; Anderson, B.; Huling, J.D.; Tignanelli, C.J.; et al. Outpatient Treatment of COVID-19 with Metformin, Ivermectin, and Fluvoxamine and the Development of Long Covid over 10-Month Follow-Up. medRxiv 2022. [Google Scholar] [CrossRef]
- Barrea, L.; Verde, L.; Grant, W.B.; Frias-Toral, E.; Sarno, G.; Vetrani, C.; Ceriani, F.; Garcia-Velasquez, E.; Contreras-Briceño, J.; Savastano, S.; et al. Vitamin D: A Role Also in Long COVID-19? Nutrients 2022, 14, 1625. [Google Scholar] [CrossRef] [PubMed]
- Gönen, M.S.; Alaylıoğlu, M.; Durcan, E.; Özdemir, Y.; Şahin, S.; Konukoğlu, D.; Nohut, O.K.; Ürkmez, S.; Küçükece, B.; Balkan, İ.İ.; et al. Rapid and Effective Vitamin D Supplementation May Present Better Clinical Outcomes in COVID-19 (SARS-CoV-2) Patients by Altering Serum INOS1, IL1B, IFNg, Cathelicidin-LL37, and ICAM1. Nutrients 2021, 13, 4047. [Google Scholar] [CrossRef]
- Vollbracht, C.; Kraft, K. Feasibility of Vitamin C in the Treatment of Post Viral Fatigue with Focus on Long COVID, Based on a Systematic Review of IV Vitamin C on Fatigue. Nutrients 2021, 13, 1154. [Google Scholar] [CrossRef] [PubMed]
- Vollbracht, C.; Kraft, K. Oxidative Stress and Hyper-Inflammation as Major Drivers of Severe COVID-19 and Long COVID: Implications for the Benefit of High-Dose Intravenous Vitamin C. Front. Pharm. 2022, 13, 899198. [Google Scholar] [CrossRef]
- Tosato, M.; Calvani, R.; Picca, A.; Ciciarello, F.; Galluzzo, V.; Coelho-Júnior, H.J.; Di Giorgio, A.; Di Mario, C.; Gervasoni, J.; Gremese, E.; et al. Effects of L-Arginine Plus Vitamin C Supplementation on Physical Performance, Endothelial Function, and Persistent Fatigue in Adults with Long COVID: A Single-Blind Randomized Controlled Trial. Nutrients 2022, 14, 4984. [Google Scholar] [CrossRef]
- Izzo, R.; Trimarco, V.; Mone, P.; Aloè, T.; Capra Marzani, M.; Diana, A.; Fazio, G.; Mallardo, M.; Maniscalco, M.; Marazzi, G.; et al. Combining L-Arginine with Vitamin C Improves Long-COVID Symptoms: The LINCOLN Survey. Pharm. Res. 2022, 183, 106360. [Google Scholar] [CrossRef]
- Mangge, H.; Prueller, F.; Dawczynski, C.; Curcic, P.; Sloup, Z.; Holter, M.; Herrmann, M.; Meinitzer, A. Dramatic Decrease of Vitamin K2 Subtype Menaquinone-7 in COVID-19 Patients. Antioxidants 2022, 11, 1235. [Google Scholar] [CrossRef]
- Debnath, U.; Dewaker, V.; Prabhakar, Y.S.; Bhattacharyya, P.; Mandal, A. Conformational Perturbation of SARS-CoV-2 Spike Protein Using N-Acetyl Cysteine, a Molecular Scissor: A Probable Strategy to Combat COVID-19. ChemRxiv 2021. [Google Scholar] [CrossRef]
- Shi, Z.; Puyo, C.A. N-Acetylcysteine to Combat COVID-19: An Evidence Review. Clin. Risk Manag. 2020, 16, 1047–1055. [Google Scholar] [CrossRef] [PubMed]
- Wong, K.K.; Lee, S.W.H.; Kua, K.P. N-Acetylcysteine as Adjuvant Therapy for COVID-19—A Perspective on the Current State of the Evidence. J. Inflamm. Res. 2021, 14, 2993–3013. [Google Scholar] [CrossRef] [PubMed]
- Sengupta, P.; Dutta, S. N-Acetyl Cysteine as a Potential Regulator of SARS-CoV-2-Induced Male Reproductive Disruptions. Middle East Fertil. Soc. J. 2022, 27, 14. [Google Scholar] [CrossRef] [PubMed]
- Debnath, U.; Mitra, A.; Dewaker, V.; Prabhakar, Y.S.; Tadala, R.; Krishnan, K.; Wagh, P.; Velusamy, U.; Subramani, C.; Agarwal, S.; et al. N-Acetyl Cysteine: A Tool to Perturb SARS-CoV-2 Spike Protein Conformation. ChemRxiv 2021. [Google Scholar] [CrossRef]
- Amin, A.N. The Role of Glutathione Deficiency and MSIDS Variables in Long COVID-19. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT05371288 (accessed on 30 September 2022).
- Guloyan, V.; Oganesian, B.; Baghdasaryan, N.; Yeh, C.; Singh, M.; Guilford, F.; Ting, Y.-S.; Venketaraman, V. Glutathione Supplementation as an Adjunctive Therapy in COVID-19. Antioxidants 2020, 9, 914. [Google Scholar] [CrossRef] [PubMed]
- Polonikov, A. Endogenous Deficiency of Glutathione as the Most Likely Cause of Serious Manifestations and Death in COVID-19 Patients. ACS Infect. Dis. 2020, 6, 1558–1562. [Google Scholar] [CrossRef]
- Silvagno, F.; Vernone, A.; Pescarmona, G.P. The Role of Glutathione in Protecting against the Severe Inflammatory Response Triggered by COVID-19. Antioxidants 2020, 9, 624. [Google Scholar] [CrossRef]
- Cardinali, D.P.; Brown, G.M.; Pandi-Perumal, S.R. Possible Application of Melatonin in Long COVID. Biomolecules 2022, 12, 1646. [Google Scholar] [CrossRef]
- Lan, S.-H.; Lee, H.-Z.; Chao, C.-M.; Chang, S.-P.; Lu, L.-C.; Lai, C.-C. Efficacy of Melatonin in the Treatment of Patients with COVID-19: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. J. Med. Virol. 2022, 94, 2102–2107. [Google Scholar] [CrossRef]
- Derosa, G.; Maffioli, P.; D’Angelo, A.; Di Pierro, F. A Role for Quercetin in Coronavirus Disease 2019 (COVID-19). Phytother. Res. 2021, 35, 1230–1236. [Google Scholar] [CrossRef]
- Tuli, H.; Sood, S.; Pundir, A.; Choudhary, D.; Dhama, K.; Kaur, G.; Seth, P.; Vashishth, A.; Kumar, P. Molecular Docking Studies of Apigenin, Kaempferol, and Quercetin as Potential Target against Spike Receptor Protein of SARS COV. J. Exp. Biol. Agric. Sci. 2022, 10, 144–149. [Google Scholar] [CrossRef]
- Önal, H.; Arslan, B.; Üçüncü Ergun, N.; Topuz, Ş.; Yilmaz Semerci, S.; Kurnaz, M.E.; Molu, Y.M.; Bozkurt, M.A.; Süner, N.; Kocataş, A. Treatment of COVID-19 Patients with Quercetin: A Prospective, Single Center, Randomized, Controlled Trial. Turk. J. Biol. 2021, 45, 518–529. [Google Scholar] [CrossRef] [PubMed]
- Pan, B.; Fang, S.; Zhang, J.; Pan, Y.; Liu, H.; Wang, Y.; Li, M.; Liu, L. Chinese Herbal Compounds against SARS-CoV-2: Puerarin and Quercetin Impair the Binding of Viral S-Protein to ACE2 Receptor. Comput. Struct. Biotechnol. J. 2020, 18, 3518–3527. [Google Scholar] [CrossRef] [PubMed]
- Manjunath, S.H.; Thimmulappa, R.K. Antiviral, Immunomodulatory, and Anticoagulant Effects of Quercetin and Its Derivatives: Potential Role in Prevention and Management of COVID-19. J. Pharm. Anal. 2022, 12, 29–34. [Google Scholar] [CrossRef]
- Khan, A.; Iqtadar, S.; Mumtaz, S.U.; Heinrich, M.; Pascual-Figal, D.A.; Livingstone, S.; Abaidullah, S. Oral Co-Supplementation of Curcumin, Quercetin, and Vitamin D3 as an Adjuvant Therapy for Mild to Moderate Symptoms of COVID-19—Results From a Pilot Open-Label, Randomized Controlled Trial. Front. Pharm. 2022, 13, 898062. [Google Scholar] [CrossRef] [PubMed]
- Ho, T.-Y.; Wu, S.-L.; Chen, J.-C.; Li, C.-C.; Hsiang, C.-Y. Emodin Blocks the SARS Coronavirus Spike Protein and Angiotensin-Converting Enzyme 2 Interaction. Antivir. Res. 2007, 74, 92–101. [Google Scholar] [CrossRef]
- Maideen, N.M.P. Prophetic Medicine-Nigella Sativa (Black Cumin Seeds)—Potential Herb for COVID-19? J. Pharmacopunct. 2020, 23, 62–70. [Google Scholar] [CrossRef]
- Rahman, M.T. Potential Benefits of Combination of Nigella Sativa and Zn Supplements to Treat COVID-19. J. Herb. Med. 2020, 23, 100382. [Google Scholar] [CrossRef]
- Banerjee, A.; Kanwar, M.; Das Mohapatra, P.K.; Saso, L.; Nicoletti, M.; Maiti, S. Nigellidine (Nigella Sativa, Black-Cumin Seed) Docking to SARS CoV-2 Nsp3 and Host Inflammatory Proteins May Inhibit Viral Replication/Transcription and FAS-TNF Death Signal via TNFR ½ Blocking. Nat. Prod. Res. 2021, 36, 5817–5822. [Google Scholar] [CrossRef]
- Giordo, R.; Zinellu, A.; Eid, A.H.; Pintus, G. Therapeutic Potential of Resveratrol in COVID-19-Associated Hemostatic Disorders. Molecules 2021, 26, 856. [Google Scholar] [CrossRef]
- Pasquereau, S.; Nehme, Z.; Haidar Ahmad, S.; Daouad, F.; Van Assche, J.; Wallet, C.; Schwartz, C.; Rohr, O.; Morot-Bizot, S.; Herbein, G. Resveratrol Inhibits HcoV-229E and SARS-CoV-2 Coronavirus Replication In Vitro. Viruses 2021, 13, 354. [Google Scholar] [CrossRef] [PubMed]
- Ramdani, L.H.; Bachari, K. Potential Therapeutic Effects of Resveratrol against SARS-CoV-2. Acta Virol. 2020, 64, 276–280. [Google Scholar] [CrossRef] [PubMed]
- McCreary, M.R.; Schnell, P.M.; Rhoda, D.A. Randomized Double-Blind Placebo-Controlled Proof-of-Concept Trial of Resveratrol for Outpatient Treatment of Mild Coronavirus Disease (COVID-19). Sci. Rep. 2022, 12, 10978. [Google Scholar] [CrossRef]
- Zahedipour, F.; Hosseini, S.A.; Sathyapalan, T.; Majeed, M.; Jamialahmadi, T.; Al-Rasadi, K.; Banach, M.; Sahebkar, A. Potential Effects of Curcumin in the Treatment of COVID-19 Infection. Phytother. Res. 2020, 34, 2911–2920. [Google Scholar] [CrossRef] [PubMed]
- Suravajhala, R.; Parashar, A.; Malik, B.; Nagaraj, A.V.; Padmanaban, G.; Kishor, P.K.; Polavarapu, R.; Suravajhala, P. Comparative Docking Studies on Curcumin with COVID-19 Proteins. Preprints 2020, 2020050439. [Google Scholar] [CrossRef]
- Jena, A.B.; Kanungo, N.; Nayak, V.; Chainy, G.B.N.; Dandapat, J. Catechin and Curcumin Interact with S Protein of SARS-CoV2 and ACE2 of Human Cell Membrane: Insights from Computational Studies. Sci. Rep. 2021, 11, 2043. [Google Scholar] [CrossRef]
- Rattis, B.A.C.; Ramos, S.G.; Celes, M.R.N. Curcumin as a Potential Treatment for COVID-19. Front. Pharmacol. 2021, 12, 2085. [Google Scholar] [CrossRef]
- Vahedian-Azimi, A.; Abbasifard, M.; Rahimi-Bashar, F.; Guest, P.C.; Majeed, M.; Mohammadi, A.; Banach, M.; Jamialahmadi, T.; Sahebkar, A. Effectiveness of Curcumin on Outcomes of Hospitalized COVID-19 Patients: A Systematic Review of Clinical Trials. Nutrients 2022, 14, 256. [Google Scholar] [CrossRef]
- Abdelazeem, B.; Awad, A.K.; Elbadawy, M.A.; Manasrah, N.; Malik, B.; Yousaf, A.; Alqasem, S.; Banour, S.; Abdelmohsen, S.M. The Effects of Curcumin as Dietary Supplement for Patients with COVID-19: A Systematic Review of Randomized Clinical Trials. Drug Discov. Ther. 2022, 16, 14–22. [Google Scholar] [CrossRef]
- Iotti, S.; Wolf, F.; Mazur, A.; Maier, J.A. The COVID-19 Pandemic: Is There a Role for Magnesium? Hypotheses and Perspectives. Magnes. Res. 2020, 33, 21–27. [Google Scholar] [CrossRef]
- Tang, C.-F.; Ding, H.; Jiao, R.-Q.; Wu, X.-X.; Kong, L.-D. Possibility of Magnesium Supplementation for Supportive Treatment in Patients with COVID-19. Eur. J. Pharm. 2020, 886, 173546. [Google Scholar] [CrossRef]
- Guerrero-Romero, F.; Mercado, M.; Rodriguez-Moran, M.; Ramírez-Renteria, C.; Martínez-Aguilar, G.; Marrero-Rodríguez, D.; Ferreira-Hermosillo, A.; Simental-Mendía, L.E.; Remba-Shapiro, I.; Gamboa-Gómez, C.I.; et al. Magnesium-to-Calcium Ratio and Mortality from COVID-19. Nutrients 2022, 14, 1686. [Google Scholar] [CrossRef]
- Tian, J.; Tang, L.; Liu, X.; Li, Y.; Chen, J.; Huang, W.; Liu, M. Populations in Low-Magnesium Areas Were Associated with Higher Risk of Infection in COVID-19′s Early Transmission: A Nationwide Retrospective Cohort Study in the United States. Nutrients 2022, 14, 909. [Google Scholar] [CrossRef]
- Tabatabaeizadeh, S.-A. Zinc Supplementation and COVID-19 Mortality: A Meta-Analysis. Eur. J. Med. Res. 2022, 27, 70. [Google Scholar] [CrossRef] [PubMed]
- Pal, A.; Squitti, R.; Picozza, M.; Pawar, A.; Rongioletti, M.; Dutta, A.K.; Sahoo, S.; Goswami, K.; Sharma, P.; Prasad, R. Zinc and COVID-19: Basis of Current Clinical Trials. Biol. Trace. Elem. Res. 2021, 199, 2882–2892. [Google Scholar] [CrossRef] [PubMed]
- Prasad, A.S.; Malysa, A.; Bepler, G.; Fribley, A.; Bao, B. The Mechanisms of Zinc Action as a Potent Anti-Viral Agent: The Clinical Therapeutic Implication in COVID-19. Antioxidants 2022, 11, 1862. [Google Scholar] [CrossRef] [PubMed]
- Pedrosa, L.F.C.; Barros, A.N.A.B.; Leite-Lais, L. Nutritional Risk of Vitamin D, Vitamin C, Zinc, and Selenium Deficiency on Risk and Clinical Outcomes of COVID-19: A Narrative Review. Clin. Nutr. ESPEN 2022, 47, 9–27. [Google Scholar] [CrossRef] [PubMed]
- Balboni, E.; Zagnoli, F.; Filippini, T.; Fairweather-Tait, S.J.; Vinceti, M. Zinc and Selenium Supplementation in COVID-19 Prevention and Treatment: A Systematic Review of the Experimental Studies. J. Trace Elem. Med. Biol. 2022, 71, 126956. [Google Scholar] [CrossRef]
- Ma, Y.; Zhang, L.; Zeng, R.; Luo, D.; Jiang, R.; Wu, H.; Zhuo, Z.; Yang, Q.; Li, J.; Leung, F.W.; et al. Associations of Habitual Fish Oil Use with Risk of SARS-CoV-2 Infection and COVID-19-Related Outcomes in UK: National Population Based Cohort Study. medRxiv 2022. [Google Scholar] [CrossRef]
- Merritt, R.J.; Bhardwaj, V.; Jami, M.M. Fish Oil and COVID-19 Thromboses. J. Vasc. Surg. Venous Lymphat. Disord. 2020, 8, 1120. [Google Scholar] [CrossRef]
- Torrinhas, R.S.; Calder, P.C.; Lemos, G.O.; Waitzberg, D.L. Parenteral Fish Oil: An Adjuvant Pharmacotherapy for Coronavirus Disease 2019? Nutrition 2021, 81, 110900. [Google Scholar] [CrossRef]
- Theoharides, T.C.; Cholevas, C.; Polyzoidis, K.; Politis, A. Long-COVID Syndrome-associated Brain Fog and Chemofog: Luteolin to the Rescue. Biofactors 2021, 47, 232–241. [Google Scholar] [CrossRef]
- Shadrack, D.M.; Deogratias, G.; Kiruri, L.W.; Onoka, I.; Vianney, J.-M.; Swai, H.; Nyandoro, S.S. Luteolin: A Blocker of SARS-CoV-2 Cell Entry Based on Relaxed Complex Scheme, Molecular Dynamics Simulation, and Metadynamics. J. Mol. Model 2021, 27, 221. [Google Scholar] [CrossRef] [PubMed]
- Theoharides, T.C. COVID-19, Pulmonary Mast Cells, Cytokine Storms, and Beneficial Actions of Luteolin. Biofactors 2020, 46, 306–308. [Google Scholar] [CrossRef]
- Di Stadio, A.; D’Ascanio, L.; Vaira, L.A.; Cantone, E.; De Luca, P.; Cingolani, C.; Motta, G.; De Riu, G.; Vitelli, F.; Spriano, G.; et al. Ultramicronized Palmitoylethanolamide and Luteolin Supplement Combined with Olfactory Training to Treat Post-COVID-19 Olfactory Impairment: A Multi-Center Double-Blinded Randomized Placebo- Controlled Clinical Trial. Curr. Neuropharmacol. 2022, 20, 2001–2012. [Google Scholar] [CrossRef]
- Masiello, P.; Novelli, M.; Beffy, P.; Menegazzi, M. Can Hypericum Perforatum (SJW) Prevent Cytokine Storm in COVID-19 Patients? Phytother. Res. 2020, 34, 1471–1473. [Google Scholar] [CrossRef] [PubMed]
- Mohamed, F.F.; Anhlan, D.; Schöfbänker, M.; Schreiber, A.; Classen, N.; Hensel, A.; Hempel, G.; Scholz, W.; Kühn, J.; Hrincius, E.R.; et al. Hypericum Perforatum and Its Ingredients Hypericin and Pseudohypericin Demonstrate an Antiviral Activity against SARS-CoV-2. Pharmaceuticals 2022, 15, 530. [Google Scholar] [CrossRef]
- Verdoorn, B.P.; Evans, T.K.; Hanson, G.J.; Zhu, Y.; Langhi Prata, L.G.P.; Pignolo, R.J.; Atkinson, E.J.; Wissler-Gerdes, E.O.; Kuchel, G.A.; Mannick, J.B.; et al. Fisetin for COVID-19 in Skilled Nursing Facilities: Senolytic Trials in the COVID Era. J. Am. Geriatr. Soc. 2021, 69, 3023–3033. [Google Scholar] [CrossRef]
- Oladele, J.O.; Oyeleke, O.M.; Oladele, O.T.; Olowookere, B.D.; Oso, B.J.; Oladiji, A.T. Kolaviron (Kolaflavanone), Apigenin, Fisetin as Potential Coronavirus Inhibitors: In Silico Investigatio. Res. Sq. 2020. [Google Scholar] [CrossRef]
- Pandey, P.; Rane, J.S.; Chatterjee, A.; Kumar, A.; Khan, R.; Prakash, A.; Ray, S. Targeting SARS-CoV-2 Spike Protein of COVID-19 with Naturally Occurring Phytochemicals: An in Silico Study for Drug Development. J. Biomol. Struct. Dyn. 2021, 39, 6306–6316. [Google Scholar] [CrossRef] [PubMed]
- Willyard, C. How Anti-Ageing Drugs Could Boost COVID Vaccines in Older People. Nature 2020, 586, 352–354. [Google Scholar] [CrossRef] [PubMed]
- Dey, D.; Dey, N.; Ghosh, S.; Chandrasekaran, N.; Mukherjee, A.; Thomas, J. Potential Combination Therapy Using Twenty Phytochemicals from Twenty Plants to Prevent SARS-CoV-2 Infection: An in Silico Approach. Virusdisease 2021, 32, 108–116. [Google Scholar] [CrossRef] [PubMed]
- Hawkins, J.; Hires, C.; Keenan, L.; Dunne, E. Aromatherapy Blend of Thyme, Orange, Clove Bud, and Frankincense Boosts Energy Levels in Post-COVID-19 Female Patients: A Randomized, Double-Blinded, Placebo Controlled Clinical Trial. Complement. Ther. Med. 2022, 67, 102823. [Google Scholar] [CrossRef]
- Fajri, M. The Potential of Moringa Oleifera as Immune Booster against COVID 19. IOP Conf. Ser. Earth Environ. Sci. 2021, 807, 022008. [Google Scholar] [CrossRef]
- Bachar, S.C.; Mazumder, K.; Bachar, R.; Aktar, A.; Al Mahtab, M. A Review of Medicinal Plants with Antiviral Activity Available in Bangladesh and Mechanistic Insight Into Their Bioactive Metabolites on SARS-CoV-2, HIV and HBV. Front. Pharm. 2021, 12, 732891. [Google Scholar] [CrossRef]
- Chaves, O.A.; Lima, C.R.; Fintelman-Rodrigues, N.; Sacramento, C.Q.; de Freitas, C.S.; Vazquez, L.; Temerozo, J.R.; Rocha, M.E.N.; Dias, S.S.G.; Carels, N.; et al. Agathisflavone, a Natural Biflavonoid That Inhibits SARS-CoV-2 Replication by Targeting Its Proteases. Int. J. Biol. Macromol. 2022, 222, 1015–1026. [Google Scholar] [CrossRef]
- Janssens, J.; Laekeman, G.M.; Pieters, L.A.; Totte, J.; Herman, A.G.; Vlietinck, A.J. Nutmeg Oil: Identification and Quantitation of Its Most Active Constituents as Inhibitors of Platelet Aggregation. J. Ethnopharmacol. 1990, 29, 179–188. [Google Scholar] [CrossRef]
- Le-Trilling, V.T.K.; Mennerich, D.; Schuler, C.; Sakson, R.; Lill, J.K.; Kasarla, S.S.; Kopczynski, D.; Loroch, S.; Flores-Martinez, Y.; Katschinski, B.; et al. Identification of Herbal Teas and Their Compounds Eliciting Antiviral Activity against SARS-CoV-2 in Vitro. BMC Biol. 2022, 20, 264. [Google Scholar] [CrossRef]
- Le-Trilling, V.T.K.; Mennerich, D.; Schuler, C.; Sakson, R.; Lill, J.K.; Kopczynski, D.; Loroch, S.; Flores-Martinez, Y.; Katschinski, B.; Wohlgemuth, K.; et al. Universally Available Herbal Teas Based on Sage and Perilla Elicit Potent Antiviral Activity against SARS-CoV-2 Variants of Concern by HMOX-1 Upregulation in Human Cells. bioRxiv 2022. [Google Scholar] [CrossRef]
- Omoboyowa, D.A.; Balogun, T.A.; Chukwudozie, O.; Nweze, V.; Saibu, O.; Abdulahi, A. SARS-COV-2 Spike Glycoprotein as Inhibitory Target for Insilico Screening of Natural Compound. Biointerface Res. Appl. Chem. 2021, 11, 14974–14985. [Google Scholar]
- Kumari, A.; Rajput, V.S.; Nagpal, P.; Kukrety, H.; Grover, S.; Grover, A. Dual Inhibition of SARS-CoV-2 Spike and Main Protease through a Repurposed Drug, Rutin. J. Biomol. Struct. Dyn. 2022, 40, 4987–4999. [Google Scholar] [CrossRef]
- Nagoor Meeran, M.F.; Seenipandi, A.; Javed, H.; Sharma, C.; Hashiesh, H.M.; Goyal, S.N.; Jha, N.K.; Ojha, S. Can Limonene Be a Possible Candidate for Evaluation as an Agent or Adjuvant against Infection, Immunity, and Inflammation in COVID-19? Heliyon 2021, 7, e05703. [Google Scholar] [CrossRef] [PubMed]
- Mohamed, M.E.; Tawfeek, N.; Elbaramawi, S.S.; Fikry, E. Agathis Robusta Bark Essential Oil Effectiveness against COVID-19: Chemical Composition, In Silico and In Vitro Approaches. Plants 2022, 11, 663. [Google Scholar] [CrossRef]
- Ziyaei, K.; Ataie, Z.; Mokhtari, M.; Adrah, K.; Daneshmehr, M.A. An Insight to the Therapeutic Potential of Algae-Derived Sulfated Polysaccharides and Polyunsaturated Fatty Acids: Focusing on the COVID-19. Int. J. Biol. Macromol. 2022, 209, 244–257. [Google Scholar] [CrossRef] [PubMed]
- Sami, N.; Ahmad, R.; Fatma, T. Exploring Algae and Cyanobacteria as a Promising Natural Source of Antiviral Drug against SARS-CoV-2. Biomed. J. 2021, 44, 54–62. [Google Scholar] [CrossRef]
- Tzachor, A.; Rozen, O.; Khatib, S.; Jensen, S.; Avni, D. Photosynthetically Controlled Spirulina, but Not Solar Spirulina, Inhibits TNF-α Secretion: Potential Implications for COVID-19-Related Cytokine Storm Therapy. Mar. Biotechnol. 2021, 23, 149–155. [Google Scholar] [CrossRef]
- Kumar, A.; Singh, R.P.; Kumar, I.; Yadav, P.; Singh, S.K.; Kaushalendra; Singh, P.K.; Gupta, R.K.; Singh, S.M.; Kesawat, M.S.; et al. Algal Metabolites Can Be an Immune Booster against COVID-19 Pandemic. Antioxidants 2022, 11, 452. [Google Scholar] [CrossRef] [PubMed]
- Tran, H.T.T.; Gigl, M.; Le, N.P.K.; Dawid, C.; Lamy, E. In Vitro Effect of Taraxacum Officinale Leaf Aqueous Extract on the Interaction between ACE2 Cell Surface Receptor and SARS-CoV-2 Spike Protein D614 and Four Mutants. Pharmaceuticals 2021, 14, 1055. [Google Scholar] [CrossRef]
- Vavilova, V.P.; Vavilov, A.M.; Tsarkova, S.A.; Nesterova, O.L.; Kulyabina, A.A.; Yakhno, N.B.; Anisimova, A.V.; Vavilov, V.A.; Elkina, E.N.; Dobryak, T.A. One of the possibilities of optimizing the therapy of a new coronavirus infection in children with the inclusion of an extract from marshmallow root, chamomile flowers, horsetail grass, walnut leaves, yarrow grass, oak bark and dandelion grass: Prospective open comparative cohort study. Pediatr. Cons. Med. 2022, 4, 322–330. [Google Scholar] [CrossRef]
- Lucas, K.; Ackermann, M.; Leifke, A.L.; Li, W.W.; Pöschl, U.; Fröhlich-Nowoisky, J. Ceylon Cinnamon and Its Major Compound Cinnamaldehyde Can Limit Overshooting Inflammatory Signaling and Angiogenesis in Vitro: Implications for COVID-19 Treatment. bioRxiv 2021. [Google Scholar] [CrossRef]
- Lucas, K.; Fröhlich-Nowoisky, J.; Oppitz, N.; Ackermann, M. Cinnamon and Hop Extracts as Potential Immunomodulators for Severe COVID-19 Cases. Front. Plant Sci. 2021, 12, 589783. [Google Scholar] [CrossRef] [PubMed]
- Zareie, A.; Soleimani, D.; Askari, G.; Jamialahmadi, T.; Guest, P.C.; Bagherniya, M.; Sahebkar, A. Cinnamon: A Promising Natural Product Against COVID-19. Adv. Exp. Med. Biol. 2021, 1327, 191–195. [Google Scholar] [CrossRef]
- Yakhchali, M.; Taghipour, Z.; Mirabzadeh Ardakani, M.; Alizadeh Vaghasloo, M.; Vazirian, M.; Sadrai, S. Cinnamon and Its Possible Impact on COVID-19: The Viewpoint of Traditional and Conventional Medicine. Biomed. Pharm. 2021, 143, 112221. [Google Scholar] [CrossRef]
- Musazadeh, V.; Karimi, A.; Bagheri, N.; Jafarzadeh, J.; Sanaie, S.; Vajdi, M.; Karimi, M.; Niazkar, H.R. The Favorable Impacts of Silibinin Polyphenols as Adjunctive Therapy in Reducing the Complications of COVID-19: A Review of Research Evidence and Underlying Mechanisms. Biomed. Pharmacother. 2022, 154, 113593. [Google Scholar] [CrossRef] [PubMed]
- Speciale, A.; Muscarà, C.; Molonia, M.S.; Cimino, F.; Saija, A.; Giofrè, S.V. Silibinin as Potential Tool against SARS-Cov-2: In Silico Spike Receptor-Binding Domain and Main Protease Molecular Docking Analysis, and in Vitro Endothelial Protective Effects. Phytother. Res. 2021, 35, 4616–4625. [Google Scholar] [CrossRef]
- Intharuksa, A.; Arunotayanun, W.; Yooin, W.; Sirisa-ard, P. A Comprehensive Review of Andrographis Paniculata (Burm. F.) Nees and Its Constituents as Potential Lead Compounds for COVID-19 Drug Discovery. Molecules 2022, 27, 4479. [Google Scholar] [CrossRef]
- Sa-Ngiamsuntorn, K.; Suksatu, A.; Pewkliang, Y.; Thongsri, P.; Kanjanasirirat, P.; Manopwisedjaroen, S.; Charoensutthivarakul, S.; Wongtrakoongate, P.; Pitiporn, S.; Chaopreecha, J.; et al. Anti-SARS-CoV-2 Activity of Andrographis Paniculata Extract and Its Major Component Andrographolide in Human Lung Epithelial Cells and Cytotoxicity Evaluation in Major Organ Cell Representatives. J. Nat. Prod. 2021, 84, 1261–1270. [Google Scholar] [CrossRef]
- Murugan, N.A.; Pandian, C.J.; Jeyakanthan, J. Computational Investigation on Andrographis Paniculata Phytochemicals to Evaluate Their Potency against SARS-CoV-2 in Comparison to Known Antiviral Compounds in Drug Trials. J. Biomol. Struct. Dyn. 2021, 39, 4415–4426. [Google Scholar] [CrossRef]
- Tanwettiyanont, J.; Piriyachananusorn, N.; Sangsoi, L.; Boonsong, B.; Sunpapoa, C.; Tanamatayarat, P.; Na-Ek, N.; Kanchanasurakit, S. Use of Andrographis Paniculata (Burm.f.) Wall. Ex Nees and Risk of Pneumonia in Hospitalised Patients with Mild Coronavirus Disease 2019: A Retrospective Cohort Study. Front. Med. 2022, 9, 947373. [Google Scholar] [CrossRef]
- Ao, Z.; Chan, M.; Ouyang, M.J.; Olukitibi, T.A.; Mahmoudi, M.; Kobasa, D.; Yao, X. Identification and Evaluation of the Inhibitory Effect of Prunella Vulgaris Extract on SARS-Coronavirus 2 Virus Entry. PLoS ONE 2021, 16, e0251649. [Google Scholar] [CrossRef] [PubMed]
- Gomaa, A.A.; Abdel-Wadood, Y.A. The Potential of Glycyrrhizin and Licorice Extract in Combating COVID-19 and Associated Conditions. Phytomed. Plus 2021, 1, 100043. [Google Scholar] [CrossRef]
- van de Sand, L.; Bormann, M.; Alt, M.; Schipper, L.; Heilingloh, C.S.; Steinmann, E.; Todt, D.; Dittmer, U.; Elsner, C.; Witzke, O.; et al. Glycyrrhizin Effectively Inhibits SARS-CoV-2 Replication by Inhibiting the Viral Main Protease. Viruses 2021, 13, 609. [Google Scholar] [CrossRef] [PubMed]
- Diomede, L.; Beeg, M.; Gamba, A.; Fumagalli, O.; Gobbi, M.; Salmona, M. Can Antiviral Activity of Licorice Help Fight COVID-19 Infection? Biomolecules 2021, 11, 855. [Google Scholar] [CrossRef]
- Gomaa, A. Evaluation of The Potential Therapeutic Effects of Licorice and Boswellia Serrata Gum in Egyptian Patients With COVID-19 as a Complementary Medicine. 2022. Available online: https://clinicaltrials.gov/ct2/show/NCT04487964 (accessed on 30 September 2022).
- Ng, S.L.; Khaw, K.-Y.; Ong, Y.S.; Goh, H.P.; Kifli, N.; Teh, S.P.; Ming, L.C.; Kotra, V.; Goh, B.H. Licorice: A Potential Herb in Overcoming SARS-CoV-2 Infections. J. Evid. Based. Integr. Med. 2021, 26, 2515690X21996662. [Google Scholar] [CrossRef]
- Yi, Y.; Li, J.; Lai, X.; Zhang, M.; Kuang, Y.; Bao, Y.-O.; Yu, R.; Hong, W.; Muturi, E.; Xue, H.; et al. Natural Triterpenoids from Licorice Potently Inhibit SARS-CoV-2 Infection. J. Adv. Res. 2021, 36, 201–210. [Google Scholar] [CrossRef] [PubMed]
- Shakeeb, N.; Varkey, P.; Hynse, A.; Mandlecha, A. Anti-Inflammatory Response of Cardamom Extract and Prediction of Therapeutic Window in COVID-19 Patients by Assessing Inflammatory Markers Using RT-PCR. Inflammopharmacology 2022, 30, 883–894. [Google Scholar] [CrossRef]
- Vicidomini, C.; Roviello, V.; Roviello, G.N. Molecular Basis of the Therapeutical Potential of Clove (Syzygium Aromaticum L.) and Clues to Its Anti-COVID-19 Utility. Molecules 2021, 26, 1880. [Google Scholar] [CrossRef]
- Paidi, R.K.; Jana, M.; Raha, S.; McKay, M.; Sheinin, M.; Mishra, R.K.; Pahan, K. Eugenol, a Component of Holy Basil (Tulsi) and Common Spice Clove, Inhibits the Interaction Between SARS-CoV-2 Spike S1 and ACE2 to Induce Therapeutic Responses. J. Neuroimmune Pharm. 2021, 16, 743–755. [Google Scholar] [CrossRef]
- Truzzi, F.; Whittaker, A.; D’Amen, E.; Tibaldi, C.; Abate, A.; Valerii, M.C.; Spisni, E.; Dinelli, G. Wheat Germ Spermidine and Clove Eugenol in Combination Stimulate Autophagy In Vitro Showing Potential in Supporting the Immune System against Viral Infections. Molecules 2022, 27, 3425. [Google Scholar] [CrossRef]
- Gomaa, A.A.; Abdel-Wadood, Y.A.; Gomaa, M.A. Glycyrrhizin and Boswellic Acids, the Golden Nutraceuticals: Multitargeting for Treatment of Mild–Moderate COVID-19 and Prevention of Post-COVID Cognitive Impairment. Inflammopharmacology 2022, 30, 1977–1992. [Google Scholar] [CrossRef] [PubMed]
- Li, Y.; Yang, D.; Gao, X.; Ju, M.; Fang, H.; Yan, Z.; Qu, H.; Zhang, Y.; Xie, L.; Weng, H.; et al. Ginger Supplement Significantly Reduced Length of Hospital Stay in Individuals with COVID-19. Nutr. Metab. 2022, 19, 84. [Google Scholar] [CrossRef] [PubMed]
- Khubber, S.; Hashemifesharaki, R.; Mohammadi, M.; Gharibzahedi, S.M.T. Garlic (Allium Sativum L.): A Potential Unique Therapeutic Food Rich in Organosulfur and Flavonoid Compounds to Fight with COVID-19. Nutr. J. 2020, 19, 124. [Google Scholar] [CrossRef] [PubMed]
- Donma, M.M.; Donma, O. The Effects of Allium Sativum on Immunity within the Scope of COVID-19 Infection. Med. Hypotheses 2020, 144, 109934. [Google Scholar] [CrossRef]
- Thuy, B.T.P.; My, T.T.A.; Hai, N.T.T.; Hieu, L.T.; Hoa, T.T.; Thi Phuong Loan, H.; Triet, N.T.; Anh, T.T.V.; Quy, P.T.; Tat, P.V.; et al. Investigation into SARS-CoV-2 Resistance of Compounds in Garlic Essential Oil. ACS Omega 2020, 5, 8312–8320. [Google Scholar] [CrossRef]
- Wang, Y.; Wu, Y.; Fu, P.; Zhou, H.; Guo, X.; Zhu, C.; Tu, Y.; Wang, J.; Li, H.; Chen, Z. Effect of Garlic Essential Oil in 97 Patients Hospitalized with COVID-19: A Multi-Center Experience. Pak. J. Pharm. Sci. 2022, 35, 1077–1082. [Google Scholar]
- Hammoudi Halat, D.; Krayem, M.; Khaled, S.; Younes, S. A Focused Insight into Thyme: Biological, Chemical, and Therapeutic Properties of an Indigenous Mediterranean Herb. Nutrients 2022, 14, 2104. [Google Scholar] [CrossRef]
- Kulkarni, S.A.; Nagarajan, S.K.; Ramesh, V.; Palaniyandi, V.; Selvam, S.P.; Madhavan, T. Computational Evaluation of Major Components from Plant Essential Oils as Potent Inhibitors of SARS-CoV-2 Spike Protein. J. Mol. Struct. 2020, 1221, 128823. [Google Scholar] [CrossRef]
- Dilokthornsakul, W.; Kosiyaporn, R.; Wuttipongwaragon, R.; Dilokthornsakul, P. Potential Effects of Propolis and Honey in COVID-19 Prevention and Treatment: A Systematic Review of in Silico and Clinical Studies. J. Integr. Med. 2022, 20, 114–125. [Google Scholar] [CrossRef]
- Berretta, A.A.; Silveira, M.A.D.; Cóndor Capcha, J.M.; De Jong, D. Propolis and Its Potential against SARS-CoV-2 Infection Mechanisms and COVID-19 Disease: Running Title: Propolis against SARS-CoV-2 Infection and COVID-19. Biomed. Pharm. 2020, 131, 110622. [Google Scholar] [CrossRef]
- Ali, A.M.; Kunugi, H. Propolis, Bee Honey, and Their Components Protect against Coronavirus Disease 2019 (COVID-19): A Review of In Silico, In Vitro, and Clinical Studies. Molecules 2021, 26, 1232. [Google Scholar] [CrossRef] [PubMed]
- Ripari, N.; Sartori, A.A.; da Silva Honorio, M.; Conte, F.L.; Tasca, K.I.; Santiago, K.B.; Sforcin, J.M. Propolis Antiviral and Immunomodulatory Activity: A Review and Perspectives for COVID-19 Treatment. J. Pharm. Pharm. 2021, 73, 281–299. [Google Scholar] [CrossRef]
- Fiorini, A.C.; Scorza, C.A.; de Almeida, A.-C.G.; Fonseca, M.C.M.; Finsterer, J.; Fonseca, F.L.A.; Scorza, F.A. Antiviral Activity of Brazilian Green Propolis Extract against SARS-CoV-2 (Severe Acute Respiratory Syndrome—Coronavirus 2) Infection: Case Report and Review. Clin. Sao Paulo 2021, 76, e2357. [Google Scholar] [CrossRef]
- Bachevski, D.; Damevska, K.; Simeonovski, V.; Dimova, M. Back to the Basics: Propolis and COVID-19. Derm. Ther. 2020, 33, e13780. [Google Scholar] [CrossRef]
- Bako, A.T.; Pan, A.; Potter, T.; Tannous, J.; Johnson, C.; Baig, E.; Meeks, J.; Woo, D.; Vahidy, F.S. Contemporary Trends in the Nationwide Incidence of Primary Intracerebral Hemorrhage. Stroke 2022, 53, e70–e74. [Google Scholar] [CrossRef]
- König, S.; Hohenstein, S.; Leiner, J.; Hindricks, G.; Meier-Hellmann, A.; Kuhlen, R.; Bollmann, A. National Mortality Data for Germany before and throughout the Pandemic: There Is an Excess Mortality Exceeding COVID-19-Attributed Fatalities. J. Infect. 2022, 84, 834–872. [Google Scholar] [CrossRef]
- Government of Canada, Statistics Canada. Provisional Deaths and Excess Mortality in Canada Dashboard. Available online: https://www150.statcan.gc.ca/n1/pub/71-607-x/71-607-x2021028-eng.htm (accessed on 1 October 2022).
- Aaby, P.; Jensen, H.; Gomes, J.; Fernandes, M.; Lisse, I.M. The Introduction of Diphtheria-Tetanus-Pertussis Vaccine and Child Mortality in Rural Guinea-Bissau: An Observational Study. Int. J. Epidemiol. 2004, 33, 374–380. [Google Scholar] [CrossRef] [PubMed]
- Aldén, M.; Olofsson Falla, F.; Yang, D.; Barghouth, M.; Luan, C.; Rasmussen, M.; De Marinis, Y. Intracellular Reverse Transcription of Pfizer BioNTech COVID-19 MRNA Vaccine BNT162b2 In Vitro in Human Liver Cell Line. Curr. Issues Mol. Biol. 2022, 44, 1115–1126. [Google Scholar] [CrossRef] [PubMed]