Algunas vacunas COVID-19 podrían aumentar el riesgo de SIDA, Roxana Bruno, PhD en Inmunología. La vacuna rusa Sputnik V consta de dos componentes: el primero se basa en el adenovirus humano tipo 26, y el segundo, en el adenovirus humano recombinante del tipo 5. Este segundo componente aumenta el riesgo de contraer SIDA, ver en : https://cienciaysaludnatural.com/algunas-vacunas-covid-19-podrian-aumentar-el-riesgo-de-sida/
——-*——-
Discrepancias de datos e informes deficientes de los datos provisionales del ensayo de fase 3 del Sputnik V. El acceso restringido a los datos obstaculiza la confianza en la investigación. El acceso a los datos que sustentan los hallazgos del estudio es imperativo para verificar y confirmar los hallazgos declarados. Es aún más grave si hay aparentes errores e inconsistencias numéricas en las estadísticas y los resultados presentados. Lamentablemente, esto parece ser lo que está sucediendo en el caso del ensayo de fase 3 del Sputnik V. Fuente: The Lancet
La controversia continúa formándose en torno a la vacuna COVID-19 de Rusia. El 11 de agosto, Rusia anunció el lanzamiento de Sputnik V, su vacuna candidata basada en adenovirus contra COVID-19 y el 4 de septiembre, los resultados de sus estudios de fase 1/2 se publicaron en The Lancet. Sin embargo, el artículo de The Lancet no resuelve los debates sobre la política y la ciencia del Sputnik V.
El 27 de octubre, CNN informó que solo 6.000 de las 17.000 personas en el ensayo de fase III del Sputnik V habían recibido la vacuna completa. El mismo artículo cita que es imposible saber si el Sputnik V puede hacer que una persona sea inmune al virus, que oficialmente se llama SARS-CoV-2. En términos de la cantidad de pacientes inscritos en las pruebas clínicas. En las Fases 1 y 2 se probaron en pocos pacientes, 72, y de un seguimiento corto de 42 días, que es la limitación que presenta el estudio.
Argentina espera 10 millones de dosis de la principal vacuna COVID-19 experimental de Rusia entre diciembre y enero, dijo el gobierno el lunes, mientras se siguen haciendo test que dan falsos positivos para aumentar las presuntas infecciones .
«La vacuna Sputnik V para Argentina será producida por socios de RDIF Fondo Soberano de Inversión Estatal, (Russian Direct Investment Fund) en India, Corea, China y varios otros países que están preparando una producción de la vacuna rusa», dijo el director ejecutivo de RDIF, Kirill Dmitriev, en comentarios compartidos por una empresa. portavoz.
Resultados Cuestionados
El Instituto de Investigación de Epidemiología y Microbiología Gamaleya, con sede en Moscú, se hizo cargo del desarrollo y los ensayos clínicos del Sputnik V, contando con su experiencia en el estudio de la plataforma para las vacunas contra el ébola y el síndrome respiratorio de Oriente Medio.
El diseño del primer ensayo humano del Sputnik V generó críticas. Sheena Cruickshank, inmunóloga de la Universidad de Manchester, Reino Unido, cree que los resultados de este estudio abierto y no aleatorizado sobrestiman los efectos del tratamiento con Sputnik V, porque la asociación entre la intervención y el resultado podría verse influida por un tercer factor.
Cruickshank cree que los niveles variables e insignificantes de anticuerpos neutralizantes son preocupantes. “Los niveles de estos indicadores mostrados son muy variables, por lo que es difícil sacar conclusiones firmes sobre si las vacunas estan provocando una respuesta robusta de células T”, dijo Cruickshank. Para la vacunóloga Tracy Hussell (Universidad de Manchester, Reino Unido), Gamaleya utilizó un camino ya transitado para preparar la respuesta inmune con un adenovirus que porta la proteína de pico del coronavirus 2 del síndrome respiratorio agudo severo y luego potenciarla con un adenovirus diferente que porta la misma proteína, es posible que la respuesta inmune secundaria a una exposición previa a adenovirus, que es una causa común de resfriados, pueda afectar la vacuna. En este contexto, las pruebas de fase 3 del Sputnik V ya han comenzado.
Para Thomas Cunei (Federación Internacional de Asociaciones y Fabricantes de Productos Farmacéuticos, Ginebra) dijo: «La falta de transparencia en los resultados de los ensayos preclínicos o clínicos, y mucho menos la transparencia en el debido proceso sigue siendo preocupante«.
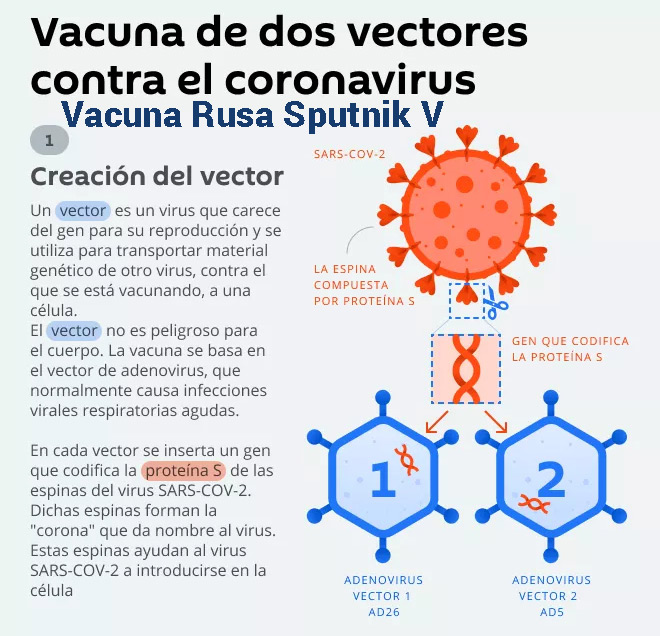
La vacuna rusa Sputnik V consta de dos componentes: el primero se basa en el adenovirus humano tipo 26, y el segundo, en el adenovirus humano recombinante del tipo 5. Este segundo componente aumenta el riesgo de contraer SIDA, ver en : https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)32156-5/fulltext

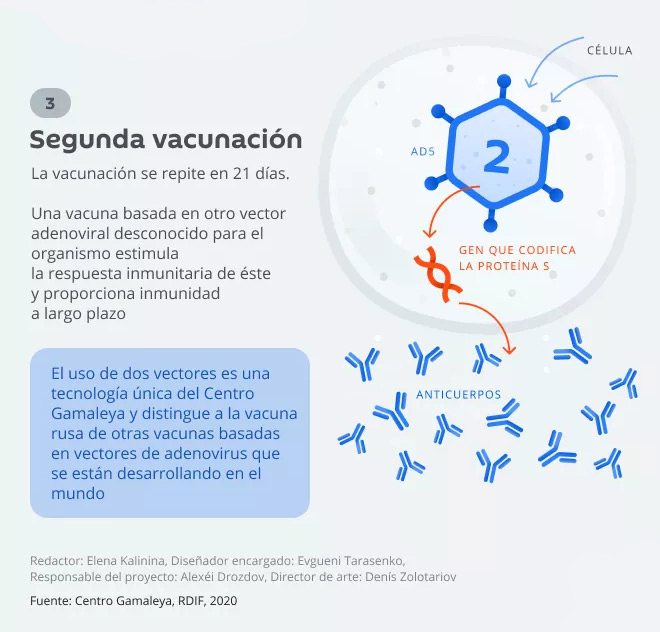
La vacuna Sputnik V se inyecta en dos etapas. Lo más importante es que no es la proteína la que produce los anticuerpos, sino el gen. La proteína comienza a ser producida en el cuerpo por un período relativamente largo.
https://mundo.sputniknews.com/infografia/202008111092387967-la-vacuna-rusa-contra-el-covid-19-en-detalle/
Antecedentes Preocupantes
El principal médico de enfermedades respiratorias de Rusia ha renunciado por «graves violaciones» de la ética médica que se apresuraron a aplicar la «vacuna» contra el coronavirus de Putin .
El profesor Alexander Chuchalin renunció al consejo de ética del Ministerio de Salud de Rusia después de realizar un feroz ataque al nuevo medicamento Sputnik V antes de que el organismo aprobara su registro.
En medio del profundo escepticismo entre los expertos occidentales sobre la droga, parece que Chuchalin buscó y no pudo bloquear su registro por motivos de «seguridad» antes de abandonar el consejo de ética.
Acusó específicamente a los dos médicos principales involucrados en su desarrollo de burlar la ética médica al acelerar la producción de la vacuna.
El Dr. Chucalin dijo: ‘Estoy deprimido por la posición de algunos de nuestros científicos que hacen declaraciones irresponsables sobre las vacunas listas para usar’
profesor Alexander Chuchalin
El Dr. Chuchalin nombró al profesor Alexander Gintsburg, director del Centro de Investigación de Epidemiología y Microbiología de Gamaleya, y al profesor Sergey Borisevich, coronel médico y principal virólogo del ejército ruso.
Los dos hombres fueron los principales académicos detrás de la nueva vacuna ‘mundial’.
Chuchalin argumenta que se ha violado gravemente uno de los principios éticos de la medicina: «no causar daño, algunos de nuestros científicos que hacen declaraciones irresponsables sobre las vacunas ya preparadas».
Chuchalin advirtió: ‘En el caso de un medicamento o vacuna, nosotros, como revisores éticos, nos gustaría comprender, en primer lugar, lo seguro que es para los humanos. ‘La seguridad siempre es lo primero. ¿Cómo evaluarlo? Las vacunas que se están creando hoy nunca se han usado en humanos y no podemos predecir cómo las tolerará una persona.
Chucalin, quien creó el Instituto Ruso de Investigación de Neumología y es el jefe del Departamento de Terapia Hospitalaria de la Universidad Médica Nacional de Investigación de Rusia Pirogov, agregó: “Es imposible determinar esto sin sopesar todos los hechos científicos».
«Por lo tanto, nuestra tarea número uno es extraer datos científicos basados en la medicina basada en evidencia para comprender que la acción realizada por los científicos no dañará a una persona».
Chuchalin dijo que es vital conocer «el efecto de la vacuna a más largo plazo», y agregó que «el hecho es que hay una serie de sustancias biológicas que no se manifiestan de inmediato, sino solo después de uno o dos años«.
Dr. Alexander Chucalin, quien creó el Instituto Ruso de Investigación de Neumología y es el jefe del Departamento de Terapia Hospitalaria de la Universidad Médica Nacional de Investigación de Rusia Pirogov.
«Los criterios de seguridad para una vacuna también deben ser a largo plazo y esto se hace evidente solo con una observación a largo plazo, al menos dos años».
El profesor Alexander Gintsburg, director del Instituto de Investigación de Epidemiología y Microbiología de Gamaleya y Sergey Borisevich, virólogo jefe de las Fuerzas Armadas. Los dos hombres fueron los principales académicos detrás de la nueva vacuna ‘mundial’
Sobre la Vacuna Sputnik y el SIDA
por Roxana Bruno Ph.D en Inunología
La vacuna Sputnik V (Rusia), es una vacuna de vector combinado para el tratamiento profiláctico de la infección por SARS-СoV-2 desarrollada en el Centro Nacional de Investigación de Epidemiología y Microbiología de Gamaleya (Federación de Rusia) y lleva adelante un ensayo clínico de fase 3 (NCT04530396 https://www.clinicaltrials.gov/ct2/show/NCT04530396)
La vacuna consta de dos dosis diferentes: una dosis con un vector de adenovirus recombinante de serotipo 26 (rAd26) y la otra dosis con un vector de adenovirus recombinante de serotipo 5 (rAd5), ambas portan el gen de la glicoproteína de la espiga (S) del SARS-CoV-2 (rAd26-S y rAd5-S).
Surge una gran preocupación por el uso de los vectores de adenovirus recombinantes para las vacunas COVID-19. Hace más de una década, estudios internacionales demostraron que las vacunas con vector de adenovirus serotipo Ad5 predisponen a un mayor riesgo de adquisición del virus del HIV-1 entre los hombres vacunados [17, 18].
Sobre la base de estos hallazgos, el uso de un vector de adenovirus no replicante Ad5 para la inmunización contra el SARS-CoV-2 podría aumentar de manera similar el riesgo de adquirir el SIDA entre los hombres que reciben la vacuna para COVID-19.
Los ensayos de otras vacunas (no relacionadas con el VIH) que utilizaron vectores similares en áreas de alta prevalencia del VIH también conducen a un mayor riesgo de contraer el VIH-1 en la población vacunada. La explicación parece estar en la inmunidad que se genera contra el vector: las células T CD4 específicas contra el adenovirus Ad5 podrían tener una mayor susceptibilidad a la infección por virus del SIDA.
Por estas razones son inaceptables las cláusulas de confidencialidad, es de extrema importancia disponer de los documentos de composición, los datos reales de los ensayos clínicos y los documentos de consentimiento informado de estos riesgos potenciales. El riesgo de la adquisición del VIH-1 con los vectores Ad5 está suficientemente documentado en la literatura. ¿Porqué siguen usando estos vectores en el desarrollo de las vacunas?
Por otra parte los ensayos clínicos de fase 1 y 2 de esta vacuna son insuficientes. Publicaron los resultados de dos ensayos clínicos de fase 1/2 en 76 personas sanas de 18 a 60 años (38 participantes en cada estudio). El primer estudio examinó las formulaciones de vacunas congeladas (0,5 ml por dosis; almacenadas a –18ºC), y el segundo estudio examinó las formulaciones de vacunas liofilizadas (1 ml por dosis; almacenadas a 2-8 ºC)
En la fase 1, los pacientes recibieron: una dosis única de la vacuna rAd5-S o una dosis única de la vacuna rAd26-S. En la fase 2, los pacientes recibieron ambas: una dosis única de rAD5-S y una dosis única de rAd26-S. Publicaron que los voluntarios que recibieron la vacuna desarrollaron títulos de anticuerpos neutralizantes iguales o superiores a los títulos observados en el plasma convaleciente de pacientes que se habían recuperado de COVID-19 (controles). Se detectaron respuestas inmunitarias en todos los voluntarios y alcanzaron su punto máximo el día 28 después de la vacunación [16].
La India rechazó los resultados de fase 2 por insuficientes, y negó el permiso para continuar con los ensayos de fase 3.
El ensayo de fase 3 se empezó en Venezuela, se hace contra placebo en un total de 40.000 participantes de mayores de 18 años. Cada sujeto participará en el ensayo durante 180 días después de la primera dosis y tendrá una visita de selección para entrar en el estudio y cinco visitas al médico del estudio durante dicho período. Las visitas de observación pueden ser remotas, a través de la consulta de telemedicina (TMC).
Tiempo del estudio de fase 3: seis meses. Período de tiempo insuficiente para ver si la vacuna induce una respuesta inmune paradójica ( es decir, si los anticuerpos protegen o si facilitan a sufrir una enfermedad peor). El periodo es insuficiente para evaluar predisposición a infección por HIV-1 que pueda provocar el vector. No están contemplados en el estudio, el seguimiento de seguridad y eficacia a mediano y largo plazo.
Sobre la base de estos hallazgos, el uso de un vector de adenovirus no replicante para la inmunización contra el SARS-CoV-2 podría aumentar de manera similar el riesgo de adquirir el SIDA entre los hombres que reciben la vacuna [19].
Los ensayos de otras vacunas (no relacionadas con el VIH) que utilizaron vectores similares en áreas de alta prevalencia del VIH-1 también demostraron un mayor riesgo de contraer el VIH-1 en la población vacunada. La explicación parece estar en la inmunidad que se genera contra el vector: las células T CD4 específicas contra el adenovirus podrían tener una mayor susceptibilidad a la infección por virus del SIDA [20]. Preocupa entonces, y exige máxima cautela, el hecho de que sea peor el remedio que la enfermedad: hay que considerar que, por evitar una infección respiratoria que tiene una sobrevida del 99% con los tratamientos actuales, la utilización de vacunas preparadas con vectores de adenovirus pueda inducir una predisposición a infección por el VIH-1 u otros virus.
Un efecto indeseado adicional es la inyección repetida de material genético humano canceroso derivado del tipo celular HELA en la que se cultivan los vectores, en biorreactores a gran escala en los que se produce la vacuna. El linaje celular al cual pertenecen estas células deriva de una muestra de cáncer cérvico-uterino obtenida el 8 de febrero de 1951; son células cancerosas inmortales, que pueden cultivarse en el laboratorio constantemente. El material genético canceroso se arrastra en la vacuna y se inyecta en las personas, con consecuencias impredecibles para la salud.
Ver más:
Ciertas vacunas COVID-19 dejan a las personas más vulnerables al virus del SIDA https://www.sciencemag.org/news/2020/10/could-certain-covid-19-vaccines-leave-people-more-vulnerable-aids-virus
16 Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia.” Lancet. 2020;0(0). doi:10.1016/S0140-6736(20)31866-3 https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31866-3/fulltext
17 Continued follow-up of Phambili phase 2b randomized HIV-1 vaccine trial participants supports increased HIV-1 acquisition among vaccinated men. Moodie Z, Metch B, Bekker LG et al. PLoS One. 2015; 10e0137666. https://pubmed.ncbi.nlm.nih.gov/26368824/
18 Efficacy assessment of a cell-mediated immunity HIV-1 vaccine (the Step Study): a double-blind, randomised, placebo-controlled, test-of-concept trial. Buchbinder SP, Mehrotra DV, Duerr A et al. Lancet. 2008; 372: 1881-1893. https://pubmed.ncbi.nlm.nih.gov/19012954/
19 Use of adenovirus type-5 vectored vaccines: a cautionary tale. S.P. Buchbinder, M. J.McElrath, C.Dieffenbach and L. Corey. The Lancet. Volume 396, ISSUE 10260, October 31, 2020 DOI:https://doi.org/10.1016/S0140-6736(20)32156-5. https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)32156-5/fulltext
20 Human adenovirus-specific T cells modulate HIV-specific T cell responses to an Ad5-vectored HIV-1 vaccine. Frahm N, DeCamp AC, Friedrich DP et al. J Clin Invest. 2012; 122: 359-367 https://pubmed.ncbi.nlm.nih.gov/22201684/