Un trastorno metabólico que está ganando más atención en el mundo del autismo es el trastorno mitocondrial. Las mitocondrias son la fuerza vital dentro de nuestras células. Generan la energía que nuestras células necesitan para hacer su trabajo. Son como paneles solares en nuestras casas que convierten la luz solar en energía utilizable. Las mitocondrias crean ATP (trifosfato de adenosina), una energía intracelular que alimenta nuestras células. Nuestras células cerebrales, nuestros órganos y nuestros músculos requieren energía intracelular para realizar sus funciones de manera eficiente y efectiva. Al igual que los paneles solares son alimentados por la luz solar, nuestras mitocondrias son alimentadas por el oxígeno y nuestra comida.
La enfermedad mitocondrial ocurre cuando las mitocondrias no pueden producir suficiente energía para que nuestras células hagan su trabajo específico correctamente. Las mitocondrias se agotan y las células pierden su poder, de forma similar a cuando la batería de un automóvil se agota. Las lesiones celulares e incluso la muerte celular son posibles si los «mitos» no pueden hacer su trabajo.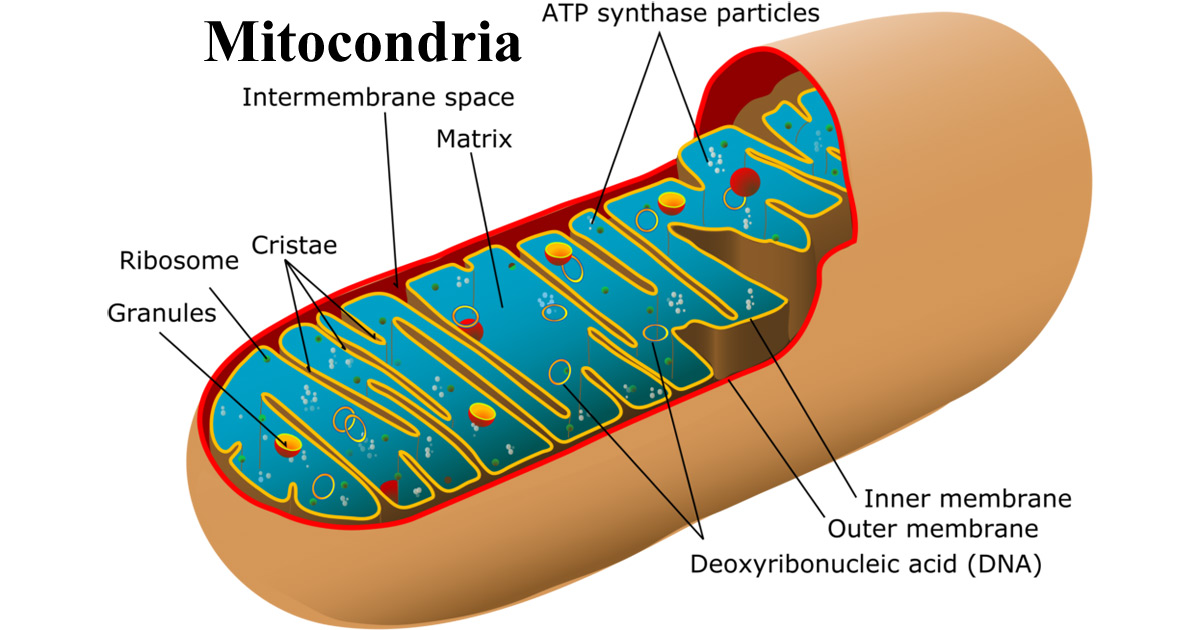
La enfermedad mitocondrial generalmente afecta a los órganos que requieren la mayor cantidad de energía, como el cerebro. El trastorno mitocondrial puede afectar muchas funciones diferentes dependiendo de qué parte del cerebro se ve afectada por la enfermedad mitocondrial. Puede ocurrir en uno o varios órganos, como en el corazón y los riñones, y si se afectan suficientes sistemas, todo el cuerpo puede fallar. El trastorno mitocondrial afecta principalmente a los niños, aunque los adultos también pueden desarrollar la enfermedad.
Síntomas de la enfermedad mitocondrial
La enfermedad mitocondrial es un grupo de síntomas que pueden afectar a uno o más órganos, por lo que puede ser difícil de diagnosticar. A menudo se identifica después de una encefalopatía regresiva. Una pérdida o regresión de las habilidades adquiridas previamente, como el habla, es común en niños con autismo, y en ocasiones esto es secundario a la enfermedad mitocondrial. Sin embargo, no toda regresión es indicativa de enfermedad mitocondrial. Los síntomas en los niños pueden aparecer después de una fiebre alta o una enfermedad similar a la gripe. Se cree que la enfermedad puede estar presente al nacer, pero los síntomas pueden no manifestarse hasta que el niño se encuentra con una enfermedad u otro insulto ambiental.que su cuerpo no puede compensar. Los insultos ambientales podrían ser exposiciones a ciertos químicos (ácido valproico-antiepiléptico), bacterias, virus, escasez de vitaminas y / o minerales, o incluso estrés.
LOS SÍNTOMAS PUEDEN INCLUIR:
- Discapacidad lingüística y social.
- Convulsiones
- Debilidad o tono bajo.
- Fatiga
- Síntomas neuropsiquiátricos (TDAH, ansiedad, TOC, depresión)
- Problemas gastrointestinales
SÍNTOMAS EN EL AUTISMO
En el autismo, los síntomas de la enfermedad mitocondrial a menudo pueden ser conductas desadaptativas, desempeño inconsistente o mesetas de desarrollo o regresiones. Otros síntomas pueden incluir bajo tono muscular o debilidad, problemas de planificación motora y convulsiones. Hay muchos otros síntomas y condiciones de salud concurrentes también.
Una variante genética asociada con el autismo que puede causar un trastorno mitocondrial es la mutación MTHFR (Methylenetetrahydrofolate reductasa). Las mutaciones en el gen MTHFR reducen la capacidad del cuerpo para desintoxicarse adecuadamente debido a la alteración de las vías de metilación. La incapacidad del cuerpo para metilar el folato disminuye la producción de glutatión y, por lo tanto, aumenta la carga tóxica, lo que lleva a un mayor daño mitocondrial.
Pruebas
La enfermedad mitocondrial se detecta a través de los análisis de sangre que incluyen un perfil metabólico completo, sin embargo, muchas veces las pruebas no lo detectan. Los neurólogos pueden ordenar una biopsia muscular que se considera la más precisa, pero también el método más invasivo y controvertido. Las pruebas genéticas también pueden identificar la mutación genética que causó la enfermedad de mito.
Tratamiento
El tratamiento varía desde administrar una dieta adecuada con comidas regulares bien balanceadas y una buena hidratación, hasta la suplementación bajo el cuidado de un médico. La coenzima Q-10, los antioxidantes y las vitaminas se están estudiando como una manera de ayudar a los mitos a generar más ATP en las células y también a prevenir el daño de los radicales libres a las células.
Autismo Prevalencia
Se desconoce cómo prevalece la enfermedad mitocondrial en el autismo, sin embargo, está recibiendo mucha atención a medida que más estudios apuntan a que la enfermedad coexiste en un número significativo de casos de autismo. Un estudio en UC Davis en 2010 encontró que el 80% de los niños con autismo inscritos en su estudio tenían análisis de sangre que mostraban enfermedad mitocondrial.

SHERI MARINO MA, CCC-SLP
DIRECTOR DE INICIATIVAS DE SALUD PEDIÁTRICA.
Sheri es una patóloga pediátrica del habla y el lenguaje con más de 25 años de experiencia clínica especializada en autismo. Como Directora de Iniciativas de Salud Pediátrica para la Fundación Focus for Health.
Fuentes:
https://www.focusforhealth.org/mitochondrial-disease-in-autism/
https://jamanetwork.com/journals/jama/fullarticle/186999
http://www.ucdmc.ucdavis.edu/publish/news/newsroom/4765
http://www.mitoaction.org/files/OXPHOSawareness.pdf
http://www.jpands.org/vol9no4/boris.pdf
TABLA 4-1. Contraindicaciones y precauciones (a) para las vacunas de uso común
| Vacuna | Cita | Contraindicaciones | Precauciones |
|---|---|---|---|
| DT, Td | ( 4 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de vacuna | GBS & lt; 6 semanas después de la dosis previa de la vacuna que contiene tétanos-toxoide & ndash; Historia de reacciones de hipersensibilidad de tipo Arthus después de una dosis previa de toxoide diftérico (Mdash) que contiene o vacuna que contiene tétanos / toxoide (antitus); postergar la vacunación hasta que hayan transcurrido al menos 10 años desde la última vacuna que contenía toxoide tetánico Enfermedad aguda moderada o grave con o sin fiebre |
| DTaP | ( 38 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de la vacuna Encefalopatía (por ejemplo, coma, disminución del nivel de conciencia, & nbsp; convulsiones prolongadas), no atribuible a otra causa identificable, dentro de los 7 días de la administración de la dosis previa de DTP o DTaP | Trastorno neurológico progresivo, que incluye espasmos infantiles, epilepsia no controlada, encefalopatía progresiva; diferir DTaP hasta que el estado neurológico se aclare y se estabilice GBS & lt; 6 semanas después de la dosis previa de la vacuna contra el tétanos-toxoide Historia de las reacciones de hipersensibilidad de tipo Arthus después de una dosis previa de toxoide de difteria que contiene o vacuna contra el tétanos-toxoide y ndash; postergar la vacunación hasta que hayan transcurrido al menos 10 años desde la última vacuna contra el tétano-toxoide y ndash; Enfermedad aguda moderada o grave con o sin fiebre |
| Hepatitis A | ( 39 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de vacuna | Enfermedad aguda moderada o grave con o sin fiebre |
| Hepatitis B | ( 40 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de la vacuna Hipersensibilidad a la levadura | Enfermedad aguda moderada o grave con o sin fiebre |
| Hib | ( 41 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de la vacuna Edad & lt; 6 semanas | Enfermedad aguda moderada o grave con o sin fiebre |
| HPV | ( 42 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de vacuna | Embarazo Enfermedad aguda moderada o grave con o sin fiebre |
| IIV | ( 43 ) | Reacción alérgica grave (p. ej., anafilaxis) después de una dosis previa de vacuna contra la influenza o al componente de la vacuna. | GBS & lt; 6 semanas después de una dosis previa de la vacuna contra la influenza Enfermedad aguda moderada o grave con o sin fiebre Alergia al huevo que no sea urticaria, por ejemplo, angioedema, dificultad respiratoria, aturdimiento, emesis recurrente; o la epinefrina requerida u otra intervención médica de emergencia (el IIV puede administrarse en un entorno médico para pacientes hospitalizados o ambulatorios y bajo la supervisión de un proveedor de atención médica que pueda reconocer y manejar afecciones alérgicas graves). |
| IPV | ( 44 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de vacuna | Embarazo Enfermedad aguda moderada o grave con o sin fiebre |
| LAIV(b) | ( 43 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de un componente de la vacuna, incluida la proteína del huevo. Uso concomitante de aspirina o medicamentos que contienen aspirina en niños y adolescentes LAIV4 no debe administrarse a personas que hayan tomado medicamentos antivirales para la influenza en las últimas 48 horas | GBS & lt; 6 semanas después de una dosis previa de la vacuna contra la influenza Asma en personas de 5 años o más Condiciones médicas que pueden predisponer a un mayor riesgo de complicaciones atribuibles a la influenza (c) Enfermedad aguda moderada o grave con o sin fiebre |
| MenACWY | ( 45 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de vacuna | Enfermedad aguda moderada o grave con o sin fiebre |
| MenB | ( 46 , 47 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de vacuna | Enfermedad aguda moderada o grave con o sin fiebre |
| MMR(d) ,(e) | ( 1 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de la vacuna Embarazo Inmunodeficiencia grave conocida (p. ej., de tumores hematológicos y sólidos, tratamiento con quimioterapia, inmunodeficiencia congénita, terapia inmunosupresora a largo plazo (f) ) o pacientes con infección por VIH que están gravemente inmunocomprometidos) </ p > Antecedentes familiares de inmunocompetencia alterada (g) | Recibo reciente (& le; 11 meses) de un producto sanguíneo que contiene anticuerpos (el intervalo específico depende del producto) Historial de trombocitopenia o púrpura trombocitopénica Necesidad de una prueba cutánea de tuberculina o un ensayo de liberación de interferón-gamma (IGRA) (h) Enfermedad aguda moderada o grave con o sin fiebre |
| MPSV4 | ( 48 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de vacuna | Enfermedad aguda moderada o grave con o sin fiebre |
| PCV13 | ( 49 ) | Reacción alérgica grave (p. ej., anafilaxis) después de una dosis previa de PCV13 o de cualquier vacuna que contenga toxina o diftea toxoide o contra un componente de una vacuna (PCV13 o cualquier vacuna que contenga toxoide diftérica & ndash; | Enfermedad aguda moderada o grave con o sin fiebre |
| PPSV23 | ( 50 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de vacuna | Enfermedad aguda moderada o grave con o sin fiebre |
| RIV | ( 43 ) | Reacción alérgica grave (por ejemplo, anafilaxis) a cualquier componente de la vacuna | GBS & lt; 6 semanas después de una dosis previa de la vacuna contra la influenza Enfermedad aguda moderada o grave con o sin fiebre |
| Rotavirus | ( 6 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de la vacuna SCID Historia de la intususcepción | Inmunocompetencia alterada distinta de SCID Enfermedad gastrointestinal crónica (i) Espina bífida o extrofia de la vejiga (i) Enfermedad aguda moderada o grave con o sin fiebre |
| Tdap | ( 51 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de la vacuna Encefalopatía (por ejemplo, coma, disminución del nivel de conciencia, & nbsp; convulsiones prolongadas), no atribuible a otra causa identificable, dentro de los 7 días de la administración de la dosis previa de DTP, DTaP o Tdap | GBS & lt; 6 semanas después de una dosis previa de toxoide tetánico-ndash; vacuna que contiene Trastorno neurológico progresivo o inestable, convulsiones no controladas o encefalopatía progresiva hasta que se establezca un régimen de tratamiento y la condición se haya estabilizado Historia de reacciones de hipersensibilidad de tipo Arthus después de una dosis previa de toxoide diftérico (Mdash) que contiene o vacuna que contiene tétanos / toxoide (antitus); postergar la vacunación hasta que hayan transcurrido por lo menos 10 años desde la última vacuna contra el tétanos-toxoide & ndash; Enfermedad aguda moderada o grave con o sin fiebre |
| Varicella(d) ,(e) | ( 52 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de la vacuna Inmunodeficiencia grave conocida (p. ej., de tumores hematológicos y sólidos, tratamiento con quimioterapia, inmunodeficiencia congénita, & nbsp; terapia inmunosupresora a largo plazo (f) o pacientes con infección por VIH que tienen inmunodeficiencia grave) < sup> (e) Embarazo Antecedentes familiares de inmunocompetencia alterada (g) | Recibo reciente (> 11 meses) de un producto sanguíneo que contiene anticuerpos (el intervalo específico depende del producto) Enfermedad aguda moderada o grave con o sin fiebre Recepción de medicamentos antivirales específicos (aciclovir, famciclovir o valaciclovir) 24 horas antes de la vacunación (evite el uso de estos medicamentos antivirales durante 14 días después de la vacunación) Uso de aspirina o productos que contienen aspirina (j) |
| Zoster | ( 53 ) | Reacción alérgica grave (por ejemplo, anafilaxis) después de una dosis previa o de un componente de la vacuna Inmunodeficiencia grave conocida (p. ej., de tumores hematológicos y sólidos, tratamiento con quimioterapia, inmunodeficiencia congénita, & nbsp; terapia inmunosupresora a largo plazo (f) o pacientes con infección por VIH que tienen inmunodeficiencia grave) < sup> (e) Pregnancy | Enfermedad aguda moderada o grave con o sin fiebre Recepción de medicamentos antivirales específicos (aciclovir, famciclovir o valaciclovir) 24 horas antes de la vacunación (evite el uso de estos medicamentos antivirales durante 14 días después de la vacunación) |
Abreviaturas: DT = toxoides diftérica y tetánica; DTaP = toxoides diftéricos y tetánicos y tos ferina acelular; DTP = toxoide diftérico, toxoide tetánico y tos ferina; GBS = Guillain-Barr & eacute; síndrome; Hib = Haemophilus influenzae tipo b; VIH = virus de inmunodeficiencia humana; VPH = virus del papiloma humano; IIV = vacuna inactivada contra la influenza; IPV = poliovirus inactivado; LAIV = vacuna viva, atenuada contra la influenza; MenACWY = vacuna conjugada meningocócica cuadrivalente; RMM = sarampión, paperas y rubéola; MPSV4 = vacuna de polisacárido meningocócico cuadrivalente; PCV13 = vacuna neumocócica conjugada; PPSV23 = vacuna polisacárida neumocócica; SCID = inmunodeficiencia combinada severa; RIV = vacuna recombinante contra la influenza; Td = toxoides del tétanos y la difteria; Tdap = toxoide tetánico, toxoide diftérico reducido y tos ferina acelular.
(a) Los eventos o condiciones enumerados como precauciones deben revisarse cuidadosamente. Deben considerarse los beneficios y riesgos de administrar una vacuna específica a una persona en estas circunstancias. Si se cree que el riesgo de la vacuna supera el beneficio, no se debe administrar la vacuna. Si se cree que el beneficio de la vacunación supera el riesgo, se debe administrar la vacuna. La administración de DTaP a los niños con trastornos neurológicos subyacentes probados o sospechosos debe decidirse caso por caso.
(b) Además, ACIP recomienda que no se use LAIV para mujeres embarazadas, personas inmunodeprimidas, personas con alergia al huevo y niños de 2 a 4 años con asma o que hayan tenido sibilancias episodio notado en el registro médico en los últimos 12 meses, o para quienes los padres informan que un proveedor de atención médica declaró que tenía sibilancias o asma en los últimos 12 meses. La LAIV no debe administrarse a personas que hayan tomado medicamentos antivirales para la influenza dentro de las 48 horas anteriores. Las personas que cuidan a personas gravemente inmunodeprimidas que requieren un entorno de protección no deben recibir LAIV, o deben evitar el contacto con dichas personas durante los 7 días posteriores a la recepción.
(c) Fuente: ( 52 ). </ p>
(d) Los niños infectados por el VIH pueden recibir la vacuna contra la varicela si el recuento de linfocitos T CD4 + es & ge; 15% y debería recibir la vacuna MMR si tiene una edad de 12 meses y no tiene pruebas. de la inmunosupresión grave actual (es decir, los individuos de 5 años o menos deben tener linfocitos T CD4 + [CD4] porcentajes & ge; 15% durante 6 meses; y los de 5 años de edad y gt; deben tener porcentajes de CD4 + & ge; 15% CD4 + & ge; 200 linfocitos / mm 3 durante & ge; 6 meses) u otra evidencia actual de inmunidad contra el sarampión, la rubéola y las paperas. En los casos en que solo están disponibles los recuentos de células CD4 + o solo los porcentajes de CD4 + para los mayores de 5 años, la evaluación de la inmunosupresión grave puede basarse en los valores de CD4 + (recuento o porcentaje) disponibles. En los casos en que los porcentajes de CD4 + no están disponibles para personas de 5 años o menos, la evaluación de la inmunosupresión grave puede basarse en los recuentos de CD4 + específicos de la edad en el momento en que se midieron los recuentos de CD4 +; es decir, la ausencia de inmunosupresión severa se define como & gt; 6 meses por encima de los criterios de recuento de CD4 + específicos de la edad: recuento de CD4 + & gt; 750 linfocitos / mm 3 mientras envejecieron & le; 12 meses y recuento de CD4 + & ge ; 500 linfocitos / mm 3 mientras envejecieron de 1 a 5 años. Fuentes: ( 1 , 50 ).
(e) MMR y las vacunas que contienen varicela se pueden administrar el mismo día. Si no se administra el mismo día, estas vacunas deben separarse por al menos 28 días.
(f) Una dosis de esteroide sustancialmente inmunosupresora se considera como 2 semanas de la recepción diaria de 20 mg o 2 mg / kg de peso corporal de prednisona o equivalente.
(g) antecedentes familiares de inmunodeficiencia congénita o hereditaria en familiares de primer grado (p. ej., padres y hermanos), a menos que la competencia inmunológica del posible receptor de la vacuna haya sido confirmada clínicamente o verificada por un laboratorio.
(h) Si se sospecha de tuberculosis activa, la MMR debe retrasarse. La vacunación contra el sarampión podría suprimir temporalmente la reactividad de la tuberculina. La vacuna que contiene el sarampión se puede administrar el mismo día que la prueba de la piel con tuberculina o IGRA. Si la prueba no se puede realizar hasta después del día de la vacunación MMR, la prueba debe posponerse por más de 4 semanas después de la vacunación. Si existe una necesidad urgente de realizar una prueba cutánea o IGRA, hágalo con el entendimiento de que la vacuna podría reducir la reactividad.
(i) Para obtener más información, consulte ( 55 ).
(j) No se han notificado eventos adversos relacionados con el uso de aspirina o productos que contengan aspirina después de la vacunación contra la varicela; sin embargo, el fabricante de la vacuna recomienda que los receptores de la vacuna eviten usar aspirina o productos que contengan aspirina durante 6 semanas después de recibir las vacunas contra la varicela debido a la asociación entre el uso de aspirina y el síndrome de Reye después de la varicela. Se debe considerar la vacunación con control posterior posterior para los niños que tienen artritis reumatoide u otras afecciones que requieren aspirina terapéutica. El riesgo de complicaciones graves asociadas con la aspirina probablemente sea mayor en los niños en los que se desarrolla una varicela natural que en los niños que reciben la vacuna que contiene VZV atenuado.
References
- McLean HQ, Fiebelkorn AP, Temte JL, Wallace GS. Prevention of measles, rubella, congenital rubella syndrome, and mumps, 2013: summary recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2013;62(RR-4):1-34.
- National Vaccine Advisory Committee. Standards for child and adolescent immunization practices. Pediatrics. 2003;112(4):958-963.
- Rubin L, Levin M, Ljungman P, et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis. 2014;58(3):e44-100. DOI: 10.1093/cid/cit684
- Kroger A, Atkinson W, Pickering L. General immunization practices. In: Plotkin S, Orenstein W, Offit P, eds. Vaccines. 6th ed. China: Elsevier Saunders; 2013:88-111.
- CDC. Diphtheria, tetanus, and pertussis: recommendations for vaccine use and other preventive measures. Recommendations of the Immunization Practices Advisory Committee (ACIP). MMWR Recomm Rep. 1991;40(RR-10):1-28.
- CDC. Addition of history of intussusception as a contraindication for rotavirus vaccination. MMWR Morb Mortal Wkly Rep. 2011;60(41):1427.
- Siber GR, Werner BG, Halsey NA, et al. Interference of immune globulin with measles and rubella immunization. J Pediatr. 1993;122(2):204-211. DOI: 10.1016/S0022-3476(06)80114-9
- Halsey NA, Boulos R, Mode F, et al. Response to measles vaccine in Haitian infants 6 to 12 months old. Influence of maternal antibodies, malnutrition, and concurrent illnesses. N Engl J Med. 1985;313(9):544-549. DOI: 10.1056/nejm198508293130904
- Ndikuyeze A, Munoz A, Stewart J, et al. Immunogenicity and safety of measles vaccine in ill African children. Int J Epidemiol. 1988;17(2):448-455. DOI: 10.1093/ije/17.2.448
- Lindegren ML, Atkinson WL, Farizo KM, Stehr-Green PA. Measles vaccination in pediatric emergency departments during a measles outbreak. JAMA. 1993;270(18):2185-2189. DOI: 10.1001/jama.1993.03510180055033
- Atkinson W, Markowitz L, Baughman A, et al. Serologic response to measles vaccination among ill children [Abstract 422]. 32nd Interscience Conference on Antimicrobial Agents and Chemotherapy; 1992; Anaheim, CA.
- Orenstein W, Rodewald L, Hinman A, Schuchat A. Immunization in the United States. In: Plotkin S, Orenstein W, Offit P, eds. Vaccines. 5th ed. China: Saunders/Elsevier; 2008:1479-1510.
- Lewis T, Osborn LM, Lewis K, Brockert J, Jacobsen J, Cherry JD. Influence of parental knowledge and opinions on 12-month diphtheria, tetanus, and pertussis vaccination rates. Am J Dis Child. 1988;142(3):283-286. DOI: 10.1001/archpedi.1988.02150030053018
- Farizo KM, Stehr-Green PA, Markowitz LE, Patriarca PA. Vaccination levels and missed opportunities for measles vaccination: a record audit in a public pediatric clinic. Pediatrics. 1992;89(4 Pt 1):589-592.
- Centers for Medicare & Medicaid Services. Overview of specifications of measures displayed on hospital compare as of December 14, 2006 [11 pages]. 2006. Accessed 9 March, 2017.
- Donovan R, Soothill JF. Immunological studies in children undergoing tonsillectomy. Clin Exp Immunol. 1973;14(3):347-357.
- Puri P, Reen DJ, Browne O, Blake P, Guiney EJ. Lymphocyte response after surgery in the neonate. Arch Dis Child. 1979;54(8):599-603. DOI: 10.1136/adc.54.8.599
- Mollitt DL, Steele RW, Marmer DJ, Stevers Golladay E, Costas S. Surgically induced immunologic alterations in the child. J Pediatr Surg. 1984;19(6):818-822. DOI: 10.1016/S0022-3468(84)80376-0
- Mollitt DL, Marmer DJ, Steele RW. Age-dependent variation of lymphocyte function in the postoperative child. J Pediatr Surg. 1986;21(7):633-635. DOI: 10.1016/S0022-3468(86)80420-1
- Kurz R, Pfeiffer KP, Sauer H. Immunologic status in infants and children following surgery. Infection. 1983;11(2):104-113. DOI: 10.1007/BF01641075
- Merry C, Puri P, Reen DJ. Effect of major surgery on neutrophil chemotaxis and actin polymerization in neonates and children. J Pediatr Surg. 1997;32(6):813-817. DOI: 10.1016/S0022-3468(97)90626-6
- Platt MP, Lovat PE, Watson JG, Aynsley-Green A. The effects of anesthesia and surgery on lymphocyte populations and function in infants and children. J Pediatr Surg. 1989;24(9):884-887. DOI: 10.1016/S0022-3468(89)80588-3
- Mattila-Vuori A, Salo M, Iisalo E. Immune response in infants undergoing application of cast: comparison of halothane and balanced anesthesia. Can J Anaesth. 1999;46(11):1036-1042. DOI: 10.1007/bf03013198
- Espanol T, Todd GB, Soothill JF. The effect of anaesthesia on the lymphocyte response to phytohaemagglutinin. Clin Exp Immunol. 1974;18(1):73-79.
- Hauser GJ, Chan MM, Casey WF, Midgley FM, Holbrook PR. Immune dysfunction in children after corrective surgery for congenital heart disease. Crit Care Med. 1991;19(7):874-881.
- Puri P, Lee A, Reen DJ. Differential susceptibility of neonatal lymphocytes to the immunosuppressive effects of anesthesia and surgery. Pediatr Surg Int. 1992;7(1):47-50. DOI: 10.1007/bf00181002
- Hansen TG, Tonnesen E, Andersen JB, Toft P, Bendtzen K. The peri-operative cytokine response in infants and young children following major surgery. Eur J Anaesthesiol. 1998;15(1):56-60. DOI: 10.1046/j.1365-2346.1998.00230.x
- Mattila-Vuori A, Salo M, Iisalo E, Pajulo O, Viljanto J. Local and systemic immune response to surgery under balanced anaesthesia in children. Paediatr Anaesth. 2000;10(4):381-388. DOI: 10.1046/j.1460-9592.2000.00505.x
- Romeo C, Cruccetti A, Turiaco A, et al. Monocyte and neutrophil activity after minor surgical stress. J Pediatr Surg. 2002;37(5):741-744. DOI: 10.1053/jpsu.2002.32268
- Vuori A, Salo M, Viljanto J, Pajulo O, Pulkki K, Nevalainen T. Effects of post-operative pain treatment using non-steroidal anti-inflammatory analgesics, opioids or epidural blockade on systemic and local immune responses in children. Acta Anaesthesiol Scand. 2004;48(6):738-749. DOI: 10.1111/j.1399-6576.2004.00404.x
- Siebert JN, Posfay-Barbe KM, Habre W, Siegrist CA. Influence of anesthesia on immune responses and its effect on vaccination in children: review of evidence. Paediatr Anaesth. 2007;17(5):410-420. DOI: 10.1111/j.1460-9592.2006.02120.x
- Currie J. Vaccination: is it a real problem for anesthesia and surgery? Paediatr Anaesth. 2006;16(5):501-503. DOI: 10.1111/j.1460-9592.2006.01898.x
- Siebert J, Posfay-Barbe KM, Habre W, Siegrist C-A. Author’s reply. Paediatr Anaesth. 2007;17(12):1218-1220. DOI: 10.1111/j.1460-9592.2007.02369.x
- Nafiu OO, Lewis I. Vaccination and anesthesia: more questions than answers. Paediatr Anaesth. 2007;17(12):1215-1215. DOI: 10.1111/j.1460-9592.2007.02318.x
- Short JA, Van Der Walt JH, Zoanetti DC. Author’s reply. Paediatr Anaesth. 2007;17(12):1215-1216. DOI: 10.1111/j.1460-9592.2007.02321.x
- Marin M, Broder KR, Temte JL, Snider DE, Seward JF. Use of combination measles, mumps, rubella, and varicella vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2010;59(RR-3):1-12.
- Szilagyi PG, Rodewald LE. Missed opportunities for immunizations: a review of the evidence. J Public Health Manag Pract. 1996;2(1):18-25. DOI: 10.1097/00124784-199600210-00005
- CDC. Use of diphtheria toxoid-tetanus toxoid-acellular pertussis vaccine as a five-dose series. Supplemental recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2000;49(RR-13):1-8.
- Fiore AE, Wasley A, Bell BP. Prevention of hepatitis A through active or passive immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2006;55(RR-7):1-23.
- Mast EE, Margolis HS, Fiore AE, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) part 1: immunization of infants, children, and adolescents. MMWR Recomm Rep. 2005;54(RR-16):1-31.
- Briere EC, Rubin L, Moro PL, Cohn A, Clark T, Messonnier N. Prevention and control of Haemophilus influenzae type b disease: recommendations of the advisory committee on immunization practices (ACIP). MMWR Recomm Rep. 2014;63(RR-1):1-14.
- Markowitz L, Dunne E, Saraiya M, et al. Human papillomavirus vaccination: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2014;63(RR-05):1-30.
- Grohskopf LA, Sokolow LZ, Olsen SJ, et al. Prevention and Control of Seasonal Influenza with Vaccines Recommendations of the Advisory Committee on Immunization Practices — United States, 2016–17 Influenza Season. MMWR Recomm Rep 2016;65(No. RR-5):1-54.
- Prevots DR, Burr RK, Sutter RW, Murphy TV. Poliomyelitis prevention in the United States. Updated recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2000;49(RR-5):1-22; quiz CE21-27.
- Cohn AC, MacNeil JR, Clark TA, et al. Prevention and control of meningococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2013;62(RR-2):1-28.
- Bexsero Package Insert (accessed 05/04/17).
- Trumenba Package Insert [15 pages] (accessed 05/04/17).
- Bilukha OO, Rosenstein N. Prevention and control of meningococcal disease. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2005;54(RR-7):1-21.
- Advisory Committee on Immunization Practices. Preventing pneumococcal disease among infants and young children. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep. 2000;49(RR-9):1-35.
- CDC. Prevention of pneumococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 1997;46(RR-8):1-24.
- Broder KR, Cortese MM, Iskander JK, et al. Preventing tetanus, diphtheria, and pertussis among adolescents: use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccines recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2006;55(RR-3):1-34.
- Marin M, Guris D, Chaves SS, Schmid S, Seward JF. Prevention of varicella: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2007;56(RR-4):1-40.
- Harpaz R, Ortega-Sanchez IR, Seward JF. Prevention of herpes zoster: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2008;57(RR-5):1-30; quiz CE32-34.
- Grohskopf LA, Olsen SJ, Sokolow LZ, et al. Prevention and control of seasonal influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP)—United States, 2014-15 influenza season. MMWR Morb Mortal Wkly Rep. 2014;63(32):691-697.
- Cortese MM, Parashar UD. Prevention of rotavirus gastroenteritis among infants and children: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2009;58(RR-2):1-25.
- American Academy of Pediatrics. Passive immunization. In: Pickering L, Baker C, Kimberlin D, Long S, eds. Red Book: 2012 Report of the Committee on Infectious Diseases. 28th ed. Elk Grove Village, IL: American Academy of Pediatrics; 2012.
Fuentes:
https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/contraindications.html
https://www.fda.gov/biologicsbloodvaccines/vaccines/approvedproducts/ucm093833.htm




