Sobre Engineering a Genetically Encoded Magnetic Protein Crystal https://doi.org/10.1021/acs.nanolett.9b02266
Stefano Montanari, director científico del laboratorio de Nanodiagnóstico de Módena sobre:
Campo magnético puede activar neuronas que contienen proteínas ricas en hierro https://www.bitchute.com/video/SeV5LZenJFIZ/
Experto Stefano Montanari, director científico del laboratorio de Nanodiagnóstico de Módena, donde se realizan investigaciones y se ofrecen consultas del más alto nivel sobre nanopatologías . https://www.bitchute.com/video/Sb1Rh54Btemb/
Cristal es un sólido que consiste en una disposición simétrica, ordenada y tridimensional de átomos o moléculas. Los científicos han diseñado células para producir cristales largos, en forma de aguja, ricos en hierro. Luego, los investigadores pueden usar imanes para controlar las células que contienen estos cristales. El video muestran estos cristales ricos en hierro moviéndose hacia un imán fuerte. Los cristales arrastran consigo a toda la célula.
Los nuevos cristales de proteínas fueron diseñados para que los científicos estudien qué neuronas controlan los movimientos y sentidos de un animal. Los cristales proporcionan algo dentro de una celda que los imanes pueden atraer. Esta innovación llena un vacío en el campo en ciernes de la magnetogenética (Mag-NEE-toh-jeh-NET-iks).
Los científicos en este campo diseñan células genéticamente para que respondan a los campos magnéticos. Ahora los investigadores pueden controlar de forma remota neuronas específicas del cuerpo mediante imanes. Esas neuronas podrían ser las que controlen el hambre que tiene un animal. O podrían ser neuronas que controlan los músculos de las piernas para que un ratón comience a correr cuando hay un imán cerca.
Ganando control magnético
Un campo magnético puede activar neuronas que contienen proteínas ricas en hierro. El campo hace esto calentando o dando un empujón mecánico a esas proteínas. Los investigadores ya habían podido controlar las neuronas con luz. Ese proceso se llama optogenética. Para usarlo, los científicos insertan moléculas sensibles a la luz en las neuronas de los animales vivos. Luego, los investigadores pueden encender o apagar las neuronas simplemente alumbrándolas con una luz. Con esta técnica, han hecho que los ratones corran en círculos. Incluso han devuelto el movimiento a la pierna paralizada de un animal. Pero la optogenética tiene sus desventajas. La luz, por ejemplo, no puede penetrar profundamente en el cuerpo. Simplemente hay demasiado hueso, músculo y otros tejidos en el camino. Entonces, los investigadores pueden implantar fibras ópticas en el animal para entregar luz a las neuronas profundas. Eso hace que el método sea engorroso e incluso potencialmente peligroso.
Toda la idea detrás de la magnetogenética es que no es necesario implantar nada, explica Jacob Robinson, neuroingeniero que trabaja en Rice University en Houston, Texas. Las células del interior del cuerpo podrían encenderse con solo un campo magnético. No se necesitarían fibras ni cirugía.
Pero hay un inconveniente. La única proteína que se encuentra naturalmente dentro de las células animales que es remotamente magnética es la ferritina (FAIR-ih-tin). Cada molécula puede tener hasta 4.500 átomos de hierro. Puede parecer mucho, pero no lo es. La fuerza que genera un imán que actúa sobre la ferritina sería solo una milmillonésima parte de la que se necesitaría para encender una neurona. Entonces, el equipo de Cui desarrolló cristales de proteínas que podrían transportar suficiente hierro para hacer que sus células respondan a los imanes.
Cristales
El equipo primero extrajo el gen para producir ferritina a partir de un microbio. Luego hicieron una pieza circular de ADN que contenía dos genes humanos. Esos genes producen cristales largos y huecos llamados inka-PAK4 (abreviatura de Inkabox-PAK4cat). El equipo introdujo estos trozos circulares de ADN en células renales humanas que crecían en una placa de Petri. Un día después, aparecieron los primeros cristales.
“Cuando vi por primera vez esos cristales ensamblarse en las células por sí mismos, fue simplemente asombroso”, recuerda Cui.
https://doi.org/10.1021/acs.nanolett.9b02266
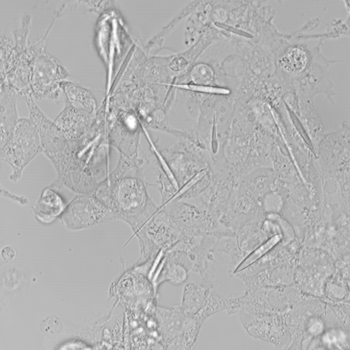
Los cristales crecieron durante tres días hasta alcanzar las 45 millonésimas de metro de largo. Eso es aproximadamente la mitad del grosor promedio de un cabello humano. Son los cristales de proteína que contienen hierro más grandes jamás fabricados en el laboratorio, o en la naturaleza, dice Cui. Eran incluso más largos que las células en las que crecieron. Pero las células en las que se formaron nunca se rompieron. Simplemente se estiraron para acomodar los cristales.
Los investigadores abrieron las células y retiraron los cristales. Luego los cargaron con hierro. El equipo estima que empaquetó unos 8 mil millones de átomos de hierro en cada cristal antes de insertar esos cristales en las células humanas que crecen en un plato. Ahora expusieron las células a un campo magnético.
Y las células se movieron. Los cristales comenzaron a acumularse cerca del imán. Y los cristales arrastraron sus células con ellos. El equipo describió esto en línea el 25 de septiembre en Nano Letters https://doi.org/10.1021/acs.nanolett.9b02266 .
Robinson expresó su entusiasmo por esto. «Es un paso excelente», dijo, «hacia la ingeniería de células para crear sus propias nanopartículas magnéticas». Los científicos no están seguros de qué pasará con los cristales después. Pero las células tienen los genes de los cristales. Entonces, cada célula reproducida a partir de las células originales debería poder producir los cristales, dice Cui.
Idealmente, los investigadores no necesitarían eliminar primero los cristales recién crecidos para llenarlos de átomos de metal. En cambio, las células enriquecerían los cristales con hierro a medida que los construyera. De hecho, el grupo de Cui intentó tres formas diferentes de introducir hierro en sus células. Incluso empaparon las células en una solución rica en hierro. Nada funcionó.
Las células suelen mantener bajos sus niveles de hierro, señala el equipo de Cui. Se estima que las células contienen naturalmente solo un 3 por ciento de la cantidad de hierro que necesitarían los cristales para ser efectivos.
Probablemente necesitemos alterar las membranas externas de la célula, sospecha Cui. Luego, dice, podrían transportar más hierro a una célula. Aún así, estos cristales magnéticos son un gran avance en el joven campo de la magnetogenética. Y los investigadores confían en que estudios adicionales superarán este obstáculo del enriquecimiento de hierro.
La magnetogenética es un nuevo campo que aprovecha la codificación genética proteínas y conjuntos de proteínas que son sensibles a los campos magnéticos para estudiar y manipular el comportamiento celular. Los estudios teóricos muestran que muchos propusieron las proteínas magnetogenéticas no contienen suficiente hierro para generar sustanciales fuerzas magnéticas. Aquí, hemos diseñado una ferritina codificada genéticamente cristal de proteína que crece dentro de las células de los mamíferos. Cada uno de estos cristales contiene más de 10 millones de subunidades de ferritina y es capaz de mineralizar sustanciales cantidades de hierro. Cuando se aíslan de las células y se cargan con hierro in vitro, estos cristales generan fuerzas magnéticas que son 9 órdenes de magnitud más grandes que las
fuerzas de las jaulas de ferritina individuales utilizadas en estudios anteriores. Estos cristales de proteína son atraídos por un campo magnético aplicado y se mueven hacia los imanes incluso cuando internalizado en las células. Si bien se necesitan estudios adicionales para realizar la potencial de la magnetogenética, estos resultados demuestran la viabilidad de ensamblajes de proteínas de ingeniería para detección magnética.
PALABRAS CLAVE: Magnetogenética, cristal proteico, ferritina, magnética https://pubs.acs.org/doi/pdf/10.1021/acs.nanolett.9b02266
Dado que nuestros ingresos operativos se ven sometidos a una gran presión, su apoyo puede ayudarnos a llevar a cabo el importante trabajo que hacemos. Si puede, colaborar por solo $ 230/mes; solo le llevará un minuto. ¡Gracias por tu colaboración!
Ver Más
Nanobots de ADN de hidrogel magnético (HG-Fe3O4) capaces de autoensamblar ‘transformadores leves’ y hacer una futura entrega de medicamentos ya implementados.
- Transformadores inteligentes basados en hidrogel controlados magnéticamente https://phys.org/news/2020-12-magnetically-hydrogel-based-smart.html…
- Avances recientes en hidrogeles magnéticos sensibles en ingeniería de tejidos https://ncbi.nlm.nih.gov/pmc/articles/PMC7068712/…
- Los nanobots de ADN se construyen a sí mismos: ¿cómo podemos ayudarlos a crecer de la manera correcta? https://phys.org/news/2020-12-dna-nanobots.html
Referencias
- Mary Aubry, Wei-An Wang, Yohan Guyodo, Eugénia Delacou, Jean-Michel Guigner, Olivier Espeli, Alice Lebreton, François Guyot, Zoher Gueroui. Engineering E. coli for Magnetic Control and the Spatial Localization of Functions. ACS Synthetic Biology 2020, 9 (11) , 3030-3041. https://doi.org/10.1021/acssynbio.0c00286
- Yihao Cui, Benke Li, Xiaoyu Wang, Ruikang Tang. Organism–Materials Integration: A Promising Strategy for Biomedical Applications. Advanced NanoBiomed Research 2021, 1 (2) , 2000044. https://doi.org/10.1002/anbr.202000044
- Jung-uk Lee, Wookjin Shin, Yongjun Lim, Jungsil Kim, Woon Ryoung Kim, Heehun Kim, Jae-Hyun Lee, Jinwoo Cheon. Non-contact long-range magnetic stimulation of mechanosensitive ion channels in freely moving animals. Nature Materials 2021, 34 https://doi.org/10.1038/s41563-020-00896-y
- Yueqi Zhao, Ruikang Tang. Improvement of organisms by biomimetic mineralization: A material incorporation strategy for biological modification. Acta Biomaterialia 2021, 120 , 57-80. https://doi.org/10.1016/j.actbio.2020.06.038
- K. V. Kavokin. Nonlinear high-frequency magnetic response of magnetoferritin metacrystals governed by spin thermodynamics. Physical Review B 2020, 102 (19) https://doi.org/10.1103/PhysRevB.102.195417
- Thomas Li, Bianxiao Cui. Production and Isolation of Magnetic Protein Crystals in HEK293T Cells. BIO-PROTOCOL 2020, 10 (14) https://doi.org/10.21769/BioProtoc.3684
- Wheeler, M. A., et al. (2016). Genetically targeted magnetic control of the nervous system. Nat. Neurosci., DOI: 10.1038/nn.4265
- https://www.theguardian.com/science/neurophilosophy/2016/mar/24/magneto-remotely-controls-brain-and-behaviour
(1) Nimpf, S.; Keays, D. A. Is Magnetogenetics the New Optogenetics? EMBO J. 2017, 36 (12), 1643−1646.
(2) Munshi, R.; Qadri, S. M.; Zhang, Q.; Castellanos Rubio, I.; Del Pino, P.; Pralle, A. Magnetothermal Genetic Deep Brain Stimulation of Motor Behaviors in Awake, Freely Moving Mice. eLife 2017, 6,
27069.
(3) Liße, D.; Monzel, C.; Vicario, C.; Manzi, J.; Maurin, I.; Coppey, M.; Piehler, J.; Dahan, M. Engineered Ferritin for Magnetogenetic Manipulation of Proteins and Organelles Inside Living Cells. Adv. Mater. 2017, 29 (42), 1700189.
(4) Chen, R.; Romero, G.; Christiansen, M. G.; Mohr, A.; Anikeeva, P. Wireless Magnetothermal Deep Brain Stimulation. Science 2015, 347 (6229), 1477−1480.
(5) Wheeler, M. A.; Smith, C. J.; Ottolini, M.; Barker, B. S.; Purohit, A. M.; Grippo, R. M.; Gaykema, R. P.; Spano, A. J.; Beenhakker, M. P.; Kucenas, S.; et al. Genetically Targeted Magnetic Control of the Nervous System. Nat. Neurosci. 2016, 19 (5), 756−761.
(6) Stanley, S. A.; Sauer, J.; Kane, R. S.; Dordick, J. S.; Friedman, J. M. Remote Regulation of Glucose Homeostasis in Mice Using Genetically Encoded Nanoparticles. Nat. Med. 2015, 21 (1), 92−98.
(7) Qin, S.; Yin, H.; Yang, C.; Dou, Y.; Liu, Z.; Zhang, P.; Yu, H.; Huang, Y.; Feng, J.; Hao, J.; et al. A Magnetic Protein Biocompass. Nat. Mater. 2016, 15 (2), 217−226.
(8) Long, X.; Zhang, S.-J. Commentary: MagR Alone Is Insufficient to Confer Cellular Calcium Responses to Magnetic Stimulation. Front. Neural Circuits 2018, 12, 97.
(9) Pang, K.; You, H.; Chen, Y.; Chu, P.; Hu, M.; Shen, J.; Guo, W.; Xie, C.; Lu, B. MagR Alone Is Insufficient to Confer Cellular Calcium Responses to Magnetic Stimulation. Front. Neural Circuits 2017, 11, 11.
(10) Meister, M. Physical Limits to Magnetogenetics. eLife 2016, 5, 17210.
(11) Jutz, G.; van Rijn, P.; Santos Miranda, B.; Böker, A. Ferritin: A Versatile Building Block for Bionanotechnology. Chem. Rev. 2015, 115 (4), 1653−1701.
(12) Giessen, T. W.; Silver, P. A. Widespread Distribution of Encapsulin Nanocompartments Reveals Functional Diversity. Nat. Microbiol 2017, 2, 17029.
(13) He, D.; Hughes, S.; Vanden-Hehir, S.; Georgiev, A.; Altenbach, K.; Tarrant, E.; Mackay, C. L.; Waldron, K. J.; Clarke, D. J.; MarlesWright, J. Structural Characterization of Encapsulated Ferritin Provides Insight into Iron Storage in Bacterial Nanocompartments. eLife 2016, 5, 18972.
(14) Yan, L.; Zhang, S.; Chen, P.; Liu, H.; Yin, H.; Li, H. Magnetotactic Bacteria, Magnetosomes and Their Application.
Microbiol. Res. 2012, 167 (9), 507−519.
(15) Elfick, A.; Rischitor, G.; Mouras, R.; Azfer, A.; Lungaro, L.; Uhlarz, M.; Herrmannsdörfer, T.; Lucocq, J.; Gamal, W.;
Bagnaninchi, P.; et al. Biosynthesis of Magnetic Nanoparticles by Human Mesenchymal Stem Cells Following Transfection with the Magnetotactic Bacterial Gene mms6. Sci. Rep. 2017, 7, 39755.
(16) Schönherr, R.; Rudolph, J. M.; Redecke, L. Protein Crystallization in Living Cells. Biol. Chem. 2018, 399 (7), 751−772.
(17) Ji, X.; Axford, D.; Owen, R.; Evans, G.; Ginn, H. M.; Sutton, G.; Stuart, D. I. Polyhedra Structures and the Evolution of the Insect Viruses. J. Struct. Biol. 2015, 192 (1), 88−99.
(18) Baskaran, Y.; Ang, K. C.; Anekal, P. V.; Chan, W. L.; Grimes, J. M.; Manser, E.; Robinson, R. C. An in Cellulo-Derived Structure of PAK4 in Complex with Its Inhibitor Inka1. Nat. Commun. 2015, 6, 8681.
(19) Tsutsui, H.; Jinno, Y.; Shoda, K.; Tomita, A.; Matsuda, M.; Yamashita, E.; Katayama, H.; Nakagawa, A.; Miyawaki, A. A
Diffraction-Quality Protein Crystal Processed as an Autophagic Cargo. Mol. Cell 2015, 58 (1), 186−193.
(20) Boudes, M.; Garriga, D.; Fryga, A.; Caradoc-Davies, T.; Coulibaly, F. A Pipeline for Structure Determination of in VivoGrown Crystals Using in Cellulo Diffraction. Acta Crystallogr. D Struct Biol. 2016, 72 (4), 576−585.
(21) Mori, H.; Ito, R.; Nakazawa, H.; Sumida, M.; Matsubara, F.; Minobe, Y. Expression of Bombyx Mori Cytoplasmic Polyhedrosis Virus Polyhedrin in Insect Cells by Using a Baculovirus Expression Vector, and Its Assembly into Polyhedra. J. Gen. Virol. 1993, 74 (1), 99−102.
(22) Koopmann, R.; Cupelli, K.; Redecke, L.; Nass, K.; Deponte, D. P.; White, T. A.; Stellato, F.; Rehders, D.; Liang, M.; Andreasson, J.; et al. Vivo Protein Crystallization Opens New Routes in Structural Biology. Nat. Methods 2012, 9 (3), 259−262.
(23) Ijiri, H.; Coulibaly, F.; Nishimura, G.; Nakai, D.; Chiu, E.; Takenaka, C.; Ikeda, K.; Nakazawa, H.; Hamada, N.; Kotani, E.; et al. Structure-Based Targeting of Bioactive Proteins into Cypovirus Polyhedra and Application to Immobilized Cytokines for Mammalian Cell Culture. Biomaterials 2009, 30 (26), 4297−4308.
(24) Abe, S.; Tabe, H.; Ijiri, H.; Yamashita, K.; Hirata, K.; Atsumi, K.; Shimoi, T.; Akai, M.; Mori, H.; Kitagawa, S.; et al. Crystal
Engineering of Self-Assembled Porous Protein Materials in Living Cells. ACS Nano 2017, 11 (3), 2410−2419.
(25) Tatur, J.; Hagen, W. R.; Matias, P. M. Crystal Structure of the Ferritin from the Hyperthermophilic Archaeal Anaerobe Pyrococcus Furiosus. JBIC, J. Biol. Inorg. Chem. 2007, 12 (5), 615−630.
(26) Ebrahimi, K. H.; Hagedoorn, P.-L.; Hagen, W. R. Self-assembly is prerequisite for catalysis of Fe(II) oxidation by catalytically active subunits of ferritin. J. Biol. Chem. 2015, 290 (290), 26801.
(27) Matsumoto, Y.; Chen, R.; Anikeeva, P.; Jasanoff, A. EngiEbrahiminK. H.eering Intracellular Biomineralization and Biosensing by a Magnetic Protein. Nat. Commun. 2015, 6, 8721.
(28) Honarmand Ebrahimi, K.; Hagedoorn, P.-L.; Hagen, W. R. Unity in the Biochemistry of the Iron-Storage Proteins Ferritin and Bacterioferritin. Chem. Rev. 2015, 115 (1), 295−326. (29) Michaelis, L.; Coryell, C. D.; Granick, S.; Ferritin, III The Magnetic Properties of Ferritin and Some Other Colloidal Ferric Compounds. J. Biol. Chem. 1943, 148 (3), 463−480.
(30) Meeker, D. Finite Element Method Magnetics: HomePage. http://www.femm.info/wiki/HomePage.
(31) Yang, K.; Lu, C.; Zhao, X.; Kawamura, R. From Bead to Rod: Comparison of Theories by Measuring Translational Drag Coefficients of Micron-Sized Magnetic Bead-Chains in Stokes Flow. PLoS One 2017, 12 (11), No. e0188015.
(32) e , N. A.; van Kempen, T. H. S.; Sonneveld, S.; Rosalina, T. T.; Vos, B. E.; Jansen, K. A.; Peters, G. W. M.; van de
Vosse, F. N.; Koenderink, G. H. Buffers Strongly Modulate Fibrin Self-Assembly into Fibrous Networks. Langmuir 2017, 33 (25), 6342−6352.
(33) Savigni, D. L.; Morgan, E. H. Mediation of Iron Uptake and Release in Erythroid Cells by Photodegradation Products of Nifedipine. Biochem. Pharmacol. 1996, 51 (12), 1701−1709. (34) Kress, G. J.; Dineley, K. E.; Reynolds, I. J. The Relationship between Intracellular Free Iron and Cell Injury in Cultured Neurons, Astrocytes, and Oligodendrocytes. J. Neurosci. 2002, 22 (14), 5848−5855.
(35) Malecki, E. A.; Cable, E. E.; Isom, H. C.; Connor, J. R. The Lipophilic Iron Compound TMH-Ferrocene [(3,5,5-
Trimethylhexanoyl)ferrocene] Increases Iron Concentrations, Neuronal L-Ferritin, and Heme Oxygenase in Brains of BALB/c Mice. Biol. Trace Elem. Res. 2002, 86 (1), 73−84.
(36) Ma, Y.; Abbate, V.; Hider, R. C. Iron-Sensitive Fluorescent Probes: Monitoring Intracellular Iron Pools. Metallomics 2015, 7 (2), 212−222.
(37) Shi, H.; Bencze, K. Z.; Stemmler, T. L.; Philpott, C. C. A Cytosolic Iron Chaperone That Delivers Iron to Ferritin. Science 2008, 320 (5880), 1207−1210.
(38) Tadolini, B. Iron Autoxidation in Mops and Hepes Buffers. Free
Radical Res. Commun. 1987, 4 (3), 149−160.r