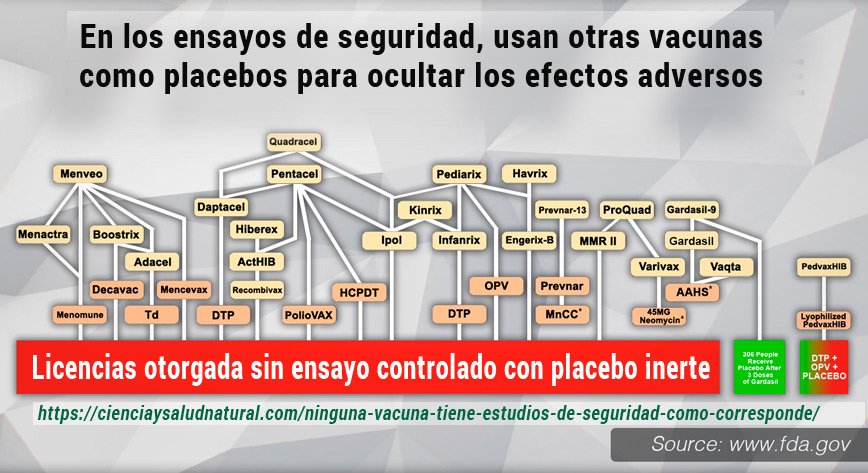
Ninguna vacuna inyectada de rutina en el calendario de los CDC fue autorizada para los niños sobre la base de un ensayo controlado con placebo. En los casos en que se utilizó una vacuna como control, tampoco se autorizó sobre la base de un ensayo controlado con placebo. Esto es un hecho basado en los datos de los ensayos clínicos de la FDA».
El 6 de junio de 2025 CNN afirmó que el equipo de noticias identificó «258 ensayos clínicos aleatorizados y controlados de vacunas» y que «Más de la mitad de esos estudios -153- probaron vacunas contra placebos, y 127 de esos estudios utilizaron placebos inertes».
Es necesario hacer conocer la corrupción histórica en el ACIP, Comité Asesor sobre Prácticas de Inmunización (ACIP) de los CDC -el panel encargado de recomendar vacunas para el público que imitan muchos países,
El ejemplo más escandaloso de la mala praxis malévola del ACIP ha sido su obstinada falta de voluntad para exigir ensayos de seguridad adecuados antes de recomendar nuevas vacunas para nuestros hijos. Hoy en día, un niño estadounidense obediente recibe entre 69 y 92 vacunas rutinarias (dependiendo de la marca/dosis indicada) desde la concepción hasta los 18 años de edad. En la Argentina son alrededor de 40 dosis.
Esta cifra es superior a las 11 inyecciones de 1986. El ACIP ha recomendado cada una de estas inyecciones adicionales sin exigir ensayos controlados con placebo para ninguna de ellas. Esto significa que nadie puede determinar científicamente si estos productos evitan más problemas de los que causan.
Muchos promotores de vacunas han cuestionado esta afirmación. Siempre se equivocan. La semana pasada, CNN, que se ha convertido en un propagandista desvergonzado de l industria farmaceutica anunció triunfalmente que tenía pruebas de que mi afirmación de que «no ha habido ensayos de seguridad controlados con placebo para ninguna vacuna de rutina» era falsa. La CNN proclamó que había encontrado 257 estudios controlados con placebo para vacunas rutinarias.
Lo siguiente demuestra que las afirmaciones de la CNN son falsas.
La CNN engaña, ninguna vacuna inyectada de rutina en el calendario de los CDC fue autorizada para los niños sobre la base de un ensayo controlado con placebo. En los casos en los que se utilizó una vacuna como control, tampoco se autorizó basándose en un ensayo controlado con placebo. Esto no es una conjetura. Es un hecho basado en los datos de los ensayos clínicos de la FDA. (Véase mas abajo en: «Control Utilizado en cada ensayo utilizado para autorizar vacunas para niños en el calendario del CDC «).
Este compendio de estudios de expertos, contiene la suficiente evidencia para que los padres puedan presentar a sus médicos y abogados y prevenir que su hijos sean intoxicados con vacunas o inyecciones génicas que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. Click aqui para descargar este compendio
De los 21 estudios restantes que la lista de la CNN afirma que utilizaron una inyección inerte, 9 claramente no lo hicieron:
- ECA 251, 252 (Varivax) inyectaron un antibiótico, neomicina – no inerte.
- ECA 84, 97 (VPH-16 y 16/18) inyectaron adyuvante de aluminio, no inerte.
- ECA 215 (Almevax) inyectó otra vacuna, no inerte.
- ECA 55 (PedvaxHIB liofilizada) inyectó lactosa, adyuvante de aluminio y timerosal – no inerte.
- ECA 197 (vacuna Salk) inyectó solución 199, cultivo de tejidos sintéticos, etanol, rojo fenol, antibióticos y formalina – no inerte.***
- ECA 168 (triple vírica de Dow) inyectó vacuna completa menos virus, incluidos todos los estabilizadores, antibióticos, diluyente, conservante y tampones – no inerte.****
- ECA 189 (Menveo) inyectó Tdap+salina o Menveo+salina – no inerte.
Para los 12 estudios restantes de la lista que pueden haber tenido una inyección inerte, ninguno fue un ensayo en el que se basaran para autorizar una vacuna rutinaria en el calendario infantil de los CDC:
- Los ECA 170, 171, 172 (MMR VaxPro), 228 (PCV11), 136 (Vaxigrip), 242 (Antitetanus), y 122 (vacunas chinas contra la gripe) ensayaron vacunas nunca autorizadas en EE.UU. ni utilizadas para autorizar una vacuna estadounidense.
- Los ensayos RCT 124 (Fluzone IIV3), 102 (WVV/SPV) y 188 (Menveo) se produjeron después de que cada vacuna fuera autorizada, por lo que no se utilizaron para su autorización.
- La FDA no se basó en el ECA 176 (vacuna contra las paperas) para autorizar la actual vacuna triple vírica. (Véase el informe del ensayo clínico MMR-II en el enlace anterior.)
- El ECA 53 (PRP-D) fue para una vacuna retirada poco después de su introducción y en la que no se basó la FDA para autorizar ninguna vacuna estadounidense.
Ver mas sobre la falta de ensayos de seguridad en este compendio de expertos click aqui
Aunque estos 12 estudios no se utilizaron para autorizar una vacuna de rutina en el calendario de los CDC, reflejan que es posible realizar un ensayo controlado con placebo de una vacuna. También reflejan lo que se puede aprender cuando se realiza un ensayo con placebo.
Por ejemplo: El ECA 136 descubrió que la vacuna era ineficaz; el ECA 122 descubrió que «se produjeron efectos adversos graves en 69 (0-6%, IC del 95%: 0-5-0-8) receptores de la vacuna en comparación con un receptor (0-1%, 0-0-2) de placebo»; y el ECA 124 descubrió que «la tasa de hospitalización fue realmente mayor en el grupo de la vacuna [Fluzone IIV3] que en el grupo placebo».
Sin embargo, la desafortunada realidad es que los ensayos controlados con placebo no se realizan y no se han basado en ellos cuando la FDA autorizó las vacunas inyectables durante la infancia o el ACIP recomienda la vacuna para añadirla al calendario rutinario de los CDC.
El aluminio en las vacunas es neurotóxico y el calendario de vacunación infantil tiene sobredosis de aluminio. Los estudios de seguridad del aluminio tienen graves errores y este tema esta postergado desde hace décadas. Más de 100 referencias científicas de expertos para que Usted presente a su abogado o médico, para eximir a sus hijos de las vacunas. Descargar libro click aqui
CNN habría llegado a la misma conclusión si hubiera revisado la documentación de la FDA para cada vacuna, en lugar de basarse en una lista aleatoria de Internet. La lista de la CNN demuestra irónicamente la falta de pruebas de seguridad adecuadas para las vacunas infantiles de rutina.
Hemos pasado de 3 inyecciones rutinarias al año de edad en 1986 (año en que se aprobó la Ley Nacional de Lesiones por Vacunas en la Infancia) a 25 inyecciones rutinarias al año de edad en 2025 (que ahora no incluye la vacuna Covid-19). Debido a la Ley de 1986, cada uno de estos productos, salvo uno, fue desarrollado por empresas que sabían que casi nunca serían responsables de daños graves. Durante este mismo periodo, se dispararon las enfermedades crónicas en niños, la mayoría de las cuales están causadas por una desregulación del sistema inmunitario. Si queremos identificar las exposiciones que están causando esta epidemia de enfermedades autoinmunes, tenemos que descartar como posibles culpables los productos administrados docenas de veces a niños pequeños, específicamente para modificar el sistema inmunitario.
Los bebés y niños merecen los mejores ensayos de seguridad posibles para mantenerlos a salvo. Debemos preocuparnos tanto por cada niño que pueda resultar herido por uno de estos productos como por cada niño que pueda resultar herido por una enfermedad infecciosa.
Control utilizado en cada ensayo utilizado para autorizar vacunas para niños en el Calendario del CDC
Obsérvese que este documento sólo aborda los ensayos en los que se basó la FDA para determinar que el producto es seguro para su autorización.
– Vacuna contra la hepatitis B (calendario de los CDC: nacimiento, 1 mes y 6 meses)
- Recombivax HB (Merck): autorizada para lactantes sobre la base de ensayos sin control de placebo y 5 días de control de seguridad tras la inyección.2 o
- Engerix-B (GSK): autorizada para lactantes sobre la base de ensayos sin control de placebo y 4 días de control de seguridad tras la inyección.3
– Vacuna DTPa (calendario de los CDC: 2, 4, 6 y 15 meses, y 4 años)
- Infanrix (GSK): autorizada para lactantes en base a ensayos sin control placebo (vacuna DTP utilizada como control) y hasta 30 días de revisión de seguridad tras la inyección.4 DTP no fue autorizada en un ensayo controlado con placebo y se ha observado repetidamente que aumenta la mortalidad en lactantes.5
- Daptacel (Sanofi): autorizada para lactantes sobre la base de ensayos sin control de placebo (vacuna DT o DTP utilizada como control) y «en los 30 días siguientes a cualquier dosis de DAPTACEL, el 3,9% de los sujetos de notificaron al menos un acontecimiento adverso grave».6
– Vacuna PCV (calendario de los CDC: 2, 4, 6 y 12 meses)
- Prevnar 13, PCV-13 (Wyeth, parte de Pfizer): autorizada para lactantes sobre la base de ensayos sin control placebo (se utilizó Prevnar 7 como control, que se autorizó sobre la base de un ensayo en el que el control era una «vacuna meningocócica conjugada del grupo C en fase de investigación», lo que significa otra vacuna experimental) y «[s]erious adverse events reported following vaccination in infants and toddlers occurred in 8. 2% entre los receptores de Prevnar 13 y 7,2% entre los receptores de Prevnar 7. «7
- Vaxneuvance PCV-15 (Merck): autorizada para lactantes en base a ensayos sin control de placebo (Prevnar 13 utilizada como control) y »[e]ntre los niños que recibieron VAXNEUVANCE (N=3.349) o Prevnar 13 (N=1.814) … se notificaron acontecimientos adversos graves … en el 9,6% de los receptores de VAXNEUVANCE (N=3.349) o Prevnar 13 (N=1.814). El 6% de los receptores de VAXNEUVANCE y el 8,9% de los receptores de Prevnar 13″. Considerada «segura» porque «[n]o hubo patrones notables o desequilibrios numéricos entre los grupos de vacunación».8
- Prevnar 20, PCV-20 (Pfizer): autorizada para lactantes sobre la base de ensayos sin control de placebo (Prevnar 13 utilizada como control) y de nuevo mostró tasas elevadas de acontecimientos graves (esta vez desglosados en dos categorías, «acontecimientos adversos graves» y «enfermedades crónicas recientemente diagnosticadas») en ambos grupos, pero considerada “segura” porque «no hubo patrones notables o desequilibrios entre los grupos de vacunación».9
– Vacuna antipoliomielítica (calendario de los CDC: 2, 4 y 6 meses, y 4 años)
IPOL (Sanofi): autorizada en 1990 para lactantes sobre la base de ensayos sin control placebo y 3 días de revisión de seguridad tras la inyección. Sanofi informa de que, «[a]unque no se ha establecido ninguna relación causal , se han producido muertes en asociación temporal tras la vacunación de lactantes con IPV».10 Dado que IPOL es un producto diferente de la vacuna antipoliomielítica desarrollada por Jonas Salk en los años 50 (que se dejó de fabricar en los años 60), incluido porque IPOL es «cultivadas en células vero, una línea continua de células de riñón de mono cultivadas en microportadores», no se basó en el ensayo Salk para autorizar IPOL.11
– Vacuna contra la Hib (calendario de los CDC: 2, 4, 6 y 12 meses)
- ActHIB (Sanofi): autorizada para lactantes sobre la base de ensayos sin control placebo (vacuna contra la Hep B utilizada como control) y 30 días de revisión de la seguridad tras la inyección durante los cuales el 3. 4% experimentaron un acontecimiento adverso grave pero «[n]inguno fue evaluado por los investigadores [Sanofi] como relacionado con el estudio de las vacunas. »12
- Hiberix (GSK): autorizado para lactantes basado en ensayos sin control placebo (ActHIB utilizó como control) y 31 días de revisión de seguridad tras la inyección.13
- PedvaxHIB líquida (Merck): autorizada para lactantes en base a ensayos sin control placebo (PedvaxHIB liofilizada utilizada como control) y 3 días de revisión de seguridad tras la inyección.14 (Nótese que PedvaxHIB liofilizada se probó en un ensayo en el que el grupo de control recibió una inyección de lactosa, adyuvante de aluminio y timerosal, junto con OPV y DTP.15)
– Vacuna antigripal (calendario CDC: 6 y 7 meses y luego anualmente)
- La formulación de cada vacuna antigripal cambia anualmente y no se realiza ningún ensayo clínico para cada nueva formulación.
– Vacuna triple vírica (calendario de los CDC: 12 meses y 4 años)
SRP o M-M-R-II (Merck): autorizada sobre la base de un ensayo con un total de 834 niños, sin grupo de control, y que revisó la seguridad durante 42 días durante los cuales un tercio de los participantes vacunados desarrollaron problemas gastrointestinales y un tercio experimentó problemas respiratorios.16
- Priorix (GSK): autorizada sobre la base de ensayos sin control de placebo (M-M-R-II se utilizó como control) y 6 meses de revisión de la seguridad tras la inyección en los que ambos grupos de vacunas tuvieron una alta tasa de acontecimientos adversos graves (2,1% del grupo Priorix y 1,9% del grupo M-M-R-II), visitas a urgencias (10,1% del grupo Priorix y 10,4% del grupo M-M-R-II), y nueva aparición de enfermedades crónicas (por ejemplo, trastornos autoinmunes, asma, diabetes tipo I, vasculitis, enfermedad celíaca , trombocitopenia y alergias) (3,4% del grupo Priorix y 3,7% del grupo M-M-R-II ).17
– Vacuna contra la varicela (calendario de los CDC: 12 meses y 4 años)
- Varivax (Merck): autorizada sobre la base de ensayos sin control placebo (el supuesto «placebo» era una inyección de neomicina, un antibiótico) y 70 días de revisión de la seguridad tras la inyección que incluyó sólo un ensayo controlado de 956 niños en el que aproximadamente la mitad recibió Varivax y la otra mitad recibió una inyección de neomicina.18
– Vacuna contra la hepatitis A (calendario de los CDC: 12 y 18 meses)
- Havrix (GSK): autorizada a partir de ensayos sin control de placebo (Engerix-B utilizado como control).19
- o Vaqta (Merck): autorizada a partir de ensayos sin control de placebo (inyección de adyuvante de aluminio y timerosal utilizado como control).20
– Vacuna Tdap (calendario de los CDC: 11 años)
- Adacel (Sanofi): autorizada a partir de ensayos sin control placebo (Td, para uso en adultos, se utilizó como control).21
- Boostrix (GSK): autorizada a partir de ensayos sin control placebo (Decavac o Adacel se utilizaron como control).22 (Nótese que Decavac se autorizó a partir de un ensayo sin control.23)
– Vacuna contra el VPH (calendario de los CDC: 9 y 9 ½ años)
- Gardasil 9 (Merck): autorizada a partir de ensayos sin control, Gardasil 4 como control o, en el caso de 306 participantes, placebo más Gardasil 4 como control.24 (Nótese que Gardasil 4 se autorizó a partir de ensayos en los que se inyectó a los controles adyuvante de aluminio o, en 594 sujetos, l-histidina, polisorbato 80 y proteína de levadura.25)
– Vacuna Men4 (calendario de los CDC: 11 y 16 años)
- Menactra (Sanofi): autorizada sobre la base de ensayos sin control placebo (Menomune se utilizó como control).26 Nótese que Menomune se autorizó sin un ensayo controlado con placebo; en su lugar, el prospecto de Menomune en menciona el ensayo utilizado para autorizar Menactra, en el que Menomune fue el control , como base de la seguridad de Menomune.27
- Menveo (GSK): autorizado sobre la base de ensayos sin control de placebo (Menactra, Boostrix, u otras vacunas de utilizadas como control).28
- MenQuadfi (Sanofi): autorizado sobre la base de ensayos sin control de placebo (Menveo u otras vacunas de utilizadas como control).29 Por lo tanto, Menomune fue autorizado sin un ensayo controlado con placebo y luego utilizado como control para autorizar Menactra; Menactra luego utilizado como control para autorizar Menveo; y Menveo luego utilizado como control para autorizar MenQuadfi.
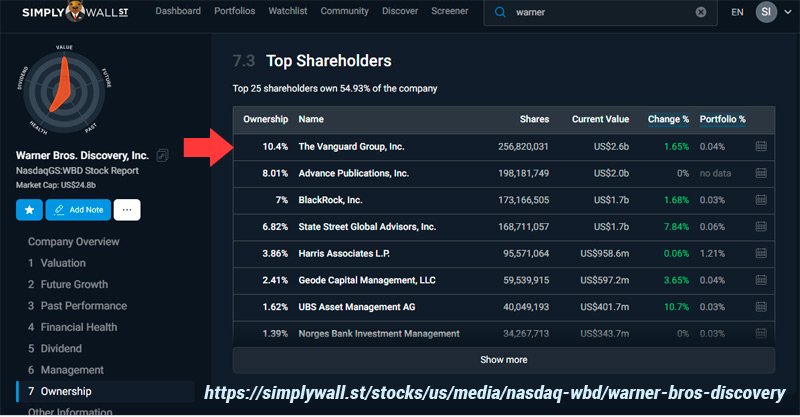
CNN pertenece al grupo Vanguard-BlackRock, dueños de los laboratorios que fabrican vacunas https://simplywall.st/stocks/us/media/nasdaq-wbd/warner-bros-discovery
Referencias
- 1 Obsérvese que este documento sólo aborda los ensayos en los que se basó la FDA para determinar que el producto es seguro para su autorización.
- 2 Véase § 6.1 en https://www.fda.gov/media/74274/download.
- 3 Véase el apartado 6.1 en https://www.fda.gov/media/119403/download.
- 4 Véase el apartado 6.1 en https://www.fda.gov/media/75157/download.
- 5 Véase https://archive.org/details/2021.01.28-letter-to-special-rapporteur-on-poverty.
- 6 Véase § 6.1 en https://www.fda.gov/media/74035/download; https://www.fda.gov/safety/reporting-serious-problems-fda/what-serious-adverse-event.
- 7 Véase § 6.1 en https://www.fda.gov/media/107657/download; https://www.fda.gov/media/76076/download.
- 8 Véase el apartado 6.1 en https://www.fda.gov/media/150819/download.
- 9 Véase § 6.1 en https://www.fda.gov/media/149987/download; https://www.fda.gov/media/150459/download.
- 10 Véanse las pp. 14-17 en https://www.fda.gov/media/75695/download.
- 11 See p. 1 at https://www.fda.gov/media/75695/download; https://pubmed.ncbi.nlm.nih.gov/6740101/; https://admin.phe-culturecollections.org.uk/media/122249/vero-cell-line-profile.pdf; https://www.atcc.org/products/all/ccl-81.aspx#characteristics.
12 See § 6.1 at https://www.fda.gov/media/74395/download; see p. 8 at
https://web.archive.org/web/20170723144656/https://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM244597.pdf.
13 See § 6.1 at https://www.fda.gov/media/77017/download; see pp. 20-21 at http://wayback.archive-
it.org/7993/20170722072902/https:/www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM182550.pdf. (https://perma.cc/N3PL-JT9J)
14 See pp. 6-8 at https://www.fda.gov/media/80438/download.
15 See pp. 6-8 at https://www.fda.gov/media/80438/download.
16 See clinical trial reports for M-M-R-II at https://www.sirillp.com/wp-content/uploads/2023/07/MMRII-FOIA.pdf; package insert; see package insert for M-M-R-II https://www.fda.gov/media/75191/download (The package insert for M-M-R-II does not list any trial as a basis for determining this product was safe for licensure, presumably because the trial relied upon to license this product could not establish it was safe for licensure.).
17 See § 6.1 at https://www.fda.gov/media/158941/download; see p. 12 at https://pmc.ncbi.nlm.nih.gov/
articles/instance/7192400/bin/piz010_suppl_supplementary_materials.docx. - 18 Véase § 6.1 en https://www.fda.gov/media/76000/download; véase p. 2 en https://pubmed.ncbi.nlm.nih.gov/6325909/.
- 19 Véase § 6.1 en https://www.fda.gov/media/119388/download.
- 20 Véase § 6.1 en https://www.fda.gov/media/74519/download (utiliza el término «placebo»); véase el informe del ensayo clínico en 454 https://www.nejm.org/doi/pdf/10.1056/NEJM199208133270702?articleTools=true (explica que el supuesto «placebo» incluía los ingredientes mencionados).
- 21 Véase § 6.1 en https://www.fda.gov/media/119862/download.
- 22 Véase § 6.1 en https://www.fda.gov/media/124002/download.
- 23 Véase https://www.sirillp.com/decavac-package-insert.
- 24 Véanse las pp. 17-19 en
- https://wayback.archive-it.org/7993/20190423065200/https:/www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM429166.pdf. (https://perma.cc/E8MU-D4A5)
- 25 Véase https://www.fda.gov/media/74350/download (Aunque este prospecto afirma que 594 controles recibieron un «placebo salino», la publicación revisada por pares de Merck explica que el «placebo utilizado en este estudio contenía componentes idénticos a los de la vacuna, con la excepción de las VLP HPV L1 y el adyuvante de aluminio», lo que significa que no se trataba en realidad de un «placebo» sino de una inyección que contenía, entre otros ingredientes, l-histidina, polisorbato 80 y proteína de levadura. https://www.ncbi.nlm.nih.gov/pubmed/17484215).
- 26 Véase § 6.1 en https://www.fda.gov/media/75619/download.
- 27 Véase https://archive.org/details/menomune-a-c-y-w-135-prescribing-information.
Notas:
* fda.gov/media/130326/download… («Los placebos, definidos como sustancias inertes sin actividad farmacológica, se utilizan habitualmente en ensayos clínicos controlados aleatorizados a doble ciego.»); fda.gov/media/71349/download… («el diseño de control con placebo, al … incluir un grupo que recibe un tratamiento inerte…»); cdc.gov/vaccines/glossary/… («Placebo: Sustancia o tratamiento que no tiene ningún efecto sobre los seres vivos, y que suele utilizarse como comparación con vacunas o medicamentos en ensayos clínicos»).
** Aunque lo anterior se refiere a vacunas inyectadas, la lista citada de la CNN también incluye 10 ensayos para la vacuna contra el rotavirus, administrada mediante gotas orales, pero ninguno de estos ensayos utilizó gotas sólo de solución salina. En su lugar, los ECA 205, 207, 208, 209, 210, 213 (Rotarix) contenían dextrano, sorbitol, aminoácidos, medio de águila modificado de Dulbecco, carbonato cálcico y xantano; los ECA 211, 212 (RotaTeq) contenían polisorbato 80, sacarosa, citrato y fosfato; y los ECA 206, 214 (Rotavac) contenían sulfato de neomicina, sulfato ácido de kanamicina, trehalosa, hidrolizado de lactoalbúmina, albúmina humana, dihidrogenoortofosfato potásico, hidrogenoortofosfato dipotásico y citrato trisódico dihidratado.
La lista también incluía tres ensayos de una vacuna antigripal inhalada; los controles en el ECA 104 fueron OPV+salina o LAIV (una vacuna), por lo tanto ninguna inerte; en el ECA 106 el control «consistió en fluido alantoideo normal recogido de huevos no infectados estabilizado con sacarosa-fosfato-glutamato»; y, en el ECA 109, el control fue «aerosol intranasal de fluido alantoideo de huevo que contenía sacarosa-fosfato-glutamato».
*** Obsérvese que las actuales vacunas antipoliomielíticas utilizadas en EE.UU. son un producto diferente de la vacuna antipoliomielítica desarrollada por Jonas Salk en la década de 1950 -que se dejó de utilizar en la década de 1960-, entre otras cosas porque las vacunas antipoliomielíticas utilizadas actualmente «se cultivan en células vero, una línea continua de células de riñón de mono cultivadas en microportadores».
Por lo tanto, no se recurrió al ensayo Salk para autorizar ninguna vacuna antipoliomielítica actual. fda.gov/media/75695/download…; pubmed.ncbi.nlm.nih.gov/6740101/; atcc.org/products/all/ccl-81.aspx#characteristics.…
**** La vacuna triple vírica de Dow Chemical utilizaba cepas diferentes a las de cualquier vacuna triple vírica autorizada en EE.UU. y, además, tras 14 días de revisión de seguridad, en este ensayo se vacunó a todos los participantes.
Colabore por favor con nosotros para que podamos incluir mas información y llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
Via PAYPAL: Euros o dólares click aqui
ARGENTINA 10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Solicite nuestro CBU contactenos