En junio de 2025, el Comité Asesor sobre Prácticas de Inmunización (ACIP) celebró su primera reunión, la expectativa pública era que este comité recién designado restablecería el rigor científico, la independencia de los laboratorios y el examen crítico de la evidencia antes de recomendar el uso rutinario de nuevos productos farmacéuticos.
Uno de los puntos más importantes del orden del día fue la recomendación del nuevo anticuerpo monoclonal contra el VRS de Merck, Clesrovimab, para su uso rutinario en recién nacidos sanos. Aunque se comercializa como un producto nuevo, su estructura y función son casi idénticas a las del Nirsevimab de Sanofi-AstraZeneca. aprobada en el 2023.
El comité finalmente votó 5 a 2 a favor de la recomendación. Esa votación se produjo después de la presentation de funcionarios del Centro de Control de Enfermedades, CDC, de datos de seguridad que no demostraban riesgo alguno en el uso de estos productos, lo que llevó a la mayoría de los miembros del ACIP a concluir que no había preocupaciones de seguridad pendientes.
Los anticuerpos monoclonales son un grupo de medicamentos que son copias cultivadas en laboratorio de células inmunitarias llamadas anticuerpos. Forman parte del sistema de defensa del organismo que combate agentes patógenos como infecciones o tumores cancerosos. La capacidad única de los anticuerpos es reconocer proteínas receptoras específicas en las células a las que pueden adherirse.
En Argentina, ya está disponible el anticuerpo monoclonal inyectable Nirsevimab, desarrollado por los laboratorios Sanofi y AstraZeneca, que se aplica en una dosis intramuscular para supuestamente prevenir el VSR en bebés.
Este compendio de estudios de expertos, contiene la suficiente evidencia para que los padres puedan presentar a sus médicos y abogados y prevenir que su hijos sean intoxicados con vacunas o inyecciones génicas que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. Click aqui para descargar este compendio
Fraude en la presentación en la cantidad de convulsiónes
Durante esa reunión, a los miembros del ACIP se les mostró una diapositiva del Enlace de Datos sobre Seguridad de las Vacunas (Vaccine Safety Datalink (VSD)) de los CDC, centrado en las convulsiones tras la administración de Nirsevimab. Los datos se dividieron en dos grupos de edad:
- lactantes de 0 a 37 días y
- lactantes de 38 días a menos de 8 meses.
Cada grupo mostró un riesgo elevado de convulsiones (3.50 y 4.38, respectivamente), pero ambos se clasificaron como «no significativos». No se presentó ningún análisis agrupado.
Al combinar los dos grupos en una sola cohorte, se obtiene un resultado muy diferente: un aumento de casi cuatro veces en el riesgo de convulsiones (RR 3.93; IC del 95 %: 1.21-12.79; p = 0.02), un resultado estadísticamente significativo. Esta señal consolidada nunca se presentó al comité.
La decisión de estratificar a los 38 días –precisamente el momento en que en los calendarios estadounidenses comienzan las vacunaciones infantiles de rutina– no tenía una justificación biológica clara y, al dispersar la señal de seguridad en dos grupos más pequeños, esto borró la significancia estadística.
Una segunda decisión de diseño de la presentación del CDC agravó el problema. El análisis de los CDC aplicó un intervalo de riesgo autocontrolado en el que solo los primeros 7 días se designaron como «riesgo» y los días 8 a 21 días se trataron como periodo de «control». Por lo tanto, cualquier convulsión que se produjera a partir del día 8 se contabilizó en la tasa de ocurrencias históricas, aunque ese momento pudiera reflejar de forma plausible un efecto relacionado con el producto. La práctica habitual de farmacovigilancia exige probar múltiples ventanas de posibilidades, no un único límite estrecho.
Este documento contiene la suficiente evidencia cientifica (más de 150 referencias) para que las madres puedan presentar a sus médicos y abogados y lograr exenciones para prevenir ser dañadas con vacunas o inyecciones génicas, que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. descargar libro, click aqui
Estas decisiones analíticas fueron importantes. La recomendación de Clerrovimab se aprobó por 5 votos a favor y 2 en contra. Si se hubiera presentado a los miembros el riesgo de convulsiones combinado junto con los desequilibrios constantes a nivel de ensayo en los eventos del sistema nervioso, un cambio de tan solo dos votos habría alterado el resultado.
La preocupación no se limita a una sola marca. Dada la similitud estructural entre Nirsevimab y Clerrovimab, es probable que el riesgo de convulsiones sea un efecto de clase. Esto significa que la omisión del análisis agrupado no solo ocultó un detalle estadístico, sino que ocultó información con implicaciones directas para todos los anticuerpos monoclonales contra el virus sincitial respiratorio, VSR, actualmente en uso.
Estos hallazgos surgieron únicamente mediante un reanálisis independiente. Sin el trabajo de la Dra. Maryanne Demasi, que fue la que reportó es incidente, podrían haber permanecido desconocidos, no solo para el público, sino incluso para los miembros del ACIP que emitieron sus votos.
El panorama de mortalidad que los miembros de ACIP no contemplaron
La presentación de los CDC al ACIP no incluyó una revisión integral de los datos de mortalidad de los ensayos clínicos de ninguno de los monoclonales contra el VRS: ni el Clerrovimab de Merck ni el Nirsevimab de Sanofi-AstraZeneca. Esta omisión es sorprendente, dado que, en ambas líneas de productos, los resultados de los ensayos muestran un desequilibrio constante y notable en las muertes entre los grupos de tratamiento y control.
La seguridad de las vacunas contra la hepatitis B que se administran a los recién nacidos no se ha probado en un solo ensayo clínico controlado aleatorio con placebo inerte como se manifiesta en los propios prospectos y tiene sobredosis de aluminio neurotóxico. Este compendio de estudios de expertos, contiene la suficiente evidencia para que los padres puedan presentar a sus médicos y abogados y prevenir que su hijos sean intoxicados con vacunas que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. Descargar libro click aqui
Nirsevimab: Muertes por grupo
La revisión integrada de la FDA del estudio sobre Nirsevimab señaló explícitamente un desequilibrio inesperado en las muertes observadas en los ensayos pediátricos. Los datos son los siguientes (Tabla 49, pág. 117):
- Trial 03: 2 muertes entre 968 receptores de nirsevimab; 3 entre 479 controles.
- Prueba 04 (MELODY): 4 muertes entre 1.998 receptores de nirsevimab; 0 entre 996 placebo.
- Prueba 05 (MEZCLA): 5 muertes entre 613 receptores de nirsevimab; 1 entre 304 que recibieron palivizumab.
- Trial 08: 1 muerte entre 60 receptores de nirsevimab; ningún grupo de control concurrente.
En total: 12 muertes entre 3.710 pacientes que recibieron nirsevimab frente a 4 muertes entre 1.797 controles, lo que representa una tasa de mortalidad del 0.32 % en los grupos de tratamiento, en comparación con el 0.22 % en los grupos de control. El desequilibrio puede parecer pequeño en términos absolutos, pero fue inesperado y se manifiesta consistentemente en una sola dirección.
Clesrovimab: Muertes por grupo
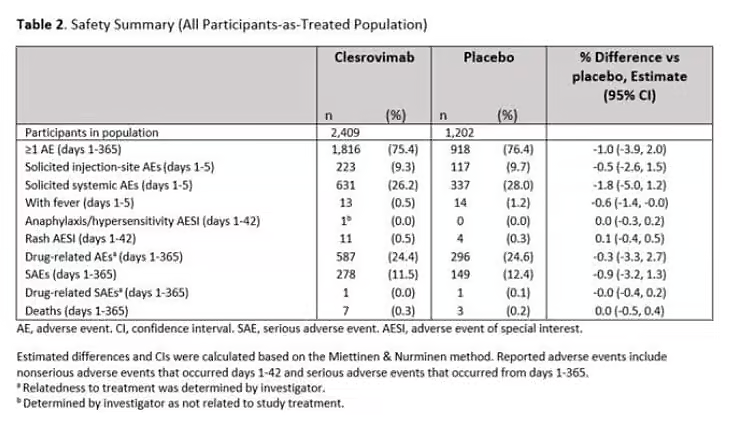
El plan 2025 de la FDA revisión de riesgos Para clerrovimab, el producto bajo consideración del ACIP, se observa una tendencia similar en sus dos ensayos principales:
- INTELIGENTE (MK-1654-004): 7 muertes entre 2.409 receptores de clerrovimab; 3 entre 1.202 que recibieron placebo.
- INTELIGENTE (MK-1654-007): 8 muertes entre aproximadamente 500 receptores de clerrovimab; 4 entre aproximadamente 500 que recibieron palivizumab.
En ambos estudios: 15 muertes en los brazos de tratamiento versus 7 en los controles.
Si bien los revisores de la FDA no atribuyeron las muertes al clerrovimab después de la revisión de casos, reconocieron explícitamente el desequilibrio numérico.
El aluminio en las vacunas es neurotóxico y el calendario de vacunación infantil tiene sobredosis de aluminio. Los estudios de seguridad del aluminio tienen graves errores y este tema esta postergado desde hace décadas. Más de 100 referencias científicas de expertos para que Usted presente a su abogado o médico, para eximir a sus hijos de las vacunas. Descargar libro click aqui
Muertes ocultas en notas a pie de página
En la actualización del ensayo de MELODY de 2023, la publicación en el New England Journal of Medicine se informaron cuatro muertes en el grupo de Nirsevimab y cero en el grupo placebo, concluyendo que el producto seguía siendo seguro porque se consideró que esas muertes no estaban relacionadas con el tratamiento.
Pero una mirada más de cerca al juicio apéndice suplementario la historia es diferente. Debajo del diagrama de flujo CONSORT, una nota al pie registra una quinta muerte en el grupo de Nirsevimab. La nota explica que se incluyeron cuatro muertes hasta el día 361 en el análisis de seguridad, mientras que se excluyó una muerte adicional en el día 440.
Esa exclusión no se alinea con el propio protocolo, que preespecificó un seguimiento de seguridad de aproximadamente 510 días después de la dosificación. Según esa definición, una muerte que ocurre el día 440 se considera que ha quedado fuera de la ventana (periodo) de seguridad prevista.


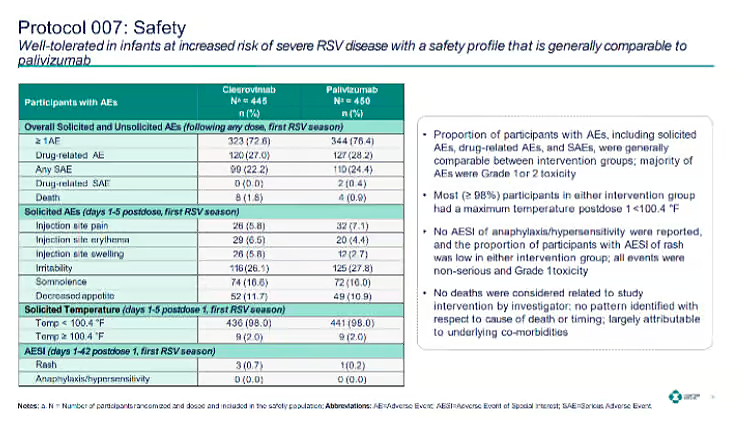
Una ambigüedad similar aparece en el ensayo de Merck Prueba CLEVER . Se informaron siete muertes en el grupo de Clerrovimab y tres en el grupo de placebo dentro del período de observación de 365 días, todas descartadas como «no relacionadas».
En la presentación de los CDC también se incluyó una nota al pie sobre una muerte adicional el día 487, después de que el bebé suspendiera formalmente su participación por indicación médica. No está claro si este caso se contabilizó entre los siete o se trató por separado.
El hecho de que se destacara en detalle que este caso esta fuera del periodo de observación, mientras que las siete muertes dentro del periodo solo se presentaran como totales sin desglosar las causas ni el momento en que se produjeron, apunta a un enfoque selectivo de la transparencia. Estas prácticas de información impiden que los revisores independientes evalúen si los patrones de mortalidad se debieron plausiblemente al azar o si justificaban una investigación más detallada.
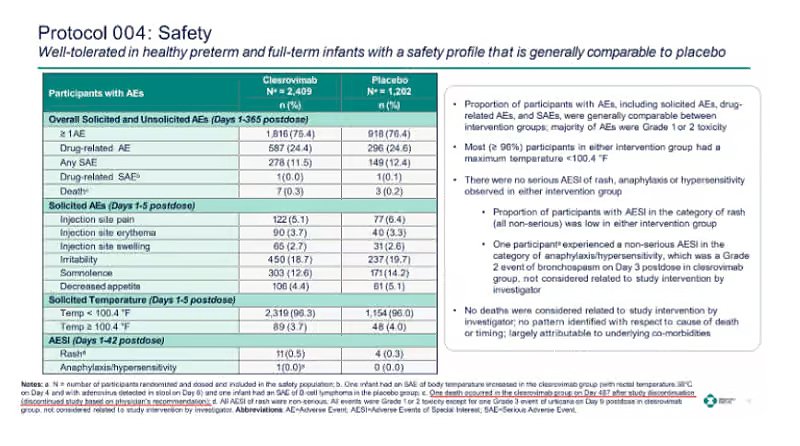
El mismo patrón se observa nuevamente en el ensayo SMART de Merck. En él, se produjeron ocho muertes entre los pacientes que recibieron Clerrovimab, frente a cuatro entre los bebés que recibieron palivizumab. Una vez más, los investigadores concluyeron que ninguna de las muertes estaba relacionada y no se proporcionó un desglose detallado por fecha o causa.
La cuestión clave aquí no es la causalidad, sino la transparencia. Los lectores y asesores deberían poder ver cada muerte en el conjunto de datos principal cuando los totales son tan bajos. En cambio, el artículo publicado reporta una cifra, mientras que los materiales complementarios revelan otra.
Este informe selectivo impide a los asesores evaluar completamente los riesgos de mortalidad. Por otro lado ninguno de los ensayos individuales tuvo la potencia estadística suficiente para detectar diferencias en la mortalidad, y las cifras totales son pequeñas. No obstante, cuando cuatro comparaciones aleatorias independientes (entre dos productos y en múltiples zonas geográficas) muestran más muertes en los grupos de tratamiento que en los controles, la consistencia es difícil de ignorar.
Los efectos secundarios de la vacuna contra el Sarampión, Rubeola y Paperas, SRP (MMR en EE.UU.) incluyen convulsiones, que ocurren en aproximadamente 1 de cada 640 niños vacunados, aproximadamente 5 veces más frecuentemente que las convulsiones por infección de sarampión, sepa como eximir a sus hijos de esta vacuna. Este compendio de estudios de expertos, contiene la suficiente evidencia para que los padres puedan presentar a sus médicos y abogados y prevenir que su hijos sean intoxicados con vacunas que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. Descargar libro click aqui
Como dijo el profesor Retsef Levi, uno de los dos únicos miembros del ACIP que votaron en contra de la aprobación, señaló: “Cuatro ensayos diferentes muestran que las muertes van en la misma dirección”.
Levi reconoció que los ensayos eran pequeños y no tenían el poder suficiente para detectar diferencias «estadísticas» en la mortalidad, pero la consistencia del desequilibrio era difícil de ignorar.
En el caso de un producto destinado a la administración rutinaria en recién nacidos sanos a término, incluso señales de seguridad leves deberían ser motivo de un escrutinio minucioso. Esto no ocurrió en este caso, y el panorama completo de mortalidad nunca se planteó.
Falta de transparencia sobre las causas de muerte
Una sesión informativa completa y transparente para el ACIP debería haber incluido no solo el recuento bruto de muertes por rama del ensayo, sino también una tabla estructurada que enumerara la causa de muerte, el momento y la asignación a la rama para cada caso.
Ese nivel de detalle es esencial según las normas metodológicas y regulatorias vigentes. Prórroga de CONSORT Harms para 2022 (que se integra en la lista de verificación principal de CONSORT) enfatiza la necesidad de un informe completo y preespecificado de los daños en los ensayos clínicos aleatorizados. De igual manera, el Directriz ICH E9(R1) Subraya la importancia de definir estimandos (en términos sencillos: el resultado exacto que el ensayo pretende medir) y realizar análisis transparentes que permitan un escrutinio independiente, en lugar de confiar únicamente en juicios narrativos.
Sin embargo, los resúmenes públicos de la FDA se basan principalmente en declaraciones narrativas que indican que las muertes no estaban relacionadas, sin presentar desgloses por grupo de pacientes que permitan a los revisores independientes verificar la agrupación por tiempo, síndrome o comorbilidad. Ni los CDC ni los patrocinadores del producto proporcionaron al ACIP un recuento comparativo de este tipo.
Este documento contiene la suficiente evidencia científica (más de 50) para que las madres puedan presentar a sus médicos y abogados y prevenir sus hijas e hijos sean dañados con vacunas que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. No espere hasta último momento para estar protegida… descargar desde: https://cienciaysaludnatural.com/recursos

Esta brecha no es teórica. En el ensayo de fase 2b de Nirsevimab, por ejemplo, dos muertes en el grupo de tratamiento se atribuyeron a gastroenteritis en bebés por lo demás sanos: una el día 143 y otra el día 338. Estos resultados son poco frecuentes. Sin una tabla transparente de causas y cronología a nivel de grupo, ni siquiera una comprobación estadística básica del desequilibrio general, los asesores no pueden determinar si estas muertes reflejan una variación aleatoria o una señal de seguridad significativa que justifique una investigación más profunda.
Una fuente de vigilancia, sin triangulación
En la reunión de junio de 2025, la sesión informativa de seguridad de los CDC al ACIP se basó exclusivamente en el Enlace de Datos de Seguridad de las Vacunas (VSD), un sistema de vigilancia activa que vincula los registros médicos electrónicos en 13 sistemas de salud de EE.UU. No se mostró ningún análisis paralelo de Extensión VAERS o de la FDA MedWatch, aunque la orientación federal divide explícitamente los informes para los monoclonales del VRS: cuando se administra el anticuerpo solo, los eventos adversos deben notificarse a MedWatch; cuando se da junto con las vacunas, los informes van a Extensión VAERS.
Al limitar su análisis a una sola fuente, los CDC presentaron al ACIP una visión unisistema de la seguridad. Esta perspectiva estrecha corre el riesgo de pasar por alto señales que podrían surgir primero en otra línea de vigilancia, precisamente por eso la triangulación entre sistemas se considera una expectativa básica en farmacovigilancia.
Esa selectividad se extendió más allá de las fronteras de Estados Unidos. Independiente de datos del mundo real. El informe de Francia, presentado por la investigadora Hélène Banoun, subraya aún más la importancia de una perspectiva integral. Durante el primer lanzamiento nacional de Nirsevimab en otoño de 2023, las muertes en bebés de 2 a 6 días de edad mostraron un patrón temporal sorprendente:
- Septiembre 2023: 55 muertes (aumento estadísticamente significativo)
- 2023 octubre: 62 muertes (aumento estadísticamente significativo)
Cuando la distribución fue limitada y el suministro racionado en noviembre de 2023, el número de muertes cayó drásticamente a 26. Más tarde, cuando se reanudó la distribución, la mortalidad aumentó nuevamente a 50 en diciembre y 52 en enero de 2024, ambos representando picos estadísticamente significativos.
Del mismo modo que hoy nos intentan seguir engañado con los beneficios de la inyección contra Covid, la historia de la vacuna contra la polio ha sido tergiversada. La verdadera historia de la vacuna contra la polio es muy diferente a la que le han relatado a los médicos en la facultad de Medicina y es todo lo opuesto. Descargar click aqui
Estos cambios se alinearon estrechamente con el patrón de implementación y las limitaciones de suministro, lo que sugiere una agrupación temporal que, si bien no demuestra causalidad, constituye una señal significativa. Estos patrones del mundo real, con las consiguientes salvedades metodológicas, deberían haberse presentado junto con los datos de VSD de EE. UU., pero se omitieron del informe del ACIP.
En conjunto, la omisión de señales nacionales e internacionales significó que a los miembros del ACIP solo se les mostró una parte tranquilizadora de la evidencia disponible, no el panorama completo.
Un punto ciego de informes integrado
Los problemas no se limitan a lo que al ACIP le pasó en junio. La propia clasificación de los monoclonales del VSR crea un punto ciego en los informes de seguridad de EE. UU. Se trata de medicamentos biológicos; sin embargo, a efectos de responsabilidad, se han incluido en el calendario de vacunación infantil, lo que otorga inmunidad a los fabricantes bajo el Programa Nacional de Compensación por Lesiones Causadas por Vacunas. Para la facturación, se tratan como medicamentos. Para los informes de seguridad, se dividen: si se administran solos, se dirigen a MedWatch; si se administran conjuntamente con vacunas, se derivan al VAERS.
Esta doble identidad crea lo que los expertos denominan un «punto ciego en la notificación«. Los proveedores suelen recurrir al VAERS al tratar a bebés, pero este no cuenta con un campo específico para nirsevimab o clerrovimab. Los informes pueden terminar archivados erróneamente en la categoría «tipo de vacuna desconocido» o aislados en la base de datos de medicamentos de la FDA, invisibles para los analistas de seguridad de vacunas de los CDC. Por lo tanto, los eventos pueden pasar desapercibidos por completo, socavando el sistema mismo diseñado para captar alertas tempranas.
Más allá de los datos: Confianza en el ACIP
Las omisiones de junio de 2025 no fueron notas técnicas a pie de página, sino decisiones que moldearon la forma en que se presentaba la evidencia para quienes debían proteger la salud pública. A los miembros del ACIP se les mostraron análisis parciales que minimizaban las preocupaciones de seguridad, mientras que los patrones más amplios y preocupantes permanecieron descartados.
Si un comité asesor reconstruido aún puede ser dirigido por presentaciones incompletas, el problema va mucho más allá de este tema. Lo que está en juego es si el ACIP puede cumplir con su papel como árbitro verdaderamente independiente de riesgos y beneficios, y si el público puede confiar en que sus miembros reciben la información completa sin este tipo de sesgos que aún perduran en el CDC.
Ver más aqui https://cienciaysaludnatural.com/category/virus-sincitial-vsr/

Descargar desde https://red.cienciaysaludnatural.com/
Colabore por favor con nosotros para que podamos incluir mas información y llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
Via PAYPAL: Euros o dólares click aqui
ARGENTINA 10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Solicite nuestro CBU contactenos
Ver más aqui https://cienciaysaludnatural.com/category/virus-sincitial-vsr/