Colabore con nostros para que podamos subtitular este video click aqui
El ensayo de fase 3 sobre la vacuna basada en ARNm de Pfizer-BioNTech, denominada BNT162b2 es una de las 48 vacunas en evaluación clínica que tiene como objetivo proteger contra COVID-19. Recientemente las noticias, afirmaron sobre el “90% de efectividad” de esta vacuna, a través de un comunicado de prensa emitido por Pfizer , el socio comercial vinculado a la joven empresa de biotecnología alemana BioNTech , que desarrolló la vacuna.
BioNTech recibió financiación del gobierno alemán. Pfizer no tuvo que compartir datos o que un comité del Operation Warp Speed compartiera sus datos. Solo hay un comunicado de prensa que se refiere a un informe provisional sobre el ensayo de fase 3 elaborado por un «Comité de seguimiento de datos (DMC) que se suponia era externo e independiente». Un artículo de la Kaiser Family Foundation sugiere que el DMC de Pfizer es todo menos independiente. El anonimato de sus 5 miembros también lo hace todo menos transparente .
Lo que hay allí es el diseño de prueba ahora obsoleto para la vacuna como un enlace al portal de NIH ClinicalTrials.gov. Pero no hay resultados de estudios provisionales. Una búsqueda en buscadores usando los términos «Comité de Monitoreo de Datos» BNT162b2 BioNTech Pfizer «y similares tampoco se encuentran datos, solo muchas referencias a la afirmación de» 90% de efectividad «en una gran cantidad de canales de medios. Aún no hay datos que respalden la afirmación.
- Es engañoso, demasiado prematuro y falso que Pfizer le esté diciendo al mundo que el ensayo ha demostrado una efectividad del 90% hasta ahora porque la mayoría de la gente asumirá que eso significa, independientemente de la edad, el estado de salud, el origen étnico o las condiciones subyacentes, Si se vacunan con una vacuna aprobada de emergencia que ha sido sometida a solo 2 meses de evaluación de seguridad, tendrán solo un 10% de posibilidades de enfermarse gravemente si se infectan, y será seguro. No hay datos suficientes para respaldar ninguno de los resultados.
- Es difícil juzgar la afirmación de la eficacia con respecto a las posibilidades que podría tener si no está vacunado. Pero si está sano y tiene menos de 75 años, las posibilidades de una enfermedad grave son muy bajas, probablemente mucho menos del 10% después de la infección. Pero aún no se pueden hacer estimaciones precisas porque seguimos sin saber al número de personas que han sido infectadas y, por lo tanto, también la verdadera tasa de enfermedad grave y mortalidad entre los infectados. También hay que considerar las grandes variaciones en las estimaciones del número de personas probablemente asintomáticas (infectadas pero sin síntomas).
- No se puede decir nada sobre el riesgo de daños por la vacunación con dos dosis de BNT162b2, como desencadenar afecciones autoinmunes, ya que los ensayos deben seguir su curso y la mayoría de estos tipos de problemas generalmente no se detectan hasta años después de que el producto se comercialice por primera vez. Y eso asumiendo un programa de desarrollo normal de 6 años. Dos meses de informes de eventos adversos posteriores a la vacunación no son suficientes si desea un control adecuado de la seguridad.
- Si esta vacuna no es eficaz unos meses después de la administración de su segunda dosis, ¿se justificará su despliegue masivo, dado el enorme costo económico para la sociedad, el riesgo de daños y el hecho de que las personas sanas parecen tolerar el SARS-CoV-2 más que adecuadamente? Recuerde, fue la vacuna BioNTech alternativa, BNT162b1, que se encontró que potenciaba más la respuesta de las células T , pero tenía un perfil de seguridad inaceptable, por lo que se descartó.
- ¿Dónde está el análisis de riesgo-costo-beneficio de los gobiernos justifica que el despliegue es necesario?
- Es inquietante que este anuncio, y la falta de datos asociados con el comunicado de prensa, demuestren que Pfizer y BioNTech tienen una incapacidad para una transparencia real y significativa .
Esto lleva a una pregunta central: ¿Puede el público realmente permitirse el lujo de confiar en las compañías de vacunas que deliberadamente retienen información y datos y se han aprovechado de la desesperación del público por escapar de los bloqueos, mientras que, al mismo tiempo, cosechan las recompensas del mercado de valores que ha respondido? a un anuncio prematuro y sin respaldo?
La noticia de que se ha demostrado que la vacuna es “90% efectiva” ha hecho volar las acciones de Pfizer y provocado que el recién nombrado ex-presidente veterinario de la compañía, el Dr. Albert Bourla , vendiera el 62% de sus acciones personales en Pfizer . La venta de acciones aparentemente fue disparada por un sistema automatizado establecido en agosto cuando el valor de la acción alcanzó un precio determinado.
Falta de Datos
En una editorial de septiembre en una de las revistas más influyentes del mundo, Nature, argumentó que “la confianza en la vacuna COVID requiere una transparencia radical”. Se suponía que Pfizer o BioNTech harían que los datos detrás de los resultados estuvieran disponibles. Niguna información en la página de la OMS » Borrador del panorama de las vacunas candidatas a COVID-19 «, que por cierto «renuncia a toda responsabilidad o responsabilidad por cualquier muerte, discapacidad, lesión, sufrimiento, pérdida, daño o otros perjuicios de cualquier tipo que puedan surgir de o en conexión con la adquisición, distribución o uso de cualquier producto incluido en cualquiera de estos documentos ”.
De vuelta al comunicado de prensa. La información clave que se desprende de ella es la siguiente:
- La afirmación dice: «más del 90% de efectividad en la prevención de COVID-19 en participantes sin evidencia de SARS-CoV-2 anterior».
- Un enlace a un diseño de estudio actualizado (protocolo) que presumiblemente reemplaza al que figura en ClinicalTrials.gov.
- 43.538 participantes inscritos hasta la fecha (89% de los cuales han recibido la segunda dosis)
- El 42% de los participantes tienen «antecedentes étnicos diversos» (lo que plantea la pregunta de qué origen étnico es el 58% no diverso.
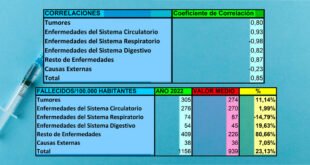
- 94 personas de los 43.538 participantes (es decir, solo el 0,2%) han contraído COVID-19 hasta el momento, y se han dividido entre los grupos vacunados y placebo, y no se informó sobre esta separación.
- “No se han observado problemas de seguridad graves”, lo que no significa que no se hayan observado reacciones adversas moderadas o graves. Los datos de seguridad estarán disponibles por sólo 2 meses mientras que Pfizer solicita la autorización de uso de emergencia ante la Administración de Alimentos y Medicamentos de EE. UU. (FDA).
- Las declaraciones más claras de todas aparecen en el aviso de divulgación y el comentario sobre las declaraciones prospectivas al final del comunicado que parecen estar dirigidas al mercado de valores. Definitvamente anulan a Pfizer y BioNTech de cualquier responsabilidad por el desempeño del producto final, especialmente en relación con la efectividad, seguridad o suministro.
Entonces solo el 10% del grupo del 94 estaba infectado. Aproximadamente 10 personas, con estos datos ellos afirman un 90%, 9 de cada 10 podrán prevenir la infección después de la vacunación.
¿Qué más necesitaríamos saber para comprender mejor el resultado intermedio de BioNTech / Pfizer? La información clave que aún no se ha puesto en el dominio público y que podría haber acompañado a la publicación provisional incluye:
- El número de personas en los grupos vacunados o placebo que estuvieron expuestos al SARS-CoV-2.
- La demografía (edad, sexo, etnia, etc.) de los infectados y cuántos de ellos representan los grupos más vulnerables, es decir, los ancianos o las personas con comorbilidades.
- ¿Sobre qué parámetros de resultado particulares se determinó la efectividad? ¿Se basó, por ejemplo, en la falta de síntomas de la enfermedad COVID-19 combinados con respuestas elevadas de anticuerpos y, de ser así, cuáles?
- ¿Qué tan grave fue la manifestación de la enfermedad COVID-19 en los grupos equivalentes vacunados y placebo (es decir, edades, género, etnia y patrón de enfermedad subyacente similares)?
- ¿Cuál es la composición del placebo que se administra al 50% de la población de estudio de 44.000 personas? ¿Incluye la nanopartícula lipídica menos el ARNm que codifica la proteína de pico de longitud completa del SARS-CoV-2?
- ¿Cuál fue la respuesta del lado mediado por células (células T) del sistema inmunitario adaptativo (que no se incluyen en los criterios de valoración según el protocolo del ensayo)? La publicación de octubre de los resultados de la Fase 1 en el New England Journal of Medicine indicó que fue la vacuna hermana, BNT162b1, la que produjo una fuerte respuesta de las células T, pero esto se descartó ya que la vacuna indujo algunas reacciones adversas graves.
- ¿Cuál fue la naturaleza, la gravedad y el alcance de los eventos adversos a BNT162b2 informados hasta ahora en el ensayo de fase 3?
- ¿Cuánto tiempo persistirá la inmunogenicidad contra el SARS-CoV-2 en diferentes personas?
También hay muchas incógnitas:
- La posibilidad de que algunos de los casos confirmados por NAAT impliquen una infección con otros coronavirus humanos y son estos virus distintos del SARS-CoV-2 los que han desencadenado la inmunogenicidad medida y los resultados de NAAT son falsos positivos o el resultado de SARS-CoV- 2 fragmentos virales.
- La presencia de fragmentos virales no replicables de SARS-CoV2 («muerto») ha desencadenado reacciones inmunogénicas, por lo que la infección no podría haberse producido de todos modos.
Falta de transparencia
Como tan apropiadamente expresó Peter Doshi , editor asociado del BMJ y también profesor asociado de servicios de salud farmacéutica en la Facultad de Farmacia de la Universidad de Maryland, » La falta de datos es muy preocupante … Todo lo que tenemos ahora es un titular de Pfizer . «