Antibody-dependent enhancement and SARS-CoV-2 vaccines and therapies https://www.nature.com/articles/s41564-020-00789-5
Dra. María José Martínez Albarracín
Efectos Adversos de la Vacuna COVID-19 Parte II
Resumen
Los medicamentos basados en anticuerpos y las vacunas contra el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2) se están acelerando a través del desarrollo clínico y preclínico. Los datos del estudio del SARS-CoV y otros virus respiratorios sugieren que los anticuerpos anti-SARS-CoV-2 podrían exacerbar el COVID-19 a través de la mejora dependiente de anticuerpos (ADE). Estudios previos de vacunas contra el virus sincitial respiratorio y el virus del dengue revelaron riesgos de seguridad clínica humana relacionados con el ADE, lo que resultó en ensayos de vacunas fallidos. Aquí, describimos los mecanismos clave de ADE y discutimos las estrategias de mitigación para las vacunas y terapias del SARS-CoV-2 en desarrollo. También describimos los datos publicados recientemente para evaluar los riesgos y oportunidades de protección basada en anticuerpos contra el SARS-CoV-2.
Introducción
El SARS-CoV-2 es un betacoronavirus estrechamente relacionado con el SARS-CoV (con una identidad de secuencia de ~ 80%), que causó el brote de SARS en 2002. Su pariente más cercano al coronavirus humano es el coronavirus relacionado con el síndrome respiratorio de Oriente Medio (MERS-CoV; ~ 54% de identidad de secuencia), lo que provocó el síndrome respiratorio Oriente Medio en 2012 (ref. 1 , 2). El SARS-CoV-2 también está relacionado genéticamente con otros coronavirus humanos endémicos que causan infecciones más leves: HCoV-HKU1 (~ 52% de identidad de secuencia), HCoV-OC43 (~ 51%), HCoV-NL63 (~ 49%) y HCoV- 229E (~ 48%) 1 . El SARS-CoV-2 está aún más relacionado con los coronavirus identificados en los murciélagos en herradura, lo que sugiere que los murciélagos en herradura son el reservorio animal primario con un posible evento de transmisión intermedia en los pangolines 3 .
La entrada celular del SARS-CoV-2 está mediada por la unión de la proteína viral spike (S) a su receptor celular, la enzima convertidora de angiotensina 2 (ACE2) 4 , 5 . Se han identificado otros factores de entrada del huésped, incluyendo neuropilina-1 (refs. 6 , 7 ) y TMPRSS2, una serina proteasa transmembrana involucrada en la maduración de la proteína S 4 . La proteína SARS-CoV-2 S consta de la subunidad S1, que contiene el dominio de unión al receptor (RBD), y la subunidad S2, que media la fusión de la membrana para la entrada viral 8. Un objetivo principal del desarrollo de vacunas y terapias es generar anticuerpos que eviten la entrada de SARS-CoV-2 en las células bloqueando las interacciones de unión de ACE2-RBD o la fusión de membranas mediada por S.
Un obstáculo potencial para las vacunas y terapias basadas en anticuerpos es el riesgo de exacerbar la gravedad de COVID-19 a través de la mejora dependiente de anticuerpos (ADE). El ADE puede aumentar la gravedad de múltiples infecciones virales, incluidos otros virus respiratorios como el virus respiratorio sincitial (VSR) 9 , 10 y el sarampión 11 , 12 . El ADE en las infecciones respiratorias se incluye en una categoría más amplia denominada enfermedad respiratoria mejorada (ERD), que también incluye mecanismos no basados en anticuerpos como las cascadas de citocinas y la inmunopatología mediada por células (Cuadro 1 ). Se ha observado ADE causado por una replicación viral mejorada para otros virus que infectan a los macrófagos, incluido el virus del dengue 13 , 14.y virus de la peritonitis infecciosa felina (FIPV) 15 . Además, se ha informado de ADE y ERD para SARS-CoV y MERS-CoV tanto in vitro como in vivo. Se está investigando activamente hasta qué punto el ADE contribuye a la inmunopatología de COVID-19.
En esta perspectiva, discutimos los posibles mecanismos de ADE en el SARS-CoV-2 y describimos varios principios de mitigación de riesgos para vacunas y terapias. También destacamos qué tipos de estudios es probable que revelen la relevancia del ADE en la patología de la enfermedad COVID-19 y examinamos cómo los datos emergentes podrían influir en las intervenciones clínicas.
Recuadro 1 ADE y ERD
ERD
La enfermedad respiratoria mejorada, ERD describe presentaciones clínicas graves de infecciones virales respiratorias asociadas con intervenciones médicas (especialmente vacunas). Pueden producirse presentaciones clínicas similares como resultado de infecciones naturales, por lo que la ERD se detecta durante los ensayos preclínicos y clínicos al comparar la distribución de la gravedad de la enfermedad entre los brazos de estudio de intervención y placebo. La ERD se puede asociar con una amplia gama de mecanismos moleculares, incluida la actividad de anticuerpos dependientes de FcR y la activación del complemento (es decir, ADE), pero también con otros mecanismos independientes de anticuerpos como la muerte de células tisulares, la liberación de citocinas y liberación y / o activación de células inmunes locales.
ADE
El ADE se puede categorizar ampliamente en dos tipos diferentes según los mecanismos moleculares involucrados:
ADE vía infección mejorada. Las tasas de infección más altas de las células diana ocurren de una manera dependiente de anticuerpos mediada por interacciones Fc-FcR. La ADE a través de una infección potenciada se mide comúnmente usando ensayos in vitro que detectan la infección dependiente de anticuerpos de células que expresan FcγRIIa, tales como monocitos y macrófagos. El vínculo entre los resultados del ensayo de ADE in vitro y la relevancia clínica a menudo está implícito, en lugar de observarse directamente. El virus del dengue representa el ejemplo mejor documentado de ADE clínico a través de una infección mejorada.
ADE a través de una activación inmunitaria mejorada. La enfermedad y la inmunopatología mejoradas son causadas por funciones efectoras mediadas por Fc excesivas y la formación de complejos inmunes de una manera dependiente de anticuerpos. Los anticuerpos asociados con el aumento de la enfermedad a menudo no son neutralizantes. El ADE de este tipo generalmente se examina in vivo mediante la detección de síntomas de enfermedad exacerbados, que incluyen inmunopatología y marcadores inflamatorios, y se asocia más claramente con infecciones virales respiratorias. El RSV y el sarampión son ejemplos bien documentados de ADE causado por una activación inmunitaria mejorada.
ERD y ADE (del segundo tipo descrito anteriormente) a menudo se identifican por datos clínicos, incluida la prevalencia de síntomas y la gravedad de la enfermedad, más que por los mecanismos moleculares específicos que impulsan la enfermedad grave. La presencia de ciclos de retroalimentación complejos entre diferentes brazos del sistema inmunológico hace que sea muy difícil (aunque no imposible) determinar de manera concluyente los mecanismos moleculares de ADE y ERD en estudios en humanos y animales, incluso si los datos clínicos que respaldan ADE y ERD son bastante claros. Se utilizan muchas mediciones y ensayos diferentes para rastrear ADE y ERD, que pueden variar según el virus específico, los protocolos preclínicos y / o clínicos, las muestras biológicas recolectadas y las técnicas in vitro utilizadas.
El ADE respiratorio es un subconjunto específico de ERD.
Mecanismos de ADE
Se ha documentado que el ADE se produce a través de dos mecanismos distintos en las infecciones virales: por una mayor captación del virus mediada por anticuerpos en las células fagocíticas que expresan el receptor Fc gamma IIa (FcγRIIa), lo que conduce a un aumento de la infección viral y la replicación, o por un exceso de funciones efectoras mediadas por el anticuerpo Fc. o formación de complejos inmunes que causan una mayor inflamación e inmunopatología (Fig. 1 , la caja 1). Ambas vías de ADE pueden ocurrir cuando los anticuerpos no neutralizantes o los anticuerpos a niveles subneutralizantes se unen a antígenos virales sin bloquear o eliminar la infección. La ADE se puede medir de varias formas, incluidos ensayos in vitro (que son los más comunes para el primer mecanismo que implica el aumento de la infección en fagocitos mediado por FcγRIIa), inmunopatología o patología pulmonar. El ADE a través de endocitosis mediada por FcγRIIa en células fagocíticas se puede observar in vitro y se ha estudiado ampliamente para virus macrófagos-trópicos, incluido el virus del dengue en humanos 16 y FIPV en gatos 15. En este mecanismo, los anticuerpos no neutralizantes se unen a la superficie viral y transportan viriones directamente a los macrófagos, que luego internalizan los viriones y se infectan productivamente. Dado que muchos anticuerpos contra diferentes serotipos del dengue presentan reactividad cruzada pero no neutralizan, las infecciones secundarias con cepas heterólogas pueden provocar un aumento de la replicación viral y una enfermedad más grave, lo que genera importantes riesgos de seguridad, como se informó en un ensayo reciente de la vacuna contra el dengue 13 , 14 . En otros estudios de vacunas, los gatos inmunizados contra la proteína FIPV S o infundidos pasivamente con anticuerpos anti-FIPV tuvieron tasas de supervivencia más bajas cuando fueron desafiados con FIPV en comparación con los grupos de control 17. Los anticuerpos no neutralizantes, o anticuerpos en niveles subneutralizantes, mejoraron la entrada en los macrófagos alveolares y peritoneales 18 , que se pensaba que diseminan la infección y empeoran el resultado de la enfermedad 19 .
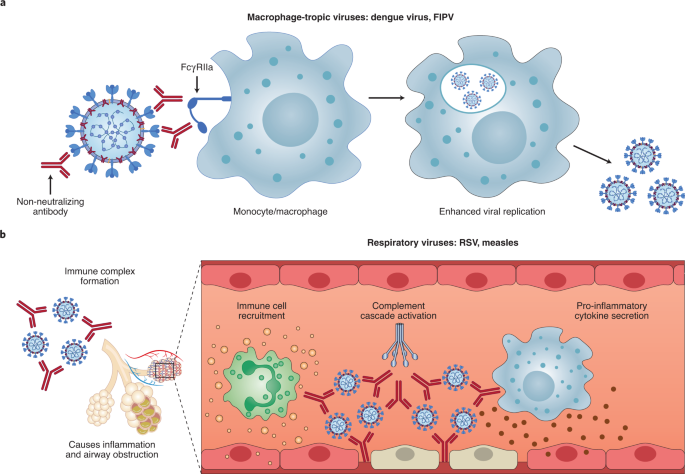
En el segundo mecanismo de ADE descrito que está mejor ejemplificado por patógenos respiratorios, las funciones efectoras de anticuerpos mediadas por Fc pueden mejorar la enfermedad respiratoria al iniciar una poderosa cascada inmune que da como resultado patología pulmonar observable 20 , 21. La activación mediada por Fc de células inmunitarias innatas locales y circulantes, como monocitos, macrófagos, neutrófilos, células dendríticas y células asesinas naturales, puede conducir a una activación inmunitaria desregulada a pesar de su eficacia potencial para eliminar las células infectadas por virus y los desechos. En el caso de los virus respiratorios trópicos no macrófagos, como el VSR y el sarampión, se ha demostrado que los anticuerpos no neutralizantes inducen la EAD y la ERD mediante la formación de complejos inmunes que se depositan en los tejidos de las vías respiratorias y activan las vías de las citocinas y del complemento, lo que provoca inflamación, obstrucción de las vías respiratorias y, en casos graves que conducen a síndrome de dificultad respiratoria aguda 10 , 11 , 22 , 23. Estas observaciones previas de ADE con RSV y sarampión tienen muchas similitudes con presentaciones clínicas conocidas de COVID-19. Por ejemplo, se ha demostrado que la sobreactivación de la cascada del complemento contribuye a la lesión pulmonar inflamatoria en COVID-19 y SARS 24 , 25 . Dos estudios recientes encontraron que los anticuerpos de inmunoglobulina G (IgG) específicos de S y RBD en pacientes con COVID-19 tienen niveles más bajos de fucosilación dentro de sus dominios Fc 26 , 27 , un fenotipo relacionado con una mayor afinidad por FcγRIIIa, un receptor de Fc activador ( FcR) que media en la citotoxicidad celular dependiente de anticuerpos. Si bien esta mayor afinidad puede ser beneficiosa en algunos casos a través de funciones efectoras mediadas por FcγRIIIa más vigorosas 28 , 29, los anticuerpos IgG no neutralizantes contra el virus del dengue que fueron afucosilados se asociaron con resultados de enfermedad más graves 30 . Larsen y col. muestran además que la IgG específica de S en pacientes con COVID-19 y síndrome de dificultad respiratoria aguda tenían niveles más bajos de fucosilación en comparación con los pacientes que tenían infecciones asintomáticas o leves 26 . Queda por determinar si los niveles más bajos de fucosilación de anticuerpos específicos de SARS-CoV-2 contribuyeron directamente a la inmunopatología de COVID-19.
Es importante destacar que no se ha demostrado que el SARS-CoV-2 infecte de manera productiva a los macrófagos 31 , 32 . Así, los datos disponibles sugieren que el mecanismo ADE más probable relevante para la patología de COVID-19 es la formación de inmunocomplejos anticuerpo-antígeno que conduce a una activación excesiva de la cascada inmune en el tejido pulmonar (Fig. 1 ).
Evidencia de ADE en infecciones por coronavirus in vitro
Si bien el ADE ha sido bien documentado in vitro para varios virus, incluidos el virus de inmunodeficiencia humana (VIH) 33 , 34 , Ébola 35 , 36 , influenza 37 y flavivirus 38 , la relevancia del ADE in vitro para los coronavirus humanos sigue siendo menos clara. Varios estudios han demostrado una mayor captación de viriones de SARS-CoV y MERS-CoV en monocitos o macrófagos que expresan FcR in vitro 32 , 39 , 40 , 41 , 42 . Yip y col. encontró una mayor captación de SARS-CoV y pseudovirus que expresan S en macrófagos derivados de monocitos mediados por FcγRIIa y anticuerpos séricos anti-S 32. Del mismo modo, Wan et al. mostró que un anticuerpo monoclonal neutralizante (mAb) contra el RBD de MERS-CoV aumentó la captación de viriones en macrófagos y varias líneas celulares transfectadas con FcγRIIa 39 . Sin embargo, el hecho de que los anticuerpos específicos de antígeno dirijan la captación fagocítica no es sorprendente, ya que los monocitos y macrófagos pueden mediar en la fagocitosis dependiente de anticuerpos a través de FcγRIIa para la eliminación viral, incluida la influenza 43 . Es importante destacar que los macrófagos en ratones infectados contribuyeron a la eliminación del SARS-CoV 44 mediada por anticuerpos . Si bien se ha descubierto que MERS-CoV infecta productivamente a los macrófagos 45, La infección de macrófagos por SARS-CoV es abortiva y no altera el perfil de expresión génica de citocinas proinflamatorias después de la captación dependiente de anticuerpos 41 , 42 . Los hallazgos hasta la fecha argumentan en contra de los macrófagos como huéspedes productivos de la infección por SARS-CoV-2 31 , 32 .
ADE en infecciones por coronavirus humano
No se ha establecido un papel definitivo para el ADE en las enfermedades por coronavirus humano. En primer lugar, surgieron preocupaciones por el ADE en pacientes con SARS cuando se encontró que la seroconversión y las respuestas de anticuerpos neutralizantes se correlacionaban con la gravedad clínica y la mortalidad 46 . Se informó un hallazgo similar en pacientes con COVID-19, con títulos de anticuerpos más altos contra el SARS-CoV-2 asociados con una enfermedad más grave 47 . Una hipótesis simple es que los títulos de anticuerpos más altos en los casos graves de COVID-19 son el resultado de una exposición al antígeno más alta y más prolongada debido a cargas virales más altas 48 , 49 . Sin embargo, un estudio reciente mostró que la diseminación viral en el tracto respiratorio superior era indistinguible entre pacientes con COVID-19 asintomático y sintomático (ref.50 ). Los pacientes sintomáticos mostraron títulos de anticuerpos anti-SARS-CoV-2 más altos y eliminaron el virus del tracto respiratorio superior más rápidamente, lo que contradice una hipótesis más simple de que los títulos de anticuerpos son causados simplemente por cargas virales más altas. Otros estudios mostraron que las respuestas de las células T anti-SARS-CoV-2 podrían encontrarse en niveles altos en infecciones leves y asintomáticas 51 , 52. En conjunto, los datos sugieren que se pueden encontrar fuertes respuestas de células T en pacientes con una amplia gama de presentaciones clínicas, mientras que los títulos de anticuerpos fuertes están más estrechamente relacionados con COVID-19 grave. Una advertencia importante es que la diseminación viral se midió en el tracto respiratorio superior en lugar de en el tracto respiratorio inferior 50. Es probable que el tracto respiratorio inferior sea más importante para la patología pulmonar grave por COVID-19, y no está claro qué tan estrechamente se correlaciona la diseminación viral del SARS-CoV-2 en los tractos respiratorios superior e inferior durante el curso de la enfermedad.
Más allá de la respuesta del huésped a las nuevas infecciones por SARS-CoV-2, el potencial de los anticuerpos preexistentes contra otras cepas de coronavirus humano para mediar en el ADE en pacientes con COVID-19 es otra posible preocupación 53 . Los anticuerpos provocados por cepas de coronavirus endémicas en poblaciones humanas (como HKU1, OC43, NL63 y 229E) podrían teóricamente mediar en la EA al facilitar el reconocimiento de reacción cruzada de SARS-CoV-2 en ausencia de neutralización viral. Los datos preliminares muestran que se encontró que los anticuerpos de donantes sin experiencia con SARS-CoV-2 que tenían una alta reactividad a las cepas de coronavirus humano estacional tenían niveles bajos de reactividad cruzada contra la nucleocápside y la subunidad S2 del SARS-CoV-2 (ref. 54). Queda por abordar si tales anticuerpos de reacción cruzada pueden contribuir al EAM clínico del SARS-COV-2.
Riesgo de ERD para las vacunas contra el SARS-CoV-2
Las preocupaciones sobre la seguridad de las vacunas contra el SARS-CoV-2 fueron impulsadas inicialmente por estudios en ratones que mostraron una inmunopatología mejorada, o ERD, en animales vacunados con el SARS-CoV después de la exposición viral 55 , 56 , 57 , 58 . La inmunopatología observada se asoció con respuestas sesgadas por células Th2 55 y fue en gran medida contra la proteína nucleocápsida 56 , 58 . Es importante destacar que no se observó inmunopatología en ratones expuestos después de la transferencia pasiva de suero inmune específico de nucleocápside 56, lo que confirma que la enfermedad potenciada no se pudo replicar utilizando los volúmenes de suero transferidos. Estudios similares que utilizaron vacunas de virus completo inactivado o basadas en vectores virales para el SARS-CoV o MERS-CoV dieron como resultado inmunopatología después de la exposición viral 59 , 60 , 61 , que se relacionaron con respuestas sesgadas por citocinas Th2 55 y / o pulmón excesivo infiltración eosinofílica 57. La selección racional de adyuvantes asegura que las respuestas sesgadas por células Th1 puedan reducir notablemente estos riesgos de ERD asociados a la vacuna. Las vacunas candidatas contra el SARS-CoV formuladas con alumbre, CpG o Advax (un adyuvante a base de inulina delta) encontraron que, si bien las respuestas con sesgo Th2 asociadas con el alumbre impulsaron la inmunopatología eosinofílica pulmonar en ratones, protección sin inmunopatología y una respuesta Th1 / Th2 más equilibrada fueron inducidos por Advax 62 . Hashem y col. mostró que los ratones vacunados con un vector viral de adenovirus 5 que expresaba MERS-CoV S1 exhibían patología pulmonar después de la exposición viral, a pesar de conferir protección. Es importante destacar que la inclusión de CD40L como adyuvante molecular impulsó las respuestas Th1 y previno la inmunopatología relacionada con la vacuna 63 .
En caso de que ocurra, la ERD causada por vacunas humanas se observará primero en ensayos de eficacia de fase II y / o III más grandes que tengan suficientes eventos de infección para realizar comparaciones estadísticas entre los brazos de estudio inmunizados y de control con placebo. Los perfiles de seguridad de las vacunas COVID-19 deben monitorearse de cerca en tiempo real durante los ensayos de eficacia en humanos, especialmente para las modalidades de vacuna que pueden tener un potencial teórico más alto para causar inmunopatología (como formulaciones de virus completo inactivado o vectores virales) 64 , 65 .
Riesgo de ADE para las vacunas contra el SARS-CoV-2
La evidencia de ADE inducida por la vacuna en modelos animales de SARS-CoV es contradictoria y plantea posibles problemas de seguridad. Liu y col. encontraron que mientras que los macacos inmunizados con un vector viral de Ankara de vaccinia modificado que expresa la proteína SARS-CoV S habían reducido la replicación viral después del desafío, la IgG anti-S también aumentó la infiltración pulmonar de macrófagos inflamatorios y resultó en una lesión pulmonar más severa en comparación con los animales no vacunados 66. Además, demostraron que la presencia de IgG anti-S antes de la eliminación viral sesgaba la respuesta de curación de heridas de los macrófagos a una respuesta proinflamatoria. En otro estudio, Wang et al. inmunizó a los macacos con cuatro epítopos de péptidos de células B de la proteína SARS-CoV S y demostró que mientras que tres péptidos producían anticuerpos que protegían a los macacos del desafío viral, una de las vacunas de péptidos inducía anticuerpos que aumentaban la infección in vitro y producían patología pulmonar más grave in vivo 67 .
Por el contrario, para determinar si títulos bajos de anticuerpos neutralizantes podrían potenciar la infección in vivo, Luo et al. desafiaron macacos rhesus con SARS-CoV nueve semanas después de la inmunización con una vacuna inactivada, cuando los títulos de anticuerpos neutralizantes habían disminuido por debajo de los niveles protectores 68 . Si bien la mayoría de los macacos inmunizados se infectaron después de la exposición viral, tenían títulos virales más bajos en comparación con los controles de placebo y no mostraron niveles más altos de patología pulmonar. Del mismo modo, Qin et al. demostraron que una vacuna inactivada contra el SARS-CoV protegía a los macacos cynomolgus del desafío viral y no daba como resultado una inmunopatología pulmonar mejorada, incluso en macacos con títulos bajos de anticuerpos neutralizantes 69. Un estudio en hámsters demostró que, a pesar de la entrada vírica in vitro mejorada en las células B a través de FcγRII, los animales vacunados con la proteína recombinante SARS-CoV S estaban protegidos y no mostraron una patología pulmonar mejorada después de la exposición viral 70 .
Por tanto, los estudios de inmunización contra el SARS-CoV en modelos animales han producido resultados que varían mucho en términos de eficacia protectora, inmunopatología y EAM potencial, dependiendo de la estrategia de vacuna empleada. A pesar de esto, las vacunas que provocan anticuerpos neutralizantes contra la proteína S protegen de manera confiable a los animales de la exposición al SARS-CoV sin evidencia de aumento de la infección o enfermedad 71 , 72 , 73. Estos datos sugieren que las estrategias de inmunización humana para el SARS-CoV-2 que provocan altos títulos de anticuerpos neutralizantes tienen una alta probabilidad de éxito con un riesgo mínimo de ADE. Por ejemplo, las vacunas de subunidades que pueden provocar anticuerpos neutralizantes específicos de S deben presentar menores riesgos de ADE (especialmente contra S estabilizado en la conformación de prefusión, para reducir la presentación de epítopos no neutralizantes 8 ). Estos enfoques de diseño de inmunógenos modernos deberían reducir la inmunopatología potencial asociada con anticuerpos no neutralizantes.
Las vacunas con un alto riesgo teórico de inducir la EA o la ERD patológica incluyen las vacunas virales inactivadas, que pueden contener dianas antigénicas no neutralizantes y / o la proteína S en conformaciones no neutralizantes, lo que proporciona una multitud de dianas no protectoras para anticuerpos que podrían conducir inflamación adicional a través de los mecanismos bien descritos observados para otros patógenos respiratorios. Sin embargo, es alentador que una evaluación reciente de una vacuna inactivada contra el SARS-CoV-2 provocó fuertes anticuerpos neutralizantes en ratones, ratas y macacos rhesus, y proporcionó protección dependiente de la dosis sin evidencia de aumento de patología en macacos rhesus 74. En el futuro, el aumento de los estudios de vacunas en el modelo de hámster sirio puede proporcionar datos preclínicos críticos, ya que el hámster sirio parece replicar la inmunopatología humana COVID-19 más de cerca que los modelos del macaco rhesus 75 .
Intervenciones con ADE y anticuerpos recombinantes
El descubrimiento del neutralizing monoclonal antibody, mAb contra la proteína SARS-CoV-2 S está progresando rápidamente. Los avances recientes en la detección de células B y el descubrimiento de anticuerpos han permitido el rápido aislamiento de potentes anticuerpos neutralizantes del SARS-CoV-2 de donantes humanos convalecientes 76 , 77 y modelos animales inmunizados 78 , y mediante la reingeniería de los anticuerpos del SARS-CoV 79 previamente identificados . En las próximas semanas y meses se identificarán muchos anticuerpos neutralizantes más potentes, y en julio de 2020 se están realizando varios ensayos clínicos en humanos. Los ensayos en humanos comprenderán usos tanto profilácticos como terapéuticos, tanto para mAbs individuales como para cócteles. Algunos ensayos clínicos en humanos también están incorporando mutaciones knockout de FcR para reducir aún más los riesgos de ADE 80. Los datos preclínicos sugieren un riesgo bajo de ADE para los mAbs potentemente neutralizantes en dosis sustancialmente por encima del umbral de neutralización, lo que protegió a los ratones y hámsteres sirios contra la exposición al SARS-CoV-2 sin aumentar la infección o la enfermedad 81 , 82 . Los riesgos de ADE podrían aumentar en el período de tiempo en el que las concentraciones de mAb han disminuido por debajo de un umbral de protección (que es análogo a los datos históricos de madre e hijo que proporcionaron evidencia clínica importante para ADE en el dengue 83). El rango de concentración de subprotección probablemente ocurrirá varias semanas o meses después de la administración de mAb, cuando gran parte de la dosis inicial del fármaco haya desaparecido del organismo. En particular, los hámsteres sirios que recibieron dosis bajas de un mAb neutralizante específico de RBD antes del desafío con SARS-CoV-2 mostraron una tendencia a una mayor pérdida de peso que los animales de control 82, aunque las diferencias no fueron estadísticamente significativas y los animales de dosis baja tenían cargas virales más bajas en el pulmón en comparación con los animales de control. Los mAb no neutralizantes contra el SARS-CoV-2 también podrían administrarse antes o después de la infección en un modelo de hámster para determinar si los anticuerpos no neutralizantes potencian la enfermedad. La transferencia pasiva de mAb en varios puntos de tiempo después de la infección (por ejemplo, en presencia de altas cargas virales durante el pico de la infección) también podría abordar la cuestión de si la formación y el depósito de complejos inmunes dan como resultado la mejora de la enfermedad y la inmunopatología pulmonar. Si el ADE de mAbs neutralizantes o no neutralizantes es una preocupación, la porción Fc de estos anticuerpos podría diseñarse con mutaciones que anulan la unión de FcR 80. Los estudios en animales pueden ayudar a informar si las funciones efectoras mediadas por Fc son cruciales para prevenir, tratar o empeorar la infección por SARS-CoV-2, de manera similar a los estudios previos sobre la infección por influenza A y B en ratones 84 , 85 y la infección por VIH en simios en macacos 86 , 87 . Una advertencia importante para probar mAb humanos en modelos animales es que las regiones Fc de anticuerpos humanos pueden no interactuar con los FcR animales de la misma manera que los FcR humanos 88 . Siempre que sea posible, los anticuerpos usados para estudios preclínicos de ADE requerirán regiones Fc emparejadas por especies para modelar adecuadamente la función efectora de Fc.
Intervenciones con ADE y plasma de convalecencia
La terapia con plasma de convalecencia (PC) se ha utilizado para tratar a pacientes con enfermedad grave durante muchos brotes virales en ausencia de terapias antivirales eficaces. Puede ofrecer una solución rápida para terapias hasta que se puedan descubrir, evaluar y producir a escala productos farmacéuticos definidos molecularmente. Si bien existe un riesgo teórico de que los anticuerpos CP puedan mejorar la enfermedad a través de ADE, los informes de casos en brotes de SARS-CoV y MERS-CoV mostraron que la terapia CP era segura y se asoció con mejores resultados clínicos 89 , 90 . Uno de los estudios más grandes durante el brote de SARS informó el tratamiento de 80 pacientes con SARS en Hong Kong 91. Si bien no hubo un grupo de control con placebo, no se detectaron efectos adversos asociados con la PC y hubo una tasa de alta más alta entre los pacientes tratados antes en la infección. Varios estudios pequeños de personas con enfermedad grave por COVID-19 y un estudio de 5.000 pacientes con COVID-19 han demostrado que la terapia con PC parece segura y puede mejorar los resultados de la enfermedad 92 , 93 , 94 , 95 , 96 , aunque los beneficios parecen ser leves 97. Sin embargo, es difícil determinar si la terapia de CP contribuyó a la recuperación, ya que la mayoría de los estudios hasta la fecha no fueron controlados y muchos pacientes también fueron tratados con otros medicamentos, incluidos antivirales y corticosteroides. Los beneficios potenciales de la terapia CP en pacientes con COVID-19 grave tampoco están claros, ya que los pacientes con enfermedad grave pueden haber desarrollado ya títulos elevados de anticuerpos contra el SARS-CoV-2 (refs. 47 , 98 ). Se ha sugerido la PC para uso profiláctico en poblaciones de alto riesgo, incluidas personas con factores de riesgo subyacentes, trabajadores de atención médica de primera línea y personas con exposición a casos confirmados de COVID-19 99. La PC para uso profiláctico puede presentar un riesgo de EAA incluso menor en comparación con su uso terapéutico, ya que hay una carga antigénica más baja asociada con la transmisión viral temprana en comparación con la infección respiratoria establecida. Como destacamos anteriormente con mAbs recombinantes, y como se muestra en los datos históricos maternos-infantiles del virus del dengue, el riesgo teórico de ADE en la profilaxis de la PC es mayor en las semanas posteriores a la transfusión, cuando los títulos de neutralización sérica de anticuerpos caen a niveles subprotectores. Los riesgos de EA en los estudios de PC serán más difíciles de cuantificar que en los estudios de mAb recombinantes porque la composición precisa de la PC varía ampliamente entre los pacientes tratados y los protocolos de tratamiento, especialmente en los estudios de PC que se realizan como protocolos uno a uno de paciente-receptor sin combinación de plasma. .
Para mitigar los riesgos potenciales de EA en la terapia y la profilaxis de la PC, los donantes de plasma podrían ser evaluados previamente para títulos de neutralización altos. Los anticuerpos anti-S o anti-RBD también podrían purificarse a partir de CP donada para enriquecer los anticuerpos neutralizantes y evitar los riesgos de ADE causados por anticuerpos no neutralizantes contra otros antígenos del SARS-CoV-2. Los estudios de infusión pasiva en modelos animales están ayudando a aclarar los riesgos de PC en un entorno bien controlado, tanto para uso profiláctico como terapéutico. Los estudios clave en animales (especialmente en hámsteres sirios, e idealmente con PC derivada de hámster para regiones Fc de anticuerpos coincidentes) y los resultados de eficacia y seguridad clínica en humanos para la PC están surgiendo al mismo tiempo.96,100.
Conclusión
Se ha observado ADE en SARS, MERS y otras infecciones por virus respiratorios humanos, incluido el RSV y el sarampión, lo que sugiere un riesgo real de ADE para las vacunas contra el SARS-CoV-2 y las intervenciones basadas en anticuerpos. Sin embargo, los datos clínicos aún no han establecido completamente el papel del ADE en la patología humana del COVID-19. Los pasos para reducir los riesgos de ADE de las inmunoterapias incluyen la inducción o administración de altas dosis de potentes anticuerpos neutralizantes, en lugar de concentraciones más bajas de anticuerpos no neutralizantes que tendrían más probabilidades de causar ADE.
En el futuro, será crucial evaluar los conjuntos de datos clínicos y animales para detectar signos de ADE, y equilibrar los riesgos de seguridad relacionados con el ADE con la eficacia de la intervención si se observa un ADE clínico. Los estudios clínicos en animales y humanos en curso proporcionarán información importante sobre los mecanismos de ADE en COVID-19. Dicha evidencia es muy necesaria para garantizar la seguridad del producto en las intervenciones médicas a gran escala que probablemente se requieran para reducir la carga global de COVID-19.
Puedes leer un resumen de esta historia de los fracasos de la inyección génica aquí . O si desea leer los estudios individuales, puede consultar estos enlaces:
- En 2004, el intento de vacunación produjo hepatitis en hurones.
- En 2005, los ratones y las civetas se enfermaron y se volvieron más susceptibles a los coronavirus después de ser vacunados.
- En 2012, los hurones enfermaron y murieron. Y en este estudio , los ratones y hurones desarrollaron una enfermedad pulmonar.
- En 2016, este estudio también produjo enfermedad pulmonar en ratones.
Ver más:
Referencias
- 1.Zhou, Y. et al. Network-based drug repurposing for novel coronavirus 2019-nCoV/SARS-CoV-2. Cell Discov. 6, 14 (2020).CAS PubMed PubMed Central Google Scholar
- 2.Lu, R. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 395, 565–574 (2020).CAS PubMed PubMed Central Google Scholar
- 3.Lam, T. T. et al. Identifying SARS-CoV-2 related coronaviruses in Malayan pangolins. Nature 583, 282–285 (2020).CAS PubMed Google Scholar
- 4.Hoffmann, M. et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 181, 271–280 (2020).CAS PubMed PubMed Central Google Scholar
- 5.Yan, R. et al. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science 367, 1444–1448 (2020).CAS PubMed PubMed Central Google Scholar
- 6.Daly, J. L. et al. Neuropilin-1 is a host factor for SARS-CoV-2 infection. Preprint at https://www.biorxiv.org/content/10.1101/2020.06.05.134114v1 (2020).
- 7.Cantuti-Castelvetri, L. et al. Neuropilin-1 facilitates SARS-CoV-2 cell entry and provides a possible pathway into the central nervous system. Preprint at https://www.biorxiv.org/content/10.1101/2020.06.07.137802v1 (2020).
- 8.Wrapp, D. et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 367, 1260–1263 (2020).CAS PubMed PubMed Central Google Scholar
- 9.Kim, H. W. et al. Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine. Am. J. Epidemiol. 89, 422–434 (1969).CAS PubMed Google Scholar
- 10.Graham, B. S. Vaccines against respiratory syncytial virus: the time has finally come. Vaccine 34, 3535–3541 (2016).PubMed PubMed Central Google Scholar
- 11.Nader, P. R., Horwitz, M. S. & Rousseau, J. Atypical exanthem following exposure to natural measles: eleven cases in children previously inoculated with killed vaccine. J. Pediatr. 72, 22–28 (1968).Google Scholar
- 12.Polack, F. P. Atypical measles and enhanced respiratory syncytial virus disease (ERD) made simple. Pediatr. Res. 62, 111–115 (2007).PubMed Google Scholar
- 13.Dejnirattisai, W. et al. Cross-reacting antibodies enhance dengue virus infection in humans. Science 328, 745–748 (2010).CAS PubMed Google Scholar
- 14.Sridhar, S. et al. Effect of dengue serostatus on dengue vaccine safety and efficacy. N. Engl. J. Med. 379, 327–340 (2018).PubMed Google Scholar
- 15.Hohdatsu, T. et al. Antibody-dependent enhancement of feline infectious peritonitis virus infection in feline alveolar macrophages and human monocyte cell line U937 by serum of cats experimentally or naturally infected with feline coronavirus. J. Vet. Med. Sci. 60, 49–55 (1998).CAS PubMed Google Scholar
- 16.Halstead, S. B. & O’Rourke, E. J. Dengue viruses and mononuclear phagocytes. I. Infection enhancement by non-neutralizing antibody. J. Exp. Med. 146, 201–217 (1977).CAS PubMed PubMed Central Google Scholar
- 17.Vennema, H. et al. Early death after feline infectious peritonitis virus challenge due to recombinant vaccinia virus immunization. J. Virol. 64, 1407–1409 (1990).CAS PubMed PubMed Central Google Scholar
- 18.Hohdatsu, T., Nakamura, M., Ishizuka, Y., Yamada, H. & Koyama, H. A study on the mechanism of antibody-dependent enhancement of feline infectious peritonitis virus infection in feline macrophages by monoclonal antibodies. Arch. Virol. 120, 207–217 (1991).CAS PubMed PubMed Central Google Scholar
- 19.Weiss, R. C. & Scott, F. W. Antibody-mediated enhancement of disease in feline infectious peritonitis: comparisons with dengue hemorrhagic fever. Comp. Immunol. Microbiol. Infect. Dis. 4, 175–189 (1981).CAS PubMed PubMed Central Google Scholar
- 20.Ye, Z. W. et al. Antibody-dependent cell-mediated cytotoxicity epitopes on the hemagglutinin head region of pandemic H1N1 influenza virus play detrimental roles in H1N1-infected mice. Front. Immunol. 8, 317 (2017).PubMed PubMed Central Google Scholar
- 21.Winarski, K. L. et al. Antibody-dependent enhancement of influenza disease promoted by increase in hemagglutinin stem flexibility and virus fusion kinetics. Proc. Natl Acad. Sci. USA 116, 15194–15199 (2019).CAS PubMed Google Scholar
- 22.Polack, F. P. et al. A role for immune complexes in enhanced respiratory syncytial virus disease. J. Exp. Med. 196, 859–865 (2002).CAS PubMed PubMed Central Google Scholar
- 23.Polack, F. P., Hoffman, S. J., Crujeiras, G. & Griffin, D. E. A role for nonprotective complement-fixing antibodies with low avidity for measles virus in atypical measles. Nat. Med. 9, 1209–1213 (2003).CAS PubMed Google Scholar
- 24.Gao, T. et al. Highly pathogenic coronavirus N protein aggravates lung injury by MASP-2-mediated complement over-activation. Preprint at https://www.medrxiv.org/content/10.1101/2020.03.29.20041962v3 (2020).
- 25.Gralinski, L. E. et al. Complement activation contributes to severe acute respiratory syndrome coronavirus pathogenesis. mBio 9, e01753-18 (2018).PubMed PubMed Central Google Scholar
- 26.Larsen, M. D. et al. Afucosylated immunoglobulin G responses are a hallmark of enveloped virus infections and show an exacerbated phenotype in COVID-19. Preprint at https://www.biorxiv.org/content/10.1101/2020.05.18.099507v1 (2020).
- 27.Chakraborty, S. et al. Symptomatic SARS-CoV-2 infections display specific IgG Fc structures. Preprint at https://www.medrxiv.org/content/10.1101/2020.05.15.20103341v1 (2020).
- 28.Hiatt, A. et al. Glycan variants of a respiratory syncytial virus antibody with enhanced effector function and in vivo efficacy. Proc. Natl Acad. Sci. USA 111, 5992–5997 (2014).CAS PubMed Google Scholar
- 29.Zeitlin, L. et al. Enhanced potency of a fucose-free monoclonal antibody being developed as an Ebola virus immunoprotectant. Proc. Natl Acad. Sci. USA 108, 20690–20694 (2011).CAS PubMed Google Scholar
- 30.Wang, T. T. et al. IgG antibodies to dengue enhanced for FcγRIIIA binding determine disease severity. Science 355, 395–398 (2017).CAS PubMed PubMed Central Google Scholar
- 31.Hui, K. P. Y. et al. Tropism, replication competence, and innate immune responses of the coronavirus SARS-CoV-2 in human respiratory tract and conjunctiva: an analysis in ex-vivo and in-vitro cultures. Lancet Respir. Med. 8, 687–695 (2020).CAS PubMed PubMed Central Google Scholar
- 32.Yip, M. S. et al. Antibody-dependent infection of human macrophages by severe acute respiratory syndrome coronavirus. Virol. J. 11, 82 (2014).PubMed PubMed Central Google Scholar
- 33.Robinson, W. E. Jr, Montefiori, D. C. & Mitchell, W. M. Antibody-dependent enhancement of human immunodeficiency virus type 1 infection. Lancet 1, 790–794 (1988).PubMed Google Scholar
- 34.Robinson, W. E. Jr et al. Antibody-dependent enhancement of human immunodeficiency virus type 1 (HIV-1) infection in vitro by serum from HIV-1-infected and passively immunized chimpanzees. Proc. Natl Acad. Sci. USA 86, 4710–4714 (1989).PubMed Google Scholar
- 35.Takada, A., Watanabe, S., Okazaki, K., Kida, H. & Kawaoka, Y. Infectivity-enhancing antibodies to Ebola virus glycoprotein. J. Virol. 75, 2324–2330 (2001).CAS PubMed PubMed Central Google Scholar
- 36.Takada, A., Feldmann, H., Ksiazek, T. G. & Kawaoka, Y. Antibody-dependent enhancement of Ebola virus infection. J. Virol. 77, 7539–7544 (2003).CAS PubMed PubMed Central Google Scholar
- 37.Ochiai, H. et al. Infection enhancement of influenza A NWS virus in primary murine macrophages by anti-hemagglutinin monoclonal antibody. J. Med. Virol. 36, 217–221 (1992).CAS PubMed Google Scholar
- 38.Sariol, C. A., Nogueira, M. L. & Vasilakis, N. A tale of two viruses: does heterologous flavivirus immunity enhance Zika disease? Trends Microbiol. 26, 186–190 (2018).CAS PubMed Google Scholar
- 39.Wan, Y. et al. Molecular mechanism for antibody-dependent enhancement of coronavirus entry. J. Virol. 94, e02015-19 (2020).PubMed PubMed Central Google Scholar
- 40.Jaume, M. et al. Anti-severe acute respiratory syndrome coronavirus spike antibodies trigger infection of human immune cells via a pH- and cysteine protease-independent FcγR pathway. J. Virol. 85, 10582–10597 (2011).CAS PubMed PubMed Central Google Scholar
- 41.Cheung, C. Y. et al. Cytokine responses in severe acute respiratory syndrome coronavirus-infected macrophages in vitro: possible relevance to pathogenesis. J. Virol. 79, 7819–7826 (2005).CAS PubMed PubMed Central Google Scholar
- 42.Yip, M. S. et al. Antibody-dependent enhancement of SARS coronavirus infection and its role in the pathogenesis of SARS. Hong Kong Med. J. 22, 25–31 (2016).CAS PubMed Google Scholar
- 43.Ana-Sosa-Batiz, F. et al. Influenza-specific antibody-dependent phagocytosis. PLoS ONE 11, e0154461 (2016).PubMed PubMed Central Google Scholar
- 44.Yasui, F. et al. Phagocytic cells contribute to the antibody-mediated elimination of pulmonary-infected SARS coronavirus. Virology 454–455, 157–168 (2014).PubMed Google Scholar
- 45.Zhou, J. et al. Active replication of Middle East respiratory syndrome coronavirus and aberrant induction of inflammatory cytokines and chemokines in human macrophages: implications for pathogenesis. J. Infect. Dis. 209, 1331–1342 (2014).CAS PubMed Google Scholar
- 46.Ho, M. S. et al. Neutralizing antibody response and SARS severity. Emerg. Infect. Dis. 11, 1730–1737 (2005).CAS PubMed PubMed Central Google Scholar
- 47.Zhao, J. et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin. Infect. Dis. https://doi.org/10.1093/cid/ciaa344 (2020).
- 48.Liu, Y. et al. Viral dynamics in mild and severe cases of COVID-19. Lancet Infect. Dis. 20, 656–657 (2020).CAS PubMed PubMed Central Google Scholar
- 49.Zheng, S. et al. Viral load dynamics and disease severity in patients infected with SARS-CoV-2 in Zhejiang province, China, January–March 2020: retrospective cohort study. BMJ 369, m1443 (2020).PubMed PubMed Central Google Scholar
- 50.Long, Q. X. et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat. Med. 26, 1200–1204 (2020).CAS PubMed Google Scholar
- 51.Sekine, T. et al. Robust T cell immunity in convalescent individuals with asymptomatic or mild COVID-19. Cell https://doi.org/10.1016/j.cell.2020.08.017 (2020).
- 52.Mathew, D., Giles, J. R., Baxter, A. E., Oldridge, D. A. & Greenplate, A. R. Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications. Science https://doi.org/10.1126/science.abc8511 (2020).
- 53.Tetro, J. A. Is COVID-19 receiving ADE from other coronaviruses? Microbes Infect. 22, 72–73 (2020).CAS PubMed PubMed Central Google Scholar
- 54.Khan, S. et al. Analysis of serologic cross-reactivity between common human coronaviruses and SARS-CoV-2 using coronavirus antigen microarray. Preprint at https://www.biorxiv.org/content/10.1101/2020.03.24.006544v1 (2020).
- 55.Tseng, C. T. et al. Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLoS ONE 7, e35421 (2012).CAS PubMed PubMed Central Google Scholar
- 56.Deming, D. et al. Vaccine efficacy in senescent mice challenged with recombinant SARS-CoV bearing epidemic and zoonotic spike variants. PLoS Med. 3, e525 (2006).PubMed PubMed Central Google Scholar
- 57.Bolles, M. et al. A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge. J. Virol. 85, 12201–12215 (2011).CAS PubMed PubMed Central Google Scholar
- 58.Yasui, F. et al. Prior immunization with severe acute respiratory syndrome (SARS)-associated coronavirus (SARS-CoV) nucleocapsid protein causes severe pneumonia in mice infected with SARS-CoV. J. Immunol. 181, 6337–6348 (2008).CAS PubMed Google Scholar
- 59.Agrawal, A. S. et al. Immunization with inactivated Middle East respiratory syndrome coronavirus vaccine leads to lung immunopathology on challenge with live virus. Hum. Vaccin. Immunother. 12, 2351–2356 (2016).PubMed PubMed Central Google Scholar
- 60.Weingartl, H. et al. Immunization with modified vaccinia virus Ankara-based recombinant vaccine against severe acute respiratory syndrome is associated with enhanced hepatitis in ferrets. J. Virol. 78, 12672–12676 (2004).CAS PubMed PubMed Central Google Scholar
- 61.Czub, M., Weingartl, H., Czub, S., He, R. & Cao, J. Evaluation of modified vaccinia virus Ankara based recombinant SARS vaccine in ferrets. Vaccine 23, 2273–2279 (2005).CAS PubMed PubMed Central Google Scholar
- 62.Honda-Okubo, Y. et al. Severe acute respiratory syndrome-associated coronavirus vaccines formulated with delta inulin adjuvants provide enhanced protection while ameliorating lung eosinophilic immunopathology. J. Virol. 89, 2995–3007 (2015).CAS PubMed Google Scholar
- 63.Hashem, A. M. et al. A highly immunogenic, protective, and safe adenovirus-based vaccine expressing Middle East respiratory syndrome coronavirus S1-CD40L fusion protein in a transgenic human dipeptidyl peptidase 4 mouse model. J. Infect. Dis. 220, 1558–1567 (2019).CAS PubMed PubMed Central Google Scholar
- 64.London, A. J. & Kimmelman, J. Against pandemic research exceptionalism. Science 368, 476–477 (2020).CAS PubMed Google Scholar
- 65.Lurie, N., Saville, M., Hatchett, R. & Halton, J. Developing Covid-19 vaccines at pandemic speed. N. Engl. J. Med. 382, 1969–1973 (2020).CAS PubMed Google Scholar
- 66.Liu, L. et al. Anti-spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection. JCI Insight 4, e123158 (2019).PubMed Central Google Scholar
- 67.Wang, Q. et al. Immunodominant SARS coronavirus epitopes in humans elicited both enhancing and neutralizing effects on infection in non-human primates. ACS Infect. Dis. 2, 361–376 (2016).CAS PubMed PubMed Central Google Scholar
- 68.Luo, F. et al. Evaluation of antibody-dependent enhancement of SARS-CoV infection in rhesus macaques immunized with an inactivated SARS-CoV vaccine. Virol. Sin. 33, 201–204 (2018).PubMed PubMed Central Google Scholar
- 69.Qin, E. et al. Immunogenicity and protective efficacy in monkeys of purified inactivated Vero-cell SARS vaccine. Vaccine 24, 1028–1034 (2006).CAS PubMed Google Scholar
- 70.Kam, Y. W. et al. Antibodies against trimeric S glycoprotein protect hamsters against SARS-CoV challenge despite their capacity to mediate FcγRII-dependent entry into B cells in vitro. Vaccine 25, 729–740 (2007).CAS PubMed Google Scholar
- 71.Yang, Z. Y. et al. A DNA vaccine induces SARS coronavirus neutralization and protective immunity in mice. Nature 428, 561–564 (2004).CAS PubMed PubMed Central Google Scholar
- 72.Bukreyev, A. et al. Mucosal immunisation of African green monkeys (Cercopithecus aethiops) with an attenuated parainfluenza virus expressing the SARS coronavirus spike protein for the prevention of SARS. Lancet 363, 2122–2127 (2004).CAS PubMed PubMed Central Google Scholar
- 73.Bisht, H. et al. Severe acute respiratory syndrome coronavirus spike protein expressed by attenuated vaccinia virus protectively immunizes mice. Proc. Natl Acad. Sci. USA 101, 6641–6646 (2004).CAS PubMed Google Scholar
- 74.Gao, Q. et al. Rapid development of an inactivated vaccine candidate for SARS-CoV-2. Science 369, 77–81 (2020).CAS PubMed Google Scholar
- 75.Chan, J. F. et al. Simulation of the clinical and pathological manifestations of Coronavirus Disease 2019 (COVID-19) in golden Syrian hamster model: implications for disease pathogenesis and transmissibility. Clin. Infect. Dis. https://doi.org/10.1093/cid/ciaa325 (2020).
- 76.Ju, B. et al. Human neutralizing antibodies elicited by SARS-CoV-2 infection. Nature 584, 115–119 (2020).CAS PubMed Google Scholar
- 77.Brouwer, P. J. M. et al. Potent neutralizing antibodies from COVID-19 patients define multiple targets of vulnerability. Science 369, 643–650 (2020).CAS PubMed Google Scholar
- 78.Hansen, J. et al. Studies in humanized mice and convalescent humans yield a SARS-CoV-2 antibody cocktail. Science 369, 1010–1014 (2020).CAS PubMed Google Scholar
- 79.Yuan, M. et al. A highly conserved cryptic epitope in the receptor binding domains of SARS-CoV-2 and SARS-CoV. Science 368, 630–633 (2020).CAS PubMed PubMed Central Google Scholar
- 80.Shi, R. et al. A human neutralizing antibody targets the receptor-binding site of SARS-CoV-2. Nature 584, 120–124 (2020).CAS PubMed Google Scholar
- 81.Cao, Y. et al. Potent neutralizing antibodies against SARS-CoV-2 identified by high-throughput single-cell sequencing of convalescent patients’ B cells. Cell 182, 73–84 (2020).CAS PubMed PubMed Central Google Scholar
- 82.Rogers, T. F. et al. Isolation of potent SARS-CoV-2 neutralizing antibodies and protection from disease in a small animal model. Science 369, 956–963 (2020).CAS PubMed Google Scholar
- 83.Halstead, S. B. Neutralization and antibody-dependent enhancement of dengue viruses. Adv. Virus. Res. 60, 421–467 (2003).CAS PubMed Google Scholar
- 84.DiLillo, D. J., Palese, P., Wilson, P. C. & Ravetch, J. V. Broadly neutralizing anti-influenza antibodies require Fc receptor engagement for in vivo protection. J. Clin. Invest. 126, 605–610 (2016).PubMed PubMed Central Google Scholar
- 85.Liu, Y. et al. Cross-lineage protection by human antibodies binding the influenza B hemagglutinin. Nat. Commun. 10, 324 (2019).PubMed PubMed Central Google Scholar
- 86.Hessell, A. J. et al. Fc receptor but not complement binding is important in antibody protection against HIV. Nature 449, 101–104 (2007).CAS PubMed Google Scholar
- 87.Parsons, M. S. et al. Fc-dependent functions are redundant to efficacy of anti-HIV antibody PGT121 in macaques. J. Clin. Invest. 129, 182–191 (2019).PubMed Google Scholar
- 88.Crowley, A. R. & Ackerman, M. E. Mind the gap: how interspecies variability in IgG and its receptors may complicate comparisons of human and non-human primate effector function. Front. Immunol. 10, 69 (2019).Google Scholar
- 89.Mair-Jenkins, J. et al. The effectiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: a systematic review and exploratory meta-analysis. J. Infect. Dis. 211, 80–90 (2015).CAS Google Scholar
- 90.Ko, J. H. et al. Challenges of convalescent plasma infusion therapy in Middle East respiratory coronavirus infection: a single centre experience. Antivir. Ther. 23, 617–622 (2018).CAS PubMed Google Scholar
- 91.Cheng, Y. et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur. J. Clin. Microbiol. Infect. Dis. 24, 44–46 (2005).CAS Google Scholar
- 92.Shen, C. et al. Treatment of 5 critically ill patients with COVID-19 with convalescent plasma. JAMA 323, 1582–1589 (2020).CAS PubMed PubMed Central Google Scholar
- 93.Duan, K. et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc. Natl Acad. Sci. USA 117, 9490–9496 (2020).CAS Google Scholar
- 94.Ahn, J. Y. et al. Use of convalescent plasma therapy in two COVID-19 patients with acute respiratory distress syndrome in Korea. J. Korean Med. Sci. 35, e149 (2020).CAS PubMed PubMed Central Google Scholar
- 95.Zhang, B. et al. Treatment with convalescent plasma for critically ill patients with SARS-CoV-2 infection. Chest 158, e9–e13 (2020).CAS PubMed PubMed Central Google Scholar
- 96.Joyner, M. J. et al. Early safety indicators of COVID-19 convalescent plasma in 5,000 patients. J. Clin. Invest. https://doi.org/10.1172/JCI140200 (2020).
- 97.Li, L. et al. Effect of convalescent plasma therapy on time to clinical improvement in patients with severe and life-threatening COVID-19: a randomized clinical trial. JAMA 324, 460–470 (2020).CAS Google Scholar
- 98.Gharbharan, A. et al. Convalescent plasma for COVID-19. A randomized clinical trial. Preprint at https://www.medrxiv.org/content/10.1101/2020.07.01.20139857v1 (2020).
- 99.Casadevall, A. & Pirofski, L. A. The convalescent sera option for containing COVID-19. J. Clin. Invest. 130, 1545–1548 (2020).CAS Google Scholar
- 100.Pandey, S. & Vyas, G. N. Adverse effects of plasma transfusion. Transfusion 52 (Suppl. 1), 65S–79S (2012).CAS PubMed PubMed Central Google Scholar




