Harlan M Krumholz , Harold H Hines Profesor de medicina y epidemiología y salud pública ,1 Joseph S Ross , 2 Amos H Presler , 3 y David S Egilman , profesor clínico asociado 4
1Department of Medicine, Yale University School of Medicine 4Department of Bio Med Community Health, Brown University, Providence, RI, USA
BMJ . 20 de enero de 2007; 334 (7585): 120–123.doi: 10.1136 / bmj.39024.487720.68 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1779871/pdf/bmj-334-7585-feat-00120.pdf

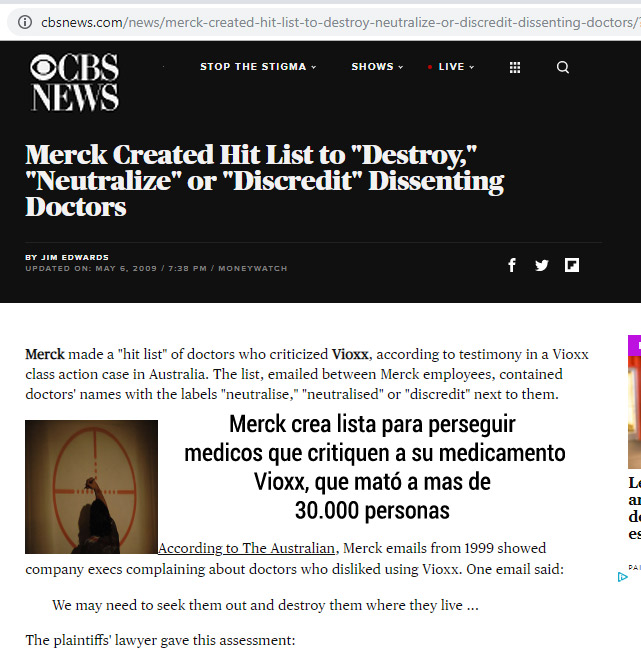
Rofecoxib (Vioxx) fue introducido por Laboratorios Merck en 1999 como una alternativa efectiva y más segura a los medicamentos antiinflamatorios para el tratamiento del dolor asociado con la osteoartritis. Posteriormente se descubrió que aumenta el riesgo de enfermedad cardiovascular y se retiró del mercado mundial. Merck ahora enfrenta demandas legales de casi 30.000 personas que tuvieron eventos cardiovasculares mientras tomaban el medicamento. 1
Sospecha temprana de riesgo cardiovascular
Desde el desarrollo temprano de rofecoxib, Vioxx, algunos científicos de Merck estaban preocupados de que el medicamento pudiera afectar negativamente al sistema cardiovascular. w1 Un estudio patrocinado por Merck durante 1996-7 informó que el rofecoxib VIOXX, redujo los metabolitos urinarios de prostaciclina en voluntarios sanos en aproximadamente la mitad. w2 En correos electrónicos internos hechos públicos a través de litigios, 3 funcionarios de Merck intentaron suavizar la interpretación de los autores académicos.
Sin embargo, a pesar del conocimiento de Merck de que el rofecoxib podría aumentar la formación de eventos trombóticos , ninguno de los estudios de intervención que constituyeron su nueva aplicación de medicamentos a la Administración de Drogas y Alimentos en 1998 fueron diseñados para evaluar el riesgo cardiovascular. Los nueve estudios fueron generalmente pequeños, tuvieron períodos cortos de tratamiento, inscribieron pacientes con bajo riesgo de enfermedad cardiovascular y no tenían un procedimiento estandarizado para recopilar y juzgar los resultados cardiovasculares. 4 Además, Merck aparentemente reunió datos de estos estudios y otros para el análisis de riesgos cardiovasculares, a pesar de la preocupación de la FDA, 5 y difundió los resultados para promover la seguridad cardiovascular del medicamento a los médicos en su «tarjeta cardiovascular» 6 7. un dispositivo de marketing citado por el congresista estadounidense Henry Waxman por minimizar falsamente los riesgos cardiovasculares 8 y nunca aprobado por la FDA.

El estudio VIGOR
En enero de 1999, Merck lanzó su estudio más grande hasta la fecha de rofecoxib, el estudio de investigación de resultados gastrointestinales Vioxx (VIGOR). El estudio tenía la intención de expandir las indicaciones aprobadas por el medicamento al mostrar que tendría menos efectos secundarios gastrointestinales que el naproxeno para el tratamiento de la artritis reumatoide. El estudio de más de 8000 pacientes se inició sin un procedimiento operativo estándar para recopilar información sobre eventos cardiovasculares y sin un cardiólogo en el panel de monitoreo de seguridad de datos. Las juntas de monitoreo de seguridad de datos son comités independientes cuyo propósito es monitorear los resultados de un ensayo en curso para garantizar la seguridad de los participantes del ensayo. w8 El estudio fue diseñado para continuar hasta que se haya producido un número predeterminado de perforaciones, úlceras o hemorragias gástricas complicadas o complicadas confirmadas.
El primer análisis de seguridad sin criterio de valoración se presentó a la junta de seguridad en noviembre de 1999, momento en el cual se encontró un riesgo de muerte o evento cardiovascular grave del 79% mayor en un grupo de tratamiento en comparación con el otro (P = 0,007). 9 La junta permitió que el estudio continuara y planeó revisar los análisis de subgrupos en diciembre, momento en el cual los análisis nuevamente mostraron un mayor riesgo cardiovascular en un grupo. Sobre esta base, la junta recomendó que se desarrolle un plan de análisis para examinar los eventos cardiovasculares graves y que el estudio continúe hasta alcanzar su objetivo de punto final gastrointestinal (previsto para marzo de 2000).
Los asuntos se complicaron por la existencia de conflictos de intereses entre los miembros de la junta. De acuerdo con las políticas de Merck, se supone que la junta debe ser independiente, sin que se controle el interés financiero o emocional en el juicio. 10 Sin embargo, el jefe de la junta de VIGOR recibió un contrato de consultoría de dos años dos semanas antes de que finalizara el juicio y cuando el juicio concluía, reveló el interés de propiedad familiar en acciones de Merck por valor de $ 70.000 (£ 37.000; € 55.000). 11 12 Esto cuestiona la independencia de la junta de seguridad.
El estudio VIGOR tuvo enormes implicaciones financieras para Merck. Si demostrara que el rofecoxib tiene una mejor seguridad gastrointestinal que el naproxeno, podría usarse para solicitar a la FDA una nueva indicación. Sin embargo, si el estudio planteara preocupaciones sobre el daño cardiovascular, la franquicia de drogas de mil millones de dólares se vería amenazada. El estudio mostró que el rofecoxib no era más efectivo para aliviar los síntomas de la artritis reumatoide pero redujo a la mitad el riesgo de eventos gastrointestinales. Sin embargo, también hubo evidencia de un mayor riesgo de infarto de miocardio (riesgo relativo 5,00, intervalo de confianza del 95%: 1,68 a 20,13). Cuando este resultado se distribuyó internamente en Merck, Edward Scolnick, el científico jefe de la compañía, escribió en un correo electrónico a sus colegas sobre el riesgo cardiovascular: “Es una pena, pero es de baja incidencia y se basa en mecanismos como nos preocupaba. [Los empleados / consultores de Merck] tenían razón sobre el significado del metabolito, es decir, los datos de orina [prostaciclina] ”.13 Esto indica que, al menos, había motivos para sospechar dentro de Merck antes de que se publicara el estudio VIGOR de que Vioxx estaba asociado con riesgo cardiovascular.
Oscureciendo el riesgo
A pesar de la preocupación expresada por el Dr. Scolnick, el estudio VIGOR publicado ocultó el riesgo cardiovascular asociado con rofecoxib de varias maneras. El informe contenía datos de un análisis intermedio que tenía diferentes fechas de finalización para eventos cardiovasculares y gastrointestinales (los eventos gastrointestinales se contaron durante un mes más que los eventos cardiovasculares). Este procedimiento altamente irregular no se describió en la publicación y tuvo el efecto de favorecer el efecto del fármaco sobre los eventos gastrointestinales al tiempo que se subestima el riesgo de eventos cardiovasculares. w9El riesgo cardiovascular publicado no fue exacto porque ocurrieron tres infartos de miocardio adicionales en el grupo de rofecoxib en el mes posterior a que los investigadores dejaron de contar los eventos cardiovasculares (ninguno había ocurrido en el grupo de naproxeno). El daño potencial se minimizó aún más mediante un análisis de subgrupos post hoc basado en la «indicación de profilaxis con aspirina»; Si Merck hubiera incluido los tres casos, el análisis de subgrupos habría mostrado un mayor riesgo cardiovascular en ambos grupos. w10
La publicación ocultó aún más el riesgo cardiovascular al presentar el riesgo de infarto de miocardio como si el naproxeno fuera el grupo de intervención (riesgo relativo 0.2, 0.1 a 0.7) y sin informar el número absoluto de eventos cardiovasculares, a pesar de que todos los demás resultados se presentaron adecuadamente con rofecoxib como grupo de intervención. w11 Finalmente, los autores propusieron una hipótesis de naproxeno, sugiriendo que el rofecoxib no había sido dañino pero que el naproxeno había sido protector, a pesar de que no había evidencia aceptada de que el naproxeno tuviera un fuerte efecto cardioprotector.
Merck promovió fuertemente el estudio VIGOR, comprando casi 1 millón de reimpresiones para distribuir a los médicos y otros profesionales de la salud. El New England Journal of Medicine informó problemas con el estudio en una «expresión de preocupación» publicada en 2006, w10 y el editor en jefe ha dicho que los autores «retuvieron datos críticos sobre la toxicidad cardiovascular del medicamento Vioxx de Merck» .14 Sin embargo, Ninguno de los autores admitió públicamente el error ni se responsabilizó por la presentación sesgada de los resultados del estudio. De hecho, dos autores de VIGOR y el jefe de la junta de VIGOR continúan colaborando en la investigación de alto perfil con Merck. 15
A excepción de un estudio de 2001 publicado en la revista JAMA que generó dudas sobre la seguridad de rofecoxib y la validez de la hipótesis de naproxeno, w12 pocos investigadores académicos cuestionaron públicamente la empresa antes de su retirada voluntaria de la droga. Además, Merck se dirigió selectivamente a médicos que plantearon preguntas sobre el medicamento, llegando incluso a presionar a algunos de ellos a través de los jefes de departamento. 16
Uso a corto y largo plazo
Durante varios años, Merck continuó investigando otras indicaciones para rofecoxib y realizó ensayos adicionales. El aumento del riesgo cardiovascular en comparación con el placebo se informó en un análisis de 2004 de la prevención de pólipos adenomatosos en el estudio Vioxx (APROBADO), w13 que condujo a la retirada del medicamento. Las implicaciones financieras fueron inmensas no solo por la pérdida de ingresos sino también por el litigio esperado. La pregunta clave fue cuándo se manifestó el riesgo. Si el uso a corto plazo no se asocia con un mayor riesgo cardiovascular, la responsabilidad de Merck se reduciría drásticamente.
Los autores aprobados, cinco de los cuales eran empleados de Merck y el resto de los cuales recibieron honorarios de consultoría de Merck, afirmaron que el mayor riesgo se hizo evidente solo después de 18 meses de uso. w13 Esta conclusión se basó en un análisis que no se especificó previamente y un enfoque metodológico defectuoso. Posteriormente, Merck admitió que había descrito incorrectamente el enfoque estadístico, y el New England Journal of Medicine emitió una corrección que indica que las declaraciones sobre un aumento en el riesgo después de 18 meses deberían eliminarse del artículo. w14 Nuevamente, los errores que favorecieron a la empresa, con colosales implicaciones económicas, lograron pasar por el proceso de revisión por pares de la revista a la profesión y al público.
Revistas médicas
El New England Journal of Medicine ha tenido un papel destacado en la historia. Publicó los estudios VIGOR y APPROVe, respondiendo a sus imprecisiones con «una expresión de preocupación» w9 w10 y una corrección w14 y publicando un artículo metodológico w15 y otros comentarios y editoriales relacionados. w16-w24 Pero otras revistas médicas académicas también jugaron un papel importante. En 2001, Circulation publicó un análisis agrupado de 23 estudios de fase IIb-V que examinan la asociación entre rofecoxib y el riesgo cardiovascular. El periódico no tenía comentario editorial ni crítica, w25A pesar de que el estudio fue coordinado internamente en Merck, los resultados favorecieron altamente la seguridad de rofecoxib, y cinco de los siete autores eran empleados de Merck (los dos autores académicos reconocieron haber sido consultores pagados a Merck). Además, en correos electrónicos internos hechos públicos a través de litigios, incluso un científico ejecutivo de Merck criticó el análisis, afirmando: «Los datos parecen haber sido interpretados para apoyar una hipótesis preconcebida en lugar de revisar críticamente los datos para generar hipótesis» .17
Los Annals of Internal Medicine publicó la evaluación de las diferencias entre Vioxx y naproxeno para determinar la tolerabilidad gastrointestinal y estudio de efectividad (ventaja). w26 Más tarde se supo que el artículo fue escrito por Merck sin acreditación, w27 w28 contenía errores en la presentación de eventos cardiovasculares con rofecoxib (minimizando el riesgo cardiovascular), y se realizó con fines de comercialización, un llamado ensayo de siembra. El diario condenó rápidamente la escritura fantasma w29 y recientemente se publicó una corrección completa de los errores w30 después de que los científicos de Merck proporcionaron una explicación inicial, pero incorrecta. w31Muchas otras revistas han publicado artículos con resultados favorables al rofecoxib que los documentos judiciales han demostrado ser escritos por compañías científicas contratadas por Merck. w32-w36
Promover la colaboración constructiva.
El caso de rofecoxib es una mala noticia para la industria, los académicos, las revistas y el público. Merck fue una de las compañías más admiradas públicamente de los EE. UU., W37 y su comportamiento puede no ser diferente al de otros en la industria farmacéutica o biotecnológica. Los periodistas han cuestionado la ética de la industria y los investigadores académicos. 18 19 20 Y, sin embargo, apenas hay una sensación de indignación en la profesión por los acontecimientos que ocurrieron.
Merck realizó los ensayos, almacenó y analizó los datos internamente, pagó a los investigadores académicos como consultores de los equipos de investigación y las juntas de monitoreo de seguridad, y mantuvo una fuerte participación en la redacción y presentación de los resultados. Las revistas publicaron los estudios, y la comunidad académica aceptó los hallazgos sin expresar mucha preocupación. Cerca de 107 millones de recetas de rofecoxib se dispensaron en los Estados Unidos entre 1999 y septiembre de 2004 21. cuando el medicamento se retiró del mercado, y ninguna de las personas que recibieron esas recetas tuvieron la oportunidad de considerar el verdadero equilibrio de sus riesgos y beneficios.
Varios de los primeros ensayos clínicos grandes de rofecoxib no se publicaron en la literatura académica durante años después de que Merck los pusiera a disposición de la FDA 22. evitando que los investigadores independientes determinen con precisión su riesgo cardiovascular mediante el metanálisis. Además, se deben realizar auditorías independientes para garantizar que las empresas sigan un protocolo estandarizado y preespecificado.
Las juntas de monitoreo independientes de datos y seguridad deben ser obligatorias y su gobierno no debe estar bajo el control de la empresa. No se debe permitir a la industria seleccionar quién sirve en estos consejos ni compensar a los miembros después de su servicio.
Los artículos de revistas cientificas deben ir acompañados de editoriales de personas sin conflictos de intereses financieros. Además, la escritura fantasma constituye una declaración falsa de autoría o una atribución falsa de autoría, y los investigadores académicos que firman o «editan» publicaciones o reseñas originales escritas por la industria deben ser penalizadas a menos que haya una revelación completa de la autoría. Incluso la mejor supervisión no siempre puede detectar errores. Cuando las revistas descubren que la información ha sido retenida o que los resultados son incorrectos, necesitan difundir rápidamente esa información y asegurarse de que cualquier búsqueda en la web que identifique el manuscrito errante también identifique la corrección. Los autores deben firmar acuerdos de que notificarán a las revistas si dicha información se vuelve disponible o se encuentra en la lista negra de la revista.
Resumen de puntos
- Merck enfrenta demandas legales de casi 30 000 personas que tuvieron un evento cardiovascular adverso mientras tomaban rofecoxib (Merck niega responsabilidad)
- Los estudios publicados sobre el medicamento ocultaron el riesgo.
- Merck tuvo influencia sobre todos los aspectos, incluidos el análisis de datos, el monitoreo de seguridad y la generación de informes.
- La medicina académica, la industria, las revistas médicas y las agencias gubernamentales no terminan de definir el conjunto de principios para restablecer la confianza enlos estudios y colaboraciones en el desarrollo de medicamentos.
Robert F Kennedy, Jr sobre Vioxx y la industria de las vacunas. https://rumble.com/vsrphw-robert-f-kennedy-jr-y-mike-tyson-hablan-sobre-la-industria-de-las-vacunas..html
Referencias:
1. United States Securities and Exchange Commission. Form 10-Q: quarterly report pursuant to section 13 or 15(d) of the Securities Exchange Act of 1934 Note 7 to consolidated financial statements.
2. Merck. Vioxx (rofecoxib): frequently asked questions. www.vioxx.com/rofecoxib/vioxx/consumer/faq.jsp
3. Morrison BW. Memo to Alan Nies, Barry Gertz, Beth Seidenberg. Letter to Ken Lasseter; manuscript draft for protocol 023. 18 Feb, 1998. Merck. Bates Nos MRK-NJ0017794 to MRK-NJ0017822.
4. Food and Drug Administration, Division of Anti-Inflammatory, Analgesic, and Ophthalmic Drug Products. HFD-550, medical officer review. Vioxx (rofecoxib), NDA 21-042/052. Washington, DC: FDA, 1999.
5. Food and Drug Administration. FDA advisory committee briefing document NDA 21-042, s007: VIOXX gastrointestinal safety. Washington, DC: 2001.
6. Merck. Vioxx. In response to your questions: cardiovascular system, clinical profile in osteoarthritis studies. Whitehouse Station NJ: Merck, 2000.
7. Waxman HA. Merck documents show aggressive marketing of Vioxx after studies indicated risk www.democrats.reform.house.gov/story.asp?ID=848&Issue=Prescription+Drugs
8. Waxman HA. Memo re: the marketing of Vioxx to physicians. Washington, DC: US House of Representatives, 2005.
9. Weinblatt M. Memo to Drs. Bjorkman, Neaton, Shapiro, Silman, and Sturrock re: Interim non-endpoint safety analysis of VIGOR—unblinded minutes. November 18, 1999. Found in sNDA S-007: P088C: Appendix 3.9.2 at p.2939-2946 (Bates No. MRK-00420015464-MRK-00420015471.
10. Merck. Medical affairs procedures and policies. Procedure 23: collaborative research efforts and megatrials. Appendix 2: Merck guidelines for data and safety monitoring boards. 29 Feb, 1999. Bates Nos MRK-AFK0047772 to AFK0047791.
11. Reicin AS. Letter re: financial disclosure for Merck and Co, Inc sponsored protocol entitled: “A double-blind, randomized, stratified, parallel-group study to assess the incidence of PUBs during chronic treatment with MK-0966 or naproxen in patients with rheumatoid arthritis (VIGOR).” 4 Feb, 2000. Merck. Bates Nos MRK-MEW00012 to MRK-MEW00014.
12. Merck and Co. Multidisciplinary strategic advisory board for cox-2 inhibitors, consulting agreement. February 29, 2000. Bates Nos MRK-STI0037747 to STI0037751.
13. Scolnick EM. Email communication to Deborah Shapiro, Alise Reicin, and Alan Nies re: Vigor. 9 Mar, 2000. Bates No MRK-ABH0016219.
14. Drazen JM. Hidden data counfounds medical journal editors. Wall Street Journal 2006. May 19:A11.
15. Cannon CP, Curtis SP, FitzGerald GA, Krum H, Kaur A, Bolognese JA, et al. Cardiovascular outcomes with etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the multinational etoricoxib and diclofenac arthritis long-term (MEDAL) programme: a randomised comparison. Lancet 2006;368:1771-81. [PubMed] [Google Scholar]
16. Fries JF. Letter to Raymond Gilmartin re: physician intimidation. 9 Jan, 2001. Merck. Bates No MRK-ABH0002204 to MRK-ABH0002207.
17. Morrison BW. Email communication to Rhonda Sperling, Alise Reicin, Deborah Shapiro, et al. re: fw: for review [peer]: 2001-ms-2470 (full paper) – due date Monday, 27 August 2001. 17 Aug, 2001. Bates Nos MRK-ACF0005697 to MRK-ACF0005699.
18. Meier B, Kolata G, Pollack A. Medicine fueled by marketing intensified trouble for pain pills. New York Times 2004. Dec 19:A1.
19. Meier B, Saul S. Marketing of Vioxx: how Merck played game of catch-up. New York Times 2005. Feb 11:A1.
20. Berenson A, Harris G, Meier B, Pollack A. Dangerous data—retracing a medical trail. New York Times 2004. Nov 14:A1.
21. IMS Health. National prescription audit plus time period 1999 to September 2004, extracted 2004. Plymouth Meeting, PA: IMS Health, 2004.
22. Targum SL. Review of cardiovascular safety database, rofecoxib. NDA 21-042, S-007. Washington, DC: FDA, 2001.
23. Graham DJ, Campen D, Hui R, et al. Risk of acute myocardial infarction and sudden cardiac death in patients treated with cyclo-oxygenase 2 selective and non-selective non-steroidal anti-inflammatory drugs: nested case-control study. Lancet 2005;365:475-481 https://www.sciencedirect.com/science/article/pii/S0140673605178647
24. Dai C, Stafford RS, Alexander GC. National trends in cyclooxygenase-2 inhibitor use since market release: nonselective diffusion of a selectively cost-effective innovation. Arch Intern Med 2005;165:171-177
25. The Lessons of Vioxx — Drug Safety and Sale – Henry A. Waxman, J.D. https://www.nejm.org/doi/full/10.1056/NEJMp058136
Timeline: The Rise and Fall of Vioxx https://www.npr.org/2007/11/10/5470430/timeline-the-rise-and-fall-of-vioxx
W1. Antman EM, DeMets D, Loscalzo J. Cyclooxygenase inhibition and cardiovascular risk. Circulation 2005;112:759-70.
W2. Catella-Lawson F, McAdam B, Morrison BW, Kapoor S, Kujubu D, Antes L, et al. Effects of specific inhibition of cyclooxygenase-2 on sodium balance, hemodynamics, and vasoactive eicosanoids. J Pharmacol Exp Ther 1999;289:735-41.
W3. Fitzgerald GA. Coxibs and cardiovascular disease. N Engl J Med 2004;351:1709- 11.
W4. FitzGerald GA, Austin S, Egan K, Cheng Y, Pratico D. Cyclo-oxygenase products and atherothrombosis. Ann Med 2000;32 Suppl 1:21-6.
W5. FitzGerald GA, Patrono C. The coxibs, selective inhibitors of cyclooxygenase-2. N Engl J Med 2001;345:433-42.
W6. McAdam BF, Mardini IA, Habib A, Burke A, Lawson JA, Kapoor S, et al. Effect of regulated expression of human cyclooxygenase isoforms on eicosanoid and
isoeicosanoid production in inflammation. J Clin Invest 2000;105:1473-82.
W7. Pratico D, Cyrus T, Li H, FitzGerald GA. Endogenous biosynthesis of
thromboxane and prostacyclin in 2 distinct murine models of atherosclerosis. Blood 2000;96:3823-6.
W8. DeMets DL, Friedman LM, Furberg CD, editors. Data monitoring in clinical trials: a case-studies approach. New York, NY: Springer Publishing Co., 2005. W9. Curfman GD, Morrissey S, Drazen JM. Expression of concern reaffirmed. N Engl J Med 2006;354:1193.
W10. Curfman GD, Morrissey S, Drazen JM. Expression of concern: Bombardier et al., «Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis,» N Engl J Med 2000;343:1520-8. N Engl J Med 2005;353:2813-4. 2
W11. Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med 2000;343:1520-8, 2 p following 1528.
W12. Mukherjee D, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA 2001;286:954-9.
W13. Bresalier RS, Sandler RS, Quan H, Bolognese JA, Oxenius B, Horgan K, et al. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl J Med 2005;352:1092-102.
W14. Correction. N Engl J Med 2006;355:221.
W15. Lagakos SW. Time-to-event analyses for long-term treatments–the APPROVe trial. N Engl J Med 2006;355:113-7.
W16. Furberg CD. Adverse cardiovascular effects of rofecoxib. N Engl J Med
2006;355:204; author reply 204-5.
W17. Nissen SE. Adverse cardiovascular effects of rofecoxib. N Engl J Med
2006;355:203-4; author reply 203-5.
W18. Oberholzer-Gee F, Inamdar SN. Merck’s recall of rofecoxib–a strategic
perspective. N Engl J Med 2004;351:2147-9.
W19. Eisenberg RS. Learning the value of drugs–is rofecoxib a regulatory success story? N Engl J Med 2005;352:1285-7.
W20. Okie S. Raising the safety bar–the FDA’s coxib meeting. N Engl J Med
2005;352:1283-5.
W21. Okie S. What ails the FDA? N Engl J Med 2005;352:1063-6.
W22. Topol EJ. Failing the public health–rofecoxib, Merck, and the FDA. N Engl J Med 2004;351:1707-9.
W23. Drazen JM. COX-2 inhibitors–a lesson in unexpected problems. N Engl J Med 2005;352:1131-2. 3 W24. Psaty BM, Furberg CD. COX-2 inhibitors–lessons in drug safety. N Engl J Med 2005;352:1133-5.
W25. Konstam MA, Weir MR, Reicin A, Shapiro D, Sperling RS, Barr E, et al.
Cardiovascular thrombotic events in controlled, clinical trials of rofecoxib. Circulation 2001;104:2280-8.
W26. Lisse JR, Perlman M, Johansson G, Shoemaker JR, Schechtman J, Skalky CS, et al. Gastrointestinal tolerability and effectiveness of rofecoxib versus naproxen in the treatment of osteoarthritis: a randomized, controlled trial. Ann Intern Med 2003;139:539-46.
W27. Flanagin A, Carey LA, Fontanarosa PB, Phillips SG, Pace BP, Lundberg GD, et al. Prevalence of articles with honorary authors and ghost authors in peer-reviewed medical journals. JAMA 1998;280:222-4.
W28. Rennie D, Flanagin A. Authorship! Authorship! Guests, ghosts, grafters, and the two-sided coin. JAMA 1994;271:469-71.
W29. Laine C, Mulrow CD. Exorcising ghosts and unwelcome guests. Ann Intern Med 2005;143:611-2.
W30. Egilman DS, Presler AH. Report of specific cardiovascular outcomes of the ADVANTAGE trial. Ann Intern Med 2006;144(10):781.
W31. Braunstein N, Polis A. Report of specific cardiovascular outcomes of the ADVANTAGE trial. Ann Intern Med 2005;143:158-9.
W32. Hochberg MC. Treatment of rheumatoid arthritis and osteoarthritis with COX-2- selective inhibitors: a managed care perspective. Am J Manag Care 2002;8(17 Suppl):S502-17.
W33. Garnett WR. Clinical implications of drug interactions with coxibs.
Pharmacotherapy 2001;21:1223-32.
W34. Gloth FM, 3rd. Pain management in older adults: prevention and treatment. J Am Geriatr Soc 2001;49:188-99. 4 W35. Schnitzer TJ. Osteoarthritis management: the role of cyclooxygenase-2- selective inhibitors. Clin Ther 2001;23:313-326; discussion 311-2.
W36. Weaver AL. Rofecoxib: clinical pharmacology and clinical experience. Clin Ther 2001;23:1323-38.
W37. Hawthorne F. The Merck druggernaut: the inside story of a pharmaceutical giant. New York, NY: John Wiley & Sons, 2003.