IL-37 is increased in brains of children with autism spectrum disorder and inhibits human microglia stimulated by neurotensin
Irene Tsilioni, Arti B. Patel, Harry Pantazopoulos, Sabina Berretta, Pio Conti, Susan E. Leeman, and Theoharis C. TheoharidesPNAS October 22, 2019 116 (43) 21659-21665; first published October 7, 2019 https://doi.org/10.1073/pnas.1906817116
- Un nuevo estudio de la Universidad de Tufts sugiere que la inflamación puede ser el «principal impulsor» en el desarrollo del trastorno del espectro autista (TEA).
- La inflamación crónica, del cerebro y el intestino, se ha reconocido desde hace mucho tiempo que desempeña un papel en el TEA, aunque las relaciones desempeñadas por cada uno siguen sin resolverse.
- ASD, junto con muchos otros trastornos autoinmunes y neurológicos asociados con la inflamación, han aumentado dramáticamente, ya que las altas tasas de vacunación han reemplazado las enfermedades infecciosas con enfermedades crónicas
Un estudio reciente del Centro Médico de la Universidad de Tufts en Boston, Massachusetts ha llegado a la conclusión de que “la inflamación puede ser el principal impulsor de autismo.” Como se informó en las Actas de la Academia Nacional de Ciencias, los investigadores compararon los cerebros de 16 hombres fallecidos, niños caucásicos entre las edades de tres y 14 años. Ocho de los niños tenían trastorno del espectro autista (TEA) y ocho no. El estudio determinó que todos los niños con TEA habían aumentado los niveles de interleucina-18 (IL-18), una proteína conocida por desencadenar una respuesta inflamatoria grave.
Las áreas del cerebro más afectadas fueron la amígdala, responsable del procesamiento de emociones como el miedo, la ira y el placer; y la corteza prefrontal dorsolateral, que desempeña un papel en una serie de funciones cognitivas del cerebro, incluido el mantenimiento de la memoria, atención, modificación del comportamiento y evaluación de recompensas. El daño a esta área del cerebro puede producir un déficit en la cognición social, control de los impulsos y la integración multisensorial.
Los investigadores también encontraron mayores niveles de la proteína antiinflamatoria IL-37 en los niños con TEA en comparación con el grupo de control, aunque las diferencias no fueron tan dramáticas como las de las proteínas inflamatorias. Los investigadores declararon que «ASD no tiene una patogénesis distinta o un tratamiento efectivo. El aumento de la evidencia apoya la presencia de disfunción inmune y la inflamación en el cerebro de los niños con TEA. ”Ellos especularon que el tratamiento con fármacos que se orientan a la IL-37 puede ser un enfoque terapéutico prometedor para disminuir la cantidad de IL-18 en el cerebro.
Respuesta inmune dirigida a las células cerebrales en el autismo
En otro estudio publicado en Annals of Neurology el 8 de octubre de 2019, investigadores del Centro Médico Beth Israel Deaconess que examinan cerebros donados a Autism BrainNet, un banco de tejidos sin fines de lucro, informaron haber encontrado evidencia que sugiere que una respuesta inmune dirigida a células especializadas en el cerebro resultó en inflamación crónica en dos tercios de los cerebros autistas analizados post mortem. Los investigadores especularon que el autismo, como la esclerosis múltiple, podría ser un trastorno autoinmune que involucra una respuesta inmune anormal dirigida a las células cerebrales. Al explicar el propósito de su estudio, los investigadores dijeron:
El trastorno del espectro autista (TEA) afecta a 1 de cada 59 niños todavía, excepto por causas genéticas raras, la etiología en la mayoría de los TEA sigue siendo desconocida. En el cerebro con TEA, la citocina inflamatoria y el perfil de transcripción muestran una mayor expresión de genes que codifican mediadores de la respuesta inmune innata. Evaluamos el tejido cerebral post mortem en busca de células inmunes adaptativas y daños citotóxicos mediados por células inmunes que podrían impulsar esta respuesta inmune innata en el cerebro ASD (Autism spectrum disorder) .
Llegaron a la conclusión de que:
De acuerdo con la lesión mediada por células inmunes multifocales en las barreras perivasculares del LCR-cerebro, un subconjunto de vasos de sustancia blanca ha aumentado el espacio perivascular (con contornos irregulares) y colágeno en ASD en comparación con los cerebros de control. La patología de la barrera cerebral del LCR también es evidente en las superficies ependimarias pial y ventricular de la corteza cerebral en ASD … Estos hallazgos sugieren que la inmunidad celular desregulada daña los astrocitos en los focos a lo largo de la barrera cerebral CSF en ASD.
La inflamación crónica es un sello distintivo de ASD reconocido desde hace mucho tiempo
El concepto de que la inflamación crónica es una de las características de autism spectrum disorder (ASD) no es nuevo. En 2013, la Revista de la neuroinflamación publicó un artículo afirma que, “aumento de la evidencia indica que la inflamación del cerebro está implicada en la patogénesis de las enfermedades neuropsiquiátricas”, incluyendo TEA. Tras señalar que muchos niños con regresión ASD «en alrededor de 3 años de edad, a menudo después de un evento específico, como reacción a la vacunación, infección, trauma, exposiciones tóxicas o estrés», los autores de ese artículo continúan desmostrando la creciente evidencia de disfunción / inflamación inmune en ASD y detallan múltiples marcadores de inflamación en el cerebro y líquido cefalorraquídeo de niños con TEA.
Otra evidencia del vínculo entre la inflamación crónica y el TEA se presenta en un estudio colaborativo entre Johns Hopkins y la Universidad de Alabama que se publicó en 2014. Los investigadores que realizaron ese estudio cuestionaron si la inflamación cerebral era una «causa raíz» o una «corriente abajo» consecuencia «de ASD. Observaron que en los cerebros autistas las células microgliales, «que controlan el cerebro en busca de patógenos y otras amenazas … parecían activarse perpetuamente, con sus genes para las respuestas de inflamación activadas».
La inflamación intestinal y cerebral van de la mano
Más recientemente, los científicos han informado de que, “A pesar de las precisas fisiopatología subyacente ASD no están claros, la evidencia creciente apoya un papel para la neuroinflamación mal regulada.” Tomando nota de que la investigación sobre el papel desempeñado por la inflamación de los TEA se extiende también a la interacción potencial entre el intestino y el cerebro:
El eje intestino-cerebro que involucra la conversación cruzada microbiana-inmune-neuronal es también un área creciente de investigación de neuroinflamación. Una mayor comprensión de estas interacciones en condiciones patológicas / fisiológicas y la identificación de anormalidades consistentes en el perfil inmune pueden conducir a medidas de diagnóstico y tratamientos más confiables en ASD.
La relación entre la inflamación intestinal y el TEA ha sido reconocida por mucho tiempo. Según un estudio reciente a gran escala, los niños con TEA tienen un 67 por ciento más de probabilidades de ser diagnosticados con Enfermedad Inflamatoria Intestinal (EII) que sus compañeros sin TEA. Esos investigadores sugieren que las variables genéticas y trastornos en microbioma intestinal podría ser un factor común en ambas TEA y la EII, y llegaron a la conclusión de que la posibilidad de que ambos trastornos comparten la exploración bases biológicas méritos.
Descubrir las conexiones precisas entre la inflamación crónica y el desarrollo de ASD es un desafío, pero una gran cantidad de datos respaldan que la inflamación es un jugador importante. Múltiples factores pueden conducir a la inflamación del cerebro y el intestino.
La inflamación cerebral puede estar relacionada con la encefalitis después de la vacunación, la placenta defectuosa o la respuesta inmune materna a la infección, la barrera hematoencefálica inmadura, el parto prematuro y las toxinas ambientales. La inflamación del intestino puede ser causada por un desequilibrio en el microbioma causado por factores como el parto por cesárea o un microbioma materno anormal, fórmula infantil o alimentos procesados, entre muchos otros.
La inflamación del cerebro inducida por la vacuna y el autismo se informaron por primera vez en 1985
La asociación entre la vacunación y el autismo fue reportada por primera vez por el historiador médico Harris L. Coulter y Barbara Loe Fisher, cofundadora del Centro Nacional de Información sobre Vacunas, en su libro de 1985 DPT: A Shot in the Dark (Harcourt Brace Jovanovich). Entre las descripciones del historial de casos de lesiones y muerte por la vacuna DPT se encuentran casos de niños sanos que sufrieron inflamación cerebral y daño cerebral después de las vacunas DPT y fueron diagnosticados con autismo.
En el año 2000, Loe Fisher escribió un informe especial para el boletín The Vaccine Reaction publicado por el Centro Nacional de Información sobre Vacunas (NVIC). Ella dijo:
La incidencia del autismo, como la de las dificultades de aprendizaje, el trastorno por déficit de atención con hiperactividad (TDAH), el asma, la diabetes, la artritis, el síndrome de fatiga crónica, la enfermedad inflamatoria intestinal y otros trastornos autoinmunes y neurológicos, ha aumentado dramáticamente en los EE. UU. Y otros países tecnológicamente avanzados. , mientras que las altas tasas de vacunación han provocado que la incidencia de enfermedades infecciosas infantiles disminuya tan dramáticamente en estos países. En lugar de epidemias de enfermedades infecciosas, ahora hay epidemias de enfermedades crónicas.
En 2008, Loe Fisher publicó Vacunas, autismo e inflamación crónica: la nueva epidemia, que proporcionó un análisis y un resumen de los estudios en la literatura médica que documentan las complicaciones de las enfermedades infecciosas y las vacunas que producen inflamación crónica en el cuerpo. Ella observó:
Una revisión de más de un siglo de literatura médica revela una amplia evidencia de que la disfunción del sistema inmunológico y neurológico causada por enfermedades infecciosas a menudo es idéntica a la disfunción del sistema inmunológico y neurológico causada por las vacunas creadas con los mismos virus y bacterias. Una interacción huésped / enfermedad o huésped / vacuna causa inflamación, que es aguda al principio, y se vuelve crónica en lugar de resolverse y dejar al huésped con buena salud. En ambos casos, el resultado final es una inflamación no resuelta que conduce a una disfunción cerebral mediada por el sistema inmune de diversos grados de gravedad, que es el mismo perfil que muchos han observado en niños con trastornos del espectro autista.
- E. Fombonne, Epidemiology of pervasive developmental disorders. Pediatr. Res. 65, 591–598 (2009).
- J. McPartland, F. R. Volkmar, Autism and related disorders. Handb. Clin. Neurol. 106, 407–418 (2012).
- M. C. Lai, M. V. Lombardo, S. Baron-Cohen, Autism. Lancet 383, 896–910 (2014).
- Centers for Disease Control and Prevention, CDC estimates 1 in 59 children has been identified with autism spectrum disorder. https://www.cdc.gov/features/new-autismdata/
index.html. Accessed 30 April 2018. - G. Kaur, N. Singh, A. S. Jaggi, Mast cells in neuropathic pain: An increasing spectrum of their involvement in pathophysiology. Rev. Neurosci. 28, 759–766 (2017).
- M. Babina et al., Yin-yang of IL-33 in human skin mast cells: Reduced degranulation, but augmented histamine synthesis through p38 activation. J. Invest. Dermatol. 139, 1516–1525.e3 (2019).
- D. A. Rossignol, R. E. Frye, A review of research trends in physiological abnormalities
in autism spectrum disorders: Immune dysregulation, inflammation, oxidative stress, mitochondrial dysfunction and environmental toxicant exposures. Mol. Psychiatry 17,
389–401 (2012). - C. Onore, M. Careaga, P. Ashwood, The role of immune dysfunction in the pathophysiology of autism. Brain Behav. Immun. 26, 383–392 (2012).
- M. L. Estes, A. K. McAllister, Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nat. Rev. Neurosci. 16, 469–486 (2015).
- M. D. Bauman et al., Activation of the maternal immune system during pregnancy alters behavioral development of rhesusmonkey offspring. Biol. Psychiatry 75, 332–341 (2014).
- T. C. Theoharides, S. Asadi, S. Panagiotidou, Z.Weng, The “missing link” in autoimmunity and autism: Extracellular mitochondrial components secreted from activated live mast
cells. Autoimmun. Rev. 12, 1136–1142 (2013). - B. Gesundheit et al., Immunological and autoimmune considerations of autism spectrum disorders. J. Autoimmun. 44, 1–7 (2013).
- T. C. Theoharides, S. Asadi, A. B. Patel, Focal brain inflammation and autism. J. Neuroinflammation 10, 46 (2013).
- A. Angelidou et al., Perinatal stress, brain inflammation and risk of autism-review and proposal. BMC Pediatr. 12, 89 (2012).
- H. Hagberg, P. Gressens, C. Mallard, Inflammation during fetal and neonatal life: Implications for neurologic and neuropsychiatric disease in children and adults. Ann. Neurol. 71, 444–457 (2012).
- K. A. Jones, C. Thomsen, The role of the innate immune system in psychiatric disorders. Mol. Cell. Neurosci. 53, 52–62 (2013).
- A. Chavarria, J. Alcocer-Varela, Is damage in central nervous system due to inflammation? Autoimmun. Rev. 3, 251–260 (2004).
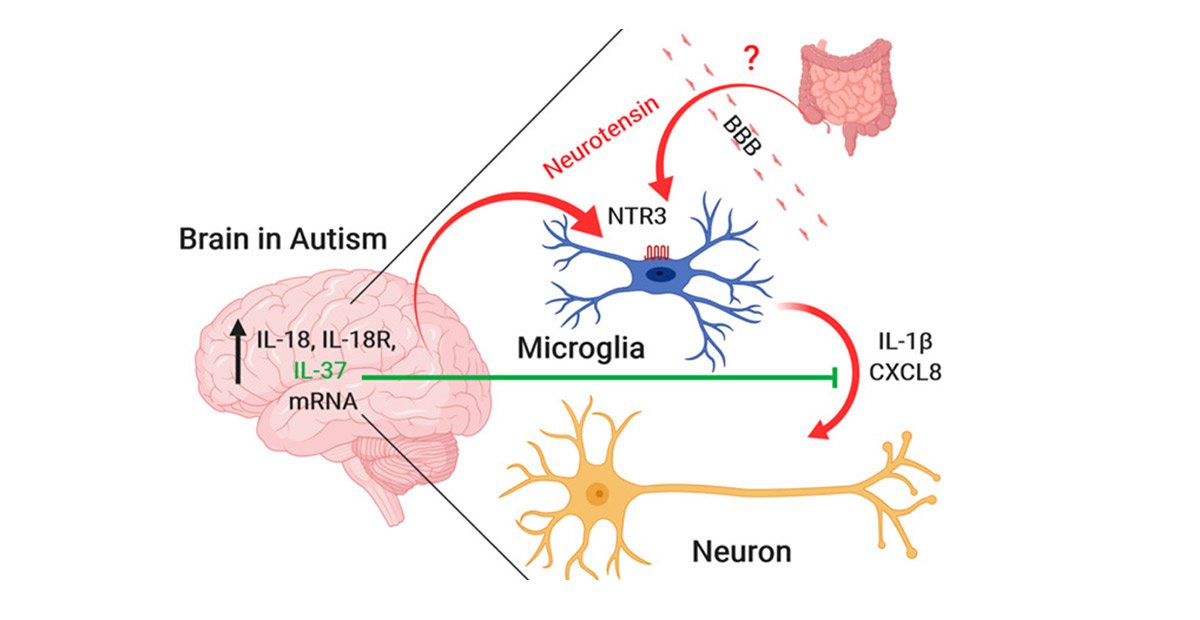
Fig. 6. Diagrammatic representation of the proposed
interactions and sites of action of IL-37. Increased expression
of IL-18 and IL-18R indicates inflammation in the amygdala and dorsolateral prefrontal cortex. Neurotensin released in these areas or entering the brain through the BBB stimulates microglia primarily in
the amygdala through activation of the NTR3/sortilin receptor. Activated microglia now exhibit abnormal synaptic pruning and secrete IL-1β and CXCL8, which contribute to focal inflammation resulting in direct neuronal damage and disrupted neuronal connectivity that contribute to the symptoms of ASD. IL-37 is increased in these brain areas in an effort to inhibit the
release of the proinflammatory molecules thus providing
a potential treatment option for ASD. - J. E. Le Belle et al., Maternal inflammation contributes to brain overgrowth and autism-associated behaviors through altered redox signaling in stem and progenitor cells. Stem Cell Reports 3, 725–734 (2014).
- A. W. Zimmerman et al., Cerebrospinal fluid and serum markers of inflammation in autism. Pediatr. Neurol. 33, 195–201 (2005).
- X. Li et al., Elevated immune response in the brain of autistic patients. J. Neuroimmunol. 207, 111–116 (2009).
- I. Tsilioni, A. Taliou, K. Francis, T. C. Theoharides, Children with autism spectrum disorders, who improved with a luteolin-containing dietary formulation, show reduced
serum levels of TNF and IL-6. Transl. Psychiatry 5, e647 (2015). - A. Angelidou et al., Neurotensin is increased in serum of young children with autistic disorder. J. Neuroinflammation 7, 48 (2010).
- I. Tsilioni et al., Elevated serum neurotensin and CRH levels in children with autistic spectrum disorders and tail-chasing Bull Terriers with a phenotype similar to autism.
Transl. Psychiatry 4, e466 (2014). - A. B. Patel, I. Tsilioni, S. E. Leeman, T. C. Theoharides, Neurotensin stimulates sortilin and mTOR in human microglia inhibitable by methoxyluteolin, a potential therapeutic
target for autism. Proc. Natl. Acad. Sci. U.S.A. 113, E7049–E7058 (2016). - S. Gupta et al., Transcriptome analysis reveals dysregulation of innate immune response genes and neuronal activity-dependent genes in autism. Nat. Commun. 5, 5748 (2014).
- R. Koyama, Y. Ikegaya, Microglia in the pathogenesis of autism spectrum disorders. Neurosci. Res. 100, 1–5 (2015).
- D. A. Rossignol, R. E. Frye, Evidence linking oxidative stress, mitochondrial dysfunction, and inflammation in the brain of individuals with autism. Front. Physiol. 5, 150 (2014).
- T. C. Theoharides, I. Tsilioni, A. B. Patel, R. Doyle, Atopic diseases and inflammation of the brain in the pathogenesis of autism spectrum disorders. Transl. Psychiatry 6, e844 (2016).
- C. A. Dinarello, The IL-1 family and inflammatory diseases. Clin. Exp. Rheumatol. 20 (suppl. 27), S1–S13 (2002).
- C. A. Dinarello, P. Bufler, Interleukin-37. Semin. Immunol. 25, 466–468 (2013).
- Al. Caraffa et al., New concepts in neuroinflammation: Mast cells pro-inflammatory and anti-inflammatory cytokine mediators. J. Biol. Regul. Homeost. Agents 32, 449–454 (2018).
- L. Tettamanti et al., IL-33 mediates allergy through mast cell activation: Potential inhibitory effect of certain cytokines. J. Biol. Regul. Homeost. Agents 32, 1061–1065 (2018).
- M. Zhao et al., IL-37 isoform D downregulates pro-inflammatory cytokines expression in a Smad3-dependent manner. Cell Death Dis. 9, 582 (2018).
- S. Li et al., Role for nuclear interleukin-37 in the suppression of innate immunity. Proc. Natl. Acad. Sci. U.S.A., 201821111 (2019).
- G. Cavalli, C. A. Dinarello, Suppression of inflammation and acquired immunity by IL-
- Immunol. Rev. 281, 179–190 (2018).
- S. Kumar et al., Interleukin-1F7B (IL-1H4/IL-1F7) is processed by caspase-1 and mature IL-1F7B binds to the IL-18 receptor but does not induce IFN-gamma production. Cytokine 18, 61–71 (2002).
- G. Pan et al., IL-1H, an interleukin 1-related protein that binds IL-18 receptor/IL-1Rrp. Cytokine 13, 1–7 (2001).
- H. Jia, J. Liu, B. Han, Reviews of interleukin-37: Functions, receptors, and roles in diseases. BioMed Res. Int. 2018, 3058640 (2018).
- P. Bufler et al., A complex of the IL-1 homologue IL-1F7b and IL-18-binding protein reduces IL-18 activity. Proc. Natl. Acad. Sci. U.S.A. 99, 13723–13728 (2002).
- G. Cavalli et al., Interleukin 37 reverses the metabolic cost of inflammation, increases oxidative respiration, and improves exercise tolerance. Proc. Natl. Acad. Sci. U.S.A.
114, 2313–2318 (2017). - C. A. Dinarello et al., Suppression of innate inflammation and immunity by interleukin-
- Eur. J. Immunol. 46, 1067–1081 (2016).
- S. Li et al., Extracellular forms of IL-37 inhibit innate inflammation in vitro and in vivo but require the IL-1 family decoy receptor IL-1R8. Proc. Natl. Acad. Sci. U.S.A. 112, 2497–2502 (2015).
- M. L. Bauman, T. L. Kemper, The neuropathology of the autism spectrum disorders: What have we learned? Novartis Found. Symp. 251, 112–122, discussion 122–128, 281–297 (2003).
- E. Bliss-Moreau, G.Moadab, A. Santistevan, D. G. Amaral, The effects of neonatal amygdala or hippocampus lesions on adult social behavior. Behav. Brain Res. 322, 123–137 (2017).
- L. K. Bicks, H. Koike, S. Akbarian, H. Morishita, Prefrontal cortex and social cognition in mouse and man. Front. Psychol. 6, 1805 (2015).
- R. M. Ransohoff, M. A. Brown, Innate immunity in the central nervous system. J. Clin.
Invest. 122, 1164–1171 (2012). - A. Aguzzi, B. A. Barres, M. L. Bennett, Microglia: Scapegoat, saboteur, or something else? Science 339, 156–161 (2013).
- J. I. Rodriguez, J. K. Kern, Evidence of microglial activation in autism and its possible role in brain underconnectivity. Neuron Glia Biol. 7, 205–213 (2011).
- T. Takano, Role ofmicroglia in autism: Recent advances. Dev. Neurosci. 37, 195–202 (2015).
- S. R. Zhang et al., IL-37 increases in patients after ischemic stroke and protects from inflammatory brain injury, motor impairment and lung infection in mice. Sci. Rep. 9, 6922 (2019).
- Y. C. Wang, G. P. Weng, J. P. Liu, L. Li, Q. H. Cheng, Elevated serum IL-37 concentrations in patients with sepsis. Medicine (Baltimore) 98, e14756 (2019).
- B. Chen et al., Interleukin-37 is increased in ankylosing spondylitis patients and associated with disease activity. J. Transl. Med. 13, 36 (2015).
- B. S. Layton, S. Lafontaine, L. P. Renaud, Connections of medial preoptic neurons with
the median eminence and amygdala. An electrophysiological study in the rat. Neuroendocrinology 33, 235–240 (1981). - G. K. Merzhanova, E. E. Dolbakyan, V. N. Khokhlova, Interactions between neurons in the amygdala and hypothalamus during conditioned reflex behavior involving choice
of reinforcement quality in cats. Neurosci. Behav. Physiol. 30, 695–702 (2000). - T. A. Avino et al., Neuron numbers increase in the human amygdala from birth to adulthood, but not in autism. Proc. Natl. Acad. Sci. U.S.A. 115, 3710–3715 (2018).
- J. R. Parratt, R. M. Sturgess, The possible roles of histamine, 5-hydroxytryptamine and prostaglandin F2alpha as mediators of the acute pulmonary effects of endotoxin. Br. J.
Pharmacol. 60, 209–219 (1977). - E. Bondarenko, D. M. Hodgson, E. Nalivaiko, Amygdala mediates respiratory responses to sudden arousing stimuli and to restraint stress in rats. Am. J. Physiol. Regul.
Integr. Comp. Physiol. 306, R951–R959 (2014). - P. Ashwood et al., Elevated plasma cytokines in autism spectrum disorders provide evidence of immune dysfunction and are associated with impaired behavioral outcome.
Brain Behav. Immun. 25, 40–45 (2011). - P. Krakowiak et al., Neonatal cytokine profiles associated with autism spectrum disorder. Biol. Psychiatry 81, 442–451 (2015).
- I. Rudloff et al., Monocytes and dendritic cells are the primary sources of interleukin 37 in human immune cells. J. Leukoc. Biol. 101, 901–911 (2017).
- M. F. Nold et al., IL-37 is a fundamental inhibitor of innate immunity. Nat. Immunol. 11, 1014–1022 (2010).
- A. Abulkhir et al., A protective role of IL-37 in cancer: A new hope for cancer patients. J. Leukoc. Biol. 101, 395–406 (2017).
- G. Cavalli et al., Treating experimental arthritis with the innate immune inhibitor interleukin-37 reduces joint and systemic inflammation. Rheumatology (Oxford) 55,
2220–2229 (2016). - L. Ye et al., IL-37 inhibits the production of inflammatory cytokines in peripheral blood mononuclear cells of patients with systemic lupus erythematosus: Its correlation
with disease activity. J. Transl. Med. 12, 69 (2014). - Y. Li et al., Increased expression of IL-37 in patients with Graves’ disease and its contribution to suppression of proinflammatory cytokines production in peripheral
blood mononuclear cells. PLoS One 9, e107183 (2014). - L. Ye et al., IL-37 alleviates rheumatoid arthritis by suppressing IL-17 and IL-17-triggering cytokine production and limiting Th17 cell proliferation. J. Immunol. 194,
5110–5119 (2015). - E. Z. Eisenmesser et al., Interleukin-37 monomer is the active form for reducing innate immunity. Proc. Natl. Acad. Sci. U.S.A. 116, 5514–5522 (2019).
- A. M. Ellisdon et al., Homodimerization attenuates the anti-inflammatory activity of interleukin-37. Sci. Immunol. 2, eaaj1548 (2017).
- T. T. Li et al., IL-37 induces autophagy in hepatocellular carcinoma cells by inhibiting the PI3K/AKT/mTOR pathway. Mol. Immunol. 87, 132–140 (2017).
- S. Moretti et al., IL-37 inhibits inflammasome activation and disease severity in murine aspergillosis. PLoS Pathog. 10, e1004462 (2014).
- N. Zsürger, J. Chabry, A. Coquerel, J. P. Vincent, Ontogenesis and binding properties of high-affinity neurotensin receptors in human brain. Brain Res. 586, 303–310 (1992).
- T. A. Lantos, M. Palkovits, W. Rostène, A. Bérod, Neurotensin receptors in the human amygdaloid complex. Topographical and quantitative autoradiographic study. J.
Chem. Neuroanat. 11, 209–217 (1996). - S. Martin, J. P. Vincent, J. Mazella, Involvement of the neurotensin receptor-3 in the neurotensin-induced migration of human microglia. J. Neurosci. 23, 1198–1205 (2003).
- M. Careaga, T. Murai, M. D. Bauman, Maternal immune activation and autism spectrum disorder: Fromrodents to nonhuman and human primates. Biol. Psychiatry 81, 391–401 (2017).
- B. Ruggeri, U. Sarkans, G. Schumann, A. M. Persico, Biomarkers in autism spectrum disorder: The old and the new. Psychopharmacology (Berl.) 231, 1201–1216 (2014).
- T. C. Theoharides, R. Doyle, K. Francis, P. Conti, D. Kalogeromitros, Novel therapeutic targets for autism. Trends Pharmacol. Sci. 29, 375–382 (2008).
- R. Carraway, S. E. Leeman, The isolation of a new hypotensive peptide, neurotensin, from bovine hypothalami. J. Biol. Chem. 248, 6854–6861 (1973).
- T. D. Schmittgen, K. J. Livak, Analyzing real-time PCR data by the comparative C(T) method. Nat. Protoc. 3, 1101–1108 (2008).
- K. C. Sonntag et al., Limited predictability of postmortem human brain tissue quality
by RNA integrity numbers. J. Neurochem. 138, 53–59 (2016). - M. Fountoulakis, R. Hardmeier, H. Höger, G. Lubec, Postmortem changes in the level of brain proteins. Exp. Neurol. 167, 86–94 (2001).
- R. E. McCullumsmith, J. H. Hammond, D. Shan, J. H. Meador-Woodruff, Postmortem
brain: An underutilized substrate for studying severe mental illness. Neuropsychopharmacology 39, 65–87 (2014). - I. Tsilioni, T. C. Theoharides, Extracellular vesicles are increased in the serum of children with autism spectrum disorder, contain mitochondrial DNA, and stimulate human
microglia to secrete IL-1β. J. Neuroinflammation 15, 239 (2018). - A. B. Patel, T. C. Theoharides, Methoxyluteolin inhibits neuropeptide-stimulated proinflammatory mediator release via mTOR activation