Vaccines 2022, Association of Cerebral Venous Thrombosis with mRNA COVID-19 Vaccines: A Disproportionality Analysis of the World Health Organization Pharmacovigilance Database https://doi.org/10.3390/vaccines10050799

La trombosis venosa cerebral (TVC) es la condición de coagulación de la sangre, que puede causar un daño neurológico grave y está significativamente asociada con la vacunación contra el covid-19 de ARNm, según demostró un estudio importante en la revista médica Vaccines .
El equipo de investigación analizó 1.154.023 informes de eventos adversos de más de 130 países registrados en VigiBase, la base de datos global de la Organización Mundial de la Salud, y encontró una «señal de seguridad potencial para la aparición de CVT después de la vacunación con ARNm de COVID-19».
Los autores señalan que muchos informes se produjeron en personas más jóvenes y las condiciones eran graves: «Las TVC se informaron comúnmente en pacientes de 18 a 44 años y de 45 a 64 años, con mayor frecuencia en mujeres, y principalmente en Europa y América… Más del 90% de los los pacientes estaban en estado grave, y el 33% no se recuperó o murió”.
Los investigadores tienen en cuenta el subregistro para producir estimaciones de un mayor riesgo por encima de una línea de base: alrededor de 3,5 veces mayor riesgo para las inyecciones de ARNm y siete veces mayor riesgo para AstraZeneca. Esto significa que el riesgo de CVT de las inyecciones de ARNm, es alto tambien, y la de AstraZeneca es aún peor.
Video: entrevista al Dr Richard Urso sobre la distribución de las nanoparticulas en todo el cuerpo
TRADUCCION: Una vacuna normal permanece en el brazo, más o menos… 99,9 por ciento. Una nanopartícula lipídica (de una inyección de ARNm) necesita abrir una puerta para salir. Una gran mayoría de las nanopartículas lipídicas no se quedan en el brazo. De hecho, ahora sabemos que una gran parte va al ganglio linfático justo debajo de aquí y sigue produciendo proteína pico 60 días después. … Eso debería haberse analizado mucho antes de que saliera este producto (inyecciones de ARNm COVID-19). Nunca le dijeron a la gente que, oye, lo que inyectamos en el brazo… aparecerá en tu ganglio linfático, aparecerá en tu cerebro, aparecerá en tus ovarios, en tu médula ósea. , sus glándulas suprarrenales, su hígado, su bazo, que luego seguirá a través del nervio vago e irá a sus ganglios basales…
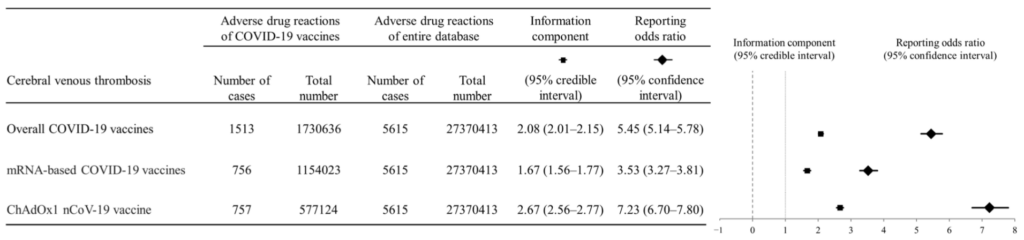
También descubrieron que la CVT después de la vacunación con ARNm es solo alrededor de un tercio de la mortalidad que sigue a la vacunación con AstraZeneca. Esto significa que las vacunas de ARNm conducen a CVT mortal alrededor de una sexta parte que AstraZeneca, lo que puede explicar por qué la condición está particularmente asociada con la inyección de AstraZeneca aunque las otras también son peligrosas.
Los investigadores citan estudios anteriores para sugerir que el mecanismo se relaciona con la unión de la proteína espiga, o pico (spike) a la pared de los vasos sanguíneos, particularmente en el cerebro, y la activación de los mecanismos de coagulación. El estudio de biodistribución japones de Pfizer demuestra que se han encontrado nanopartículas lipídicas de la inyección en todos los órganos del cuerpo (posiblemente transportadas por la linfa), principalmente en los ovarios. Entonces, no, no se quedan localizados en el lugar de la inyección, como nos han asegurado.
Los fabricantes de inyecciones dijeron que la proteína Spike podría sobrevivir en el cuerpo humano durante unos seis meses. Una investigación más reciente encontró que la proteína espiga persistió en pacientes recuperados de COVID durante 15 meses .
La proteína pico (Spike) tiene un efecto inflamatorio sobre las células endoteliales del cerebro , alterando la función de la barrera hematoencefálica, permitiéndoles cruzar más fácilmente.
Estos estudios sugirieron que las ocurrencias de CVT relacionadas con las inyecciones COVID-19 basadas en ARNm pueden deberse a la disfunción endotelial causada por las interacciones de la glucoproteína pico con las células endoteliales que dan como resultado la inmunotrombosis. Si la glicoproteína pico de las inyecciones COVID-19 basadas en ARNm se une al receptor de la enzima convertidora de angiotensina 2, varias moléculas inflamatorias y trombogénicas, como factores quimiotácticos de leucocitos, moléculas de adhesión celular (molécula de adhesión celular vascular 1 y molécula de adhesión intercelular 1), y citocinas procoagulantes, pueden activarse. Este mecanismo puede causar disfunción endotelial, particularmente en las células endoteliales del cerebro, lo que podría contribuir a una alteración significativa de la integridad de la barrera endotelial del cerebro y, en última instancia, promover la formación de trombos.
Además, un estudio anterior sugirió que la glicoproteína pico puede inducir la agregación y activación de plaquetas y, finalmente, provocar la formación de trombos. Aunque no se ha establecido claramente el período de tiempo en el que persiste la glucoproteína del pico, varios estudios han sugerido que puede durar semanas.
Por lo tanto, la activación de plaquetas relacionada con la glicoproteína de pico provocada por las vacunas COVID-19 basadas en ARNm podría explicar la tendencia de las ocurrencias de CVT después de las vacunas COVID-19 basadas en ARNm.
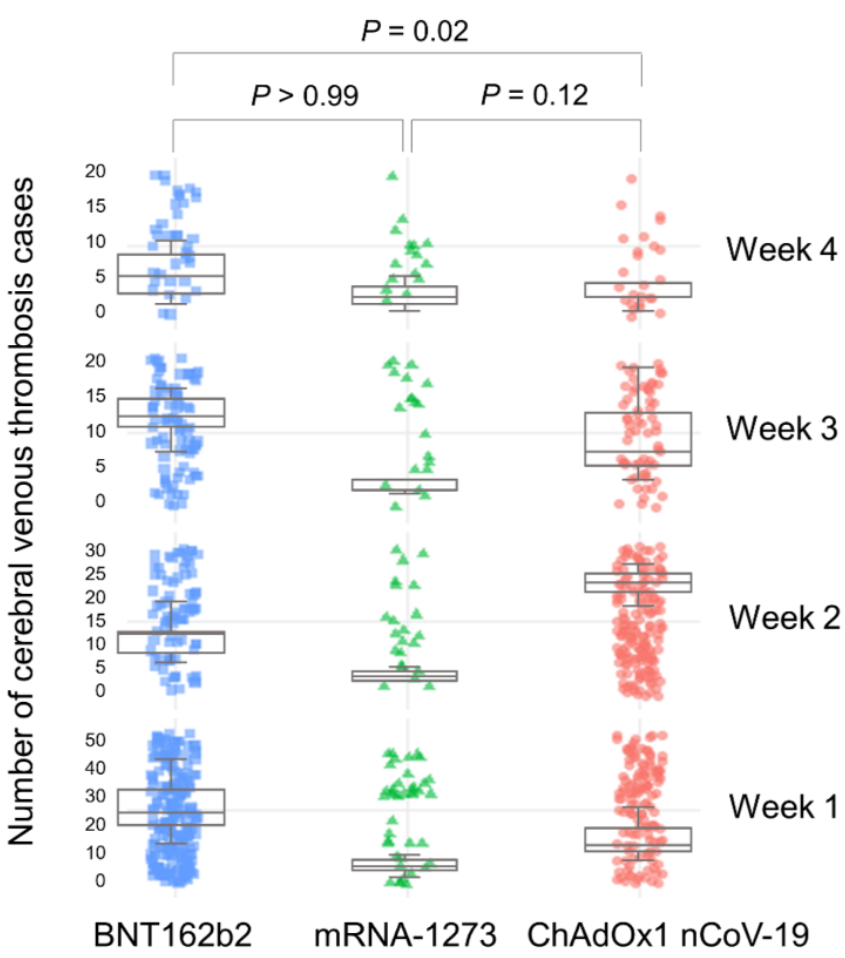
Además, en línea con estos informes de casos anteriores, nuestros resultados mostraron que la CVT se produjo principalmente a las pocas semanas de las vacunas COVID-19 basadas en ARNm.
Aquí está el resumen del estudio, que resume los hallazgos.
Se ha informado trombosis venosa cerebral (TVC), un evento trombótico raro que puede causar déficits neurológicos graves, después de inyecciones ChAdOx1 [AstraZeneca] nCoV-19 contra coronavirus 2019. Analizamos retrospectivamente la ocurrencia de TVC, el tiempo de inicio después de la vacunación, los resultados (recuperados/no recuperados) y la muerte después de la vacunación con COVID-19 a partir de los informes de reacciones adversas a medicamentos (ADR) en VigiBase. Se realizó un análisis de desproporcionalidad con respecto a las inyecciones de ARNm de COVID-19 (BNT162b2 [Pfizer] y mRNA-1273 [Moderna]) y la vacuna ChAdOx1 nCoV-19. Identificamos 756 (0,07 %) casos de TVC (620 (0,05 %) después de BNT162b2 y 136 (0,01 %) después de mRNA-1273) de 1 154 023 RAM relacionadas con la inyección de ARNm.
Menos pacientes con TVC murieron después de recibir inyecciones de ARNm que después de recibir la inyección ChAdOx1 nCoV-19 (odds ratio, 0,32; IC 95 %, 0,22–0,45; p < 0,001). Observamos una posible señal de seguridad para la aparición de CVT después de la inyección con ARNm de COVID-19. Por lo tanto, es necesaria la conciencia sobre el riesgo de CVT, incluso después de la vacunación con ARNm de COVID-19.
La asociación de reacciones adversas de coagulación sanguínea con vacunas de vectores de adenovirus como AstraZeneca y Johnson and Johnson ha llevado a que se restrinjan o retiren en muchos países, más recientemente por la FDA de EE. UU . El tratamiento con estos dos tipos de inyecciones no es sostenible.
El estudio realizado por un equipo de investigadores de las agencias de salud de esos países, publicado en el Journal of the American Medical Association, JAMA, identificó 1077 “eventos incidentes de miocarditis” y 1149 “eventos incidentes de pericarditis” entre 23.122.522 residentes nórdicos (81 % de los cuales fueron vacunados al final del estudio; 50,2% de los cuales eran mujeres). “Dentro del período de 28 días, para hombres y mujeres de 12 años o más combinados que recibieron un programa homólogo, la segunda dosis se asoció con un mayor riesgo de miocarditis”.
“Este estudio de cohorte de 23,1 millones de residentes en 4 países nórdicos mostró tasas más altas de miocarditis y pericarditis dentro de los 28 días posteriores a la vacunación con las inyecciones de ARNm del SARS-CoV-2 en comparación con la no vacunación” Hay riesgo 5 veces mayor después de Comirnaty [Pfizer] y uno 15 veces mayor con Spikevax [Moderna] en comparación con los no vacunados.
¿Que consecuencias puede haber con la donación de sangre?
Referencias
- Chang, Y.; Jeon, J.; Song, T.J.; Kim, J. Association between the fatty liver index and the risk of severe complications in COVID-19 patients: A nationwide retrospective cohort study. BMC Infect. Dis. 2022, 22, 384. [Google Scholar] [CrossRef] [PubMed]
- Yoo, J.; Kim, J.H.; Jeon, J.; Kim, J.; Song, T.J. Risk of COVID-19 Infection and of Severe Complications Among People with Epilepsy: A Nationwide Cohort Study. Neurology 2022, 98, e1886–e1892. [Google Scholar] [CrossRef] [PubMed]
- Chung, S.J.; Chang, Y.; Jeon, J.; Shin, J.I.; Song, T.J.; Kim, J. Association of Alzheimer’s Disease with COVID-19 Susceptibility and Severe Complications: A Nationwide Cohort Study. J. Alzheimer’s Dis. 2022, 87, 701–710. [Google Scholar] [CrossRef] [PubMed]
- Kim, H.J.; Park, M.S.; Shin, J.I.; Park, J.; Kim, D.H.; Jeon, J.; Kim, J.; Song, T.J. Associations of heart failure with susceptibility and severe complications of COVID-19: A nationwide cohort study. J. Med. Virol. 2021, 94, 1138–1145. [Google Scholar] [CrossRef] [PubMed]
- Park, J.; Shin, J.I.; Kim, D.H.; Park, J.; Jeon, J.; Kim, J.; Song, T.J. Association of atrial fibrillation with infectivity and severe complications of COVID-19: A nationwide cohort study. J. Med. Virol. 2022, 94, 2422–2430. [Google Scholar] [CrossRef]
- Omer, S.B.; Yildirim, I.; Forman, H.P. Herd Immunity and Implications for SARS-CoV-2 Control. JAMA 2020, 324, 2095–2096. [Google Scholar] [CrossRef]
- Márquez Loza, A.M.; Holroyd, K.B.; Johnson, S.A.; Pilgrim, D.M.; Amato, A.A. Guillain-Barré Syndrome in the Placebo and Active Arms of a COVID-19 Vaccine Clinical Trial: Temporal Associations Do Not Imply Causality. Neurology 2021, 96, 1052–1054. [Google Scholar] [CrossRef]
- Pascual-Iglesias, A.; Canton, J.; Ortega-Prieto, A.M.; Jimenez-Guardeño, J.M.; Regla-Nava, J.A. An Overview of Vaccines against SARS-CoV-2 in the COVID-19 Pandemic Era. Pathogens 2021, 10, 1030. [Google Scholar] [CrossRef]
- Voysey, M.; Clemens, S.A.C.; Madhi, S.A.; Weckx, L.Y.; Folegatti, P.M.; Aley, P.K.; Angus, B.; Baillie, V.L.; Barnabas, S.L.; Bhorat, Q.E.; et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: An interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 2021, 397, 99–111. [Google Scholar] [CrossRef]
- Anand, P.; Stahel, V.P. The safety of Covid-19 mRNA vaccines: A review. Patient Saf. Surg. 2021, 15, 20. [Google Scholar] [CrossRef]
- Schultz, N.H.; Sorvoll, I.H.; Michelsen, A.E.; Munthe, L.A.; Lund-Johansen, F.; Ahlen, M.T.; Wiedmann, M.; Aamodt, A.H.; Skattor, T.H.; Tjonnfjord, G.E.; et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. N. Engl. J. Med. 2021, 384, 2124–2130. [Google Scholar] [CrossRef]
- Hippisley-Cox, J.; Patone, M.; Mei, X.W.; Saatci, D.; Dixon, S.; Khunti, K.; Zaccardi, F.; Watkinson, P.; Shankar-Hari, M.; Doidge, J.; et al. Risk of thrombocytopenia and thromboembolism after covid-19 vaccination and SARS-CoV-2 positive testing: Self-controlled case series study. BMJ 2021, 374, n1931. [Google Scholar] [CrossRef] [PubMed]
- Scully, M.; Singh, D.; Lown, R.; Poles, A.; Solomon, T.; Levi, M.; Goldblatt, D.; Kotoucek, P.; Thomas, W.; Lester, W. Pathologic Antibodies to Platelet Factor 4 after ChAdOx1 nCoV-19 Vaccination. N. Engl. J. Med. 2021, 384, 2202–2211. [Google Scholar] [CrossRef]
- Stam, J. Thrombosis of the cerebral veins and sinuses. N. Engl. J. Med. 2005, 352, 1791–1798. [Google Scholar] [CrossRef]
- De Gregorio, C.; Colarusso, L.; Calcaterra, G.; Bassareo, P.P.; Ieni, A.; Mazzeo, A.T.; Ferrazzo, G.; Noto, A.; Koniari, I.; Mehta, J.L.; et al. Cerebral Venous Sinus Thrombosis following COVID-19 Vaccination: Analysis of 552 Worldwide Cases. Vaccines 2022, 10, 232. [Google Scholar] [CrossRef] [PubMed]
- Aladdin, Y.; Algahtani, H.; Shirah, B. Vaccine-Induced Immune Thrombotic Thrombocytopenia with Disseminated Intravascular Coagulation and Death following the ChAdOx1 nCoV-19 Vaccine. J. Stroke Cerebrovasc. Dis. 2021, 30, 105938. [Google Scholar] [CrossRef]
- Dias, L.; Soares-Dos-Reis, R.; Meira, J.; Ferrão, D.; Soares, P.R.; Pastor, A.; Gama, G.; Fonseca, L.; Fagundes, V.; Carvalho, M. Cerebral Venous Thrombosis after BNT162b2 mRNA SARS-CoV-2 vaccine. J. Stroke Cerebrovasc. Dis. 2021, 30, 105906. [Google Scholar] [CrossRef] [PubMed]
- Schulz, J.B.; Berlit, P.; Diener, H.-C.; Gerloff, C.; Greinacher, A.; Klein, C.; Petzold, G.C.; Piccininni, M.; Poli, S.; Röhrig, R.; et al. COVID-19 Vaccine-Associated Cerebral Venous Thrombosis in Germany. Ann. Neurol. 2021, 90, 627–639. [Google Scholar] [CrossRef]
- Greinacher, A.; Thiele, T.; Warkentin, T.E.; Weisser, K.; Kyrle, P.A.; Eichinger, S. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N. Engl. J. Med. 2021, 384, 2092–2101. [Google Scholar] [CrossRef]
- Al-Mayhani, T.; Saber, S.; Stubbs, M.J.; Losseff, N.A.; Perry, R.J.; Simister, R.J.; Gull, D.; Jäger, H.R.; Scully, M.A.; Werring, D.J. Ischaemic stroke as a presenting feature of ChAdOx1 nCoV-19 vaccine-induced immune thrombotic thrombocytopenia. J. Neurol. Neurosurg. Psychiatry 2021, 92, 1247–1248. [Google Scholar] [CrossRef]
- Lindquist, M. VigiBase, the WHO Global ICSR Database System: Basic Facts. Drug Inf. J. 2008, 42, 409–419. [Google Scholar] [CrossRef]
- Brown, E.G.; Wood, L.; Wood, S. The medical dictionary for regulatory activities (MedDRA). Drug Saf. 1999, 20, 109–117. [Google Scholar] [CrossRef] [PubMed]
- Salem, J.E.; Manouchehri, A.; Bretagne, M.; Lebrun-Vignes, B.; Groarke, J.D.; Johnson, D.B.; Yang, T.; Reddy, N.M.; Funck-Brentano, C.; Brown, J.R.; et al. Cardiovascular Toxicities Associated with Ibrutinib. J. Am. Coll Cardiol 2019, 74, 1667–1678. [Google Scholar] [CrossRef]
- Salem, J.E.; Manouchehri, A.; Moey, M.; Lebrun-Vignes, B.; Bastarache, L.; Pariente, A.; Gobert, A.; Spano, J.P.; Balko, J.M.; Bonaca, M.P.; et al. Cardiovascular toxicities associated with immune checkpoint inhibitors: An observational, retrospective, pharmacovigilance study. Lancet Oncol. 2018, 19, 1579–1589. [Google Scholar] [CrossRef]
- Norén, G.N.; Hopstadius, J.; Bate, A. Shrinkage observed-to-expected ratios for robust and transparent large-scale pattern discovery. Stat. Methods Med. Res. 2013, 22, 57–69. [Google Scholar] [CrossRef] [PubMed]
- Rothman, K.J.; Lanes, S.; Sacks, S.T. The reporting odds ratio and its advantages over the proportional reporting ratio. Pharmacoepidemiol. Drug Saf. 2004, 13, 519–523. [Google Scholar] [CrossRef] [PubMed]
- De Bruin, M.L.; Pettersson, M.; Meyboom, R.H.B.; Hoes, A.W.; Leufkens, H.G.M. Anti-HERG activity and the risk of drug-induced arrhythmias and sudden death. Eur. Heart J. 2005, 26, 590–597. [Google Scholar] [CrossRef]
- Fan, B.E.; Shen, J.Y.; Lim, X.R.; Tu, T.M.; Chang, C.C.R.; Khin, H.S.W.; Koh, J.S.; Rao, J.P.; Lau, S.L.; Tan, G.B.; et al. Cerebral venous thrombosis post BNT162b2 mRNA SARS-CoV-2 vaccination: A black swan event. Am. J. Hematol. 2021, 96, E357–E361. [Google Scholar] [CrossRef]
- Buzhdygan, T.P.; DeOre, B.J.; Baldwin-Leclair, A.; Bullock, T.A.; McGary, H.M.; Khan, J.A.; Razmpour, R.; Hale, J.F.; Galie, P.A.; Potula, R.; et al. The SARS-CoV-2 spike protein alters barrier function in 2D static and 3D microfluidic in-vitro models of the human blood-brain barrier. Neurobiol. Dis. 2020, 146, 105131. [Google Scholar] [CrossRef]
- Zhang, S.; Liu, Y.; Wang, X.; Yang, L.; Li, H.; Wang, Y.; Liu, M.; Zhao, X.; Xie, Y.; Yang, Y.; et al. SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19. J. Hematol. Oncol. 2020, 13, 120. [Google Scholar] [CrossRef]
- Probst, J.; Weide, B.; Scheel, B.; Pichler, B.J.; Hoerr, I.; Rammensee, H.G.; Pascolo, S. Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent. Gene Ther. 2007, 14, 1175–1180. [Google Scholar] [CrossRef] [PubMed]
- Taquet, M.; Husain, M.; Geddes, J.R.; Luciano, S.; Harrison, P.J. Cerebral venous thrombosis and portal vein thrombosis: A retrospective cohort study of 537,913 COVID-19 cases. eClinicalMedicine 2021, 39, 101061. [Google Scholar] [CrossRef] [PubMed]
- Perry, R.J.; Tamborska, A.; Singh, B.; Craven, B.; Marigold, R.; Arthur-Farraj, P.; Yeo, J.M.; Zhang, L.; Hassan-Smith, G.; Jones, M.; et al. Cerebral venous thrombosis after vaccination against COVID-19 in the UK: A multicentre cohort study. Lancet 2021, 398, 1147–1156. [Google Scholar] [CrossRef]
- Ramasamy, M.N.; Minassian, A.M.; Ewer, K.J.; Flaxman, A.L.; Folegatti, P.M.; Owens, D.R.; Voysey, M.; Aley, P.K.; Angus, B.; Babbage, G.; et al. Safety and immunogenicity of ChAdOx1 nCoV-19 vaccine administered in a prime-boost regimen in young and old adults (COV002): A single-blind, randomised, controlled, phase 2/3 trial. Lancet 2021, 396, 1979–1993. [Google Scholar] [CrossRef]
- Greinacher, A.; Selleng, K.; Warkentin, T.E. Autoimmune heparin-induced thrombocytopenia. J. Thromb. Haemost. 2017, 15, 2099–2114. [Google Scholar] [CrossRef]
- Østergaard, S.D.; Schmidt, M.; Horváth-Puhó, E.; Thomsen, R.W.; Sørensen, H.T. Thromboembolism and the Oxford-AstraZeneca COVID-19 vaccine: Side-effect or coincidence? Lancet 2021, 397, 1441–1443. [Google Scholar] [CrossRef]
- European Medicines Agency. COVID-19 Vaccine AstraZeneca: Benefits Still Outweigh the Risks despite Possible Link to Rare Blood Clots with Low Platelets. 2021. Available online: https://www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-benefits-still-outweigh-risks-despite-possible-link-rare-blood-clots (accessed on 29 April 2021).
- Lord, J.M. The effect of ageing of the immune system on vaccination responses. Hum. Vaccines Immunother. 2013, 9, 1364–1367. [Google Scholar] [CrossRef]
- Gustafson, C.E.; Kim, C.; Weyand, C.M.; Goronzy, J.J. Influence of immune aging on vaccine responses. J. Allergy Clin. Immunol. 2020, 145, 1309–1321. [Google Scholar] [CrossRef]
- Jackson, L.A.; Anderson, E.J.; Rouphael, N.G.; Roberts, P.C.; Makhene, M.; Coler, R.N.; McCullough, M.P.; Chappell, J.D.; Denison, M.R.; Stevens, L.J.; et al. An mRNA Vaccine against SARS-CoV-2—Preliminary Report. N. Engl. J. Med. 2020, 383, 1920–1931. [Google Scholar] [CrossRef]
- Walsh, E.E.; Frenck, R.W., Jr.; Falsey, A.R.; Kitchin, N.; Absalon, J.; Gurtman, A.; Lockhart, S.; Neuzil, K.; Mulligan, M.J.; Bailey, R.; et al. Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. N. Engl. J. Med. 2020, 383, 2439–2450. [Google Scholar] [CrossRef]
- Warkentin, T.E.; Greinacher, A. Heparin-induced thrombocytopenia: Recognition, treatment, and prevention: The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004, 126, 311S–337S. [Google Scholar] [CrossRef] [PubMed]
- Pavord, S.; Scully, M.; Hunt, B.J.; Lester, W.; Bagot, C.; Craven, B.; Rampotas, A.; Ambler, G.; Makris, M. Clinical Features of Vaccine-Induced Immune Thrombocytopenia and Thrombosis. N. Engl. J. Med. 2021, 385, 1680–1689. [Google Scholar] [CrossRef] [PubMed]
- Steensels, D.; Pierlet, N.; Penders, J.; Mesotten, D.; Heylen, L. Comparison of SARS-CoV-2 Antibody Response Following Vaccination With BNT162b2 and mRNA-1273. JAMA 2021, 326, 1533–1535. [Google Scholar] [CrossRef] [PubMed]
- Wang, L.; Davis, P.B.; Kaelber, D.C.; Volkow, N.D.; Xu, R. Comparison of mRNA-1273 and BNT162b2 Vaccines on Breakthrough SARS-CoV-2 Infections, Hospitalizations, and Death During the Delta-Predominant Period. JAMA 2022, 327, 678–680. [Google Scholar] [CrossRef] [PubMed]
- Hwang, J.; Park, S.H.; Lee, S.W.; Lee, S.B.; Lee, M.H.; Jeong, G.H.; Kim, M.S.; Kim, J.Y.; Koyanagi, A.; Jacob, L.; et al. Predictors of mortality in thrombotic thrombocytopenia after adenoviral COVID-19 vaccination: The FAPIC score. Eur. Heart J. 2021, 42, 4053–4063. [Google Scholar] [CrossRef]