Por Stephanie Seneff, Ph.D – Versión en inglés

Stephanie Seneff, Ph.D., científica investigadora principal del Laboratorio de Ciencias de la Computación e Inteligencia Artificial del MIT en Cambridge, Massachusetts, dijo a Fox News que vacunar a los jóvenes contra el COVID puede causar enfermedades neurodegenerativas graves, como el Parkinson y el Alzheimer.
Darles a los jóvenes inyecciones contra el COVID probablemente causará un “aumento alarmante en varias enfermedades neurodegenerativas importantes”, Stephanie Seneff, Ph.D.
Los jóvenes tienen un «riesgo muy bajo» de morir a causa del virus, dijo Seneff.
“Cuando observa el daño potencial de estas vacunas, simplemente no tiene ningún sentido”, “Y los refuerzos repetidos van a ser muy devastadores a largo plazo”.
Seneff le dijo a Laura Ingraham de Fox News que ha investigado mucho para ayudarla a comprender cómo las vacunas COVID pueden conducir a enfermedades neurodegenerativas más adelante en la vida.
Las inyecciones K0 B1T podrían causar enfermedades neurodegenerativas como el Parkinson y el Alzheimer en jóvenes. Stephanie Seneff, Ph.D https://www.bitchute.com/video/attvJSVBE4a1/ , Colabore con nosotros para que podamos subtitular este video…
Según la investigación de Seneff :
“Tanto las vacunas de ARNm como las vacunas de vector de ADN pueden ser un camino hacia una enfermedad incapacitante en el futuro. A través de la acción similar a la de los priones de la proteína espiga, es probable que veamos un aumento alarmante en varias enfermedades neurodegenerativas importantes, como la enfermedad de Parkinson, la ERC, la ELA y el Alzheimer, y estas enfermedades aparecerán con una prevalencia cada vez mayor entre las poblaciones cada vez más jóvenes, en los próximos años.
“Desafortunadamente, no sabremos si las inyecciones causaron este aumento porque, por lo general, habrá una separación prolongada entre el evento de vacunación y el diagnóstico de la enfermedad”.
Ese último punto, dijo Seneff, es “muy conveniente para los fabricantes de vacunas, que pueden obtener grandes ganancias con nuestras desgracias, tanto por la venta de las vacunas como por el gran costo médico del tratamiento de todas estas enfermedades debilitantes”. 58.002 Muertes y 4.278.046 Efectos Adversos por la inyección K0 B1T reportados en Europa y EE.UU al 7 de enero del 2022.
Paso a Paso en el desarrollo de las inyecciones
Operation Warp Speed lanzó al mercado en los Estados Unidos dos vacunas de ARNm, producidas por Pfizer y Moderna. Los datos provisionales sugirieron una alta eficacia para ambas vacunas, lo que ayudó a legitimar la Autorización de uso de emergencia (EUA) de la FDA. Sin embargo, el movimiento excepcionalmente rápido de estas vacunas a través de ensayos controlados y al despliegue masivo plantea múltiples preocupaciones de seguridad. En esta revisión, primero describimos en detalle la tecnología subyacente a estas vacunas. Luego revisamos ambos componentes y la respuesta biológica prevista a estas vacunas, incluida la producción de la proteína de pico en sí, y su posible relación con una amplia gama de patologías inducidas tanto agudas como a largo plazo, como trastornos sanguíneos, enfermedades neurodegenerativas y autoinmunes. enfermedades. Entre estas posibles patologías inducidas, discutimos la relevancia de las secuencias de aminoácidos relacionadas con la proteína priónica dentro de la proteína espiga.
También presentamos una breve revisión de los estudios que apoyan el potencial de la «eliminación» de la proteína de pico, la transmisión de la proteína de una persona vacunada a una no vacunada, lo que resulta en síntomas inducidos en esta última. Terminamos abordando un punto común de debate, a saber, si estas vacunas podrían modificar o no el ADN de quienes reciben la vacuna. Si bien no hay estudios que demuestren definitivamente que esto está sucediendo, proporcionamos un escenario plausible, respaldado por vías previamente establecidas para la transformación y transporte de material genético, mediante el cual el ARNm inyectado podría finalmente incorporarse al ADN de las células germinales para la transmisión transgeneracional. Concluimos con nuestras recomendaciones con respecto a la vigilancia que ayudarán a aclarar los efectos a largo plazo de estos fármacos experimentales y nos permitirán evaluar mejor la verdadera relación riesgo / beneficio de estas nuevas tecnologías.
Introduction
La expresión sin precedentes ha definido mucho el año 2020 y la pandemia relacionada con el SARS-CoV-2. Además de una enfermedad sin precedentes y su respuesta global, COVID-19 también inició un proceso sin precedentes de investigación, producción, prueba y distribución pública de vacunas (Shaw,2021). El sentido de urgencia en torno a combatir el virus llevó a la creación, en marzo de 2020, de Operation Warp Speed (OWS), el programa del entonces presidente Donald Trump para llevar al mercado una vacuna contra COVID-19 lo más rápido posible (Jacobs y Armstrong, 2020).
La Operation Warp Speed (OWS) estableció algunos aspectos más sin precedentes de COVID-19. En primer lugar, puso al Departamento de Defensa de EE. UU. en colaboración directa con los departamentos de salud de EE. UU. Con respecto a la distribución de vacunas (Bonsell, 2021). En segundo lugar, los Institutos Nacionales de Salud (NIH) colaboraron con la empresa de biotecnología Moderna para llevar al mercado un tipo de vacuna sin precedentes contra las enfermedades infecciosas, que utiliza una tecnología basada en ARN mensajero (ARNm) (Institutos Nacionales de Salud, 2020).
Muchos aspectos de Covid-19 y el desarrollo posterior de la vacuna no tienen precedentes para una vacuna implementada para su uso en la población general. Algunos de estos incluyen lo siguiente.
- 1. Primero en usar PEG (polietilenglicol) en una inyección (ver texto)
- 2. Utilizar la tecnología de la vacuna de ARNm contra un agente infeccioso
- 3. Es la primera vez que Moderna lanza un producto al mercado.
- 4. Primera vez que los funcionarios de salud pública les digan a los que reciben la vacuna que esperen una reacción adversa.
- 5. Primera vez en implementarse públicamente con nada más que datos preliminares de eficacia (ver texto)
- 6. Primera vez que una «vacuna» que no hace afirmaciones claras sobre la reducción de infecciones, transmisibilidad o muertes.
- 7. Primera «vacuna» contra el coronavirus jamás probada en humanos
- 8. Primera inyección de polinucleótidos modificados genéticamente en la población general
La confluencia de estos eventos sin precedentes ha llevado rápidamente a la conciencia pública sobre la promesa y el potencial de las «vacunas» de ARNm como una nueva arma contra las enfermedades infecciosas en el futuro. Al mismo tiempo, los eventos sin precedentes carecen, por definición, de una historia y un contexto contra los cuales evaluar plenamente los riesgos, los beneficios esperados, la seguridad y la viabilidad a largo plazo como una contribución positiva a la salud pública.
En este artículo revisaremos brevemente un aspecto particular de estos eventos sin precedentes, a saber, el desarrollo y despliegue de vacunas de ARNm contra la clase de enfermedades infecciosas objetivo bajo el paraguas de “SARS-CoV-2”. Creemos que muchas de las cuestiones que planteamos aquí serán aplicables a cualquier futura vacuna de ARNm que pueda producirse contra otros agentes infecciosos, o en aplicaciones relacionadas con el cáncer y enfermedades genéticas, mientras que otras parecen específicamente relevantes para las vacunas de ARNm que se están implementando actualmente contra la subclase de los virus corona. Si bien las promesas de esta tecnología han sido ampliamente anunciadas, los riesgos evaluados objetivamente y las preocupaciones de seguridad han recibido una atención mucho menos detallada. Nuestra intención es revisar varios aspectos moleculares muy preocupantes de la tecnología de ARNm relacionada con enfermedades infecciosas y correlacionarlos con efectos patológicos tanto documentados como potenciales.
Desarrollo de vacunas
El desarrollo de vacunas de ARNm contra enfermedades infecciosas no tiene precedentes en muchos sentidos. En una publicación de 2018 patrocinada por Bill y Melinda Gates Foundation, las vacunas se dividieron en tres categorías: simples, complejas y sin precedentes (Young et al., 2018). Las vacunas simples y complejas representaron aplicaciones estándar y modificadas de las tecnologías de vacunas existentes.
Sin precedentes representa una categoría de vacuna contra una enfermedad para la que nunca antes había existido una vacuna adecuada. Las vacunas contra el VIH y la malaria son ejemplos. Como indica su análisis, que se muestra en la Figura 1, se espera que las vacunas sin precedentes tarden 12,5 años en desarrollarse. Aún más inquietante, tienen una probabilidad estimada del 5% de superar los ensayos de fase II (evaluación de la eficacia) y, de ese 5%, un 40% de posibilidades de superar los ensayos de fase III (evaluación del beneficio de la población). En otras palabras, se predijo que una vacuna sin precedentes tendría un 2% de probabilidad de éxito en la etapa de un ensayo clínico de fase III. Como lo expresaron sin rodeos los autores, existe una «baja probabilidad de éxito, especialmente para vacunas sin precedentes». (Young et al., 2018)
Figura 1. El lanzamiento de vacunas innovadoras es costoso y requiere mucho tiempo, con una baja probabilidad de éxito, especialmente para vacunas sin precedentes (adaptado de Young et al, 2018).
La eficacia de estas inyecciones necesitan una reevaluación
Con eso en mente, dos años después tenemos una vacuna sin precedentes con informes de eficacia del 90-95% (Baden et al. 2020). De hecho, estos informes de eficacia son la principal motivación detrás del apoyo público a la adopción de la vacunación (Departamento de Salud y Servicios Humanos de EE. UU., 2020). Esto desafía no solo las predicciones, sino también las expectativas. El British Medical Journal (BMJ) puede ser la única publicación médica convencional prominente que ha brindado una plataforma a las voces que llaman la atención sobre las preocupaciones en torno a la eficacia de las vacunas COVID-19. De hecho, existen razones para creer que las estimaciones de eficacia necesitan una reevaluación.
Peter Doshi, editor asociado del BMJ, ha publicado dos análisis importantes (Doshi 2021a, 2021b) de los datos brutos publicados a la FDA por los fabricantes de vacunas, datos que son la base de la afirmación de alta eficacia. Desafortunadamente, estos se publicaron en el blog de BMJ y no en su contenido revisado por pares. Sin embargo, Doshi ha publicado un estudio sobre la eficacia de la vacuna y la utilidad cuestionable de los criterios de valoración del ensayo de la vacuna en el contenido revisado por pares de BMJ (Doshi 2020).
Un aspecto central de la crítica de Doshi a los datos preliminares de eficacia es la exclusión de más de 3400 «casos sospechosos de COVID-19» que no se incluyeron en el análisis intermedio de los datos de la vacuna Pfizer presentados a la FDA. Además, un porcentaje bajo pero no trivial de individuos tanto en Moderna y los ensayos de Pfizer se consideraron positivos para el SARS-CoV-1 al inicio del estudio a pesar de que la infección previa era motivo de exclusión. Por estas y otras razones, la estimación provisional de la eficacia de alrededor del 95% para ambas vacunas es sospechosa.
Riesgo relativo vs absoluto
Un análisis más reciente se centró específicamente en la cuestión de la reducción del riesgo relativo frente al absoluto. Si bien las estimaciones altas de la reducción del riesgo se basan en riesgos relativos, la reducción absoluta del riesgo es una métrica más apropiada para que un miembro del público en general determine si una vacuna proporciona una reducción significativa del riesgo personalmente. En ese análisis, utilizando los datos proporcionados por los fabricantes de vacunas a la FDA, la vacuna Moderna en el momento del análisis intermedio demostró una reducción del riesgo absoluto del 1,1% (p = 0,004), mientras que la reducción del riesgo absoluto de la vacuna Pfizer fue del 0,7% (p <0,000) (Marrón 2021).
Preguntas con relevancia directa para las vacunas de ARNm
Otros han planteado preguntas adicionales importantes con respecto al desarrollo de la vacuna COVID-19, preguntas con relevancia directa para las vacunas de ARNm revisadas aquí. Por ejemplo, Haidere, et. Alabama. (2021) identifican cuatro “preguntas críticas” relacionadas con el desarrollo de estas vacunas, preguntas que guardan relación tanto con su seguridad como con su eficacia:
• ¿Estimularán las vacunas la respuesta inmunitaria?
• ¿Proporcionarán las vacunas una resistencia inmunológica sostenible?
• ¿Cómo mutará el SARS-CoV-2?
• ¿Estamos preparados para los fracasos de las vacunas?
La falta de ensayos clínicos y preclínicos estándar y ampliados de las dos vacunas de ARNm implementadas con el tiempo deja cada una de estas preguntas sin respuesta . Ahora, sólo mediante la observación de los datos fisiológicos y epidemiológicos pertinentes generados por la entrega a gran escala de las vacunas al público en general, se resolverán estas cuestiones. Y esto solo es posible si hay acceso gratuito a informes imparciales de los resultados, algo que parece poco probable dada la censura generalizada de la información relacionada con las vacunas debido a la necesidad percibida de declarar el éxito a toda costa.
Pfizer y Moderna
Las dos vacunas de ARNm que han superado los ensayos de fase 3 y ahora se están entregando a la población general son la vacuna Moderna y la vacuna Pfizer-BioNTech. Las vacunas tienen mucho en común. Ambos se basan en ARNm que codifica la proteína de pico del virus SARS-CoV-2. Ambas demostraron una tasa de eficacia relativa del 94-95%. Las indicaciones preliminares son que los anticuerpos todavía están presentes después de tres meses. Ambos recomiendan dos dosis espaciadas por tres o cuatro semanas, y recientemente hay informes de que son necesarias inyecciones de refuerzo anuales (Mahose, 2021). Ambas se administran mediante inyección muscular y ambas requieren almacenamiento en congelación para evitar que el ARN se descomponga. Esto se debe a que, a diferencia del ADN bicatenario que es muy estable, los productos de hebra de ARN pueden dañarse o volverse impotentes a temperaturas cálidas y deben mantenerse extremadamente fríos para conservar su eficacia potencial (Pushparajah et al., 2021). Los fabricantes afirman que la vacuna Pfizer requiere almacenamiento a -94 grados Fahrenheit (-70 grados Celsius), lo que hace que sea muy difícil transportarla y mantenerla fría durante el período intermedio antes de que finalmente se administre. La vacuna Moderna se puede almacenar durante 6 meses a -4 grados Fahrenheit (- 20 grados Celsius) y se puede almacenar de forma segura en el refrigerador durante 30 días después de descongelarla (Zimmer et al., 2021).
Johnson & Johnson y AstraZeneca
Otras dos vacunas que ahora se están administrando bajo uso de emergencia son la vacuna Johnson & Johnson y la vacuna AstraZeneca. Ambas se basan en una tecnología de ADN vectorial que es muy diferente de la tecnología utilizada en las vacunas de ARNm. Si bien estas vacunas también se lanzaron al mercado con una evaluación insuficiente, no son el tema de este documento, por lo que solo describiremos brevemente cómo se desarrollan. Estas vacunas se basan en una versión defectuosa de un adenovirus, un virus de ADN de doble hebra que causa el resfriado común. El adenovirus se ha modificado genéticamente de dos formas, de modo que no puede replicarse debido a la falta de genes críticos, y su genoma se ha aumentado con el código de ADN de la proteína espiga del SARS-CoV-2. La producción de AstraZeneca involucra una línea celular humana inmortalizada llamada Riñón Embrionario Humano (HEK) 293, que se cultiva en cultivo junto con los virus defectuosos (Dicks et al., 2012). La línea celular HEK se modificó genéticamente en la década de 1970 aumentando su ADN con segmentos de un adenovirus que suministran los genes faltantes necesarios para la replicación del virus defectuoso (Louis et al., 1997). Johnson & Johnson utiliza una técnica similar basada en una línea celular retiniana fetal. Debido a que la fabricación de estas vacunas requiere líneas de células tumorales humanas modificadas genéticamente, existe la posibilidad de contaminación del ADN humano, así como de muchos otros contaminantes potenciales.
Los medios de comunicación han generado mucho entusiasmo por esta tecnología revolucionaria, pero también existe la preocupación de que no nos estemos dando cuenta de la complejidad del potencial del cuerpo para las reacciones al ARNm extraño y otros ingredientes en estas vacunas que van mucho más allá del simple objetivo de engañar al cuerpo para que produzca anticuerpos contra la proteína de pico.
En el resto de este artículo, primero describiremos con más detalle la tecnología detrás de las vacunas de ARNm. Dedicamos varias secciones a aspectos específicos de las vacunas de ARNm que nos preocupan con respecto al potencial de consecuencias negativas predecibles e impredecibles. Concluimos con un llamamiento a los gobiernos y a la industria farmacéutica para que consideren actuar con mayor cautela en el compromiso actual de vacunar a la mayor cantidad posible de personas contra el SARS-CoV-2.
Tecnología de vacunas de ARNm
En la fase inicial del desarrollo de la terapia génica basada en nucleótidos, se invirtió considerablemente más esfuerzo en la entrega de genes a través de plásmidos de ADN que a través de la tecnología de ARNm. Dos obstáculos importantes para el ARNm son su naturaleza transitoria debido a su susceptibilidad a la degradación por ARNses, así como su poder conocido para invocar una fuerte respuesta inmune, que interfiere con su transcripción en proteína. Se ha demostrado que el ADN plasmídico persiste en el músculo hasta seis meses, mientras que el ARNm casi con certeza desaparece mucho antes. Para las aplicaciones de vacunas, originalmente se pensó que la naturaleza inmunogénica del ARN podría funcionar ventajosamente, ya que el ARNm podría funcionar como adyuvante de la vacuna, eliminando los argumentos a favor de un aditivo tóxico como el aluminio. Sin embargo, la respuesta inmune da como resultado no solo una respuesta inflamatoria sino también la rápida eliminación del ARN y la supresión de la transcripción. Entonces esta idea resultó no ser práctica.
Hubo un extenso período de tiempo durante el cual se exploraron varias ideas para tratar de evitar que el ARNm se descompusiera antes de que pudiera producir proteínas. Un avance importante fue la constatación de que la sustitución de todos los nucleótidos de uridina por metil-pseudouridina estabilizaría el ARN contra la degradación, lo que le permitiría sobrevivir el tiempo suficiente para producir cantidades adecuadas de antígeno proteico necesarios para la inmunogénesis (Liu, 2019). Esta forma de ARNm suministrado en la vacuna nunca se ve en la naturaleza y, por lo tanto, tiene el potencial de consecuencias desconocidas.
Las vacunas de ARNm de Pfizer-BioNTech y Moderna se basan en tecnologías muy similares, en las que una nanopartícula de lípidos encierra una secuencia de ARN que codifica la proteína de pico SARS-CoV-2 de longitud completa. En el proceso de fabricación, el primer paso es ensamblar una molécula de ADN que codifique la proteína de pico. Este proceso ahora se ha comercializado, por lo que es relativamente sencillo obtener una molécula de ADN a partir de una especificación de la secuencia de nucleótidos (Corbett et al., 2020). Después de una transcripción in vitro libre de células a partir de ADN, utilizando una reacción enzimática catalizada por la ARN polimerasa, el ARN monocatenario se estabiliza mediante modificaciones específicas de nucleósidos y se purifica en gran medida.
La empresa Moderna, en Cambridge, MA, es uno de los desarrolladores de vacunas de ARNm implementadas para el SARS-CoV-2. Los ejecutivos de Moderna tienen la gran visión de extender la tecnología para muchas aplicaciones donde el cuerpo puede ser dirigido a producir proteínas terapéuticas no solo para la producción de anticuerpos sino también para tratar enfermedades genéticas y cáncer, entre otras. Están desarrollando una plataforma genérica donde el ADN es el elemento de almacenamiento, el ARN mensajero es el “software” y las proteínas que codifica el ARN representan diversos dominios de aplicación. La visión es grandiosa y las aplicaciones potenciales teóricas son vastas (Moderna, 2020). La tecnología es impresionante, pero la manipulación del código de vida podría provocar efectos negativos completamente inesperados, potencialmente a largo plazo o incluso permanentes.
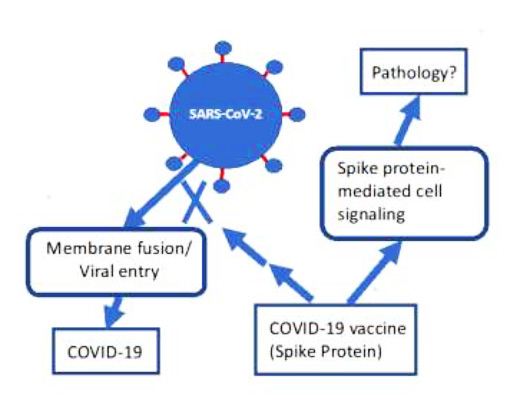
El SARS-CoV-2 es un miembro de la clase de virus de ARN de cadena positiva, lo que significa que codifican directamente las proteínas que codifica el ARN, en lugar de requerir una copia en una cadena antisentido antes de la traducción en proteína. El virus consiste principalmente en la molécula de ARN monocatenario empaquetada dentro de una cubierta proteica, que consiste en las proteínas estructurales del virus, más notablemente la proteína espiga, que facilita la unión viral a un receptor (en el caso del SARS-CoV-2, este es el receptor ACE2) y la fusión del virus con la membrana de la célula huésped. La proteína pico SARS-CoV-2 es el objetivo principal de los anticuerpos neutralizantes. Es una glicoproteína de fusión de clase I, y es análoga a la hemaglutinina producida por los virus de la influenza y la glicoproteína de fusión producida por los virus sincitiales.
Las vacunas de ARNm son la culminación de años de investigación para explorar la posibilidad de utilizar ARN encapsulado en una partícula lipídica como mensajero. La maquinaria biológica existente de la célula huésped se coopta para facilitar la producción natural de proteína a partir del ARNm. El campo ha florecido en parte debido a la facilidad con la que se pueden sintetizar secuencias específicas de ADN de oligonucleótidos en el laboratorio sin la participación directa de organismos vivos. Esta tecnología se ha convertido en un producto básico y se puede hacer a gran escala, con un costo relativamente bajo. La conversión enzimática de ADN en ARN también es sencilla, y es factible aislar ARN monocatenario esencialmente puro de la sopa de reacción (Kosuri y Church, 2014).
1. Consideraciones en la selección y modificación de ARNm
Si bien el proceso es simple en principio, los fabricantes de vacunas de ARNm se enfrentan a considerables desafíos técnicos:
- El primero, como hemos comentado, es que el ARNm extracelular en sí mismo puede inducir una respuesta inmune que daría como resultado su rápida eliminación antes incluso de que sea absorbido por las células. Por lo tanto, el ARNm debe estar encerrado en una nanopartícula que lo mantendrá oculto al sistema inmunológico.
- El segundo problema es lograr que las células absorban las nanopartículas. Esto se puede resolver en parte incorporando fosfolípidos en la nanopartícula para aprovechar las vías naturales de endocitosis de partículas lipídicas.
- El tercer problema es activar la maquinaria que interviene en la traducción del ARN en proteína. En el caso del SARS-CoV-2, la proteína que se produce es la proteína de pico.
Después de la síntesis de proteína de pico, las células presentadoras de antígeno necesitan presentar la proteína de pico a las células T, que finalmente producirán anticuerpos protectores de memoria (Moderna, 2020). Este paso no es particularmente sencillo, porque las nanopartículas son absorbidas principalmente por las células musculares, las cuales, al estar inmóviles, no están necesariamente equipadas para lanzar una respuesta inmune. Como veremos, el escenario probable es que las células musculares sinteticen la proteína de pico y luego se entregue a los macrófagos que actúan como células presentadoras de antígenos, que luego lanzan la respuesta en cascada estándar de generación de anticuerpos basada en células B.
El ARNm que está incluido en las vacunas se somete a varios pasos de modificación después de su síntesis a partir de una plantilla de ADN. Algunos de estos pasos implican prepararlo para que se vea exactamente como una secuencia de ARNm humano debidamente modificada para soportar la traducción ribosómica en proteína. Otras modificaciones tienen el objetivo de protegerlo de la degradación, de modo que se pueda producir suficiente proteína para provocar una respuesta de anticuerpos. El ARNm no modificado induce una respuesta inmunitaria que conduce a niveles séricos elevados de interferón-α (IF-α), que se considera una respuesta indeseable. Sin embargo, los investigadores han descubierto que reemplazar todas las uridinas en el ARNm con N-metil-pseudouridina mejora la estabilidad de la molécula al tiempo que reduce su inmunogenicidad (Karikó et al. 2008; Corbett et al., 2020). Este paso es parte de la preparación del ARNm en las vacunas, pero, Además, se añade una “tapa” de 7-metilguanosina al extremo 5 ‘de la molécula y se añade una cola de poliadenina (poli-A), que consta de 100 o más nucleótidos de adenina, en el extremo 3’. El casquete y la cola son esenciales para mantener la estabilidad del ARNm dentro del citosol y promover la traducción en proteína (Schlake et al., 2012; Gallie, 1991).
Normalmente, la proteína de pico cambia muy fácilmente de una configuración previa a la fusión a una configuración posterior a la fusión. La proteína de pico que se encuentra en estas vacunas se ha ajustado para alentarla a favorecer una configuración estable en su estado de prefusión, ya que este estado provoca una respuesta inmune más fuerte (Jackson et al., 2020). Esto se hizo mediante una «mutación genética», reemplazando un segmento crítico de dos residuos con dos residuos de prolina en las posiciones 986 y 987, en la parte superior de la hélice central de la subunidad S2 (Wrapp et al., 2020). La prolina es un aminoácido muy inflexible, por lo que interfiere con la transición al estado de fusión. Esta modificación proporciona a los anticuerpos un acceso mucho mejor al sitio crítico que soporta la fusión y la subsiguiente captación celular. Pero, ¿podría esto también significar que la versión modificada genéticamente de la proteína de pico producida por la célula huésped humana siguiendo las instrucciones del ARNm de la vacuna permanece en la membrana plasmática unida a los receptores ACE2 debido a las capacidades de fusión dañadas? ¿Cuál podría ser la consecuencia de esto? No lo sabemos.
Investigadores en China publicaron un informe en Nature en agosto de 2020 en el que presentaron datos sobre varias vacunas de ARNm experimentales donde el ARNm codificaba varios fragmentos y proteínas en el virus SARS-CoV-2. Probaron tres formulaciones de vacunas distintas para determinar su capacidad para inducir una respuesta inmune adecuada en ratones. Las tres proteínas estructurales, S (pico), M y E son requisitos mínimos para ensamblar una «partícula similar a un virus» (VLP). Su hipótesis era que proporcionar M y E, así como la proteína de pico S en el código de ARNm, permitiría el ensamblaje de VLP que podrían provocan una respuesta inmune mejorada, porque se parecen más al virus natural que a la proteína S expuesta en la superficie de las células que han absorbido solo el ARNm de la proteína S de las nanopartículas de la vacuna. También esperaban que los fragmentos críticos de la proteína de pico fueran suficientes para inducir inmunidad, en lugar de toda la proteína de pico, si se pudieran producir partículas de tipo viral mediante el aumento con M y E (Lu et al., 2020).
Confirmaron experimentalmente que una vacuna que contiene los genes completos de las tres proteínas provocó una sólida respuesta inmune que duró al menos ocho semanas después de la segunda dosis de la vacuna. Su rendimiento fue muy superior al de una vacuna que contiene solo la proteína de pico. Lamentablemente, una vacuna que contenía solo componentes críticos de la proteína de pico, aumentada con las otras dos proteínas de la envoltura, no provocó prácticamente ninguna respuesta.
Los investigadores de Moderna han realizado estudios similares con resultados similares. Llegaron a la conclusión de que la proteína de pico sola era claramente inferior a una formulación que contenía ARN que codificaba las tres proteínas de la envoltura, y plantearon la hipótesis de que esto se debía al hecho de que las tres proteínas eran necesarias para permitir que la célula liberara partículas intactas parecidas a virus, en lugar de que simplemente publicar la proteína de pico en la membrana plasmática. La proteína de pico sola no pudo iniciar una respuesta de células T en estudios con animales, mientras que la formulación con las tres proteínas lo hizo (Corbett et al., 2020).
Las dos vacunas aprobadas de emergencia solo contienen el código de ARNm para la proteína de pico (sin E o M), y debe haber una buena razón para esta decisión, a pesar de su bajo rendimiento observado. Es posible que un diseño más sofisticado de la nanopartícula lipídica (ver más abajo) haya dado como resultado la capacidad de que los lípidos sirvan como adyuvantes (similar al aluminio que se agrega comúnmente a las vacunas tradicionales) mientras se protege al ARN de la degradación.
Otra modificación curiosa en el código del ARN es que los desarrolladores han enriquecido la secuencia en citosinas y guaninas (Cs y Gs) a expensas de adeninas y uracilos (As y Us). Han tenido cuidado de reemplazar solo la tercera posición en el codón de esta manera, y solo cuando no altera el mapa de aminoácidos (Hubert, 2020). Se ha demostrado experimentalmente que las secuencias de ARNm ricas en GC se expresan (traducen en proteína) hasta 100 veces más eficientemente que las secuencias pobres en GC (Kudla et al., 2006). Así que esta parece ser otra modificación para asegurar aún más la síntesis de copias abundantes de la proteína de pico. No conocemos las consecuencias no deseadas de esta maniobra. Los patógenos intracelulares, incluidos los virus, tienden a tener un bajo contenido de GC en comparación con el genoma de la célula huésped (Rocha y Danchin, 2020). Entonces,
Todas estas diversas modificaciones del ARN están diseñadas para hacer que resista la descomposición, se parezca más a una secuencia codificadora de proteínas del ARN mensajero humano y se traduzcan de manera eficiente en proteínas antigénicas.
2. Construcción de nanopartículas lipídicas
Las nanopartículas lipídicas (LNP), también conocidas como liposomas, pueden encapsular moléculas de ARN, protegiéndolas de la degradación enzimática por ribonucleasas y, por lo tanto, forman un ingrediente esencial de un método de administración exitoso (Wadhwa et al., 2020; Xu et al., 2020) ). Estas construcciones artificiales se parecen mucho a los exosomas. Los exosomas son vesículas extracelulares secretadas por las células y captadas por sus vecinos, y también a menudo incrustan ADN o ARN. Por lo tanto, estas nanopartículas pueden aprovechar los procesos de endocitosis natural que normalmente internalizan exosomas extracelulares en endosomas. A medida que el endosoma se acidifica para convertirse en lisosoma, el ARNm se libera en el citoplasma, y aquí es donde tiene lugar la traducción a proteína. De hecho, se ha descubierto que los liposomas son más exitosos para mejorar la presentación de antígenos y la maduración de las células dendríticas, en comparación con las proteínas de fusión que encapsulan vacunas basadas en virus (Norling et al., 2019).
Las nanopartículas lipídicas (LNP) de estas vacunas están compuestas por lípidos catiónicos ionizables, fosfolípidos, colesterol y polietileína glicol (PEG). Juntos, esta mezcla se ensambla en una bicapa lipídica estable alrededor de la molécula de ARNm. Los fosfolípidos en estas vacunas experimentales consisten en un grupo de cabeza de fosfatidilcolina conectado a dos colas de alquilo saturadas a través de un enlazador de glicerol. El lípido utilizado en estas vacunas, denominado 1,2-diestearoil-sn-glicero-3-fosfocolina (DSPC), tiene 18 unidades de carbono repetidas. La cadena relativamente larga tiende a formar una fase de gel en lugar de una fase fluida. En cambio, las moléculas con cadenas más cortas (como una cadena de 12 carbonos) tienden a permanecer en una fase fluida. Se ha descubierto que los liposomas en fase de gel que utilizan DSPC tienen un rendimiento superior en la protección del ARN de la degradación porque las cadenas de alquilo más largas están mucho más restringidas en sus movimientos dentro del dominio lipídico. También parecen ser más eficientes como adyuvantes, aumentando la liberación del factor de necrosis tumoral de cytockines-α (TNF-α), interleucina (IL) -6 e IL-1β de las células expuestas (Norling et al., 2019). Sin embargo, su capacidad para inducir una respuesta inflamatoria puede ser la causa de los muchos síntomas que experimentan las personas, como dolor, hinchazón, fiebre y somnolencia. Un estudio publicado en bioRxiv verificó experimentalmente que estos lípidos catiónicos ionizables en nanopartículas lipídicas inducen una fuerte respuesta inflamatoria en ratones (Ndeupen et al., 2021). También parecen ser más eficientes como adyuvantes, aumentando la liberación del factor de necrosis tumoral de cytockines-α (TNF-α), interleucina (IL) -6 e IL-1β de las células expuestas (Norling et al., 2019). Sin embargo, su capacidad para inducir una respuesta inflamatoria puede ser la causa de los muchos síntomas que experimentan las personas, como dolor, hinchazón, fiebre y somnolencia. Un estudio publicado en bioRxiv verificó experimentalmente que estos lípidos catiónicos ionizables en nanopartículas lipídicas inducen una fuerte respuesta inflamatoria en ratones (Ndeupen et al., 2021). También parecen ser más eficientes como adyuvantes, aumentando la liberación del factor de necrosis tumoral de cytockines-α (TNF-α), interleucina (IL) -6 e IL-1β de las células expuestas (Norling et al., 2019). Sin embargo, su capacidad para inducir una respuesta inflamatoria puede ser la causa de los muchos síntomas que experimentan las personas, como dolor, hinchazón, fiebre y somnolencia. Un estudio publicado en bioRxiv verificó experimentalmente que estos lípidos catiónicos ionizables en nanopartículas lipídicas inducen una fuerte respuesta inflamatoria en ratones (Ndeupen et al., 2021). fiebre y somnolencia.
Las vacunas de ARNm actuales se administran mediante inyección intramuscular. Los músculos contienen una gran red de vasos sanguíneos donde se pueden reclutar células inmunitarias en el lugar de la inyección (Zeng et al., 2020). Las células musculares generalmente pueden mejorar una reacción inmune una vez que las células inmunes se infiltran, en respuesta a un adyuvante (Marino et al., 2011). Un análisis cuidadoso de la respuesta a una vacuna de ARNm, administrada a ratones, reveló que el antígeno se expresa inicialmente dentro de las células musculares y luego se transfiere a las células presentadoras de antígeno, lo que sugiere un «cebado cruzado» como la ruta principal para iniciar una respuesta de células T CD8 ( Lazzaro et al., 2015). Se puede especular que las células musculares hacen uso de una respuesta inmune que normalmente se usa para lidiar con proteínas humanas mal plegadas. Dichas proteínas inducen la regulación positiva de proteínas de clase II del complejo principal de histocompatibilidad (MHC),
La proteína de superficie unida al MHC luego induce una respuesta inflamatoria y la subsiguiente infiltración de células presentadoras de antígenos (p. Ej., Células dendríticas y macrófagos) en el tejido muscular, que luego absorben las proteínas mostradas y las transportan al sistema linfático para presentárselas a Células T.
Estas células T pueden finalmente lanzar la cascada que finalmente produce anticuerpos de memoria específicos para la proteína. Las células musculares expresan proteínas MHC de clase II (Cifuentes-Diaz et al., 1992). A diferencia de la clase I, las proteínas MHC de clase II se especializan en el transporte de proteínas intactas a la superficie en lugar de pequeñas secuencias de péptidos derivadas de la degradación parcial de las proteínas (Jiang et al., 2013).
Un estudio in vitro en primates no humanos demostró que el ARNm radiomarcado se movía desde el lugar de la inyección al ganglio linfático de drenaje y permanecía allí durante al menos 28 horas. Se demostró que las Células Presentadoras de Antígeno (APC) tanto en el tejido muscular como en los ganglios linfáticos de drenaje contenían ARNm radiomarcado (Lindsay et al., 2019). Las APC clásicas incluyen células dendríticas, macrófagos, células de Langerhans (en la piel) y células B. Muchos de los efectos secundarios asociados con estas vacunas implican dolor e inflamación en el lugar de la inyección, como era de esperar dada la rápida infiltración de las células inmunes.
La linfadenopatía es un estado inflamatorio en el sistema linfático asociado con la inflamación de los ganglios linfáticos. Los ganglios linfáticos inflamados en la axila (linfadenopatía axilar) es una característica del cáncer de mama metastásico. Un artículo publicado en 2021 describió cuatro casos de mujeres que desarrollaron linfadenopatía axilar después de una vacuna contra el SARS-CoV-2 (Mehta et al., 2021). Los autores instaron a tener precaución al malinterpretar esta condición como un indicador que requiere un seguimiento de biopsia para un posible cáncer de mama. Este síntoma corrobora los estudios de trazadores que muestran que la vacuna de ARNm es absorbida predominantemente por APC que luego presumiblemente sintetizan el antígeno (proteína de pico) del ARNm y migran al sistema linfático, mostrando proteína de pico en sus membranas.
Una lista de los efectos adversos más comunes informados por la FDA que se experimentaron durante los ensayos clínicos de Pfizer-BioNTech incluyen “dolor en el lugar de la inyección, fatiga, dolor de cabeza, dolor muscular, escalofríos, dolor en las articulaciones, fiebre, hinchazón en el lugar de la inyección, enrojecimiento en el lugar de la inyección, náuseas, malestar y linfadenopatía «. (Administración de Drogas y Alimentos de EE. UU., 2021).
Pasamos ahora a las preocupaciones de los sistemas de órganos y moleculares individuales que surgen con estas vacunas de ARNm.
Adyuvantes, polietilenglicol y anafilaxia
Los adyuvantes son aditivos de vacunas destinados a «provocar perfiles inmunológicos distintivos con respecto a la dirección, duración y fuerza de las respuestas inmunitarias» de las vacunas a las que se agregan (Liang et al., 2020). El alumbre u otros compuestos de aluminio se utilizan con mayor frecuencia en las vacunas tradicionales y provocan una amplia gama de vías de activación inmunitaria sistémica, así como la activación de las células estromales en el sitio de la inyección (Lambrecht et al., 2009; Danielsson y Eriksson, 2021). .
Se determinó que un adyuvante a base de aluminio no era óptimo para una vacuna contra el coronavirus, por lo que se buscaron otras soluciones (Liang et. Al., 2020). Una solución se presentó en forma de polietilenglicol o PEG, un ingrediente farmacéutico ampliamente utilizado. Un factor limitante en el uso de vacunas basadas en ácidos nucleicos es la tendencia a que los ácidos nucleicos se degraden rápidamente por las enzimas nucleasas (Ho et al., 2021). Con respecto a las enzimas ARNasa que se dirigen al ARNm inyectado, estas enzimas están ampliamente distribuidas tanto intracelularmente (principalmente dentro de los lisosomas) (Fujiwara et al., 2017) como extracelularmente (Lu et al., 2018). Para superar esta limitación, ambas vacunas de ARNm actualmente desplegadas contra COVID-19 utilizan nanopartículas a base de lípidos como vehículos de administración. La carga de ARNm se coloca dentro de una capa compuesta de lípidos sintéticos y colesterol,
La vacuna producida por Pfizer / BioNTech crea nanopartículas a partir de 2 – [(polietilenglicol) – 2000] -N, N-ditetradecilacetamida o ALC-0159, abreviado comúnmente simplemente como PEG (Organización Mundial de la Salud, 2021, 14 de enero). La vacuna Moderna contiene otra variante de PEG, SM-102, 1,2-dimiristoil-rac-glicero-3-metoxipolietilenglicol 2000 (Organización Mundial de la Salud, 2021, 19 de enero). Por conveniencia, abreviaremos ambos lípidos modificados con PEG como PEG, y nos referiremos a las vacunas como PEGiladas de acuerdo con la nomenclatura estándar.
La cáscara lipídica juega un papel triple. Primero, protege el material genético de la degradación antes de la absorción celular. En segundo lugar, la capa lipídica, que también contiene colesterol, facilita la captación celular mediante la fusión con la membrana lipídica de la célula y la posterior endocitosis de la partícula lipídica, invocando procesos que existen de forma natural. Y finalmente, actúa como adyuvante (Ho et al., 2021). Es en este último papel como estimulante inmunológico que se han planteado la mayoría de las preocupaciones con respecto al uso generalizado de PEG en una terapia de inyección.
En un artículo publicado en mayo de 2019, antes de grandes ensayos clínicos con estas vacunas PEGiladas, Mohamed et. Alabama. (2019) describieron una serie de hallazgos preocupantes con respecto al PEG y la activación inmunológica que se había demostrado que produce, que incluye la activación humoral, mediada por células y basada en el complemento. Señalan que, paradójicamente, las grandes dosis de inyección de PEG no provocan ninguna reacción alérgica aparente. Sin embargo, las dosis pequeñas pueden provocar una activación inmunitaria patológica espectacular. Las vacunas que emplean PEGilación utilizan cantidades micromolares de estos lípidos, lo que constituye esta exposición a dosis bajas potencialmente inmunogénica.
En estudios con animales se ha demostrado que la activación del complemento es responsable tanto de la anafilaxia como del colapso cardiovascular, y el PEG inyectado también activa múltiples vías del complemento en humanos. Los autores de un estudio concluyen señalando que “esta cascada de mediadores secundarios amplifica sustancialmente las respuestas inmunitarias efectoras y puede inducir anafilaxia en individuos sensibles. De hecho, estudios recientes en cerdos han demostrado que la activación sistémica del complemento (p. Ej., Inducida después de la inyección intravenosa de liposomas PEGilados) puede ser la base de la anafilaxia cardíaca en la que C5a jugó un papel causal ”. (Hamad et al., 2008) También es importante tener en cuenta que el shock anafilactoide en los cerdos no ocurrió con la primera exposición inyectada, sino después de la segunda exposición inyectada (Kozma et al., 2019).
La presencia de anticuerpos contra PEG está muy extendida en la población (Zhou et al., 2020). Yang y Lai (2015) encontraron que alrededor del 42% de las muestras de sangre encuestadas contenían anticuerpos anti-PEG, y advierten que estos podrían tener consecuencias importantes para cualquier terapéutica basada en PEG introducida. Hong et. Alabama. (2020) encontraron anticuerpos anti-PEG con una prevalencia de hasta el 72% en poblaciones sin exposición previa a la terapia médica basada en PEG. Lila et. Alabama. (2018) señalan que la «existencia de tales anticuerpos anti-PEG se ha correlacionado íntimamente con un deterioro de la eficacia terapéutica junto con el desarrollo de efectos adversos graves en varios entornos clínicos que emplean terapias basadas en PEGiladas».
Anteriormente se suponía que la anafilaxia a las vacunas era poco común en función de la frecuencia de tales eventos informados a VAERS, una base de datos establecida por los Centros para el Control y la Prevención de Enfermedades en 1990 para informar de los eventos adversos relacionados con las vacunas (Centros para el Control y la Prevención de Enfermedades, 1990; Su et al., 2019). Si bien es poco común, la anafilaxia puede poner en peligro la vida, por lo que es importante vigilar la posibilidad en el corto período posterior a la vacunación (McNeil et al., 2016).
Sellaturay et. al., después de revisar 5 casos de anafilaxia que relacionan con la exposición a PEG, uno casi fatal y que involucra un paro cardíaco, escriben: “El PEG es un alérgeno ‘oculto’ de alto riesgo, generalmente insospechado y puede causar reacciones alérgicas frecuentes debido a reacciones inadvertidas de reexposición. La investigación de alergias conlleva el riesgo de anafilaxia y debe realizarse solo en centros especializados en alergia a medicamentos «. (Sellaturay et al., 2020). De hecho, ya se ha demostrado que los anticuerpos preexistentes a PEG están relacionados con reacciones más comunes y más graves tras la reexposición (Ganson et al., 2016).
¿La anafilaxia por exposición a PEG ocurre con una frecuencia relevante para la salud pública? Numerosos estudios han documentado el fenómeno (Lee et al., 2015; Povsic et al., 2016; Wylon et al., 2016). Las reacciones anafilácticas a las vacunas de ARNm se informan ampliamente en los medios (Kelso, 2021) y, como se señaló anteriormente, se han informado con frecuencia en la base de datos VAERS (690 informes de anafilaxia después de las vacunas contra el SARS-CoV-2 hasta el 29 de enero de 2021) . También hay algunos estudios de casos iniciales publicados en la literatura revisada por pares (Garvey y Nasser, 2020; CDC COVID-19 Response Team, 2021, 15 de enero). Las reacciones de anafilaxia a las vacunas antes de estas vacunas COVID-19 generalmente se notificaron en tasas inferiores a 2 casos por millón de vacunas (McNeil et al., 2016), mientras que los CDC informaron que la tasa actual con las vacunas COVID-19 era de más de 11 casos por millón (Equipo de respuesta de COVID-19 de los CDC, 2021, 29 de enero). Sin embargo, un estudio prospectivo publicado sobre 64.900 empleados médicos, donde se monitorearon cuidadosamente sus reacciones a su primera vacuna de ARNm, encontró que el 2.1% de los sujetos informaron reacciones alérgicas agudas. Una reacción más extrema que involucró anafilaxia ocurrió a una tasa de 247 por millón de vacunaciones (Blumenthal et al., 2021). Esto es más de 21 veces más de lo que informaron inicialmente los CDC. Es probable que la exposición a la segunda inyección cause un número aún mayor de reacciones anafilácticas. donde sus reacciones a su primera vacunación con ARNm fueron cuidadosamente monitoreadas, encontró que el 2.1% de los sujetos reportaron reacciones alérgicas agudas. Una reacción más extrema que involucró anafilaxia ocurrió a una tasa de 247 por millón de vacunaciones (Blumenthal et al., 2021). Esto es más de 21 veces más de lo que informaron inicialmente los CDC. Es probable que la exposición a la segunda inyección cause un número aún mayor de reacciones anafilácticas. donde sus reacciones a su primera vacunación con ARNm fueron cuidadosamente monitoreadas, encontró que el 2.1% de los sujetos reportaron reacciones alérgicas agudas. Una reacción más extrema que involucró anafilaxia ocurrió a una tasa de 247 por millón de vacunaciones (Blumenthal et al., 2021). Esto es más de 21 veces más de lo que informaron inicialmente los CDC. Es probable que la exposición a la segunda inyección cause un número aún mayor de reacciones anafilácticas.
«Vacunas» de ARNm, proteínas de pico y mejoramiento o magnificación dependiente de anticuerpos (ADE)
El ADE es un fenómeno inmunológico descrito por primera vez en 1964 (Hawkes et al., 1964). En esa publicación, Hawkes describió una serie de experimentos en los que se incubaron cultivos de flavivirus con sueros de aves que contenían títulos elevados de anticuerpos contra esos virus. El hallazgo inesperado fue que, con diluciones cada vez más altas de los sueros que contienen anticuerpos, se aumentó la infectividad celular . La falta de una explicación de cómo podría suceder esto probablemente sea responsable de que se haya ignorado en gran medida durante casi 20 años (Morens et al., 1994).
Se han propuesto múltiples vías a través de las cuales los anticuerpos participan tanto directa como indirectamente en la neutralización de infecciones (Lu et al., 2018b). El ADE es un caso especial de lo que puede suceder cuando en el momento de la infección están presentes niveles bajos, no neutralizantes, de anticuerpos específicos o de reacción cruzada contra un virus. Estos anticuerpos pueden estar presentes debido a una exposición previa al virus, exposición a un virus relacionado o debido a una vacunación previa contra el virus. Tras la reinfección, los anticuerpos en cantidades insuficientes para neutralizar el virus, no obstante, se unen al virus. Luego, estos anticuerpos se acoplan al receptor Fc en las superficies celulares, lo que facilita la entrada del virus en la célula y, posteriormente, aumenta la infectividad del virus (Wan et. Al., 2020).
Dengue y Ebola
Se cree que el ADE es la base de la fiebre del dengue más severa que a menudo se observa en aquellos con exposición previa (Beltramello et al., 2010), y también podría desempeñar un papel en la enfermedad más grave entre aquellos previamente vacunados contra la enfermedad (Shukla et al., 2020). ). También se cree que el ADE desempeña un papel en el ébola (Takada et al., 2003), la infección por el virus del zika (Bardina et al., 2017) y otras infecciones por flavivirus (Campos et al., 2020).
En una correspondencia extendida publicada en Nature Biotechnology , Eroshenko et. Alabama. ofrecen una revisión completa de la evidencia que sugiere que el ADE podría manifestarse con cualquier vacuna empleada contra el SARS-CoV-2. Es importante destacar que señalan que se ha observado ADE con vacunas de coronavirus probadas en modelos tanto in vitro como in vivo (Eroshenko et al., 2020). Otros han advertido sobre la misma posibilidad con las vacunas contra el SARS-CoV-2. Una teoría sobre cómo podría ocurrir el ADE en el caso de una vacuna contra el SARS-CoV-2 sugiere que los anticuerpos no neutralizantes forman complejos inmunes con antígenos virales para provocar:
- una secreción excesiva de citocinas proinflamatorias y,
- en el caso extremo, una tormenta de citocinas, causando daño tisular local generalizado (Lee et al., 2020).
Una revisión extensa del ADE potencialmente asociado con las vacunas contra el SARS-CoV-2 señaló: “En la actualidad, no se conocen hallazgos clínicos, ensayos inmunológicos o biomarcadores que puedan diferenciar una infección viral grave de una enfermedad inmuno-mejorada, ya sea mediante la medición de anticuerpos, T células o respuestas intrínsecas del huésped ”(Arvin et al. 2020; Liu et al., 2019). Volveremos a este punto a continuación.
Los anticuerpos de inmunoglobulina G (IgG) preexistentes, inducidos por vacunación previa, contribuyen al daño pulmonar severo por SARS-CoV en macacos (Liu et al., 2019). Peron y Nakaya (2020) proporcionan evidencia que sugiere que la gama mucho más diversa de exposiciones previas a coronavirus experimentadas por los ancianos podría predisponerlos a ADE tras la exposición al SARS-CoV-2. Un artículo preimpreso preocupante informó que el plasma del 76% de los pacientes que se habían recuperado de la enfermedad grave COVID-19, cuando se agregó a cultivos de SARS-CoV-2 y células susceptibles, exhibió una mayor capacidad para la infección viral del SARS-CoV-2 de Células Raji (Wu et al., 2020). Los autores señalan que “los títulos de anticuerpos [contra la proteína de pico] fueron más altos en pacientes de edad avanzada con COVID-19, y una respuesta de anticuerpos más fuerte se asoció con un aclaramiento viral retardado y una mayor gravedad de la enfermedad en los pacientes. Por lo tanto, es razonable especular que los anticuerpos específicos de la proteína S pueden contribuir a la gravedad de la enfermedad durante la infección por SARS-CoV-2 «. (Wu et al., 2020)
Se ha informado que los tres fabricantes de vacunas de EE. UU., Moderna, Pfizer y Johnson & Johnson, están trabajando para desarrollar vacunas de refuerzo (Zaman 2021). Con decenas de millones de adultos jóvenes e incluso niños ahora con anticuerpos de proteína de pico de coronavirus inducidos por la vacuna, existe la posibilidad de desencadenar un ADE relacionado con una futura infección por SARS-CoV-2 o una inyección de refuerzo entre esta población más joven. El tiempo dirá.
Las vacunas de ARNm finalmente entregan la proteína de pico altamente antigénica a las células presentadoras de antígeno. Como tal, los anticuerpos monoclonales contra la proteína de pico son el resultado esperado de las vacunas de ARNm actualmente desplegadas. Se encontró que los anticuerpos monoclonales de proteína de espiga humana producen altos niveles de anticuerpos de reacción cruzada contra proteínas humanas endógenas (Vojdani et. Al., 2021; revisado con más detalle a continuación). Dada la evidencia que solo se revisó parcialmente aquí, hay razones suficientes para sospechar que los anticuerpos contra la proteína de pico contribuirán al ADE provocado por una infección o vacunación previa por SARS-CoV-2, que puede manifestarse como afecciones autoinmunes e inflamatorias agudas o crónicas. Hemos señalado anteriormente que no es posible distinguir una manifestación de enfermedad por ADE de una verdadera infección viral no ADE.no es una causa proximal.
Cebado patógeno, enfermedad inflamatoria multisistémica y autoinmunidad
El cebado patógeno es un concepto que tiene un resultado similar al ADE, pero diferente en el mecanismo subyacente. Lo discutimos aquí como un mecanismo único a través del cual las vacunas de ARNm podrían provocar patologías asociadas.
En abril de 2020 se publicó un artículo importante sobre la posibilidad de que se generen anticuerpos autorreactivos tras la exposición a la proteína de pico y otros epítopos antigénicos diseminados a lo largo del SARS-CoV-2. Lyons-Weiler (2020) acuñó la frase «cebado de patógenos» porque creía que el «refuerzo inmunológico» más comúnmente utilizado no capta la gravedad de la afección y sus consecuencias. En su análisis in silico , Lyons-Weiler comparó todos los epítopos de la proteína antigénica SARS-CoV-2 marcados en la base de datos SVMTriP y buscó en la base de datos p-BLAST para la homología entre esos epítopos y proteínas humanas endógenas. De las 37 proteínas del SARS-CoV-2 analizadas, 29 tenían regiones antigénicas. Todos menos uno de estos 29 tenían homología con proteínas humanas (autoantígenos putativos) y se predijo que serían autoreactogénicos. El mayor número de homologías se asoció con la proteína pico (S) y la proteína NS3, ambas con 6 proteínas humanas homólogas.
Un análisis funcional de las proteínas humanas endógenas homólogas con proteínas virales encontró que más de 1/3 de ellas están asociadas con el sistema inmunológico adaptativo. El autor especula que la exposición previa al virus o la vacunación previa, cualquiera de las cuales podría iniciar la producción de anticuerpos dirigidos a estas proteínas endógenas, puede estar desempeñando un papel en el desarrollo de una enfermedad más grave en los ancianos en particular. En este caso, los anticuerpos preexistentes actúan para suprimir el sistema inmunológico adaptativo y provocar una enfermedad más grave.
Otro grupo (Ehrenfeld et. Al., 2020), en un artículo predominantemente sobre la amplia gama de enfermedades autoinmunes encontradas en asociación con una infección previa por SARS-CoV-2, también investigó cómo la proteína de pico podría desencadenar tal variedad de enfermedades. Informan, en la Tabla 1 de esa referencia, cadenas de heptapéptidos dentro del proteoma humano que se superponen con la proteína de pico generada por el SARS-CoV-2. Identificaron 26 heptapéptidos que se encuentran en humanos y en la proteína de pico. Es interesante observar que se encontró que 2 de los 26 heptapéptidos superpuestos eran secuenciales, una cadena sorprendentemente larga de péptidos idénticos que se encuentran en común entre las proteínas humanas endógenas y la proteína espiga. Al comentar sobre los péptidos superpuestos que habían descubierto y el potencial de que esto impulse muchos tipos de autoinmunidad simultáneamente, comentan: «El escenario clínico que emerge es perturbador».
En mayo de 2020, Vojdani y Kharrazian (2020) publicaron otro artículo importante al respecto. Los autores utilizaron anticuerpos monoclonales de ratón y conejo contra la proteína de pico del SARS de 2003 para probar la reactividad no solo contra la proteína de pico del SARS-CoV-2, sino también contra varias proteínas humanas endógenas. Descubrieron que había un alto nivel de unión no solo con la proteína espiga del SARS-CoV-2, sino contra una amplia gama de proteínas endógenas. “[Encontramos] que las reacciones más fuertes fueron con transglutaminasa 3 (tTG3), transglutaminasa 2 (tTG2), ENA, proteína básica de mielina (MBP), mitocondrias, antígeno nuclear (NA), α-miosina, peroxidasa tiroidea (TPO) , colágeno, claudina 5 + 6 y S100B «. (Vojdani y Kharrazian, 2020).
Es necesario enfatizar estos importantes hallazgos. Los anticuerpos con una alta afinidad de unión al pico de SARS-CoV-2 y otras proteínas también tienen una alta afinidad de unión con tTG (asociada con la enfermedad celíaca), TPO (tiroiditis de Hashimoto), proteína básica de mielina (esclerosis múltiple) y varias proteínas endógenas. A diferencia del proceso autoinmune asociado con el cebado de patógenos, estas enfermedades autoinmunes suelen tardar años en manifestarse sintomáticamente.
Los autoanticuerpos generados por la proteína de pico predichos por Lyons-Weiler (2020) y descritos anteriormente se confirmaron con un estudio in vitro publicado más recientemente. En este artículo de seguimiento, Vojdani et. al., (2021) examinó nuevamente el tema de la reactividad cruzada de los anticuerpos, esta vez utilizando anticuerpos monoclonales humanos (mAb) contra la proteína de pico del SARS-CoV-2 en lugar de mAbs de ratón y conejo. Sus resultados confirmaron y ampliaron sus hallazgos anteriores. «En un límite de 0,32 DO [densidad óptica], el anticuerpo de la proteína de membrana del SARS-CoV-2 reaccionó con 18 de los 55 antígenos probados». Estos 18 antígenos endógenos abarcan la reactividad a los tejidos del hígado, las mitocondrias, el sistema nervioso y digestivo, el páncreas y otras partes del cuerpo.
En un informe sobre el síndrome inflamatorio multisistémico en niños (MIS-C), Carter et. Alabama. (2020) estudiaron 23 casos. Diecisiete de 23 (68%) pacientes tenían evidencia serológica de infección previa por SARS-CoV-2. De los tres anticuerpos evaluados en la población de pacientes (nucleocápside, RBD y pico), la densidad óptica del anticuerpo de la proteína del pico de IgG (que cuantifica las concentraciones de anticuerpos frente a una curva estandarizada (Wikipedia, 2021)) fue la más alta (consulte la Figura 1d en Carter et al. ., 2020).
En la actualidad, se especula comúnmente que MIS-C es un ejemplo de cebado inmunológico por exposición previa al SARS-CoV-2 u otros coronavirus. Buonsenso et. Alabama. (2020) revisaron múltiples similitudes inmunológicas entre MIS-C y la enfermedad relacionada con una infección previa por estreptococos del grupo A β-hemolítico (GAS). Los autores escriben: “Podemos especular que la exposición múltiple de los niños al SARS-CoV-2 con padres con COVID-19 puede funcionar como un estímulo del sistema inmunológico, como sucede con la infección por GAS y, en niños genéticamente predispuestos, conducir a [MIS -C] desarrollo. Otra hipótesis es que infecciones previas con otros coronavirus, mucho más frecuentes en la población pediátrica, pueden haber preparado al sistema inmunológico infantil para el virus SARS-CoV-2 ”.
En junio de 2019, Galeotti y Bayry (2020) revisaron la aparición de enfermedades inflamatorias y autoinmunes en pacientes con COVID-19. Centran su análisis en MIS-C. Después de revisar varios informes publicados anteriormente de un vínculo temporal entre COVID-19 y el inicio de MIS-C y describir una serie de posibles conexiones mecánicas entre los dos, los autores notaron que no se había establecido un vínculo causal. En una recomendación algo profética, escribieron: “Se debe considerar un análisis fino de homología entre varios antígenos de SARS-CoV-2 y autoantígenos, mediante el uso de enfoques in silico y la validación en modelos experimentales, para confirmar esta hipótesis. . » Es precisamente este tipo de análisis in silico realizado por Lyons-Weiler (2020) y por Ehrenfeld et. Alabama. (2020) descrito en los párrafos iniciales de esta sección que encontró la estrecha homología entre los antígenos virales y los autoantígenos. Si bien esto puede no confirmar definitivamente el vínculo causal planteado por Galeotti y Bayry, es una fuerte evidencia de apoyo.
La autoinmunidad es cada vez más reconocida como una secuela de COVID-19. Existen múltiples informes de personas previamente sanas que desarrollaron enfermedades como la púrpura trombocitopénica idiopática, el síndrome de Guillain-Barré y la anemia hemolítica autoinmune (Galeotti y Bayry, 2020). Hay tres informes de casos independientes de lupus eritemoso sistémico (LES)
con manifestaciones cutáneas después de COVID-19 sintomático. En un caso, un hombre de 39 años tuvo inicio de LES dos meses después del tratamiento ambulatorio por COVID-19 (Zamani et.al., 2021). Slimani et.al. describen otro caso sorprendente de LES fatal y de rápida progresión con manifestaciones cutáneas. (2021).
Los autoanticuerpos se encuentran con mucha frecuencia en pacientes con COVID-19, incluidos los anticuerpos que se encuentran en la sangre (Vlachoyiannopoulos et. Al., 2020) y en el líquido cefalorraquídeo (SFC) (Franke et. Al., 2021).
Aunque el SARS-CoV-2 no se encuentra en el LCR, se teoriza que los autoanticuerpos creados en respuesta a la exposición al SARS-CoV-2 pueden provocar al menos una parte de las complicaciones neurológicas documentadas en los pacientes con COVID-19. Una importante carta al editor enviada a la revista Arthritis & Rheumatology por Bertin et. Alabama. (2020) observaron la alta prevalencia y la fuerte asociación (p = 0,009) de autoanticuerpos contra cardiolipina en pacientes con COVID-19 con enfermedad grave.
Zuo et. Alabama. (2020) encontraron autoanticuerpos antifosfolípidos en el 52% de los pacientes COVID-19 hospitalizados y especularon que estos anticuerpos contribuyen a la alta incidencia de coagulopatías en estos pacientes. Schiaffino et. Alabama. (2020) informaron que el suero de un alto porcentaje de pacientes hospitalizados con COVID-19 contenía autoanticuerpos reactivos a la membrana plasmática de hepatocitos y células gástricas. Se encontró que un paciente con síndrome de Guillain-Barré tenía reactividad de anticuerpos en el líquido cefalorraquídeo (SFC), lo que llevó a los autores a sugerir que la reactividad cruzada con proteínas en el SFC podría conducir a complicaciones neurológicas observadas en algunos pacientes con COVID-19. En una revisión más reciente, Gao et. Alabama. (2021) observaron altos niveles de autoanticuerpos en pacientes con COVID-19 en múltiples estudios. Ellos concluyen,
Una publicación reciente recopila una gran cantidad de pruebas de que se pueden encontrar autoanticuerpos contra una amplia gama de receptores y tejidos en personas que han tenido una infección previa por SARS-CoV-2. «Los 31 ex pacientes con COVID-19 tenían entre 2 y 7 diferentes GPCR-fAAB [autoanticuerpos funcionales del receptor acoplado a proteína G] que actuaban como agonistas del receptor». (Wallukat et. Al.2021) La diversidad de los GPCR-fAAB identificados, que abarcan tanto la actividad agonista como la antagonista en los receptores diana, está fuertemente correlacionada con una variedad de síntomas posteriores al COVID-19, que incluyen taquicardia, bradicardia, alopecia, déficit de atención, PoTS , neuropatías y otros.
El mismo estudio, que hace referencia a los autoanticuerpos predichos por Lyons-Weiler (2020) mencionados anteriormente, señala con obvia grave preocupación: “La proteína de pico Sars-CoV-2 es un objetivo epitópico potencial para procesos autoinmunológicos inducidos por biomimetismo [ 25 ]. Por lo tanto, creemos que será extremadamente importante investigar si los GPCR-fAAB también serán detectables después de la inmunización mediante vacunación contra el virus ”.
Aquí hemos revisado la evidencia de que la proteína de pico de SARS-CoV-2 tiene una amplia homología de secuencia con múltiples proteínas humanas endógenas y podría preparar al sistema inmunológico hacia el desarrollo de enfermedades autoinflamatorias y autoinmunes. Esto es particularmente preocupante dado que la proteína se ha rediseñado con dos residuos de prolina adicionales para impedir potencialmente su eliminación de la circulación a través de la fusión de membranas. Estas enfermedades pueden presentarse de forma aguda y en períodos de tiempo relativamente cortos, como con MIS-C, o podría potencialmente no manifestarse durante meses o años después de la exposición a la proteína de pico, ya sea por infección natural o por vacunación.
Muchos de los que dan positivo por COVID-19 no expresan síntomas. El número de casos positivos por PCR asintomáticos varía ampliamente entre los estudios, desde un mínimo del 1,6% hasta un máximo del 56,5% (Gao et. Al., 2020). Aquellos que son insensibles al COVID-19 probablemente tengan un sistema inmunológico innato muy fuerte. Los neutrófilos y macrófagos de la barrera mucosa sana eliminan rápidamente los virus, a menudo sin la necesidad de que el sistema adaptativo produzca anticuerpos. Sin embargo, la vacuna evita por completo intencionalmente el sistema inmunológico de la mucosa, tanto a través de su inyección más allá de las barreras mucosas naturales como de su configuración artificial como una nanopartícula que contiene ARN. Como se señaló en Carsetti (2020), aquellos con una fuerte respuesta inmune innata experimentan casi universalmente una infección asintomática o solo una presentación leve de la enfermedad COVID-19. A pesar de eso,
El bazo, las plaquetas y la trombocitopenia
El Dr. Gregory Michael, un obstetra de Miami Beach, murió de una hemorragia cerebral 16 días después de recibir la primera dosis de la vacuna Pfizer / BioNTech COVID-19. A los tres días de recibir la vacuna, desarrolló púrpura trombocitopénica idiopática (PTI), un trastorno autoinmune en el que las células inmunes atacan y destruyen las plaquetas. Su recuento de plaquetas se redujo precipitadamente, y esto provocó una incapacidad para detener la hemorragia interna, lo que provocó el accidente cerebrovascular, como se describe en un artículo del New York Times (Grady y Mazzei, 2021). The New York Times siguió con un segundo artículo que discutió varios otros casos de PTI después de la vacunación contra el SARS-CoV-2 (Grady, 2021),
1. Biodistribución de vacunas de ARNm
Varios estudios sobre vacunas basadas en ARNm han confirmado de forma independiente que el bazo es un centro importante de actividad para la respuesta inmune. Un estudio sobre una vacuna contra el virus de la influenza basada en ARNm es extremadamente relevante para responder a la pregunta de la biodistribución del ARNm en la vacuna. Esta vacuna, al igual que las vacunas contra el SARS-CoV-2, se diseñó como nanopartículas lipídicas con ARN modificado que codifica la hemaglutinina (la proteína de fusión de superficie equivalente a la proteína de pico en los virus corona) y se administró mediante inyección muscular. Se siguió la concentración de ARNm a lo largo del tiempo en varias muestras de tejido y se registró la concentración máxima observada en cada sitio. Como era de esperar, la concentración fue mayor en el músculo en el lugar de la inyección (5680 ng / ml). Este nivel disminuyó lentamente con el tiempo, alcanzando la mitad del valor original en 18. 8 horas después de la inyección. El siguiente nivel más alto se observó en el ganglio linfático proximal, alcanzando un máximo de 2.120 ng / ml y no descendiendo a la mitad de este valor hasta 25,4 horas después. Entre los órganos, los niveles más altos se encontraron con diferencia en el bazo (86,69 ng / ml) y el hígado (47,2 ng / ml). En otras partes del cuerpo, la concentración fue de 100 a 1000 veces menor. En particular, los ganglios linfáticos distales solo tenían una concentración máxima de 8 ng / ml. Llegaron a la conclusión de que el ARNm se distribuye desde el lugar de la inyección hasta el hígado y el bazo a través del sistema linfático y finalmente llega a la circulación general. Esto probablemente sucede a través de su transporte dentro de los macrófagos y otras células inmunes que lo absorben en el 4 horas después. Entre los órganos, los niveles más altos se encontraron con diferencia en el bazo (86,69 ng / ml) y el hígado (47,2 ng / ml). En otras partes del cuerpo, la concentración fue de 100 a 1000 veces menor. En particular, los ganglios linfáticos distales solo tenían una concentración máxima de 8 ng / ml. Llegaron a la conclusión de que el ARNm se distribuye desde el lugar de la inyección hasta el hígado y el bazo a través del sistema linfático y finalmente llega a la circulación general. Esto probablemente sucede a través de su transporte dentro de los macrófagos y otras células inmunes que lo absorben en el 4 horas después. Entre los órganos, los niveles más altos se encontraron con diferencia en el bazo (86,69 ng / ml) y el hígado (47,2 ng / ml). En otras partes del cuerpo, la concentración fue de 100 a 1000 veces menor. En particular, los ganglios linfáticos distales solo tenían una concentración máxima de 8 ng / ml. Llegaron a la conclusión de que el ARNm se distribuye desde el lugar de la inyección hasta el hígado y el bazo a través del sistema linfático y finalmente llega a la circulación general. Esto probablemente sucede a través de su transporte dentro de los macrófagos y otras células inmunes que lo absorben en el Llegaron a la conclusión de que el ARNm se distribuye desde el lugar de la inyección hasta el hígado y el bazo a través del sistema linfático y finalmente llega a la circulación general. Esto probablemente sucede a través de su transporte dentro de los macrófagos y otras células inmunes que lo absorben en el Llegaron a la conclusión de que el ARNm se distribuye desde el lugar de la inyección hasta el hígado y el bazo a través del sistema linfático y finalmente llega a la circulación general. Esto probablemente sucede a través de su transporte dentro de los macrófagos y otras células inmunes que lo absorben en el sitio de inyección muscular. De manera inquietante, también llega al cerebro, aunque a niveles mucho más bajos (Bahl et al., 2017). El informe de evaluación de la Agencia Europea de Medicamentos para la vacuna Moderna también señaló que el ARNm podría detectarse en el cerebro después de la administración intramuscular en aproximadamente el 2% del nivel encontrado en el plasma (Agencia Europea de Medicamentos, 2021).
En otro experimento realizado para rastrear la ruta de biodistribución de las vacunas de ARN, se administró una vacuna de ARN contra la rabia por vía intramuscular a ratas en una sola dosis. La vacuna incluía un código para una proteína inmunogénica contra la rabia, así como el código para la ARN polimerasa, y se formuló como una nanoemulsión de aceite en agua. Por lo tanto, no es completamente representativo de las vacunas de ARNm del SARS-CoV-2. Sin embargo, su administración intramuscular y su dependencia de la captación de ARN por las células inmunes probablemente signifique que migraría a través de los tejidos en una vía similar a la del
Vacuna contra el SARS-CoV-2. Los autores observaron un agrandamiento de los ganglios linfáticos de drenaje, y los estudios de tejidos revelaron que el ARN de la rabia apareció inicialmente en el lugar de la inyección y en los ganglios linfáticos de drenaje en un día, y también se encontró en la sangre, los pulmones, el bazo y el hígado (Stokes et al. al., 2020).
Estos resultados son consistentes con el estudio anterior sobre las vacunas de ARNm de la influenza.
Finalmente, un estudio que comparó nanopartículas de ARNm que expresan luciferasa con células dendríticas de ARNm que expresan luciferasa como un enfoque alternativo a la vacunación reveló que la señal de luciferasa alcanzó una gama más amplia de sitios linfoides con el mecanismo de liberación de nanopartículas. Más importante aún, la señal de luciferasa se concentró en el bazo para las nanopartículas en comparación con la dominancia en los pulmones para las células dendríticas (Firdessa-Fite y Creuso, 2020).
2. Trombocitopenia inmunitaria
La trombocitopenia inmunitaria (PTI) ha surgido como una complicación importante del COVID-19 (Bhattacharjee y Banerjee, 2020). En muchos casos, surge después de la recuperación completa de la enfermedad, es decir, después de que el virus se ha eliminado, lo que sugiere que se trata de un fenómeno autoinmune. Una vía probable por la cual la PTI podría ocurrir después de la vacunación es a través de la migración de células inmunes que llevan una carga de nanopartículas de ARNm a través del sistema linfático al bazo. Estas células inmunes producirían proteína de pico de acuerdo con el código en las nanopartículas, y la proteína de pico induciría la generación de anticuerpos IgG por parte de las células B.
La PTI aparece inicialmente como petequias o púrpura en la piel y / o sangrado de las superficies mucosas. Tiene un alto riesgo de muerte por hemorragia y accidente cerebrovascular. La PTI se caracteriza tanto por una mayor destrucción de plaquetas como por una menor producción de plaquetas, y los autoanticuerpos juegan un papel fundamental (Sun y Shan, 2019). Las plaquetas están recubiertas por anticuerpos antiplaquetarios y complejos inmunes, y esto induce su eliminación por parte de los fagocitos.
Particularmente en condiciones de autofagia alterada, la cascada de señalización resultante también puede resultar en la supresión de la producción de megacariocitos en la médula ósea, que son las células precursoras de la producción de plaquetas (Sun y Shan, 2019). Un estudio de caso de un paciente diagnosticado con COVID-19 es revelador porque desarrolló trombocitopenia de aparición repentina un par de días después de haber sido dado de alta del hospital debido a una prueba de ácido nucleico de COVID-19 negativa. Después de este desarrollo, se verificó que el paciente tenía un número reducido de megacariocitos productores de plaquetas, mientras que los anticuerpos autoinmunes fueron negativos, lo que sugiere un problema con la producción de plaquetas más que con la destrucción de plaquetas (Chen et al., 2020).
La autofagia es esencial para eliminar proteínas, orgánulos y patógenos bacterianos y virales dañados. Las alteraciones en las vías de autofagia están emergiendo como un sello distintivo de la patogénesis de muchos virus respiratorios, incluidos el virus de la influenza, MERS-CoV, SARS-CoV y, lo que es más importante, SARS-CoV-2 (Limanaqi et al., 2020). La autofagia es sin duda fundamental en la eliminación de la proteína de pico producida por las células inmunes programadas para producirla a través de las vacunas de ARNm.
Se puede especular que la autofagia alterada evita la eliminación de la proteína de punta producida por los macrófagos del ARNm de la vacuna. Como mostraremos más adelante, las plaquetas poseen proteínas autofágicas y utilizan la autofagia para eliminar los virus. La autofagia alterada es un rasgo característico de la PTI y puede ser clave para el ataque autoinmune a las plaquetas (Wang et al., 2019).
3. Un papel fundamental para el bazo
El bazo es el órgano linfoide secundario más grande de los seres humanos y contiene hasta 1/3 de las plaquetas del cuerpo. El bazo es el sitio principal para la destrucción de plaquetas durante la PTI, ya que controla la respuesta de anticuerpos contra las plaquetas. Los dos principales autoanticuerpos asociados con la PTI son contra la inmunoglobulina G (IgG) y el complejo de glicoproteína (GP) IIb / IIIa en las plaquetas (Aslam et al., 2016).
El bazo juega un papel central en la eliminación de antígenos extraños y la síntesis de IgG por las células B. Tras la exposición a un antígeno, como la proteína de pico, los neutrófilos en la zona marginal del bazo adquieren la capacidad de interactuar con las células B, induciendo la producción de anticuerpos (Puga et al., 2011).
Es probable que esto sea crucial para el éxito de la vacunación. La modificación del ARNm con pseudouridina es importante para asegurar la supervivencia del ARN el tiempo suficiente para que llegue al bazo. En un experimento sobre la inyección de nanopartículas de ARNm en ratones, tanto el ARNm entregado como la proteína codificada pudieron detectarse en el bazo 1, 4 y 24 horas después de la inyección, a niveles significativamente más altos que cuando se utilizó ARN no modificado (Karikó et al., 2008).
Un mecanismo sofisticado de comunicación cruzada entre plaquetas y neutrófilos en el bazo puede provocar trombocitopenia, mediada por una respuesta patológica llamada NETosis. El TLR7 de plaquetas (receptor 7 de tipo toll) reconoce las partículas de influenza en circulación y conduce a su absorción y endocitosis por las plaquetas. Después de engullir los virus, las plaquetas estimulan a los neutrófilos para que liberen su ADN dentro de las trampas extracelulares de neutrófilos (NET) (Koupenova et al., 2019), y el ADN, en cantidades excesivas, lanza una cascada protrombótica.
4. Lecciones de la influenza
El virus de la influenza, como el virus corona, es un virus de ARN monocatenario. La trombocitopenia es una complicación común de la infección por influenza y su gravedad predice los resultados clínicos en pacientes críticamente enfermos (Jansen et al., 2020). Las plaquetas contienen abundantes glicoproteínas en sus membranas que actúan como receptores y apoyan la adhesión a la pared endotelial. Los autoanticuerpos contra las glicoproteínas plaquetarias se encuentran en la mayoría de los pacientes con trombocitopenia autoinmune (Lipp et al., 1998). El virus de la influenza se une a las células a través de glicoproteínas y libera una enzima llamada neuraminidasa que puede descomponer los glicosaminoglicanos unidos a las glicoproteínas y liberarlos. Esta acción probablemente expone las glicoproteínas plaquetarias a las células B, lo que induce la producción de autoanticuerpos.
Las plaquetas parecen jugar un papel importante en la eliminación viral. Un minuto después de que las plaquetas se incubaron junto con los virus de la influenza, los virus ya se habían adherido a las plaquetas.
La internalización posterior, posiblemente por fagocitosis, alcanzó su punto máximo a los 30 minutos (Jansen et al., 2020).
La proteína pico del SARS-CoV-2 se une al ácido siálico, lo que significa que podría unirse a las glicoproteínas en las membranas plaquetarias (Baker et al., 2020). Existe una similitud estructural entre la proteína de pico S1 en el CoV del SARS y la neuraminidasa expresada por el virus de la influenza, lo que podría significar que la proteína de pico posee actividad neuraminidasa (Zhang et al., 2004). Varios virus expresan neuraminidasa y generalmente actúa enzimáticamente para catabolizar los glicanos en glicoproteínas a través de la desialilación.
Por lo tanto, parece plausible que pueda producirse una cascada peligrosa que conduce a la PTI después de la vacunación con ARNm, incluso sin la presencia de virus vivos, particularmente en el contexto de la autofagia alterada. Las células inmunitarias del músculo del brazo absorben las partículas de ARN y circulan dentro del sistema linfático, acumulándose en el bazo. Allí, las células inmunitarias producen abundantes proteínas de pico, que se unen a las glicoproteínas plaquetarias y las desializan. La interacción de las plaquetas con los neutrófilos causa NETosis y el lanzamiento de una cascada inflamatoria. Las glicoproteínas expuestas se convierten en objetivos de los anticuerpos autoinmunes que luego atacan y eliminan las plaquetas, lo que provoca una caída rápida en el recuento de plaquetas y un evento potencialmente mortal.
Activación del herpes zóster latente
Un estudio observacional realizado en Tel Aviv Medical Center y Carmel Medical Center en Haifa, Israel, encontró una tasa significativamente mayor de herpes zóster después de la vacunación Pfizer (Furer 2021). Este estudio observacional monitoreó a pacientes con enfermedades reumáticas inflamatorias autoinmunes preexistentes (AIIRD). Entre los 491 pacientes con AIIRD durante el período de estudio, a 6 (1,2%) se les diagnosticó herpes zóster como primer diagnóstico entre 2 días y 2 semanas después de la primera o la segunda vacunación. En el grupo de control de 99 pacientes no se identificaron casos de herpes zóster.
La base de datos VAERS de los CDC, consultada el 19 de abril de 2021, contiene 278 informes de herpes zóster después de las vacunas Moderna o Pfizer. Dado el subregistro documentado a VAERS (Lazarus et al. 2010), y dada la naturaleza asociativa de los informes VAERS, no es posible probar ningún vínculo causal entre las vacunas y los informes de zóster. Sin embargo, creemos que la aparición de zóster es otra «señal» importante en VAERS.
Este mayor riesgo de culebrilla, si es válido, puede tener importantes implicaciones más amplias. Múltiples estudios han demostrado que los pacientes con inmunodeficiencia primaria o adquirida son más susceptibles a la infección por herpes zóster grave (Ansari et al., 2020). Esto sugiere que las vacunas de ARNm pueden estar suprimiendo la respuesta inmune innata. Existe una interrelación entre el TNF-α y el interferón de tipo I en las enfermedades autoinmunitarias, en las que cada uno suprime al otro (Palucka et al., 2005). El interferón de tipo I inhibe la replicación del virus varicela-zoster (Ku et al., 2016). El TNF-α está fuertemente regulado al alza en una respuesta inflamatoria, que es inducida por las nanopartículas lipídicas en la vacuna. Su regulación positiva también está asociada con el estado inflamatorio crónico de la artritis reumatoide (Matsuno et al., 2002).
La expresión exuberante de TNF-α después de la vacunación puede estar interfiriendo con la célula dendrítica INF-α respuesta que mantiene a raya el herpes zóster latente.
Toxicidad de la proteína de pico
Ahora está surgiendo la imagen de que el SARS-CoV-2 tiene efectos graves sobre la vasculatura de múltiples órganos, incluida la vasculatura del cerebro. Como se mencionó anteriormente, la proteína espiga facilita la entrada del virus en una célula huésped al unirse a ACE2 en la membrana plasmática. La ACE2 es una proteína de membrana integral de tipo I que escinde la angiotensina II en angiotensina (1-7), lo que elimina la angiotensina II y reduce la presión arterial. En una serie de artículos, Yuichiro Suzuki, en colaboración con otros autores, presentó un fuerte argumento de que la proteína de pico por sí sola puede causar una respuesta de señalización en la vasculatura con consecuencias potencialmente generalizadas (Suzuki, 2020; Suzuki et al., 2020; Suzuki et al., 2020; Suzuki et al. ., 2021; Suzuki y Gychka, 2021). Estos autores observaron que, en casos graves de COVID-19, el SARS-CoV-2 provoca cambios morfológicos importantes en la vasculatura pulmonar.
El análisis post-mortem de los pulmones de los pacientes que fallecieron por COVID-19 reveló características histológicas que mostraban un engrosamiento de la pared vascular, principalmente debido a la hipertrofia de la túnica media. Las células de músculo liso agrandadas se habían redondeado, con núcleos hinchados y vacuolas citoplasmáticas (Suzuki et al., 2020). Además, demostraron que la exposición de células de músculo liso de la arteria pulmonar humana cultivadas a la subunidad S1 de la proteína espiga del SARS-CoV-2 era suficiente para promover la señalización celular sin el resto de los componentes del virus.
Los artículos posteriores (Suzuki et al., 2021, Suzuki y Gychka, 2021) mostraron que la subunidad S1 de la proteína de pico suprime la ECA2, causando una afección que se asemeja a la hipertensión arterial pulmonar (HAP), una enfermedad pulmonar grave con una mortalidad muy alta. Su modelo se muestra aquí en la Figura 2.
Figura 2: Un modelo simple para un proceso mediante el cual la proteína de pico producida a través de las vacunas de ARNm podría inducir una respuesta patológica distinta de la inducción deseable de anticuerpos para suprimir la entrada viral. Suzuki y Gychka, 2021.
De manera ominosa, Suzuki y Gychka (2021) escribieron: “Por lo tanto, estos estudios in vivo demostraron que la proteína de pico de SARS-CoV-1 (sin el resto del virus) reduce la expresión de ACE2, aumenta el nivel de angiotensina II, y agrava la lesión pulmonar «. Los «estudios in vivo» a los que se refieren aquí (Kuba et al., 2005) habían demostrado que la lesión pulmonar inducida por el coronavirus del SARS se debía principalmente a la inhibición de la ECA2 por el pico del SARS-CoV proteína, provocando un gran aumento de la angiotensina-II. Suzuki y col. (2021) pasó a demostrar experimentalmente que el componente S1 del virus SARS-CoV-2, a una concentración baja de 130 pM, activó la vía de señalización MEK / ERK / MAPK para promover el crecimiento celular. Especularon que estos efectos no se limitarían a la vasculatura pulmonar. La cascada de señalización desencadenada en la vasculatura del corazón causaría enfermedad de las arterias coronarias y la activación en el cerebro podría provocar un accidente cerebrovascular. También se predeciría la hipertensión sistémica. Plantearon la hipótesis de que esta capacidad de la proteína de pico para promover la hipertensión arterial pulmonar podría predisponer a los pacientes que se recuperan de SARS-CoV-2 para desarrollar posteriormente insuficiencia cardíaca del ventrículo derecho. Además, sugirieron que podría ocurrir un efecto similar en respuesta a las vacunas de ARNm, y advirtieron de las posibles consecuencias a largo plazo tanto para niños como para adultos que recibieron vacunas COVID-19 basadas en la proteína de pico (Suzuki y Gychka, 2021).
Un interesante estudio de Lei et. Alabama. (2021) encontraron que los pseudovirus (esferas decoradas con la proteína SARS-CoV-2 S1 pero que carecen de ADN viral en su núcleo) causaban inflamación y daño tanto en las arterias como en los pulmones de los ratones expuestos por vía intratraqueal. Luego expusieron células endoteliales humanas sanas a las mismas partículas de pseudovirus. La unión de estas partículas a los receptores ACE2 endoteliales provocó daño mitocondrial y fragmentación en esas células endoteliales, lo que dio lugar a cambios patológicos característicos en el tejido asociado. Este estudio deja en claro que la proteína de pico sola, no asociada con el resto del genoma viral, es suficiente para causar el daño endotelial asociado con COVID-19. Las implicaciones para las vacunas destinadas a hacer que las células fabriquen la proteína de pico son claras y son una causa obvia de preocupación.
Los síntomas neurológicos asociados con COVID-19, como dolor de cabeza, náuseas y mareos, encefalitis y coágulos de sangre cerebrales fatales, son todos indicadores de efectos virales dañinos en el cerebro. Buzhdygan y col. (2020) propuso que las células endoteliales microvasculares del cerebro humano primario podrían causar estos síntomas. La ACE2 se expresa de forma ubicua en las células endoteliales de los capilares cerebrales. La expresión de ACE2 está regulada al alza en la vasculatura cerebral en asociación con la demencia y la hipertensión, los cuales son factores de riesgo para los malos resultados de COVID-19. En un estudio in vitro de la barrera hematoencefálica, el componente S1 de la proteína de pico promovió la pérdida de la integridad de la barrera, lo que sugiere que la proteína de pico que actúa sola desencadena una respuesta proinflamatoria en las células endoteliales del cerebro. lo que podría explicar las consecuencias neurológicas de la enfermedad (Buzhdygan et al., 2020). Las implicaciones de esta observación son inquietantes porque las vacunas de ARNm inducen la síntesis de la proteína de pico, que teóricamente podría actuar de manera similar para dañar el cerebro.
La proteína de pico generada de forma endógena por la vacuna también podría afectar negativamente a los testículos masculinos, ya que el receptor ACE2 se expresa en gran medida en las células de Leydig de los testículos (Verma et al., 2020). Varios estudios han demostrado ahora que la proteína de pico de coronavirus puede acceder a las células de los testículos a través del receptor ACE2 e interrumpir la reproducción masculina (Navarra et al., 2020; Wang y Xu, 2020). Un artículo que incluía el examen post mortem de los testículos de seis pacientes varones con COVID-19 encontró evidencia microscópica de proteína de pico en las células intersticiales en los testículos de pacientes con testículos dañados (Achua et al., 2021).
Un posible vínculo con las enfermedades priónicas y la neurodegeneración
Las enfermedades priónicas son un conjunto de enfermedades neurodegenerativas que se inducen a través del plegamiento incorrecto de proteínas corporales importantes, que forman oligómeros tóxicos que finalmente se precipitan como fibrillas y causan un daño generalizado a las neuronas. Stanley Prusiner acuñó por primera vez el nombre de «prión» para describir estas proteínas mal plegadas (Prusiner, 1982). La enfermedad priónica más conocida es la enfermedad MADCOW (encefalopatía espongiforme bovina), que se convirtió en una epidemia en el ganado europeo a partir de la década de 1980. El sitio web de los CDC sobre enfermedades priónicas establece que «las enfermedades priónicas suelen progresar rápidamente y siempre son mortales». (Centros para el Control y la Prevención de Enfermedades, 2018). Ahora se cree que muchas enfermedades neurodegenerativas, incluidas la enfermedad de Alzheimer, la enfermedad de Parkinson y la esclerosis lateral amiotrófica (ELA) puede ser una enfermedad priónica, y los investigadores han identificado partículas infecciosas proteínicas específicas relacionadas con estas enfermedades (Weickenmeier et al., 2019).
Además, los investigadores han identificado un motivo característico relacionado con la susceptibilidad al plegado incorrecto en oligómeros tóxicos, llamado motivo de cremallera de glicina. Se caracteriza por un patrón de dos residuos de glicina espaciados por tres aminoácidos intermedios, representados como GxxxG. El prión bovino vinculado a MADCOW tiene una secuencia espectacular de diez GxxxG seguidos (ver uniprot.org/uniprot/P10279).
De manera más general, el motivo GxxxG es una característica común de las proteínas transmembrana, y las glicinas juegan un papel esencial en la reticulación de las hélices α en la proteína (Mueller et al., 2014). Las proteínas priónicas se vuelven tóxicas cuando las hélices α se pliegan mal como láminas β, y luego la proteína se ve afectada en su capacidad para ingresar a la membrana (Prusiner, 1982). Las glicinas dentro de los motivos transmembrana de cremallera de glicina en la proteína precursora de amiloide-β (APP) desempeñan un papel central en el plegamiento incorrecto de amiloide-β relacionado con la enfermedad de Alzheimer (Decock et al., 2016). APP contiene un total de cuatro motivos GxxxG.
Cuando se considera que la proteína de pico del SARS-CoV-2 es una proteína transmembrana y que contiene cinco motivos GxxxG en su secuencia (ver uniprot.org/uniprot/P0DTC2), resulta extremadamente plausible que pueda comportarse como un prión. Una de las secuencias GxxxG está presente dentro de su dominio de fusión de membrana. Recuerde que las vacunas de ARNm están diseñadas con una secuencia alterada que reemplaza dos aminoácidos adyacentes en el dominio de fusión con un par de prolina. Esto se hace intencionalmente para obligar a la proteína a permanecer en su estado abierto y dificultar su fusión con la membrana. Esto nos parece un paso peligroso hacia un plegado incorrecto que podría conducir a la enfermedad priónica.
Un artículo publicado por J. Bart Classen (2021) propuso que la proteína de pico en las vacunas de ARNm podría causar enfermedades similares a priones, en parte a través de su capacidad para unirse a muchas proteínas conocidas e inducir su plegamiento incorrecto en posibles priones. Idrees y Kumar (2021) han propuesto que el componente S1 de la proteína de pico tiende a actuar como un amiloide funcional y a formar agregados tóxicos. Estos autores escribieron que S1 tiene la capacidad de «formar agregados amiloides y tóxicos que pueden actuar como semillas para agregar muchas de las proteínas cerebrales mal plegadas y, en última instancia, conducir a la neurodegeneración».
Según Tetz y Tetz (2020), la forma de la proteína de pico en el SARS-CoV-2 tiene regiones priónicas que no están presentes en las proteínas de pico de otros coronavirus. Si bien esto se informó en un artículo no revisado por pares, los autores habían publicado un artículo anterior en 2018 que identificaba regiones similares a priones en múltiples virus eucariotas, por lo que tienen una experiencia considerable en esta área (Tetz y Tetz, 2018).
Un último punto aquí se relaciona con la información sobre la vacuna Pfizer en particular. El Informe de Evaluación Pública de la Agencia Europea de Medicamentos (EMA) es un documento presentado para obtener la aprobación para comercializar la vacuna en Europa. Describe en detalle una revisión del proceso de fabricación, así como una amplia gama de datos de prueba asociados. Una revelación preocupante es la presencia de «especies fragmentadas» de ARN en la solución de inyección. Estos son fragmentos de ARN que resultan de la terminación temprana del proceso de transcripción del molde de ADN. Estos fragmentos, si son traducidos por la célula después de la inyección, generarían proteínas de pico incompletas, lo que nuevamente daría como resultado una estructura tridimensional alterada e impredecible y un impacto fisiológico que es, en el mejor de los casos, neutral y, en el peor, perjudicial para el funcionamiento celular. Habia una significativa cantidad más de formas de ARN que se encuentran en los productos fabricados comercialmente que en los productos utilizados en los ensayos clínicos. Estos últimos se produjeron mediante un proceso de fabricación mucho más controlado.
Pfizer afirma que los fragmentos de ARN «probablemente … no darán como resultado proteínas expresadas» debido a su supuesta degradación rápida dentro de la célula. Sin embargo, no se presentaron datos para descartar la expresión de proteínas, lo que dejó a los revisores comentar: “Estas formas [de ARN fragmentado] están mal caracterizadas y los datos limitados proporcionados para la expresión de proteínas no abordan completamente las incertidumbres relacionadas con el riesgo de traducir proteínas / péptidos distintos de la proteína de pico prevista ”(EMA 2020). Hasta donde sabemos, no se han recibido datos desde ese momento.
Si bien no estamos afirmando que las proteínas sin picos generadas a partir de ARN fragmentado estén mal plegadas o sean patológicas, creemos que al menos contribuirían al estrés celular que promueve cambios conformacionales asociados a priones en la proteína de pico que está presente.
1. Lecciones de la enfermedad de Parkinson
La enfermedad de Parkinson es una enfermedad neurodegenerativa asociada con depósitos de cuerpos de Lewy en el cerebro, y la principal proteína que se encuentra en estos cuerpos de Lewy es la α-sinucleína. Esa proteína, la α-sinucleína, es sin duda similar a un prión en la medida en que, en determinadas condiciones, se agrega en oligómeros solubles tóxicos y fibrillas (Lema Tomé et al., 2013). La investigación ha demostrado que la α-sinucleína mal plegada se puede formar primero en el intestino y luego viajar desde allí al cerebro a lo largo del nervio vago, probablemente en forma de exosomas liberados de las células moribundas donde se originó la proteína mal plegada (Kakarla et al., 2020; Steiner et al., 2011). Las condiciones celulares que promueven el plegamiento incorrecto incluyen tanto un pH ácido como una alta expresión de citocinas inflamatorias. Está claro que el nervio vago es fundamental para la transmisión de proteínas mal plegadas al cerebro,
La atrofia del nervio vago en asociación con la enfermedad de Parkinson proporciona más evidencia de la participación del nervio vago en el transporte de oligómeros de α-sinucleína mal plegados desde el intestino al cerebro (Walter et al., 2018). Otra vía es a través del nervio olfatorio y la pérdida del sentido del olfato es un signo temprano de la enfermedad de Parkinson. Ominosamente, la disminución o pérdida del sentido del olfato también es un síntoma común de la infección por SARS-CoV-2.
Existen muchos paralelismos entre la α-sinucleína y la proteína de pico, lo que sugiere la posibilidad de una enfermedad de tipo priónico después de la vacunación. Ya hemos demostrado que el ARNm de la vacuna termina en altas concentraciones en el hígado y el bazo, dos órganos que están bien conectados con el nervio vago. Los lípidos catiónicos de la vacuna crean un pH ácido que conduce al plegamiento incorrecto y también inducen una fuerte respuesta inflamatoria, otra condición predisponente.
Los centros germinales son estructuras dentro del bazo y otros órganos linfoides secundarios donde las células dendríticas foliculares presentan antígenos a las células B, que a su vez perfeccionan su respuesta de anticuerpos. Los investigadores han demostrado que las vacunas de ARNm, a diferencia de las vacunas de proteínas recombinantes, provocan un desarrollo sólido de anticuerpos neutralizantes en estos centros germinales del bazo (Lederer et al., 2020). Sin embargo, esto también significa que las vacunas de ARNm inducen una situación ideal para la formación de priones a partir de la proteína espiga y su transporte a través de exosomas a lo largo del nervio vago hasta el cerebro.
Los estudios han demostrado que la propagación de priones de un animal a otro aparece por primera vez en los tejidos linfoides, particularmente en el bazo. Las células dendríticas foliculares diferenciadas son fundamentales para el proceso, ya que acumulan proteínas priónicas mal plegadas (Al-Dybiat et al., 2019). Una respuesta inflamatoria regula al alza la síntesis de α-sinucleína en estas células dendríticas, lo que aumenta el riesgo de formación de priones. Los priones que se acumulan en el citoplasma se empaquetan en cuerpos lipídicos que se liberan como exosomas (Liu et al., 2017). Estos exosomas eventualmente viajan al cerebro y causan enfermedades.
2. Posibilidad de que las personas vacunadas causen enfermedades en personas no vacunadas cercanas
Se ha hablado mucho en Internet sobre la posibilidad de que las personas vacunadas causen enfermedades en personas no vacunadas cercanas. Si bien esto puede parecer difícil de creer, existe un proceso plausible por el cual podría ocurrir a través de la liberación de exosomas de las células dendríticas en el bazo que contienen proteínas de pico mal plegadas, en complejo con otras proteínas reconformadas por priones. Estos exosomas pueden viajar a lugares distantes. No es imposible imaginar que se liberan de los pulmones y que una persona cercana los inhala. Se han detectado vesículas extracelulares, incluidos exosomas, en esputo, moco, líquido de revestimiento epitelial y líquido de lavado broncoalveolar en asociación con enfermedades respiratorias (Lucchetti et al., 2021).
Un estudio de fase 1/2/3 realizado por BioNTech sobre la vacuna de ARNm de Pfizer implicaba en su protocolo de estudio que anticipaban la posibilidad de exposición secundaria a la vacuna (BioNTech, 2020). El protocolo incluía el requisito de que las participantes del estudio informaran sobre la «exposición durante el embarazo». Luego dieron ejemplos de «exposición ambiental durante el embarazo» que incluían exposición «a la intervención del estudio por inhalación o contacto con la piel». Incluso sugirieron dos niveles de exposición indirecta: «Un miembro de la familia masculino o un proveedor de atención médica que ha estado expuesto a la intervención del estudio por inhalación o contacto con la piel, expone a su pareja femenina antes o alrededor del momento de la concepción».
Aparición de nuevas variantes del SARS-CoV-2
Se ha propuesto una hipótesis interesante en un artículo publicado en Nature, que describió un caso de enfermedad grave por COVID-19 en un paciente con cáncer que estaba tomando fármacos quimioterápicos inmunosupresores (Kemp et al., 2021). El paciente sobrevivió 101 días después de su ingreso en el hospital, finalmente sucumbiendo en la batalla contra el virus. El paciente arrojó virus constantemente durante los 101 días completos y, por lo tanto, lo trasladaron a una sala de aislamiento de enfermedades infecciosas con cambio de aire alto y presión negativa, para evitar la propagación contagiosa.
Durante el transcurso de la estancia hospitalaria, el paciente fue tratado con Remdesivir y posteriormente con dos rondas de plasma que contenía anticuerpos extraídas de individuos que se habían recuperado de COVID-19 (plasma convaleciente). Fue solo después de los tratamientos con plasma que el virus comenzó a mutar rápidamente y finalmente surgió una nueva cepa dominante, verificada a partir de muestras tomadas de la nariz y la garganta del paciente. Un paciente inmunodeprimido ofrece poco apoyo de las células T citotóxicas para eliminar el virus.
Un experimento in vitro demostró que esta cepa mutante tenía una sensibilidad reducida a múltiples unidades de plasma convaleciente extraídas de varios pacientes recuperados. Los autores propusieron que los anticuerpos administrados en realidad habían acelerado la tasa de mutación en el virus, porque el paciente no pudo eliminar completamente el virus debido a su débil respuesta inmune. Esto permitió que se estableciera un programa de «supervivencia del más apto», que finalmente llenó el cuerpo del paciente con una nueva cepa resistente a los anticuerpos. La replicación viral prolongada en este paciente condujo a un «escape inmunológico viral» y similares
las cepas podrían extenderse potencialmente muy rápidamente dentro de una población expuesta (Kemp et al., 2021). De hecho, un proceso similar podría estar funcionando para producir las nuevas cepas altamente contagiosas que ahora están apareciendo en el Reino Unido, Sudáfrica y Brasil.
Hay al menos dos preocupaciones que tenemos con respecto a este experimento, en relación con las vacunas de ARNm. La primera es que, a través de la infección continua de pacientes inmunodeprimidos, podemos esperar la aparición continua de más cepas nuevas que son resistentes a los anticuerpos inducidos por la vacuna, de modo que la vacuna puede volverse obsoleta rápidamente y puede haber demandas de la población se someterá a otra campaña de vacunación masiva. Un estudio publicado por investigadores de Pfizer ya ha demostrado que la eficacia de la vacuna se reduce para muchas de estas variantes de cepas. La vacuna fue solo 2/3 más efectiva contra la cepa sudafricana que contra la cepa original (Liu et al., 2021).
La segunda consideración más ominosa es reflexionar sobre lo que sucederá con un paciente inmunodeprimido después de la vacunación. Es concebible que respondan a la vacuna produciendo anticuerpos, pero esos anticuerpos no podrán contener la enfermedad después de la exposición a COVID-19 debido a la función alterada de las células T citotóxicas. Este escenario no es muy diferente de la administración de plasma convaleciente a pacientes inmunodeprimidos, por lo que podría generar la evolución de cepas resistentes a anticuerpos de la misma manera, solo que en una escala mucho mayor. Esta posibilidad seguramente se utilizará para defender rondas repetidas de vacunas cada pocos meses, con un número creciente de variantes virales codificadas en las vacunas. Esta es una carrera armamentista que probablemente perderemos.
Potencial de incorporación permanente del gen de la proteína espiga en el ADN humano Se ha afirmado que las vacunas basadas en ARNm son más seguras que las vacunas vectorizadas por ADN que funcionan incorporando el código genético de la proteína antigénica diana en un virus de ADN, porque el ARN no puede incorporarse inadvertidamente al genoma humano. Sin embargo, no está del todo claro que esto sea cierto. Ahora se sabe que el modelo clásico de ADN → ARN → proteína es falso. Ahora es indiscutible que existe una gran clase de virus llamados retrovirus que portan genes que transcriben de forma inversa el ARN en ADN complementario (ADNc). En 1975, Howard Temin, Renato Dulbecco y David Baltimore compartieron el Premio Nobel de Fisiología o Medicina en 1975 por su descubrimiento de la transcriptasa inversa y su síntesis por retrovirus (como el virus de inmunodeficiencia humana (VIH)) para derivar el ADN del ARN (Temin y Mizutani, 1970, Baltimore, 1970).
Mucho más tarde, se descubrió que la transcriptasa inversa no es exclusiva de los retrovirus. Más de un tercio del genoma humano está dedicado a misteriosos elementos móviles de ADN llamados SINEs y LINEs (elementos nucleares intercalados cortos y largos, respectivamente). Los LINE proporcionan capacidades de transcriptasa inversa para convertir ARN en ADN, y los SINE brindan soporte para integrar el ADN en el genoma. Por lo tanto, estos elementos proporcionan las herramientas necesarias para convertir el ARN en ADN e incorporarlo al genoma para mantener el nuevo gen a lo largo de las generaciones futuras (Weiner, 2002).
SINE y LINE son miembros de una clase más amplia de elementos genéticos llamados retrotransposones. Los retrotransposones pueden copiar y pegar su ADN en un nuevo sitio del genoma a través de un ARN intermedio, aunque posiblemente introduzca alteraciones genéticas en el proceso (Pray, 2008). Los retrotransposones, también conocidos como «genes saltarines», fueron identificados por primera vez por la genetista Barbara McClintock del Cold Spring Harbor Laboratory en Nueva York, hace más de 50 años (McClintock, 1965). Mucho más tarde, en 1983, fue reconocida con un premio Nobel por este trabajo.
Sorprendentemente, los retrotransposones parecen poder expandir su dominio de generación en generación. LINE y SINE colaboran para invadir nuevos sitios genómicos a través de la traducción de su ADN a ARN y de regreso a una nueva copia de ADN, que luego se inserta en una región rica en AT del genoma. Estos LINE y SINE se habían considerado durante mucho tiempo como ADN «basura», una idea absurda que ahora se ha disipado, a medida que ha aumentado la conciencia de sus funciones críticas. En particular, ahora ha quedado claro que también pueden importar ARN de una fuente exógena al ADN de un huésped mamífero. Se ha demostrado que los elementos repetidos de tipo retrovírico que se encuentran en el genoma del ratón, llamados partículas A intracisternales (IAP), son capaces de incorporar ARN viral en el genoma del ratón.
La recombinación entre un virus de ARN no retroviral exógeno y un retrotansposón IAP dio como resultado la transcripción inversa del ARN viral y la integración en el genoma del huésped (Geuking et al., 2009).
Además, como veremos más adelante, el ARNm de las nuevas vacunas contra el SARS-CoV-2 también podría transmitirse de generación en generación, con la ayuda de LINE expresados en espermatozoides, a través de ADNc no integrado encapsulado en plásmidos. Las implicaciones de este fenómeno predecible no están claras, pero pueden tener un gran alcance.
1. Retrovirus exógenos y endógenos
También existe la preocupación de que el ARN de las vacunas de ARNm pueda transferirse al genoma humano con la ayuda de retrovirus. Los retrovirus son una clase de virus que mantienen su información genómica en forma de ARN, pero que poseen las enzimas necesarias para realizar la transcripción inversa de su ARN en ADN e insertarlo en el genoma del huésped. Luego, confían en las herramientas naturales existentes del huésped para producir copias del virus a través de la traducción del ADN a ARN y para producir las proteínas que codifica el ARN viral y ensamblarlas en una nueva partícula viral (Lesbats et al., 2016). .
Los retrovirus endógenos humanos (HERV) son secciones benignas en el ADN de humanos que se parecen mucho a los retrovirus y que se cree que se han convertido en secuencias permanentes en el genoma humano a través de un proceso de integración de lo que originalmente era un retrovirus exógeno.
Los retrovirus endógenos abundan en todos los vertebrados con mandíbula y se estima que ocupan el 5-8% del genoma humano. La proteína sincitina, que se ha vuelto esencial para la fusión placentaria con la pared uterina y para el paso de fusión entre el espermatozoide y el óvulo en la fecundación, es un buen ejemplo de proteína retroviral endógena. La sincitina es el gen de la envoltura de un retrovirus endógeno defectuoso humano recientemente identificado, HERV-W (Mi et al., 2000). Durante la gestación, el feto expresa niveles elevados de otro retrovirus endógeno, HERV-R, y parece proteger al feto del ataque inmunológico de la madre (Luganini y Gribaudo, 2020). Los elementos retrovirales endógenos se parecen mucho a los retrotransposones. Su transcriptasa inversa, cuando se expresa, tiene la capacidad teórica de convertir el ARN de proteína de pico de las vacunas de ARNm en ADN.
2. Integración permanente del ADN de genes de retrovirus exógenos
Los seres humanos están colonizados por una gran colección de retrovirus exógenos que en muchos casos no causan daño al huésped y pueden incluso ser simbióticos (Luganini y Gribaudo, 2020). Los virus exógenos se pueden convertir en virus endógenos (incorporados permanentemente al ADN del hospedador) en el laboratorio, como demostró Rudolf Jaenisch (Jaenisch, 1976), quien infectó embriones de ratón preimplantatorios con el virus de la leucemia murina de Moloney (M-MuLV). Los ratones generados a partir de estos embriones infectados desarrollaron leucemia y el ADN viral se integró en su línea germinal y se transmitió a su descendencia. Además de la incorporación de ADN viral en el genoma del hospedador, también se demostró ya en 1980 que los plásmidos de ADN se podían microinyectar en los núcleos de embriones de ratón para producir ratones transgénicos que se reproducen de verdad (Gordon et al., 1980). El ADN plasmídico se incorporó al genoma nuclear de los ratones a través de procesos naturales existentes, preservando así la información genética recién adquirida en el genoma de la descendencia. Este descubrimiento ha sido la base de muchos experimentos de ingeniería genética en ratones transgénicos diseñados para expresar genes humanos recién adquiridos desde entonces (Bouabe y Okkenhaug, 2013).
3. LINE-1 se expresa ampliamente
Los LINE por sí solos constituyen más del 20% del genoma humano. El LINE más común es LINE-1, que codifica una transcriptasa inversa que regula los procesos biológicos fundamentales. LINE-1 se expresa en muchos tipos de células, pero a niveles especialmente altos en los espermatozoides. Los espermatozoides pueden usarse como vectores tanto de ADN exógeno como de moléculas de ARN exógeno a través de ensayos de transferencia génica mediada por espermatozoides.
Los espermatozoides pueden realizar la transcripción inversa de ARN exógeno directamente en ADNc y pueden enviar plásmidos que empaquetan este ADNc al óvulo fertilizado. Estos plásmidos pueden propagarse dentro del embrión en desarrollo y poblar muchos tejidos en el feto. De hecho, sobreviven hasta la edad adulta como estructuras extracromosómicas y son capaces de transmitirse a la progenie. Estos plásmidos son transcripcionalmente competentes, lo que significa que pueden usarse para sintetizar proteínas codificadas por el ADN que contienen (Pittoggi et al., 2006).
Además de los espermatozoides, los embriones también expresan transcriptasa inversa antes de la implantación y su inhibición provoca un paro del desarrollo. LINE-1 también es expresado por células cancerosas, y el silenciamiento de LINE-1 humano mediado por interferencia de ARN induce la diferenciación en muchas líneas de células cancerosas. La maquinaria de la transcriptasa inversa está implicada en la génesis de nueva información genética, tanto en células cancerosas como en células germinales. Se ha descubierto que muchos tejidos tumorales expresan niveles elevados de LINE-1 y contienen muchos plásmidos extracromosómicos en su núcleo. Los gliomas malignos son los tumores primarios del sistema nervioso central. Se ha demostrado experimentalmente que estos tumores liberan exosomas que contienen ADN, ARN y proteínas, que terminan en la circulación general (Vaidya y Sugaya, 2020).
4. Integración del gen de la proteína Spike en el genoma humano
Sorprendentemente, se ha demostrado que las neuronas del cerebro de los pacientes con Alzheimer albergan múltiples variantes del gen de la proteína precursora amiloide APP, incorporada al genoma, que se crean mediante un proceso llamado recombinación de genes somáticos (SGR) (Kaeser et al., 2020). SGR requiere transcripción de genes, roturas de cadenas de ADN y actividad de transcriptasa inversa, todo lo cual puede ser promovido por factores de riesgo bien conocidos de la enfermedad de Alzheimer. El ADN que codifica la APP se transcribe de forma inversa en ARN y luego se transcribe nuevamente en ADN y se incorpora al genoma en un sitio de ruptura de la hebra. Dado que el ARN es más susceptible a las mutaciones, el ADN en estas copias en mosaico contiene muchas variantes mutantes del gen, por lo que la célula se convierte en un mosaico, capaz de producir múltiples variantes de APP. Las neuronas de los pacientes con Alzheimer contenían hasta 500 millones de pares de bases de ADN en exceso en sus cromosomas (Bushman et al., 2015).
Investigadores del MIT y Harvard publicaron un artículo perturbador en 2021, donde proporcionaron pruebas sólidas de que el ARN del SARS-CoV-2 se puede transcribir de forma inversa en ADN e integrar en el ADN humano (Zhang et al., 2021). Se les llevó a investigar esta idea después de haber observado que muchos pacientes continúan dando positivo por COVID-19 después de que el virus ya ha sido eliminado de su cuerpo. Los autores encontraron transcripciones quiméricas que contenían secuencias de ADN viral fusionadas con secuencias de ADN celular en pacientes que se habían recuperado de COVID-19. Dado que COVID-19 a menudo induce una tormenta de citocinas en casos graves, confirmaron la posibilidad de una actividad mejorada de la transcriptasa inversa a través de un estudio in vitro utilizando medios acondicionados que contienen citocinas en cultivos celulares. Encontraron una regulación positiva de 2-3 veces de la expresión de LINE-1 endógena en respuesta a las citocinas. El ARN exógeno del virus incorporado al ADN humano podría producir fragmentos de proteínas virales indefinidamente después de que la infección se haya eliminado, y esto arroja un falso positivo en una prueba de PCR.
5. Diarrea viral bovina: un modelo perturbador
La diarrea viral bovina (BVD) es una enfermedad viral infecciosa que afecta al ganado en todo el mundo. Es un miembro de la clase de pestivirus, que son virus de ARN pequeños, esféricos, monocatenarios y con envoltura. La enfermedad está asociada con enfermedades gastrointestinales, respiratorias y reproductivas. Una característica única de la DVB es que el virus puede atravesar la placenta de una madre embarazada infectada.
Esto puede resultar en el nacimiento de un ternero que transporta partículas virales intracelulares que confunde como «propias». Su sistema inmunológico se niega a reconocer el virus como una invasión extraña y, como resultado, el ternero arroja el virus en grandes cantidades a lo largo de su vida, infectando potencialmente a toda la manada. Se ha convertido en una práctica generalizada identificar a estos terneros portadores y eliminarlos del rebaño en un intento de reducir la infección (Khodakaram-Tafti & Farjanikish, 2017).
Parece plausible que pueda surgir una situación peligrosa en el futuro en la que una mujer reciba una vacuna de ARNm para el SARS-CoV-2 y luego conciba un hijo poco después. Los espermatozoides podrían tomar liposomas incluidos en ARN de la vacuna y convertirlos en ADN utilizando LINE-1. Luego producirían plásmidos que contienen el código de la proteína de pico que ser absorbido por el óvulo fertilizado a través del proceso descrito anteriormente. El bebé que nace es entonces potencialmente incapaz de montar anticuerpos contra la proteína de pico porque su sistema inmunológico la considera «propia». Si ese bebé se infectara con el SARS-CoV-2 en cualquier momento de su vida, su sistema inmunológico no montaría una defensa contra el virus, y el virus probablemente podría multiplicarse libremente en el cuerpo del bebé sin restricciones. El bebé lógicamente se convertiría en un super esparcidor en tal situación. Es cierto que esto es una especulación en este momento, pero hay evidencia de lo que sabemos sobre los retrotransposones, los espermatozoides, la fertilización, el sistema inmunológico y los virus, de que tal escenario no puede descartarse. Ya se ha demostrado en experimentos con ratones que los elementos genéticos de las vacunas de vector de ADN, genoma (Wang et al., 2004). De hecho, dicho proceso se ha sugerido como base para la evolución lamarckiana definida como la herencia de rasgos adquiridos (Steele, 1980).
La comprensión de que lo que antes se llamaba “ADN basura” no es basura, es solo uno de los resultados que surgen del nuevo paradigma filosófico en el lenguaje humano, la biología y la genética que se basa en la genómica fractal (Pellionisz, 2012), un paradigma que Pellionisz se ha relacionado con la participación de “verdaderas representaciones narrativas” (TNRs; Oller, 2010), realizadas como “iteraciones de una plantilla fractal” en los procesos altamente repetitivos del desarrollo normal de las muchas estructuras ramificadas del cuerpo humano. Estos procesos son numerosos en los pulmones, riñones, venas y arterias, y lo más importante en el cerebro. Las vacunas de ARNm son una terapia génica experimental con el potencial de incorporar el código de la proteína pico del SARS-CoV-2 en el ADN humano.
Conclusión
Se ha anunciado que las vacunas experimentales de ARNm tienen el potencial de generar grandes beneficios, pero también albergan la posibilidad de consecuencias imprevistas potencialmente trágicas e incluso catastróficas. Las vacunas de ARNm contra el SARS-CoV-2 se han implementado con gran fanfarria, pero hay muchos aspectos de su amplia utilización que merecen preocupación. Hemos revisado algunas, pero no todas, esas preocupaciones aquí, y queremos enfatizar que estas preocupaciones son potencialmente serias y podrían no ser evidentes durante años o incluso transgeneracionalmente. Para descartar adecuadamente las potencialidades adversas descritas en este documento, recomendamos, como mínimo, que se adopten las siguientes prácticas de investigación y vigilancia:
- Un esfuerzo nacional para recopilar datos detallados sobre los eventos adversos asociados con las vacunas de ARNm con abundante asignación de fondos, seguido mucho más allá de las primeras dos semanas después de la vacunación.
- Pruebas repetidas de autoanticuerpos de la población receptora de la vacuna. Los autoanticuerpos probados podrían estandarizarse y deberían basarse en anticuerpos previamente documentados y autoanticuerpos potencialmente provocados por la proteína de pico. Estos incluyen autoanticuerpos contra fosfolípidos, colágeno, actina, tiroperoxidasa (TPO), proteína básica de mielina, transglutaminasa tisular y quizás otros.
- Perfiles inmunológicos relacionados con el equilibrio de citocinas y efectos biológicos relacionados. Las pruebas deben incluir, como mínimo, IL-6, INF-α, dímero D, fibrinógeno y proteína C reactiva.
- Estudios que comparan poblaciones que fueron vacunadas con las vacunas de ARNm y aquellas que no confirmaron la disminución esperada de la tasa de infección y los síntomas más leves del grupo vacunado, mientras que al mismo tiempo se compararon las tasas de diversas enfermedades autoinmunes y enfermedades priónicas en las mismas dos poblaciones. .
- Estudios para evaluar si es posible que una persona no vacunada adquiera formas específicas de la vacuna de las proteínas de punta de una persona vacunada en las proximidades.
- Estudios in vitro para evaluar si los espermatozoides pueden absorber las nanopartículas de ARNm y convertirlas en plásmidos de ADNc.
- Estudios en animales para determinar si la vacunación poco antes de la concepción puede dar como resultado que la descendencia lleve en sus tejidos plásmidos que codifican proteínas de punta, posiblemente integrados en su genoma.
- Los estudios in vitro tenían como objetivo comprender mejor la toxicidad de la proteína de pico en el cerebro, corazón, testículos, etc.
La política pública en torno a la vacunación masiva generalmente se ha basado en la suposición de que la relación riesgo / beneficio de las nuevas vacunas de ARNm es un «slam dunk». Con la campaña de vacunación masiva en marcha en respuesta a la emergencia internacional declarada de COVID-19, nos hemos apresurado a realizar experimentos con vacunas a escala mundial. Como mínimo, deberíamos aprovechar los datos que están disponibles en estos experimentos para aprender más sobre esta tecnología nueva y no probada previamente. Y, en el futuro, instamos a los gobiernos a actuar con más cautela frente a las nuevas biotecnologías.
Finalmente, como una sugerencia obvia pero trágicamente ignorada, el gobierno también debería alentar a la población a tomar medidas seguras y asequibles para estimular su sistema inmunológico de forma natural, como salir a la luz del sol para elevar los niveles de vitamina D (Ali, 2020), y comer principalmente alimentos integrales orgánicos en lugar de alimentos procesados cargados de químicos (Rico-Campà et al., 2019). Además, se debe fomentar el consumo de alimentos que sean buenas fuentes de vitamina A, vitamina C y vitamina K2, ya que las deficiencias en estas vitaminas están relacionadas con los malos resultados del COVID-19 (Goddek, 2020; Sarohan, 2020).
Conflicto de intereses
Los autores declaran no tener intereses en competencia o conflictos.
Palabras clave: mejora dependiente de anticuerpos, enfermedades autoinmunes, edición de genes, nanopartículas lipídicas, ARN mensajero, enfermedades priónicas, transcripción inversa, vacunas contra el SARS-CoV-2
Referencias
Achua, J. K., Chu, K. Y., Ibrahim, E., Khodamoradi, K., Delma, K. S., Ramsamy, R. Arora, H. (2021). Histopathology
and Ultrastructural Findings of Fatal COVID-19 Infections on Testis. The World Journal of Men’s Health 39(1): 65-74. https://doi.org/10.5534/wjmh.200170.
Al-Dybiat, I., Moudjou, M., Martin, D., Reine, F., Herzog, L., Truchet, S.,.. Sibille, P. (2019) Prion Strain-dependent
Tropism is Maintained between Spleen and Granuloma and Relies on Lymphofollicular Structures. Scientific Reports 9: 14656. https://doi.org/10.1038/s41598-019-51084-1.
Ali, N. (2020). Role of Vitamin D in Preventing of COVID-19 Infection, Progression and Severity. Journal of Infection and Public Health 13(10): 1373-1380. https://doi.org/10.1016/j.jiph.2020.06.021.
Ansari, B. Rosen, L. B., Lisco, A., Gilden, D., Holland, S. M., Zerbe, C. S.,…. Cohen, J. I. (2020). Primary and Acquired
Immunodeficiencies Associated with Severe Varicella-Zoster Virus Infections. Clinical Infectious Diseases August 28 [Epub ahead of print]. https://doi.org/10.1093/cid/ciaa1274.
Arvin, A. M., Fink, K. Schmid, M. A., Cathcart, A., Spreafico, R., Havenar-Daughton, C… Virgin, H. W. (2020). A
Perspective on Potential Antibody-Dependent Enhancement of SARS-CoV-2. Nature 584(7821): 353-363. https://doi.org/10.1038/s41586-020-2538-8.
Aslam, R., Kapur, R., egel, G. B., Guo, L., Zufferey, A., Ni, H. & Semple, J. W. (2016). The Spleen Dictates Platelet Destruction, Anti-platelet Antibody Production, and Lymphocyte Distribution Patterns in a Murine Model of Immune Thrombocytopenia. Experimental Hematology 44(10): 924-930. https://doi.org/10.1016/j.exphem.2016.07.004.
Baden, L. R., El Sahly, H. M., Essink, B.,Kotloff, K., Frey, S., Novak, R… Zaks, T. (2021). Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. The New England Journal of Medicine 384: 403-416. https://doi.org/10.1056/NEJMoa2035389.
Bahl, K., Senn, J. J., Yuzhakov, O., Bulychev, A., Brito, L. A., Hassett, K. J.. Ciaramella, G. (2017). Preclinical and Clinical Demonstration of Immunogenicity by mRNA Vaccines against H10N8 and H7N9 Influenza Viruses. Molecular Therapy 25(6): 1316-1327. http://dx.doi.org/10.1016/j.ymthe.2017.03.035.
Baker, A. N., Richards,S.-J., Guy, C. S., Congdon, T. R., Hasan, M., Zwetsloot, A. J., … Gibson, M. I. (2020). The SARS-COV-2 Spike Protein Binds Sialic Acids and Enables Rapid Detection in a Lateral Flow Point of Care Diagnostic Device. ACS Central Science 6(11): 2046-2052. https://doi.org/10.1021/acscentsci.0c00855.
Baltimore, D. (1970). Viral RNA-dependent DNA Polymerase: RNA-dependent DNA Polymerase in visions of RNA Tumor Viruses. Nature 226(5252): 1209-1211. https://doi.org/10.1038/2261209a0.
Bardina, S. V., Bunduc, P., Tripathi, S., Duehr, J., Frere, J. J., Brown, J. A.. Lim, J. K. (2017). Enhancement of Zika Virus Pathogenesis by Preexisting Antiflavivirus Immunity. Science 356(6334): 175-180. https://doi.org/10.1126/science.aal4365.
Beltramello, M., Williams, K. L., Simmons, C. P., Macagno, A., Simonelli, L., Ha Quyen, N. T. Sallusto, F. (2010). The Human Immune Response to Dengue Virus is Dominated by Highly Cross-Reactive Antibodies Endowed with Neutralizing and Enhancing Activity. Cell Host Microbe 8(3): 271-83. https://doi.org/10.1016/j.chom.2010.08.007.
Bertin, D., Brodovitch, A., Beziane, A., Hug, S., Bouamri, A., Mege, J. L..Bardin, N. (2020). Anticardiolipin IgG Autoantibody Level Is an Independent Risk Factor for COVID‐19 Severity. Arthritis & Rheumatology, 72(11), 1953-1955. https://doi.org/10.1002/art.41409.
Bhattacharjee, S. & Banerjee, M. (2020). Immune Thrombocytopenia Secondary to COVID-19: a Systematic Review SN Comprehensive Clinical Medicine 2: 2048-2058. https://doi.org/10.1007/s42399-020-00521-8.
BioNTech (2020). A Phase 1/2/3, Placebo-Controlled, Randomized, Observer-Blind, Dose-Finding Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of Sars-CoV-2 RNA Vaccine Candidates against COVID-19 in Healthy Individuals. PF-07302048 (BNT162 RNA-Based COVID-19 Vaccines) Protocol C4591001. November. https://media.tghn.org/medialibrary/2020/11/C4591001_Clinical_Protocol_Nov2020_Pfizer_BioNTech.pdf.
Blumenthal, K. G., Robinson, L. B., Camargo, C. Jr., Shenoy, E. S., Banerji, A., Landman, A. B., Wickner, P. (2021) Acute Allergic Reactions to mRNA COVID-19 Vaccines. Journal of the American Medical Association 325(15):1562-1565. https://doi.org/10.1001/jama.2021.3976.
Bonsell, D. (2021, January 10). Largest Multi-Site Distribution Complex in Defense Department Delivers for Operation Warp. Defense Logistics Agency. Retrieved January 27, 2021, from https://www.dla.mil/AboutDLA/News/NewsArticleView/Article/2467282/largest-warehouse-in-defense- department-delivers-for-operation-warp-speed/
Bouabe, H. & Okkenhaug, K. (2013). Gene Targeting in Mice: a Review. Methods in Molecular Biology 2013; 1064: 315- 336. https://doi.org/10.1007/978-1-62703-601-6_23.
Brown, R. B. (2021) Outcome Reporting Bias in COVID-19 mRNA Vaccine Clinical Trials. Medicina (Kaunas) 57(3): 199. https://www.doi.org/10.3390/medicina57030199.
Buonsenso, D., Riitano, F., & Valentini, P. (2020). Pediatric Inflammatory Multisystem Syndrome Temporally Related with SARS-CoV-2: Immunological Similarities with Acute Rheumatic Fever and Toxic Shock Syndrome. Frontiers in Pediatrics 8: 574. https://doi.org/10.3389/fped.2020.00574.
Bushman, D. M., Kaeser, G. E., Siddoway, B., Westra, J. W., Rivera, R. R., Rehen, S. K. Chun, J. (2015). Genomic Mosaicism with Increased Amyloid Precursor Protein (APP) Gene Copy Number in Single Neurons from Sporadic Alzheimers Disease Brains. eLife 4: e05116. https://doi.org/10.7554/eLife.05116.
Buzhdygana, T. P., DeOrec, B. J., Baldwin-Leclair, A., Bullock, T. A., McGary, H. M. Ramirez, S. H. (2020). The SARS-CoV-2 Spike Protein Alters Barrier Function in 2D Static and 3D Microfluidic in-Vitro Models of the Human Blood-Brain Barrier. Neurobiology of Disease 146: 105131. https://doi.org/10.1016/j.nbd.2020.105131.
CDC COVID-19 Response Team; Food and Drug Administration (2021, January 15). Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine—United States, December 14–23, 2020. Morbidity and Mortality Weekly Report 70(2): 46. https://www.cdc.gov/mmwr/volumes/70/wr/mm7002e1.htm.
CDC COVID-19 Response Team; Food and Drug Administration (2021, January 29). Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Moderna COVID-19 Vaccine-United States. December 21, 2020 — January 10, 2021. MMWR. Morbidity and Mortality Weekly Report 70(4): 125-129. https://www.cdc.gov/mmwr/volumes/70/wr/mm7004e1.htm.
Campos, J. Slon, L., Mongkolsapaya, J., & Screaton, G. R. (2018). The Immune Response Against Flaviviruses. Nature immunology 19(11): 1189-1198. https://doi.org/10.1038/s41590-018-0210-3.
Carsetti, R., Zaffina, S., Piano Mortari, E., Terreri, S., Corrente, F., Capponi, C., … & Locatelli, F. (2020). Different Innate and Adaptive Immune Responses to SARS-CoV-2 Infection of Asymptomatic, Mild, and Severe Cases. Frontiers in immunology, 11, 3365. https://www.frontiersin.org/articles/10.3389/fimmu.2020.610300/full
Carter, M. J., Fish, M., Jennings, A., Doores, K. J., Wellman, P., Seow, J., … Shankar-Hari, M. (2020). Peripheral Immunophenotypes in Children with Multisystem Inflammatory Syndrome Associated with SARS-CoV-2 Infection. Nature Medicine, 26(11), 1701-1707. https://doi.org/10.1038/s41591-020-1054-6.
Centers for Disease Control and Prevention. COVID Data Tracker. https://covid.cdc.gov/covid-data- tracker/#vaccinations. Accessed 2/6/21. Centers for Disease Control and Prevention, Prion Diseases. October 9, 2018. https://www.cdc.gov/prions/index.html. Centers for Disease Control and Prevention (1990). Vaccine Adverse Events Reporting System [database]. Retrieved February 11, 2021 from https://vaers.hhs.gov/about.html
Chen, W., Yang, B., Li, Z., Wang, P., Chen, Y. & Zhou, H. (2020). Sudden Severe Thrombocytopenia in a Patient in the Recovery Stage of COVID-19. Lancet Haematology 7(8): e624. https://doi.org/10.1016/S2352-3026(20)30175-7.
Cifuentes-Diaz, C., Delaporte, C., Dautréaux,B., Charron, D. & Fardeau, M. (1992) Class II MHC Antigens in Normal Human Skeletal Muscle. Muscle Nerve 15(3): 295-302. https://doi.org/10.1002/mus.880150307.
Classen, J. B. (2021). Review of COVID-19 Vaccines and the Risk of Chronic Adverse Events Including Neurological Degeneration. Journal of Medical-Clinical Research and Reviews 5(4): 1-7. https://foundationforhealthresearch.org/review-of-covid-19-vaccines-and-the-risk-of-chronic-adverse-events/.
Corbett, K. S., Edwards, D.K., Leist, S. R., Abiona, O. M., Boyoglu-Barnum, S., Gillespie, R. A.. Graham, B. S. (2020)
SARS-CoV-2 mRNA Vaccine Design Enabled by Prototype Pathogen Preparedness. Nature 586(7830): 567-571. https://doi.org/10.1038/s41586-020-2622-0.
Danielsson, R. & Eriksson, H. (2021, January 7). Aluminium Adjuvants in Vaccines — A Way to Modulate the Immune Response. Seminars in Cell & Developmental Biology. (Epub ahead of print) https://doi.org/10.1016/j.semcdb.2020.12.008.
Decock, M, Stanga, S., Octave, J.-N., Dewachter, I., Smith, S. O., Constantinescu, S. N., and Kienlen-Campard, P. (2016). Glycines from the APP GXXXG/GXXXA Trans- membrane Motifs Promote Formation of Pathogenic A Oligomers in Cells. Frontiers in Aging Neuroscience 8: 107. https://doi.org/10.3389/fnagi.2016.00107.
Dicks, M. D. J., Spencer, A. J., Edwards, N. J., Wadell, G., Bojang, %K., Gilbert, S.C.,. Cottingham, M. G. (2012). A Novel Chimpanzee Adenovirus Vector with Low Human Seroprevalence: Improved Systems for Vector Derivation and Comparative Immunogenicity. PLoS ONE 7(7): e40385. https://doi.org/10.1371/journal.pone.0040385.
Doshi, P. (2020). Will COVID-19 Vaccines Save Lives? Current Trials Aren’t Designed to Tell Us. BMJ 371: m4037. https://doi.org/10.1136/bmj.m4037.
Doshi, P. (2021a). Peter Doshi: Pfizer and Moderna’s “95% effective” vaccines—we need more details and the raw data. BMJ blog. Accessed 02/20/2021. https://blogs.bmj.com/bmj/2021/01/04/peter-doshi-pfizer-and-modernas-95- effective-vaccines-we-need-more-details-and-the-raw-data/
Doshi, P. (2021b). Clarification: Pfizer and Moderna’s “95% effective” Vaccines — We Need More Details and the Raw Data. BMJ blog. Accessed 02/20/21. https://blogs.bmj.com/bmj/2021/02/05/clarification-pfizer-and-modernas- 95-effective-vaccines-we-need-more-details-and-the-raw-data/
Ehrenfeld, M., Tincani, A., Andreoli, L., Cattalini, M., Greenbaum, A., Kanduc, D.. Shoenfeld, Y. (2020). COVID-19 and Autoimmunity. Autoimmunity Reviews 19(8): 102597. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7289100/
EMA Public Assessment Report on Pfizer-BioNTech Vaccine. (2020). Accessed 5/2/21. https://www.documentcloud.org/documents/20516010-ema-assessment-report-12-21- 2020#document/p35/a2023027
Eroshenko, N., Gill, T., Keaveney, M. K., Church, G. M., Trevejo, J. M. & Rajaniemi, H. (2020). Implications of Antibody-dependent Enhancement of Infection for SARS-CoV-2 Countermeasures. Nature Biotechnology 38(7): 789-791. https://doi.org/10.1038/s41587-020-0577-1.
European Medicines Agency. Committee for Medicinal Products for Human Use (CHMP) Assessment report. COVID- 19 Vaccine Moderna. Common name: COVID-19 mRNA Vaccine (nucleoside-modified) Procedure. No.
EMEA/H/C/005791/0000. March 11 2021. p. 47. https://www.ema.europa.eu/en/documents/assessment- report/covid-19-vaccine-moderna-epar-public-assessment-report_en.pdf
Firdessa-Fite, R. & Creusot, R. J. (2020). Nanoparticles versus Dendritic Cells as Vehicles to Deliver mRNA Encoding Multiple Epitopes for Immunotherapy. Molecular Therapy: Methods & Clinical Development 16: 50-62. https://doi.org/10.1016/j.omtm.2019.10.015.
Franke, C., Ferse, C., Kreye, J., Reincke, S. M., Sanchez-Sendin, E., Rocco, A., & Pruess, H. (2021). High Frequency of Cerebrospinal Fluid Autoantibodies in COVID-19 Patients with Neurological Symptoms. Brain, Behavior, and Immunity 93: 415-419. https://doi.org/10.1016/j.bbi.2020.12.022.
Fujiwara, Y., Wada, K. & Kabuta, T. (2017). Lysosomal Degradation of Intracellular Nucleic Acids — Multiple Autophagic Pathways. The Journal of Biochemistry 161(2): 145-154. https://doi.org/10.1093/jb/mvw085.
Furer, V., Zisman, D., Kibari, A., Rimar, D., Paran, Y., & Elkayam, O. (2021). Herpes zoster Following BNT162b2 mRNA Covid-19 Vaccination in Patients with Autoimmune Inflammatory Rheumatic Diseases: a Case Series. Rheumatology keab345. April 12 [Epub ahead of print] https://doi.org/10.1093/rheumatology/keab345.
Galeotti, C., & Bayry, J. (2020). Autoimmune and Inflammatory Diseases Following COVID-19. Nature Reviews Rheumatology, 16(8), 413-414. https://doi.org/10.1038/s41584-020-0448-7.
Gallie, D. R., (1991) The Cap and Poly(A) Tail Function Synergistically to Regulate mRNA Translational Efficiency.Genes & Development 5: 2108–2116. https://doi.org/10.1101/gad.5.11.2108.
Ganson, N. J., Povsic, T. J., Sullenger, B. A., Alexander, J. H., Zelenkofske, S. L. Hershfield, M. S. (2016). Pre-existing Anti–Polyethylene Glycol Antibody Linked to First-Exposure Allergic Reactions to Pegnivacogin, A PEGylated RNA Aptamer. Journal of Allergy and Clinical Immunology 137(5): 1610-1613. https://doi.org/10.1016/j.jaci.2015.10.034.
Garvey, L. H., & Nasser, S. (2020, December 17) Allergic Reactions to the First COVID-19 Vaccine: is Polyethylene Glycol (PEG) the Culprit? British Journal of Anaesthesia. Epub ahead of print. https://doi.org/10.1016/j.bja.2020.12.020.
Gao, Z., Xu, Y., Sun, C., Wang, X., Guo, Y., Qiu, S., & Ma, K. (2020). A systematic review of asymptomatic infections with COVID-19. Journal of Microbiology, Immunology and Infection 54(1): 12-16. https://www.sciencedirect.com/science/article/pii/S1684118220301134.
Gao, Z. W., Zhang, H. Z., Liu, C., & Dong, K. (2021). Autoantibodies in COVID-19: Frequency and Function. Autoimmune Reviews 20(3): 102754. https://doi.org/10.1016/j.autrev.2021.102754.
Geuking, M. B., Weber, J., Dewannieux, M., Gorelik, E., Heidmann, T., Hengartner, H., … Hangartner, L. (2009). Recombination of Retrotransposon and Exogenous RNA Virus Results in Nonretroviral cDNA Integration. Science 323(5912): 393-6. https://doi.org/10.1126/science.1167375.
Goddek, S. (2020). Vitamin D3 and K2 and Their Potential Contribution to Reducing the COVID-19 Mortality Rate. International Journal of Infectious Diseases 99: 286-290. https://doi.org/10.1016/j.ijid.2020.07.080.
Gordon, J. W., Scangos, G. A., Plotkin, D. J., Barbosa, J. A. & Ruddle, F.H. (1980). Genetic Transformation of Mouse Embryos by Microinjection of Purified DNA. Proceedings of the National Academy of Sciences USA.77: 7380-84. https://doi.org/10.1073/pnas.77.12.7380.
Grady, D. & Mazzei, P. (2021). Doctor’s Death After COVID Vaccine Is Being Investigated. New York Times Jan. 12. https://www.nytimes.com/2021/01/12/health/covid-vaccine-death.html.
Grady, D. (2021). A Few Covid Vaccine Recipients Developed a Rare Blood Disorder. New York Times Feb. 8. https://www.nytimes.com/2021/02/08/health/immune-thrombocytopenia-covid-vaccine-blood.html.
Haidere, M. F., Ratan, Z. A., Nowroz, S., Zaman, S. B., Jung, Y. J., Hosseinzadeh, H., & Cho, J. Y. (2021). COVID-19 Vaccine: Critical Questions with Complicated Answers. Biomolecules & therapeutics, 29(1), 1. https://doi.org/10.4062/biomolther.2020.178.
Hamad, I., Hunter, A. C., Szebeni, J. & Moghimi, S. M. (2008). Poly (Ethylene Glycol)s Generate Complement Activation Products in Human Serum through Increased Alternative Pathway Turnover and a MASP-2-Dependent Process. Molecular immunology 46(2): 225-232. https://doi.org/10.1016/j.molimm.2008.08.276.
Hawkes, R. A. (1964). Enhancement of the Infectivity of Arboviruses by Specific Antisera Produced in Domestic Fowls. Australian Journal of Experimental Biology and Medical Science 42(4): 465-482. https://doi.org/10.1038/icb.1964.44.
Ho, W., Gao, M.,Li, F., Li, J., Zhang, X.-Q. & Xu, X. (2021, January 18). Next‐Generation Vaccines: Nanoparticle‐ Mediated DNA and mRNA Delivery. Advanced Healthcare Materials 10(8): e2001812. https://doi.org/10.1002/adhm.202001812.
Hong, L., Wang, Z., Wei, X., Shi, J. & Li, C. (2020). Antibodies Against Polyethylene Glycol in Human Blood: A Literature Review. Journal of Pharmacological and Toxicological Methods 102: 106678. https://doi.org/10.1016/j.vascn.2020.106678.
Hubert, B. Reverse Engineering the source code of the BioNTech/Pfizer SARS-CoV-2 Vaccine. Dec. 25, 2020. https://berthub.eu/articles/posts/reverse-engineering-source-code-of-the-biontech-pfizer-vaccine/
Idrees D, Kumar V. SARS-CoV-2 spike protein interactions with amyloidogenic proteins: Potential clues to Neurodegeneration. Biochemical and Biophysical Re- search Com- munications. 2021; 554: 94-98. https://www.doi.org/10.1016/j.bbrc.2021.03.100.
Jackson, L. A., Anderson, E. J., Rouphael, N. G., Roberts, P. C., Makhene, M., Coler, R. N. Beigel, J. H. (2020). An mRNA Vaccine against SARS-CoV-2 Preliminary Report. The New England Journal of Medicine 383: 1920-31. https://doi.org/10.1056/NEJMoa2022483.
Jacobs, J. & Armstrong, D. (2020, April 29) Trump’s `Operation Warp Speed’ Aims to Rush Coronavirus Vaccine Bloomberg. Retreived February 11 from https://www.bloomberg.com/news/articles/2020-04-29/trump-s- operation-warp-speed-aims-to-rush-coronavirus-vaccine.
Jaenisch R. (1976). Germ Line Integration and Mendelian Transmission of the Exogenous Moloney Leukemia Virus. Proceedings of the National Academy of Sciences of the United States of America 73: 1260-1264. https://doi.org/10.1073/pnas.73.4.1260.
Jansen, A. J. G., Spaan, T., Low, H. Z., Di Iorio D., van den Brand, J., Malte Tieke, M.. van der Vries, E. (2020). Influenza-Induced Thrombocytopenia is Dependent on the Subtype and Sialoglycan Receptor and Increases with Virus Pathogenicity. Blood Advances 4(13): 2967-2978. https://doi.org/10.1182/bloodadvances.2020001640.
Jiang, Y., Arase, N., Kohyama, M., Hirayasu, K., Suenaga, T., Jin, H. Hisashi Arase , H. (2013) Transport of Misfolded Endoplasmic Reticulum Proteins to the Cell Surface by MHC Class II Molecules. International Immunology 25(4): 235-246. https://doi.org/10.1093/intimm/dxs155
Kaeser, G. E. & Chun, J. (2020). Mosaic Somatic Gene Recombination as a Potentially Unifying Hypothesis for Alzheimers Disease. Frontiers in Genetics 11: 390. https://doi.org/10.3389/fgene.2020.00390.
Kakarla, R., Hur, J., Kim, Y. J., Kim, J., and Chwae, Y.-J. (2020). Apoptotic Cell- derived Exosomes: Messages from Dying Cells. Experimental & Molecular Medicine 52: 16 https://www.doi.org/10.1038/s12276-019-0362-8.
Karikó, K., Muramatsu, H., Welsh, F. A., Ludwig, J., Kato, H., Akira, S. & Weissman, D. (2008). Incorporation of Pseudouridine Into mRNA Yields Superior Nonimmunogenic Vector With Increased Translational Capacity and Biological Stability. Molecular Therapy 16(11): 1833-1840. https://doi.org/10.1038/mt.2008.200.
Kelso, J. M. (2021) Anaphylactic Reactions to Novel mRNA SARS-CoV-2/COVID-19 Vaccines. Vaccine 39(6): 865– 867. https://doi.org/10.1016/j.vaccine.2020.12.084.
Kemp, S. A., Collier, D. A. Datir, R. P., Ferreira, I. A. T. M. Gayed, S., Jahun, A. Gupta, R. K. (2021) SARS-CoV-2 Evolution during Treatment of Chronic Infection. Nature 2021 Apr;592(7853):277-282. https://doi.org/10.1038/s41586-021-03291-y.
Khodakaram-Tafti, A. & Farjanikish, G. H. (2017) Persistent Bovine Viral Diarrhea Virus (BVDV) Infection in Cattle Herds. Iranian Journal of Veterinary Research, Shiraz University 18(3): 154-163. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5674437/.
Kosuri, S. & Church, G. M., Large-Scale de Novo DNA Synthesis: Technologies and Applications. Nature Methods 2014; 11 (5): 499–507. https://doi.org/10.1038/nmeth.2918.
Koupenova, M., Corkrey, H. A., Vitseva, O., Manni, G., Pang, C. J., Clancy, L.. Freedman, J. E. (2019). The Role of Platelets in Mediating a Response to Human Influenza Infection. Nature Communications 2019;10: 1780. https://doi.org/10.1038/s41467-019-09607-x.
Kozma, G. T., Mészáros, T., Vashegyi, I., Fülöp, T., Örfi, E., Dézsi, L. Szebeni, J. (2019). Pseudo-anaphylaxis to Polyethylene Glycol (PEG)-Coated Liposomes: Roles of Anti-PEG IgM and Complement Activation in a Porcine Model of Human Infusion Reactions. ACS Nano 13(8): 9315-9324. https://doi.org/10.1021/acsnano.9b03942.
Ku, C.-C., Chang, Y.-H., Chien, Y., & Lee, T.-L. (2016). Type I Interferon Inhibits Varicella-zoster Virus Replication by Interfering with the Dynamic Interaction between Mediator and IE62 within Replication Compartments. Cell & Bioscience 6: 21. https://doi.org/10.1186/s13578-016-0086-6.
Kuba, K., Imai, Y., Rao, S., Gao, H., Guo, F., Guan, B. Penninger, J. M. (2005). A Crucial Role of Angiotensin Converting Enzyme 2 (ACE2) in SARS Coronavirus-Induced Lung Injury. Natural Medicine 11: 875-879. https://doi.org/10.1038/nm1267.
Kudla, G., Lipinski, L., Caffin, F., Helwak, A., Zylicz, M. (2006) High Guanine and Cytosine Content Increases mRNA Levels in Mammalian Cells. PlOS Biology 4(6): e180. https://doi.org/10.1371/journal.pbio.0040180.
Kullaya, V., de Jonge, M. E., Langereis, J. D., van der Gaast-de Jongh, C. E., Büll, C., Adema, G. J. van der Ven, A. J. (2018). Desialylation of Platelets by Pneumococcal Neuraminidase A Induces ADP-Dependent Platelet Hyperreactivity. Infection and Immunity 86(10): e00213-18. https://doi.org/10.1128/IAI.00213-18.
Lambrecht, B. N., Kool, M., Willart, M. A. M. & Hammad, H. (2009). Mechanism of Action of Clinically Approved Adjuvants. Current opinion in immunology 21.1 (2009): 23-29. https://doi.org/10.1016/j.coi.2009.01.004.
Lazzaro, S., Giovani, C., Mangiavacchi, S., Magini,D., Maione, D., Baudner, B. Buonsanti, C. (2015). CD8 T-cell Priming upon mRNA Vaccination is Restricted to Bone-marrow-derived Antigen-presenting Cells and May Involve Antigen Transfer from Myocytes. Immunology 146: 312-326. https://doi.org/10.1111/imm.12505.
Michael Klompas, Steve Bernstein, and Harvard Pilgrim Health Care, Inc. 2010. “Electronic Support for Public Health– Vaccine Adverse Event Reporting System (ESP-VAERS).” Rockville, MD: Harvard Pilgrim Health Care, Inc. https://healthit.ahrq.gov/sites/default/files/docs/publication/r18hs017045-lazarus-final-report-2011.pdf.
Lederer, K., Castaño, D., Gómez Atria, D., Oguin T. H., III, Wang, S., Manzoni, T. B. (2020).SARS-CoV-2 mRNA Vaccines Foster Potent Antigen-Specific Germinal Center Responses Associated with Neutralizing Antibody Generation.Immunity 53: 1281-1295. https://doi.org/10.1016/j.immuni.2020.11.009.
Lee, S. H., Cha, J. M., Lee, J. I., Joo, K. R., Shin, H. P., Baek, I. H. Cho, J. L. (2015). Anaphylactic Shock Caused by Ingestion of Polyethylene Glycol. Intestinal research 13(1): 90-94. https://doi.org/10.5217/ir.2015.13.1.90.
Lee, W. S., Wheatley, A. K., Kent, S. J. & DeKosky, B. J. (2020). Antibody-Dependent Enhancement and SARS-CoV-2 Vaccines and Therapies. Nature Microbiology 5(10): 1185-1191. https://doi.org/10.1038/s41564-020-00789-5.
Lema Tomé, C. M., Tyson, T., Rey, N. L., Grathwohl, S., Britschgi, M. and Brundin, P. (2013). Inflammation and α- Synuclein Prion-like Behavior in Parkinson’s Disease – Is There a Link? Molecular Neurobiology 47: 561-574. https://www.doi.org/10.1007/s12035-012-8267-8. Lesbats, P., Engelman, A. N. & Cherepanov, P. (2016). Retroviral DNA Integration. Chemical Reviews 2016 116(20): 12730012757. https://doi.org/10.1021/acs.chemrev.6b00125.
Liang, J., Zhu, H., Wang, X., Jing, B., Li, Z., Xia, X.Sun, B. (2020). Adjuvants for Coronavirus Vaccines. Frontiers in Immunology 11: 2896. https://doi.org/10.3389/fimmu.2020.589833.
Lila, A. S., Shimizu, A. T. & Ishida, T. (2018). PEGylation and Anti-PEG Antibodies. Engineering of Biomaterials for Drug Delivery Systems. Woodhead Publishing 51-68. https://doi.org/10.1016/B978-0-08-101750-0.00003-9. Limanaqi, F., Letizia Busceti, C., Biagioni, F., Lazzeri, G., Forte, M., Schiavon, S. Fornai, F. (2020). Cell Clearing
Systems as Targets of Polyphenols in Viral Infections: Potential Implications for COVID-19 Pathogenesis. Antioxidants 9: 1105. https://doi.org/10.3390/antiox9111105.
Lindsay, K. E., Bhosle, S. M., Zurla, C., Beyersdorf, J., Rogers, K. A., Vanover D. & Xiao, P. (2019). Visualization of Early Events in mRNA Vaccine Delivery in Non-Human Primates via PET–CT and Near-Infrared Imaging. Nature Biomedical Engineering 3: 371-380. https://doi.org/10.1038/s41551-019-0378-3.
Lipp, E., von Felten, A., Sax, H., Mller, D. & Berchtold, P. (1998). Antibodies Against Platelet Glycoproteins and Antiphospholipid Antibodies in Autoimmune Thrombocytopenia. European Journal of Haematology 60(5): 283-8. https://doi.org/10.1111/j.1600-0609.1998.tb01041.x.
Liu, L., Wei, Q., Lin, Q., Fang, J., Wang, H., Kwok, H. Chen, Z. (2019). Anti–spike IgG Causes Severe Acute Lung Injury by Skewing Macrophage Responses During Acute SARS-CoV Infection. JCI Insight 4(4): e123158. https://doi.org/10.1172/jci.insight.123158.
Liu, M. A. (2019). A Comparison of Plasmid DNA and mRNA as Vaccine Technologies. Vaccines (Basel) 7(2): 37. https://doi.org/10.3390/vaccines7020037.
Liu, S., Hossinger, A., Gbbels, S., and Ina M. Vorberga, I. M. (2017). Prions on the Run: How Extracellular Vesicles Serve as Delivery Vehicles for Self-templating Protein Aggregates. Prion 11(2): 98-112. https://www.doi.org/10.1080/19336896.2017.1306162.
Liu, Y., Liu, J., Xia, H., Zhang, X., Fontes-Garfias, C. R., Swanson, K. A. Shi, P.-Y. (2021). Neutralizing Activity of BNT162b2-Elicited Serum. N Engl J Med 384: 1466-1468. https://doi.org/10.1056/NEJMc2102017.
Louis, N., Evelegh, C., Graham, F. L. (1997) Cloning and Sequencing of the Cellular-Viral Junctions from the Human Adenovirus Type 5 Transformed 293 Cell Line. Virology 233: 423-429. https://doi.org/10.1006/viro.1997.8597.
Lu, J., Lu, G., Tan, S., Xia, J., Xiong, H., Yu, X. … Lin, J. (2020). A COVID-19 mRNA Vaccine Encoding SARS-CoV-2 Virus-like Particles Induces a Strong Antiviral-like Immune Response in Mice. Cell Research 30: 936-939. https://doi.org/10.1038/s41422-020-00392-7.
Lu, L., Li, J., Moussaoui, M. & Boix, E. (2018). Immune Modulation by Human Secreted RNases at the Extracellular Space. Frontiers in Immunology 9: 1012. https://doi.org/10.3389/fimmu.2018.01012.
Lu, L. L., Suscovich, T. J., Fortune, S. M. & Alter G. (2018b). Beyond Binding: Antibody Effector Functions in Infectious Diseases. Nature Reviews Immunology18(1): 46-61. https://doi.org/10.1038/nri.2017.106.
Lucchetti, D., Santini, G., Perelli, L., Ricciardi-Tenore, C., Colella, F., Mores, N., … Montuschi, P. (2021). Detection and Characterization of Extracellular Vesicles in Exhaled Breath Condensate and Sputum of COPD and Severe Asthma Patients. European Respiratory Journal Apr 1; 2003024. [Epub ahead of print]. https://www.doi.org/10.1183/13993003.03024-2020.
Luganini, A. & Gribaudo, G. (2020). Retroviruses of the Human Virobiota: The Recycling of Viral Genes and the Resulting Advantages for Human Hosts During Evolution. Frontiers in Microbiology 11: 1140. https://doi.org/10.3389/fmicb.2020.01140.
Lyons-Weiler, J. (2020). Pathogenic Priming Likely Contributes to Serious and Critical Illness and Mortality in COVID- 19 via Autoimmunity. Journal of Translational Autoimmunity 3: 100051. https://www.sciencedirect.com/science/article/pii/S2589909020300186.
Mahose, E. (2021) Covid-19: Booster Dose will be Needed in Autumn to Avoid Winter Surge, Says Government Adviser. BMJ 372: n664. https://doi.org/10.1136/bmj.n664.
Marino, M., Scuderi, F., Provenzano, C. & Bartoccioni, E. (2011) Skeletal Muscle Cells: from Local Inflammatory Response to Active Immunity. Gene Therapy 18: 109-116. https://doi.org/10.1038/gt.2010.124.
Matsuno, H., Yudoh, K., Katayama, R., Nakazawa, F., Uzuki, M., Sawai, T., … Kimura, T. (2002). The Role of TNF-α iin the Pathogenesis of Inflammation and Joint Destruction in Rheumatoid Arthritis (RA): a Study Using a Human RA/SCID Mouse Chimera. Rheumatology (Oxford) 41(3): 329-37. https://doi.org/10.1093/rheumatology/41.3.329.
McClintock, B. (1965). Components of Action of the Regulators Spm and Ac. Carnegie Institution of Washington Year Book 64: 527-536. http://repository.cshl.edu/id/eprint/34634/.
McNeil, M. M., Weintraub, E. S., Duffy, J., Sukumaran, L., Jacobsen, S. J., Klein, N. P. DeStefano, F. (2016). Risk ofAnaphylaxis after Vaccination in Children and Adults. The Journal of Allergy and Clinical Immunology 137(3): 868-78. https://doi.org/10.1016/j.jaci.2015.07.048.
Mehta, N., Sales, R. M., Babagbemi, K., Levy, A. D., McGrath, A. L., Drotman, M. & Dodelzon. K. (2021). Unilateral axillary Adenopathy in the setting of COVID-19 vaccine. Clinical Imaging 75: 12-15. https://doi.org/10.1016/j.clinimag.2021.01.016.
Mi, S., Lee, X., Li, X., Veldman, G. M., Finnerty, H., Racie, L. McCoy, J. M. (2000). Syncytin is a Captive Retroviral Envelope Protein Involved in Human Placental Morphogenesis. Nature 403(6771): 785-9. https://doi.org/10.1038/35001608.
Moderna. mRNA Platform: Enabling Drug Discovery & Development. 2020. https://www.modernatx.com/mrna- technology/mrna-platform-enabling-drug-discovery-development
Mohamed, M., Lila, A. S., Shimizu, T., Alaaeldin, E., Hussein, A., Sarhan, H. A., Szebeni, J. & Ishida, T. (2019).PEGylated Liposomes: Immunological Responses. Science and Technology of Advanced Materials 20(1): 710-724. https://doi.org/10.1080/14686996.2019.1627174.
Morens, D. M. (1994). Antibody-dependent Enhancement of Infection and the Pathogenesis of Viral Disease. Clinical Infectious Diseases 19(3): 500-512, https://doi.org/10.1093/clinids/19.3.500.
Mueller, B. K., Subramaniam, S., and Senes, A. (2014). A Frequent, GxxxG-mediated, Transmembrane Association Motif is Optimized for the Formation of Interhelical Cα-H Hydrogen Bonds. PNAS E888-E895. Proceedings of the Natural Academy of Sciences USA 111(10): E888-95. https://doi.org/10.1073/pnas.1319944111.
National Institutes of Health (December 11, 2020). NIH-Moderna COVID-19 Vaccine Shows Promising Interim. Results. NIH Record Vol. LXXII, No. 25. Retrieved January 27, 2021 from https://nihrecord.nih.gov/2020/12/11/nih-moderna-covid-19-vaccine-shows-promising-interim-results
Navarra, A., Albani, E., Castellano, S., Arruzzolo L., & Levi-Setti P. E. (2020). Coronavirus Disease-19 Infection: Implications on Male Fertility and Reproduction. Frontiers in Physiology 11: 574761. https://www.doi.org/10.3389/fphys.2020.574761.
Ndeupen, S., Qin, Z., Jacobsen, S., Estanbouli, H., Bouteau, A., & Igyártó, B.Z. (2021) The mRNA-LNP Platform’s Lipid Nanoparticle Component Used in Preclinical Vaccine Studies is Highly Inflammatory. bioRxiv 2021.03.04.430128. https://doi.org/10.1101/2021.03.04.430128.
Norling, K., Bernasconi, V., Hernández, V. A., Parveen, N., Edwards, K., Lycke, N. Y. Bally. M. (2019). Gel Phase 1,2-Distearoyl-sn-glycero-3-phosphocholine-Based Liposomes Are Superior to Fluid Phase Liposomes at Augmenting Both Antigen Presentation on Major Histocompatibility Complex Class II and Costimulatory Molecule Display by Dendritic Cells in Vitro. ACS Infectious Diseases 5(11): 1867-1878. https://doi.org/10.1021/acsinfecdis.9b00189.
Oller, J. W., Jr. (2010). The Antithesis of Entropy: Biosemiotic Communication from Genetics to Human Language with Special Emphasis on the Immune Systems. Entropy 12: 631-705. https://www.doi.org/10.3390/e12040631.
Palucka, A. K., Blanck, J. P., Bennett, L., Pascual, V,, Banchereau, J. (2005) Cross-regulation of TNF and IFN-α in Autoimmune Diseases. Proceedings of the National Academy of Sciences USA 102: 3372-3377. https://doi.org/10.1073/pnas.0408506102.
Pellionisz, A. J. (2012). The Decade of Fractogene: From Discovery to Utility – Proofs of Concept Open Genome-Based Clinical Applications. International Journal of Systemics, Cybernetics and Informatics 12-02: 17-28. http://www.junkdna.com/pellionisz_decade_of_fractogene.pdf.
Peron, J. P. S. & Nakaya, H. (2020). Susceptibility of the Elderly to SARS-CoV-2 Infection: ACE-2 Overexpression, Shedding, and Antibody-dependent Enhancement (ADE). Clinics (Sao Paulo) 75: e1912. https://doi.org/10.6061/clinics/2020/e1912.
Pittoggi, C., Beraldi, R., Sciamanna, I., Barberi, L., Giordano, R., Magnano, A. R.& Spadafora C (2006). Generation of Biologically Active Retro-genes upon Interaction of Mouse Spermatozoa with Exogenous DNA. Molecular Reproduction and Development 73(10): 1239-46. https://doi.org/10.1002/mrd.20550.
Povsic, T. J., Lawrence, M. G., Lincoff, A. M., Mehran, R., Rusconi, C. P. REGULATE-PCI Investigators. (2016).Pre-existing Anti-PEG Antibodies are Associated with Severe Immediate Allergic Reactions to Pegnivacogin, a PEGylated Aptamer. Journal of Allergy and Clinical Immunology 138(6): 1712-1715. https://doi.org/10.1016/j.jaci.2016.04.058.
Pray, L. (2008) Transposons, or Jumping Genes: Not Junk DNA? Nature Education 1(1): 32. https://www.nature.com/scitable/topicpage/transposons-or-jumping-genes-not-junk-dna-1211/.
Prusiner, S. B. (1982). Novel proteinaceous infectious particles cause scrapie Science 216(4542): 136-44. https://www.doi.org/10.1126/science.6801762.
Puga, I., Cols, M., Barra, C. M., He, B., Cassis, L., Gentile, M. Cerutti, A. (2011). B Cell-helper Neutrophils Stimulate the Diversification and Production of Immunoglobulin in the Marginal Zone of the Spleen. Natural Immunology 13(2): 170-80. https://doi.org/10.1038/ni.2194.
Pushparajah, D., Jimeneza, S., Wong, S., Alattas, H., Nafissi, N. & Slavcev, R. A. (2021) Advances in Gene-Based Vaccine Platforms to Address the COVID-19 Pandemic. Advanced Drug Delivery Reviews 170: 113-141. https://doi.org/10.1016/j.addr.2021.01.003.
Rico-Campà, A., Martínez-González, M. A., Alvarez-Alvarez, I., de Deus Mendonça, R., de la Fuente-Arrillaga, C., Gómez-Donoso, C. & Bes-Rastrollo, M. (2019). Association Between Consumption of Ultra-Processed Foods and All Cause Mortality: SUN Prospective Cohort Study. Journal of Infection and Public Health 13(10): 1373-1380. https://pubmed.ncbi.nlm.nih.gov/31142450/
Rocha, E. P. C., & Danchin, A. (2002). Base composition bias might result from competition for metabolic resources.Trends in Genetics, 18(6), 291–294. https://doi.org/10.1016/S0168-9525(02)02690-2
Sarohan, A. R. (2020). COVID-19: Endogenous Retinoic Acid Theory and Retinoic Acid Depletion Syndrome. Medical Hypotheses 144: 110250. https://www.doi.org/10.1016/j.mehy.2020.110250.
Schiaffino, M. T., Di Natale, M., García-Martínez, E., Navarro, J., Muñoz-Blanco, J. L., Demelo-Rodríguez, P., & Sánchez-Mateos, P. (2020). Immunoserologic Detection and Diagnostic Relevance of Cross-reactive Autoantibodies in Coronavirus Disease 2019 Patients. The Journal of Infectious Diseases, 222(9), 1439-1443. https://doi.org/10.1093/infdis/jiaa485.
Schlake, T., Thess, A., Fotin-Mleczek, M. & Kallen, K.-J. (2012). Developing mRNA-vaccine technologies, RNA Biology 9: 1319–1330. https://doi.org/10.4161/rna.22269.
Sellaturay, P., Nasser, S., & Ewan, P. (2020). Polyethylene Glycol (PEG)-Induced Anaphylactic Reaction During Bowel Preparation. ACG Case Reports Journal 2(4) 216-217. https://doi.org/10.14309/crj.2015.63.
Sellaturay, P., Nasser, S., & Ewan, P. (2020). Polyethylene Glycol–Induced Systemic Allergic Reactions (Anaphylaxis).
The Journal of Allergy and Clinical Immunology: In Practice 9(2): 670-675. https://doi.org/10.1016/j.jaip.2020.09.029.
Shaw, C.A. (2021). The Age of COVID-19: Fear, Loathing, and the New Normal. International Journal of Vaccine Theory, Practice, and Research 1: 98-142. https://ijvtpr.com/index.php/IJVTPR/article/view/11.
Shukla, R., Ramasamy, V., Shanmugam, R. K., Ahuja, R. & Khanna, N. (2020). Antibody-Dependent Enhancement: A Challenge for Developing a Safe Dengue Vaccine. Frontiers in Cellular and Infection Microbiology 10: 572681. https://doi.org/10.3389/fcimb.2020.572681.
Slimani, Y., Abbassi, R., El Fatoiki, F. Z., Barrou, L., & Chiheb, S. (2021). Systemic Lupus Erythematosus and Varicella‐ Like Rash Following COVID‐19 in a Previously Healthy Patient. Journal of Medical Virology 93(2): 1184-1187. https://doi.org/10.1002/jmv.26513.
Steele, E. J., Gorczynski, R. M., Lindley, R. A., Liu, Y., Temple, R., Tokoro, G.. Wickramasinghe, , N. C. (2019). Lamarck and Panspermia – On the Efficient Spread of Living Systems Throughout the Cosmos. Progress in Biophysics and Molecular Biology 149: 10-32. https://doi.org/10.1016/j.pbiomolbio.2019.08.010.
Steiner, J. A., Angot, E., and Brundin, P. (2011). A Deadly Spread: Cellular Mechanisms of α-Synuclein Transfer. Cell Death and Differentiation 18: 1425-1433. https://www.doi.org/10.1038/cdd.2011.53.
Stokes, A., Pion, J., Binazon, O., Laffont, B., Bigras, M., Dubois, G. Rodriguez L.-A. (2020). Nonclinical Safety Assessment of Repeated Administration and Biodistribution of a Novel Rabies Self-amplifying mRNA Vaccine in Rats. Regulatory Toxicology and Pharmacology 113: 104648. https://doi.org/10.1016/j.yrtph.2020.104648.
Su, J. R., Moro, P. L., Ng, C. S., Lewis, P. W., Said, M. A., & Cano, M.V. (2019). Anaphylaxis after vaccination reported to theVaccine Adverse Event Reporting System, 1990-2016.Journal of Allergy and Clinical Immunology 143(4): 1465-1473. https://doi.org/10.1016/j.jaci.2018.12.1003.
Sun, R.-J. & Shan, N.-N. (2019). Megakaryocytic Dysfunction in Immune Thrombocytopenia is Linked to Autophagy Cancer Cell International 19: 59. https://doi.org/10.1186/s12935-019-0779-0.
Suzuki, Y. J. & Gychka, S. G. (2021). SARS-CoV-2 Spike Protein Elicits Cell Signaling in Human Host Cells: Implications for Possible Consequences of COVID-19 Vaccines. Vaccines 9: 36. https://doi.org/10.3390/vaccines9010036.
Suzuki, Y. J. (2020). The Viral Protein Fragment Theory of COVID-19 Pathogenesis. Medical Hypotheses 144: 110267. https://doi.org/10.1016/j.mehy.2020.110267.
Suzuki, Y. J., Nikolaienko, S. I., Dibrova, V. A., Dibrova, Y. V., Vasylyk, V. M., Novikov, M. Y. Gychka, S. G. (2021). SARS-CoV-2 Spike Protein-Mediated Cell Signaling in Lung Vascular Cells. Vascular Pharmacology 137: 106823. https://doi.org/10.1016/j.vph.2020.106823.
Suzuki, Y.J., Nikolaienko, S.I., Dibrova, V.A., Dibrova, Y.V., Vasylyk, V.M., Novikov, M.Y. Gychka, S.G. (2020). SARS-CoV-2 Spike Protein-Mediated Cell Signaling in Lung Vascular Cells. Vascular Pharmacology 137: 106823. https://www.doi.org/10.1016/j.vph.2020.106823.
Takada, A., Feldmann, H., Ksiazek, T. G. & Kawaoka, Y. (2003). Antibody-Dependent Enhancement of Ebola Virus Infection. Virology 77(13): 7539-7544. https://doi.org/10.1128/JVI.77.13.7539-7544.2003.
Temin, H. M. and Mizutani, S. (1970). RNA-dependent DNA polymerase in virions of Rous Sarcoma Virus. Nature 226: 1211–3. https://www.doi.org/10.1038/2261211a0.
Tetz, G. and Tetz, V. (2020). SARS-CoV-2 Prion-Like Domains in Spike Proteins Enable Higher Affinity to ACE2. Preprints 2020030422. https://www.doi.org/10.20944/preprints202003. 0422.v1.
Tetz, G. and Tetz,V (2018). Prion-like Domains in Eukaryotic Viruses. Scientific Reports 8: 8931. https://doi.org/10.1038/s41598-018-27256-w.
U.S. Department of Health and Human Services, Food and Drug Administration. Center for Biologics Evaluation and Research. (2020, June) Development and Licensure of Vaccines to Prevent COVID-19 Guidance for Industry. Retrieved February 11, 2021 from https://www.fda.gov/regulatory-information/search-fda-guidance- documents/development-and-licensure-vaccines-prevent-covid-19.
US Food and Drug Administration (2021). Pfizer-BioNTech COVID-19 Vaccine EUA Fact Sheet for Healthcare Providers Administering Vaccine (Vaccination Providers). https://www.fda.gov/media/144413
Verma, S., Saksena, S. & Sadri-Ardekani, H. (2020). ACE2 Receptor Expression in Testes: Implications in Coronavirus Disease 2019 Pathogenesis. Biology of Reproduction 103(3): 449-451. https://doi.org/10.1093/biolre/ioaa080.
Vlachoyiannopoulos, P. G., Magira, E., Alexopoulos, H., Jahaj, E., Theophilopoulou, K., Kotanidou, A., & Tzioufas, A. G. (2020). Autoantibodies Related to Systemic Autoimmune Rheumatic Diseases in Severely Ill Patients with COVID-19. Annals of the Rheumatic Diseases 79(12): 1661-1663. http://dx.doi.org/10.1136/annrheumdis-2020- 218009.
Vaidya, M. and Sugaya, K (2020). DNA Associated with Circulating Exosomes as a Biomarker for Glioma. Genes 11: 1276. https://www.doi.org/10.3390/genes11111276.
Vojdani, A., & Kharrazian, D. (2020). Potential Antigenic Cross-Reactivity Between SARS-CoV-2 and Human Tissue with a Possible Link to an Increase in Autoimmune Diseases. Clinical Immunology (Orlando, Fla.) 217: 108480. https://doi.org/10.1016/j.clim.2020.108480.
Vojdani, A., Vojdani, E., & Kharrazian, D. (2021). Reaction of Human Monoclonal Antibodies to SARS-CoV-2 Proteins with Tissue Antigens: Implications for Autoimmune Diseases. Frontiers in Immunology 11: 3679. https://doi.org/10.3389/fimmu.2020.617089.
Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C. & Thakur, A. (2020). Opportunities and Challenges in the Delivery of mRNA-based Vaccines. Pharmaceutics 12(2): 102. https://doi.org/10.3390/pharmaceutics12020102.
Wallukat, G., Hohberger, B., Wenzel, K.,Fürst, J.,Schulze-Rothe, S., Wallukat, A. Müller, J. (2021). Functional Autoantibodies against G-protein Coupled Receptors in Patients with Persistent Post-COVID-19 Symptoms. Journal of Translational Autoimmunity 4: 100100. https://doi.org/10.1016/j.jtauto.2021.100100.
Walter, U., Tsiberidou, P., Kersten, M., Storch, A., and Lohle, M. (2018). Atrophy of the Vagus Nerve in Parkinsons Disease Revealed by High-resolution Ultrasonography. Frontiers in Neurology 9:805. https://www.doi.org/10.3389/fneur.2018.00805.
Wan, Y., Shang, J., Sun, S., Tai, W., Chen, J., Geng, Q. & Li, F. (2020). Molecular Mechanism for Antibody-Dependent Enhancement of Coronavirus Entry. Journal of virology, 94(5). https://doi.org/10.1128/JVI.02015- 19.
Wang, C.-Y., Ma, S., Bi, S.-J., Su,L., Huang, S.-Y. Peng, J. (2019). Enhancing Autophagy Protects Platelets in Immune Thrombocytopenia Patients. Ann Transl Med 7(7): 134. https://doi.org/10.21037/atm.2019.03.04.
Wang, Z., Troilo, P. J., Wang, X., Griffiths, T.G. II, Pacchione, S. J., Barnum, A. B. Ledwith, B. J. (2004). Detection of integration of plasmid DNA into host genomic DNA following intramuscular injection and electroporation. Gene Therapy 11: 711-721. https://doi.org/10.1038/sj.gt.3302213.
Wang, Z.& Xu, X. (2020). ScRNA-seq Profiling of Human Testes Reveals the Presence of the ACE2 Receptor, a Target for SARS-CoV-2 Infection in Spermatogonia, Leydig and Sertoli Cells. Cells 9: 920. https://doi.org/10.3390/cells9040920.
Weickenmeier, J., Jucker, M., Goriely, A., and Kuhl, E. (2019). A Physics-based Model Explains the Prion-like Features of Neurodegeneration in Alzheimer’s Disease, Parkinson’s Disease, and Amyotrophic Lateral Sclerosis. Journal of the Mechanics and Physics of Solids 124: 264-281. https://doi.org/10.1016/j.jmps.2018.10.013.
Weiner, A. M. (2002). SINEs and LINEs: the Art of Biting the Hand that Feeds You. Current Opinions in Cell Biology 14(3): 343-50. https://doi.org/10.1016/s0955-0674(02)00338-1.
Wikipedia contributors. (2021, February 13). ELISA. Retrieved February 16, 2021, from Wikipedia, The Free Encyclopedia. https://en.wikipedia.org/w/index.php?title=ELISA&oldid=1006455262.
World Health Organization (2021, January 19). mRNA-1273 Vaccine (Moderna) Against COVID-19 Background Document: Draft Prepared by the Strategic Advisory Group of Experts (SAGE) on Immunization Working Group on COVID-19 vaccines. No. WHO/2019-nCoV/vaccines/mRNA-1273/2021.1. https://policycommons.net/artifacts/1424630/mrna-1273-vaccine-moderna-against-covid-19-background- document/
World Health Organization. (2021, January 14). Background document on mRNA vaccine BNT162b2 (Pfizer- BioNTech) against COVID-19. License: CC BY-NC-SA 3.0 IGO. https://apps.who.int/iris/handle/10665/338671.
Wrapp, D., Wang, N., Corbett, K. S., Goldsmith, J. A., Hsieh, C.-L., Abiona, O. Graham, B. S. (2020). Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation. Science 2020; 367: 1260-3. https://doi.org/10.1126/science.abb2507.
Wu, F., Yan, R., Liu, M., Liu, Z., Wang, Y., Luan, D. Huang, J. (2020). Antibody-Dependent Enhancement (ADE) of SARS-CoV-2 Infection in Recovered COVID-19 Patients: Studies Based on Cellular and Structural Biology Analysis. medRxiv preprint. https://doi.org/10.1101/2020.10.08.20209114.
Wylon, K. Sabine Dölle, S., & Margitta Worm, M. (2016). Polyethylene Glycol as a Cause of Anaphylaxis. Allergy, Asthma & Clinical Immunology 12(1): 1-3. https://doi.org/10.1186/s13223-016-0172-7.
Xu, S., Yang, K., Li, R. & Zhang, L. (2020) mRNA Vaccine Era — Mechanisms, Drug Platform and Clinical Prospection.International Journal of Molecular Science 21(18): 6582. https://doi.org/10.3390/ijms21186582.
Yang, Q. & Lai, S. K. (2015). Anti‐PEG Immunity: Emergence, Characteristics, and Unaddressed Questions. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology 7(5): 655-677. https://doi.org/10.1002/wnan.1339.
Young, R., Bekele, T., Gunn, A., Chapman, N., Chowdhary, V., Corrigan, K., … Yamey, G. (2018). Developing New Health Technologies for Neglected Diseases: A Pipeline Portfolio Review and Cost Model. Gates Open Res 2:23. https://doi.org/10.12688/gatesopenres.12817.2.
Zaman, M. (2021). COVID Vaccine Booster Shots Are Coming — Here’s What to Know. https://www.msn.com/en- us/health/medical/covid-vaccine-booster-shots-are-coming-here-s-what-to-know/ar-BB1foY4s. Accessed 5/1/2021.
Zamani, B., Moeini Taba, S.-M. & Shayestehpour, M. (2021). Systemic Lupus Erythematosus Manifestation Following COVID-19: A Case Report. Journal of Medical Case Reports 15(1): 1-4. https://doi.org/10.1186/s13256-020- 02582-8.
Zeng, C., Zhang, C, Walker, P. G. & Dong, Y. (2020). Formulation and Delivery Technologies for mRNA Vaccines.
Current Topics in Microbiology and Immunology June 2. [Epub ahead of print]. https://doi.org/10.1007/82_2020_217.
Zhang, L., Richards, A., Barrasa, M, I., Hughes, S. H., Young, R. A. & Jaenisch, R. (2021). Reverse-transcribed SARS- CoV-2 RNA can Integrate into the Genome of Cultured Human Cells and can be Expressed in Patient-derived Tissues. Proceedings of the National Academy of Sciences 118(21): e2105968118. https://doi.org/10.1073/pnas.2105968118.
Zhang, X. W. & Yap, Y. L. (2004). The 3D Structure Analysis of SARS-CoV S1 Protein Reveals a Link to Influenza Virus Neuraminidase and Implications for Drug and Antibody Discovery. Theochemistry 681(1): 137-141. https://doi.org/10.1016/j.theochem.2004.04.065.
Zhou, Z.-H., Stone, C. A., Jr., Jakubovic, B., Phillips, E. J., Sussman, G., Park, J.-M. Kozlowski, S. (2020). Anti-PEG
IgE in Anaphylaxis Associated with Polyethylene Glycol. The Journal of Allergy and Clinical Immunology in Practice ;9(4): 1731-1733.e3. https://doi.org/10.1016/j.jaip.2020.11.011.
Zimmer, C., Corum, J., Wee, S.-L. Coronavirus Vaccine Tracker. New York Times. Updated Jan. 28, 2021. https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html.
Zuo, Y., Estes, S. K., Ali, R. A., Gandhi, A. A., Yalavarthi, S., Shi, H. & Knight, J. S. (2020). Prothrombotic Autoantibodies in Serum from Patients Hospitalized with COVID-19. Science Translational Medicine, 12(570): eabd3876. https://doi.org/10.1126/scitranslmed.abd3876.
 CienciaySaludNatural.com
CienciaySaludNatural.com