Por Michael Palmer, MD y Sucharit Bhakdi, MD de julio de 23 de 2021
Resumimos los hallazgos de un estudio en animales que Pfizer presentó a las autoridades sanitarias japonesas en 2020, y que se refería a la distribución y eliminación de una vacuna modelo de ARNm. Mostramos que este estudio presagiaba claramente graves riesgos de coagulación sanguínea y otros efectos adversos. El hecho de no monitorear y evaluar estos riesgos en los ensayos clínicos posteriores, y el proceso de revisión por negligencia grave junto con las autorizaciones de uso de emergencia, como era de esperar, han resultado en un desastre médico sin precedentes.
1. Introducción y antecedentes
Al igual que con cualquier medicamento, una consideración clave para la toxicidad de las vacunas de ARNm de COVID es dónde terminan exactamente en el cuerpo y por cuánto tiempo permanecerán allí. Estas cuestiones, que son objeto de farmacocinética , suelen investigarse a fondo y durante el desarrollo del fármaco. Los estudios iniciales de farmacocinética y también de toxicidad se llevan a cabo en animales. Si el resultado es favorable, se realizarán experimentos similares en un pequeño número de voluntarios humanos. Solo después de que dichos estudios preliminares se hayan concluido con éxito, se aprueban los ensayos clínicos adecuados, que luego determinarán si el fármaco o la vacuna en cuestión tiene la eficacia clínica deseada.
Debido a la prisa oficialmente sancionada y la negligencia grave sistemática en el desarrollo y aprobación de las vacunas K0 B¡T, nuestro conocimiento de su farmacocinética es incompleto. El único estudio en animales algo detallado que ha llegado al público se refiere a la inyección de Pfizer [ 1 , 2 ]. Estos datos se publicaron después de que Pfizer los presentara a las autoridades sanitarias de Japón al solicitar la autorización de uso de emergencia de su vacuna en ese país. 1 Estos datos se referían en particular a la distribución de la vacuna dentro del cuerpo después de la inyección y a su eliminación del cuerpo. Aunque lejos de ser exhaustivo o incluso adecuado, este documento tiene implicaciones de gran alcance: muestra que Pfizer, así como las autoridades que estaban al tanto de estos datos, deben haber reconocido los graves riesgos de eventos adversos después de la vacunación incluso antes de la fecha de la vacunación e inicio de ensayos clínicos. Sin embargo, los propios ensayos clínicos de Pfizer no pudieron monitorear ninguno de los riesgos que eran claramente evidentes a partir de estos datos, y las autoridades reguladoras no hicieron cumplir los estándares adecuados de supervisión. Esta doble falla ha causado un daño más grave al público.
Antes de discutir este estudio y sus implicaciones en detalle, revisaremos brevemente cómo funciona la vacuna de ARNm de Pfizer. Estas explicaciones también se aplican a la vacuna de ARNm de Moderna, mientras que las vacunas de AstraZeneca y Johnson & Johnson difieren en algunos aspectos.
1.1 Cómo funcionan las inyecciones de ARNm K0 B¡T
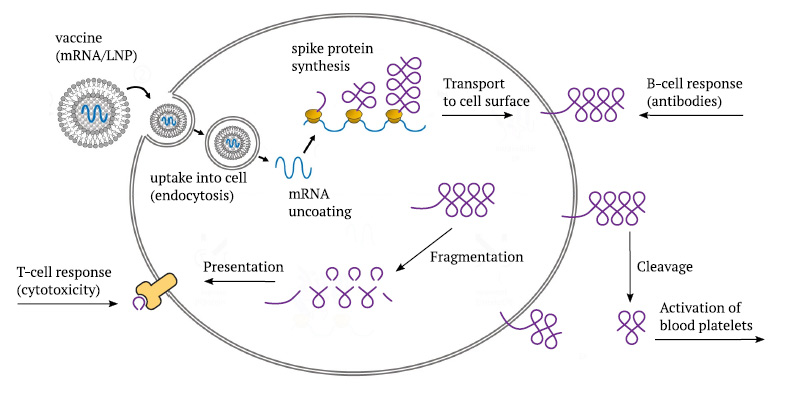
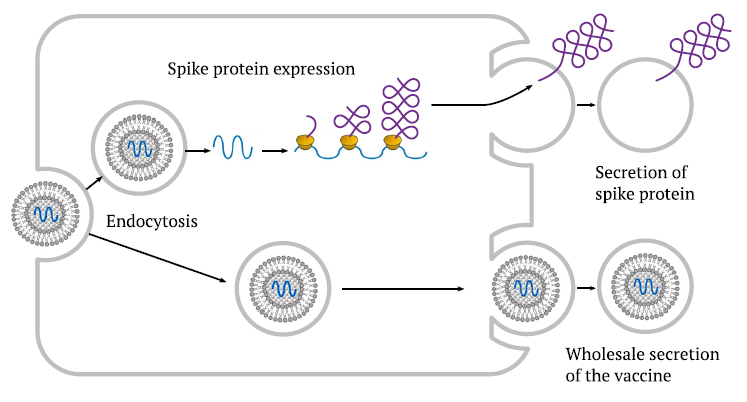
Las vacunas de ARNm de Pfizer y Moderna consisten en un ARN mensajero sintético (ARNm) que codifica la “proteína de pico” «Spike»del SARS-CoV-2, que normalmente se encuentra en la superficie de las partículas del coronavirus. Este ARNm está recubierto con una mezcla de lípidos sintéticos (moléculas similares a las grasas) que lo protegen durante el transporte dentro del cuerpo y que también facilitan su captación en las células objetivo a través de la endocitosis .
Una vez que la inyección ha entrado en una célula, inicialmente se encuentra encerrada por una vesícula de membrana, una pequeña burbuja que se desprendió de la membrana celular. La posterior acumulación de ácido dentro de esta burbuja hace que los lípidos se eliminen y el ARNm se libere en el citosol (el líquido intracelular); este paso de liberación es facilitado por el lípido catiónico ALC-0315 (ver más adelante). Luego, el ARNm se une a los ribosomas , las pequeñas fábricas de proteínas de la célula, e induce la síntesis de las moléculas de proteína de pico reales. La mayoría de las moléculas de proteína de punta «Proteina Spike» se transportarán luego a la superficie celular.
Una vez que aparezca allí, será reconocido por los linfocitos B (células B), que luego comenzarán a producir anticuerpos contra él. 2 Además, una parte de la proteína pico «Proteina Spike» también puede escindirse mediante proteasas en la superficie celular y liberarse de la célula. Si esto sucede dentro de la circulación, el fragmento liberado, denominado S1, puede unirse a las plaquetas sanguíneas (trombocitos) y activarlas. De esta manera, la proteína de pico promueve directamente la coagulación de la sangre.
Al igual que con cualquier proteína que se sintetiza dentro de la célula, una pequeña cantidad de moléculas sufrirán fragmentación y los fragmentos se presentarán en la superficie celular en asociación con proteínas portadoras específicas (HLA-). El propósito de este mecanismo es la vigilancia inmunológica: tan pronto como aparezcan fragmentos de alguna proteína que el sistema inmunológico no reconoce como «propia», se montará una respuesta inmunitaria contra esa proteína y contra las células que la producen. Esta respuesta está mediada por linfocitos T citotóxicos (CTL, células T-killer).
Al montar su respuesta citotóxica, el sistema inmunológico no distinguirá entre una verdadera infección por virus y la expresión de una vacuna de ARNm; mientras los fragmentos de proteína de pico aparezcan en la célula, las células asesinas estarán en marcha. Si la vacuna se expresa en las células que recubren los vasos sanguíneos, las células endoteliales , la lesión vascular causada por el ataque inmunológico volverá a desencadenar la coagulación de la sangre. Por lo tanto, tenemos al menos dos caminos distintos hacia la coagulación sanguínea después de la vacunación.
Colabore con Nosotros, sea parte del equipo click aqui , su participación es fundamental!
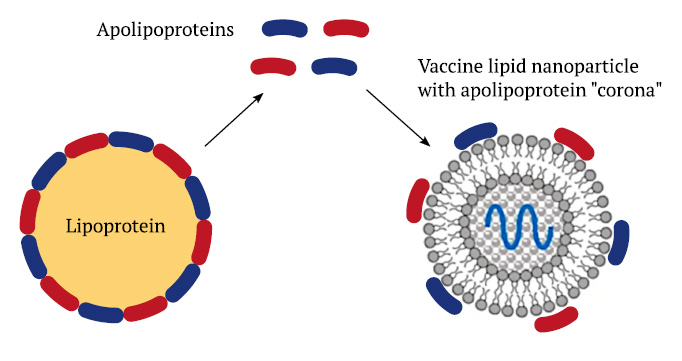
1.2 Las vacunas de ARNm recubiertas de lípidos adquieren una apolipoproteína «corona»
Las partículas de lipoproteínas se encuentran naturalmente en el torrente sanguíneo y dentro de los tejidos de nuestro cuerpo. Consisten en un núcleo de lípidos que está rodeado por una capa de proteínas llamadas apolipoproteínas . Su propósito es transportar lípidos como el colesterol y el triacilglicerol (grasa regular) entre órganos. Por ejemplo, un tipo específico de lipoproteína llamado quilomicrones transporta las grasas de la dieta después de que han sido absorbidas por el intestino delgado. Otras lipoproteínas llamadas VLDL y LDL distribuyen las grasas que se han sintetizado en el hígado a otros órganos y tejidos.
Las diversas apolipoproteínas que encierran las lipoproteínas estabilizan las partículas y también sirven como «etiquetas de dirección» que se unen a las moléculas receptoras en la superficie celular. Esta interacción desencadenará la absorción de las lipoproteínas en esas células. Las nanopartículas de lípidos artificiales (LNP), como las que se utilizan en las vacunas de ARNm de K0 B¡T, pueden adquirir una capa, una “corona”, de las propias moléculas de apolipoproteína del cuerpo [ 3 ]. Esto permite que estas vacunas también sean absorbidas por las células de nuestro cuerpo.
El hígado tiene un lugar central en el recambio metabólico de lípidos y lipoproteínas. En consecuencia, las células del hígado son ricas en moléculas receptoras de superficie específicas que median la captación de lipoproteínas, lo que sugiere que también absorberán eficazmente LNP decoradas con apolipoproteínas. De hecho, este es el caso. Sin embargo, otros órganos también tienen altas tasas de captación de lipoproteínas y, por lo tanto, es de esperar que también acumulen las LNP de la vacuna decoradas con apolipoproteínas.
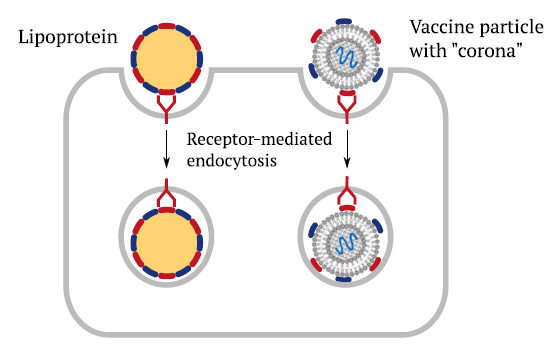
1.3 Captación celular de lipoproteínas y vacunas mediada por receptores
Esta diapositiva ilustra el papel de los receptores celulares y las apolipoproteínas para facilitar la captación de vacunas en las células a través de la endocitosis. Se unen a los mismos receptores celulares que las partículas de lipoproteínas regulares y, posteriormente, se absorben de la misma manera. Los eventos posteriores, liberación del ARNm y síntesis de proteínas.
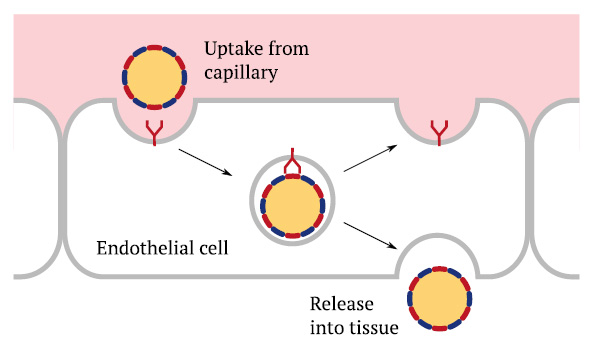
1.4 Transcitosis de lipoproteínas del torrente sanguíneo a los tejidos
Todo el intercambio de sustrato entre los tejidos y el torrente sanguíneo se produce en los capilares. En el más fino de todos los vasos sanguíneos, la sangre está separada de la matriz extracelular de los tejidos por una sola capa celular, a saber, las células endoteliales. La pared capilar permite el paso libre solo a moléculas pequeñas como, por ejemplo, azúcar en sangre (glucosa) o aminoácidos. Las lipoproteínas, que son mucho más grandes, deben transportarse a través de la pared capilar mediante transcitosis . En este proceso de dos etapas, la endocitosis en un lado de la célula es seguida por exocitosis , es decir, por la liberación de las partículas, que ocurre en el otro lado.
Si bien esta figura muestra la transcitosis del torrente sanguíneo al tejido, el proceso en realidad funciona en ambas direcciones. De esta manera, las células de los tejidos pueden aprovechar el colesterol transportado por el LDL circulante, pero también pueden devolver el exceso de colesterol a través del torrente sanguíneo al hígado a través de otras lipoproteínas (HDL).
La transcitosis también se aplicará a los LNP de la vacuna decorados en forma de «corona» y les permitirá llegar a los tejidos de varios órganos. La transcitosis inversa de la vacuna podría contribuir a su absorción desde el tejido muscular hacia la circulación después de la inyección (ver más abajo).
2 El estudio de farmacocinética de la vacuna Pfizer en ratas
- Se utilizó una «vacuna modelo»: los mismos LNP, diferentes ARNm (que codifican la luciferasa)
- El colesterol contenido en los LNP se marcó con radiactividad ( 3 H) para rastrear
- La distribución de lípidos entre diferentes órganos se midió en varios puntos de tiempo después de la inyección intramuscular.
Este es el experimento clave en el estudio con animales de Pfizer [ 1 ]. El enfoque técnico utilizado aquí es bastante común, ya que la radiactividad se puede medir con mucha sensibilidad y precisión. La preparación de vacuna marcada radiactivamente se inyectó en ratas. Los animales fueron «sacrificados» (cortados) en varios puntos de tiempo después de la inyección, y se midió la cantidad de radiactividad en diferentes órganos.
La proteína modelo utilizada en este estudio fue una proteína de luciérnaga llamada luciferasa . Esta es la proteína que permite que las luciérnagas brillen en la oscuridad. Cuando las células del cuerpo de las ratas captan el ARNm que codifica la luciferasa y luego sintetizan la proteína, ellas también comenzarán a brillar en la oscuridad. La luz, como la radiactividad, es conveniente de medir; cuanta más luz emana de un tejido dado, más captación de ARNm y síntesis de proteínas se han producido. 3 Por tanto, entre el radiomarcaje sobre el lípido y la luminiscencia provocada por la luciferasa, fue posible determinar tanto la distribución de la vacuna modelo dentro del organismo como su actividad biológica.
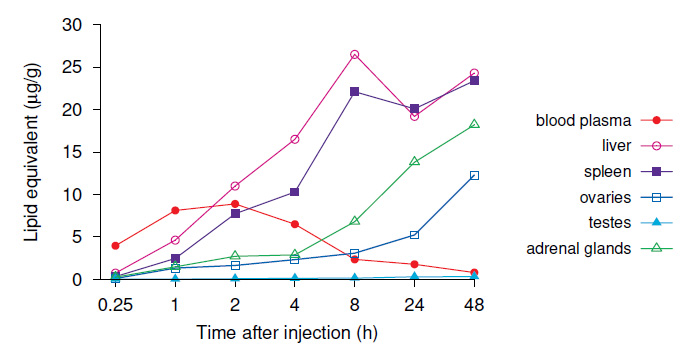
2.1 Datos clave del estudio de distribución de lípidos
Lo primero que hay que tener en cuenta es que el lípido marcado aparece en el plasma sanguíneo después de muy poco tiempo. El nivel plasmático más alto se alcanza dos horas después de la inyección; sin embargo, incluso después de solo 15 minutos (0,25 horas), el nivel ya alcanza casi la mitad de ese valor máximo. La transcitosis inversa podría explicar en parte este rápido proceso de captación. Un factor más importante puede ser el drenaje de líquido tisular a través de los vasos linfáticos hacia el torrente sanguíneo. Es probable que el drenaje linfático se acelere por la liberación aguda de mediadores inflamatorios dentro del tejido muscular.
A medida que desciende el nivel del plasma sanguíneo, la actividad aumenta en varios otros órganos. El aumento más rápido y más alto se observa en el hígado y el bazo. Ambos órganos son ricos en macrófagos , un tipo de célula que se encarga de eliminar partículas como microbios o fragmentos de células en descomposición del torrente sanguíneo. Los macrófagos también son numerosos en la médula ósea, donde la vacuna alcanza niveles algo más bajos pero aún sustanciales.
Si bien es probable que los macrófagos sean responsables de la mayor parte de la captación en el bazo, este puede no ser el caso en el hígado. Aquí, es probable que la inyección termine principalmente en las células epiteliales específicas de órganos, que son muy ricas en receptores de lipoproteínas. Es muy probable que la captación en los ovarios y en las glándulas suprarrenales también esté mediada por receptores de lipoproteínas. Ambos órganos absorben lipoproteínas para obtener colesterol, que utilizan como precursor para producir hormonas esteroides: corticosteroides en las glándulas suprarrenales y hormonas sexuales femeninas (estrógenos y progestinas) en los ovarios.
Los testículos también producen hormonas sexuales (en particular testosterona) a partir del colesterol, pero aquí la acumulación de lípidos de la vacuna es notablemente mucho menor. La literatura científica no ofrece una explicación completa y sencilla de la captación restringida en los testículos, pero puede estar relacionada con la llamada barrera hemato-testicular. En la mayoría de los demás órganos examinados, los niveles eran igualmente bajos que en los testículos. Sin embargo, observamos que al menos los vasos sanguíneos se verán afectados en todos los órganos y en todos los tejidos.
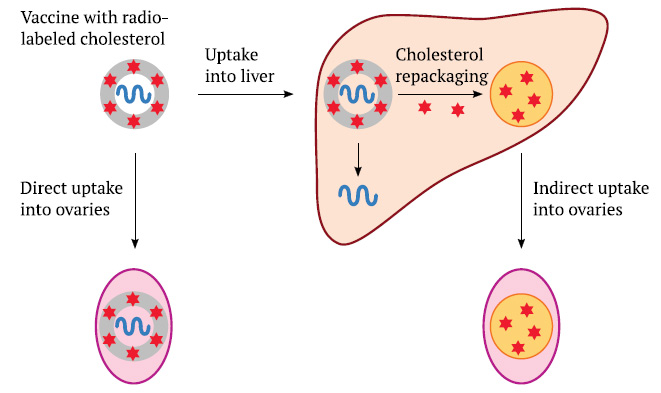
2.2 Transporte directo o indirecto de radiomarcaje a los ovarios
Es de destacar que el nivel de radiactividad en el hígado aumenta muy rápidamente durante las primeras ocho horas pero luego se estanca, mientras que en los ovarios y las glándulas suprarrenales el aumento continúa incluso dos días completos después de la inyección. Esto sugiere que la radiactividad puede redistribuirse del hígado a estas glándulas. En este contexto, debemos recordar que el componente LNP que llevaba la etiqueta era el colesterol. El colesterol marcado se comportaría como el colesterol endógeno (no marcado) y, después de la absorción en el hígado, esperaríamos que se reciclara y se redistribuyera a otros órganos. El colesterol redistribuido desde el hígado probablemente no estaría acompañado por el ARNm.
Además del colesterol, los LNP de la vacuna contienen otro lípido natural (diestearoil-fosfatidilcolina) y dos no naturales (ver más abajo). Por lo tanto, debemos preguntarnos en qué medida estos otros lípidos sufrirían una redistribución desde el hígado y luego también se acumularían, por ejemplo, en los ovarios.
Finalmente, también debe tenerse en cuenta que la distribución de la vacuna podría verse afectada por la proteína codificada por su componente de ARNm. Si en lugar de la enzima luciferasa supuestamente inerte se hubiera expresado la proteína de pico, esto podría haber afectado la integridad vascular, particularmente también en la barrera hematoencefálica. Esto podría traducirse en una mayor captación en otros órganos, incluido el sistema nervioso central.
Cada una de las preguntas planteadas podría haberse respondido fácilmente mediante experimentos similares a los informados por Pfizer; en particular, cada uno de los lípidos relevantes debería haber sido marcado radiactivamente a su vez, y debería haberse utilizado el ARNm adecuado que codifica la proteína de pico real en lugar de el que codifica la luciferasa. No hace falta decir que la FDA, la EMA y otros reguladores nunca deberían haber autorizado el uso de la vacuna sin exigir y revisar estudios exhaustivos de este tipo.
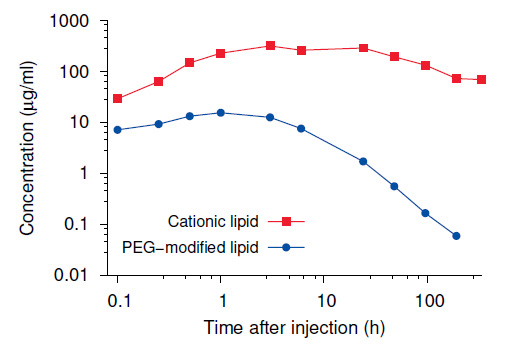
2.3 Eliminación muy lenta del lípido catiónico ALC-0315 del hígado de rata
De los dos lípidos no naturales contenidos en los LNP de la vacuna, uno (ALC-0315) es débilmente básico, mientras que el otro (ALC-0159) lleva una fracción de polietilenglicol (PEG). Como se acaba de comentar, no se llevaron a cabo estudios exhaustivos de distribución de estos lípidos. Sin embargo, Pfizer informó el cambio a lo largo del tiempo de sus concentraciones en el hígado. El nivel del lípido modificado con PEG disminuyó lenta pero regularmente con tiempo. El otro, sin embargo, el lípido catiónico ALC-0315, se mantuvo en niveles muy altos dos semanas (336 horas) después de la inyección. Incluso después de 6 semanas, todavía se detectó parte del compuesto en el hígado. Como se discutió en la sección anterior, no podemos descartar que estos lípidos sintéticos también se redistribuyan desde el hígado a otros órganos, donde luego podrían almacenarse durante períodos de tiempo aún más prolongados.
Es posible que haya escuchado que algunos pesticidas como el DDT pueden persistir en el cuerpo humano durante meses e incluso años. Esto suele ocurrir con compuestos que son muy lipofílicos , lo que significa que se dividen en gotitas de grasa dentro del tejido graso y otros órganos. Mientras no se utilice la grasa contenida en estas gotitas, las sustancias químicas disueltas en ellas estarán a salvo de la degradación y el recambio metabólico. Es probable que el lípido catiónico ALC-0315 se acumule de la misma manera. Si es así, podemos esperar persistencia durante períodos de tiempo incluso más largos de lo que se evidencia en este gráfico en tejidos que tienen una actividad metabólica más baja que el hígado.
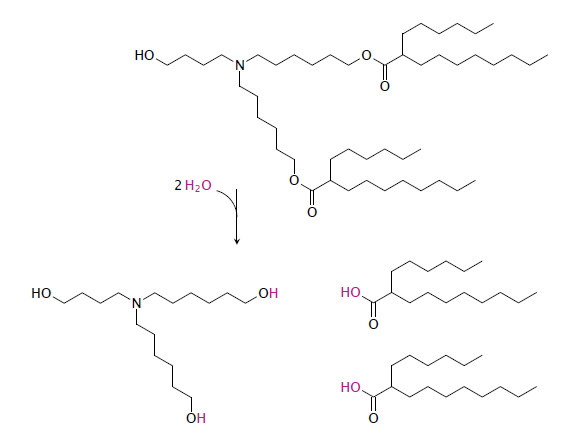
2.4 La degradación lenta está integrada en la estructura de ALC-0315
Este tema es bastante técnico y no es necesario para el panorama general. Si no puede distinguir lo que muestra este diagrama, no dude en omitirlo.
La estructura en la parte superior muestra el lípido catiónico intacto denominado ALC-0315. La hidrólisis de los dos enlaces éster (C (= O) O) produce los tres fragmentos en la parte inferior; según el documento de Pfizer, este es el paso inicial en la degradación y vía de eliminación de este lípido. Las siguientes características sugieren que dentro del cuerpo este paso ocurrirá con bastante lentitud:
- La molécula completa no contiene carga permanente y solo un átomo ionizable (el nitrógeno, N), que está unido a tres cadenas de alquilo. Aparte del grupo hidroxi (OH) un polar, todo el resto de la molécula es hidrófobo. Esto significa que la molécula se dividirá muy fuertemente no solo en bicapas lipídicas (membranas) sino también en gotitas lipídicas, donde se ocultará de manera efectiva de cualquier enzima degradante.
- Cuando esta molécula es parte de una bicapa lipídica, como es el caso dentro de los LNP de la vacuna, los dos enlaces éster todavía estarán enterrados profundamente dentro de la porción hidrófoba de esa bicapa, lo que los protegerá de la escisión hidrolítica.
- La hidrólisis de los enlaces éster se verá impedida estéricamente hasta cierto punto por las ramas adyacentes en los residuos de acilo graso.
Con la posible excepción de la falta de carga permanente, ninguna de estas características es esencial para la función deseada de la molécula, es decir, liberar el ARNm de las partículas de la vacuna después de que estas últimas hayan sido absorbidas por las células de nuestro cuerpo. Hay muchas formas en las que esta molécula podría haber sido modificada para una degradación más rápida in vivo. Por lo tanto, es digno de mención que esto no se hizo: la inyección se formuló deliberadamente con un compuesto que se degrada y elimina del cuerpo muy lentamente. Dado que es muy probable que este lípido permanezca en nuestros tejidos durante meses, debemos esperar una toxicidad acumulativa con las vacunas repetidas.
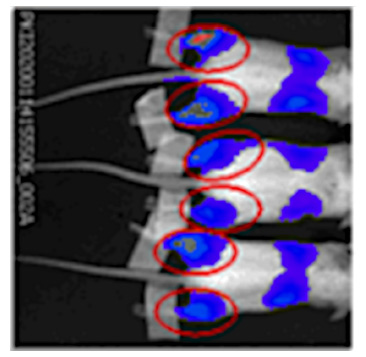
2.5 Fuerte expresión de luciferasa en hígado y bazo de rata
Esta imagen se tomó del estudio de Pfizer. Por lo que puedo decir, muestra tres cuerpos de rata desollados. El momento de la medición es 6 horas después de la inyección. Los óvalos rojos indican los sitios de inyección en las patas traseras, y los diversos colores (en su mayoría azules) dentro de ellos indican la luminiscencia producida por la expresión local de luciferasa. Esta luminiscencia indica que la vacuna ingresó a las células cercanas a los sitios de inyección y entregó con éxito su ARNm a los ribosomas dentro de la célula.
Las áreas separadas de color azul y violeta a la derecha están sobre el hígado y el bazo. Por tanto, la acumulación pronunciada de lípidos en estos órganos también se correlaciona con una fuerte expresión del ARNm de luciferasa liberado.
2.6 ¿La correlación entre la captación de lípidos y la expresión de ARNm se aplica también a otros órganos?
- Solo se rastreó el colesterol, pero no se determinó la distribución del ARNm.
- La expresión de luciferasa o proteína de pico podría haberse probado con otros órganos, pero no se informaron tales resultados.
- La distribución de ARNm podría fácilmente haberse rastreado directamente.
En la Sección 2.2 , observamos que el colesterol radiomarcado podría llegar a órganos distintos del hígado, en particular a los ovarios, ya sea a través de la absorción de las partículas de la vacuna por estos órganos, o indirectamente después de la absorción inicial en el hígado, donde se volvería a empaquetar en nuevos partículas de lipoproteínas sintetizadas. En el primer caso, la radiactividad estaría acompañada por el ARNm, mientras que en el segundo probablemente no lo estaría. Por tanto, habría sido importante estudiar la expresión del ARNm en estos otros órganos también.
Los ovarios de rata son pequeños y, por lo tanto, las mediciones de luminiscencia en este órgano pueden no ser muy sensibles; sin embargo, en ese caso, tales mediciones podrían haberse realizado en una especie animal más grande. La expresión de la proteína de la punta en sí podría haberse medido usando anticuerpos marcados. Como mínimo, si el análisis de expresión se considerara demasiado engorroso, habría sido bastante fácil detectar la captación del propio ARNm en diferentes tejidos, por ejemplo, etiquetándolo con yodo radiactivo [ 4 ]. Tales mediciones habrían sido incluso más precisas y sencillas que las que se llevaron a cabo realmente para los lípidos.
Dado que tales experimentos no habrían sido particularmente difíciles, sospecho que Pfizer los realizó, pero decidió no informar los resultados. Sea como fuere, sin embargo, sabemos que la mayor parte del lípido permanecerá unido al ARNm hasta que ambos hayan sido absorbidos por las células. En ausencia de una prueba positiva a lo contrario, debemos asumir que existe una estrecha correlación entre la captación de lípidos, la captación de mRNA y la expresión de mRNA. Esto plantea preocupaciones obvias por la salud y la integridad de los ovarios.
3 ¿Qué presagian los datos en animales de Pfizer sobre los efectos biológicos en los seres humanos?
- Rápida aparición de proteína de pico (Spike) en la circulación.
- Toxicidad para los órganos con altas tasas de captación observadas
- Toxicidad para órganos con tasas elevadas de captación esperadas , en particular placenta y glándulas mamarias lactantes
- La penetración de algunos órganos podría ser mayor con la vacuna real que con este modelo de luciferasa
La rápida entrada de la vacuna modelo en la circulación significa que debemos esperar que la proteína de pico se exprese dentro de la circulación, particularmente por las células endoteliales. Hemos visto antes que esto conducirá a la activación de la coagulación sanguínea a través de la activación directa de las plaquetas y también, probablemente más importante, a través del ataque inmunológico a las células endoteliales.
Además, debemos esperar daños en los órganos que absorben grandes cantidades de la vacuna. De hecho, el informe de evaluación de la EMA sobre la vacuna Pfizer [ 5 ] menciona dicho daño orgánico (consulte la Sección 3.4 ). La toxicidad probablemente pertenecerá a algunos órganos que no fueron examinados en el estudio de Pfizer. Esto incluye en particular la placenta, que al igual que los ovarios produce grandes cantidades de hormonas progestágenas a partir del colesterol, también adquiridas de las lipoproteínas circulantes, y las glándulas mamarias lactantes, que adquieren la grasa y el colesterol contenidos en las lipoproteínas para su secreción a la leche materna.
Los estudios de distribución discutidos aquí proporcionaron información útil y relevante; sin embargo, como ya se señaló en la Sección 2.2 , la expresión de la proteína de pico en lugar de la enzima luciferasa supuestamente inerte podría afectar la distribución de la vacuna debido a su interferencia con la integridad vascular, incluso en la barrera hematoencefálica. Por lo tanto, la inyección K0 B¡T real podría lograr una mayor entrada en el cerebro que la inyección modelo de luciferasa. La FDA, la EMA y otros reguladores deberían haber insistido en que tales experimentos se llevaran a cabo y documentaran.
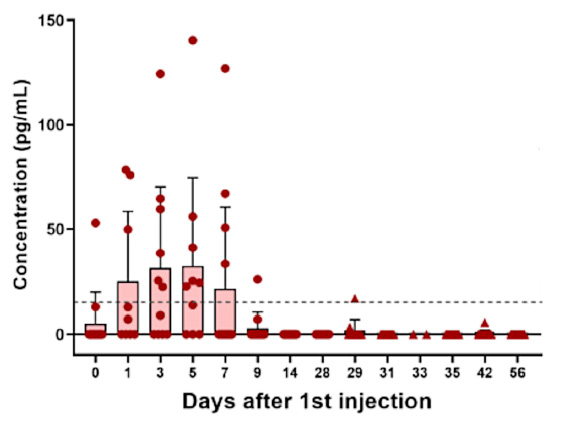
3.1 Expresión de la proteína de pico poco después de la inyección de una vacuna de ARNm en humanos
La entrada temprana de la inyección en la circulación observada en los animales nos lleva a esperar lo mismo en los humanos. De acuerdo con esto, la proteína de pico se vuelve detectable en el plasma sanguíneo de los vacunados humanos incluso el día de la inyección (día 0) y alcanza su punto máximo varios días después [ 6 ]. Tenga en cuenta que este ensayo midió solo el fragmento S1 que se escindió de la superficie celular y se liberó, no la proteína pico intacta que permaneció en las células (consulte la Sección 1.1 ).
Los triángulos del día 29 y posteriores en la figura indican los niveles de fragmento S1 libre después de la segunda inyección. Lo más probable es que los niveles muy bajos no reflejen una falla en la expresión del ARNm inyectado, sino que son el resultado de la respuesta inmune desencadenada por la primera inyección. Los anticuerpos circulantes se unirán a la proteína de pico e interferirán con su medición. Los complejos pico-anticuerpo resultantes pueden ser eliminados del torrente sanguíneo por los fagocitos, pero también pueden contribuir a la inflamación. Los mismos anticuerpos también se unirían a la proteína de pico que permanece en las células. Una vez unidas, pueden activar el sistema del complemento , una cascada de proteínas plasmáticas que finalmente mata las células al perforarlas [ 7 ].
Junto con el aumento de anticuerpos, la primera inyección también inducirá células T-killer dirigidas contra las células productoras de picos (ver Sección 1.1 ). La acción citotóxica más rápida e intensa de estas células T puede destruir las células que tomaron la inyección antes de que tuvieran mucho tiempo para producir proteína de pico. Cualesquiera que sean las contribuciones relativas de los anticuerpos / complemento y de las células T citotóxicas a la supresión de los niveles de proteína de pico libre, está claro que este hallazgo indica un mayor daño a los vasos sanguíneos después de la segunda inyección que después de la primera.
Debemos mencionar que los datos anteriores se obtuvieron de una muestra bastante pequeña: 13 personas en total, de las cuales 11 exhibieron un fragmento S1 libre detectable. Es muy posible que se hubieran observado niveles aún más altos entre un grupo más grande de personas de prueba. En conjunto, los hallazgos de este estudio corroboran el mecanismo hipotético de la coagulación sanguínea inducida por la vacuna que fue establecido de forma clara y temprana por los Médicos por la Ética Covid [ 8 ], y que desde entonces ha sido plenamente confirmado por la experiencia [ 9 ].
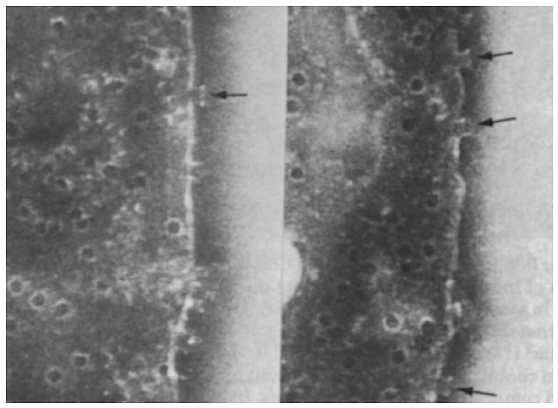
3.2 Complemento de los poros en la superficie de los glóbulos rojos
Acabamos de ver que, en particular, la segunda inyección probablemente provocará la activación del sistema del complemento en las células endoteliales. Esta imagen, tomada de un artículo fundamental sobre el modo de acción del sistema del complemento [ 7 ], ilustra que el sistema del complemento es perfectamente capaz de «disparar la articulación», de destruir por completo una célula.
En el experimento representado, se permitió que los anticuerpos contra los glóbulos rojos de oveja se unieran a tales células en presencia de suero humano, que proporcionó las proteínas complementarias [ 10 ]. Como puede ver, las celdas están plagadas de agujeros. Un poro individual consta de múltiples moléculas de proteína del complemento; sobresale de la membrana (ver flechas) y tiene un diámetro de aproximadamente 10 nanómetros. Los poros romperán la función de barrera de la membrana celular y la célula morirá.
Se deben esperar efectos similares con las células endoteliales aguas abajo de la expresión de la proteína pico y la unión de anticuerpos. El daño a los capilares promoverá la fuga vascular y la coagulación de la sangre.
3.3 Los lípidos catiónicos son citotóxicos
Este gráfico se tomó de un estudio [ 11 ] que no está relacionado con la vacuna Pfizer; se incluye aquí solo como una ilustración de la toxicidad de los lípidos catiónicos en general. Muestra el efecto dosis-dependiente del lípido catiónico en cuestión (estearilamina) sobre la viabilidad de tres líneas celulares diferentes. Entre estos, las dos líneas similares a macrófagos RTS-11 y SHK-1 son más sensibles al efecto citotóxico que la línea celular RTH-149 derivada del hígado.
Si bien los diversos lípidos catiónicos que se han utilizado para el suministro de ADN o ARNm difieren en la citotoxicidad, todos son tóxicos hasta cierto punto; y como ilustra esta figura, varios tipos de células difieren en susceptibilidad. La alta susceptibilidad de los macrófagos se debe a su capacidad incorporada para producir especies reactivas de oxígeno (ROS) como como peróxido de hidrógeno y superóxido. Cuando esta vía es activada por lípidos catiónicos, las ROS producidas pueden matar las células directamente, como se observa en el experimento ilustrado. Un nivel más bajo de activación puede hacer que los macrófagos se «porten mal», lo que puede provocar inflamación, enfermedades autoinmunes y potencialmente cáncer.
Es interesante observar que la evidencia mencionada anteriormente de toxicidad hepática y muscular en el informe de la EMA se obtuvo con el modelo de ARNm que codifica la enzima luciferasa presumiblemente no tóxica. Por lo tanto, esta toxicidad observada no involucra a la proteína de pico. La luciferasa, a diferencia de la proteína pico, no se transporta a la superficie celular; y además, los animales no habrán tenido inmunidad preexistente a la luciferasa que podría haber desencadenado una respuesta inmune rápida e intensa. Por tanto, inferimos que el daño celular informado se debe a la toxicidad química, mediada muy probablemente por los componentes lipídicos catiónicos de los LNP. En consecuencia, también se debe esperar que las futuras vacunas que utilicen la misma tecnología de administración compartan esta toxicidad, independientemente de si se dirigen contra la proteína de pico, otro antígeno del SARS-CoV-2,
3.4 Toxicidad en tejidos y órganos
- Degeneración y cicatrización de las fibras musculares.
- Inflamación subcutánea
- Vacuolización y degeneración de células hepáticas
- Inflamación y daño funcional de los nervios y las articulaciones.
Estos hallazgos de experimentos con ratas se enumeran en el informe de la EMA [ 5 ]. También se obtuvieron utilizando la vacuna modelo que codificaba la luciferasa en lugar de la proteína de pico del SARS-CoV-2 real, lo que significa que la toxicidad probablemente se deba a los lípidos catiónicos en los LNP. Cabe señalar que ninguno de estos efectos tóxicos observados en animales se controló en los denominados ensayos clínicos. Sin embargo, corresponden a los efectos adversos observados en los vacunados desde el inicio de las vacunaciones masivas.
3.5 Datos en animales sobre toxicidad para la reproducción
- Datos muy limitados recopilados en una sola especie animal (ratas)
- Pérdida de embriones tempranos antes de la implantación en el útero> 2 veces más común en el grupo de la vacuna que en los controles
- Las malformaciones son más frecuentes en el grupo de la vacuna que en los controles
Pfizer probó su vacuna en busca de toxicidad reproductiva en solo una especie (ratas) y solo en un pequeño número de animales (21 camadas). Se observó un aumento de más del doble en la pérdida de embriones antes de la implantación, con una tasa del 9,77% en el grupo de la vacuna, en comparación con el 4,09% en el grupo de control. El informe de la EMA simplemente indica que el valor más alto estaba «dentro del rango de datos de control histórico» [ 5 , p. 50]. Por supuesto, la EMA debería haber obligado a Pfizer a declarar sin ambigüedades si la diferencia fue estadísticamente significativa; y de no ser así, aumentar el tamaño de la muestra para asegurar el poder estadístico requerido.
La misma crítica se aplica a las observaciones informadas de «muy baja incidencia de gastrosquisis, malformaciones de la boca / mandíbula, arco aórtico del lado derecho y anomalías de las vértebras cervicales». En general, los estudios de Pfizer están descritos de manera inadecuada y aparentemente también se llevaron a cabo de manera inadecuada.
La pérdida observada antes de la implantación indica toxicidad en una etapa muy temprana del desarrollo, ya sea para el embrión o la placenta naciente. Puede ser causado por un alto nivel de expresión de proteína de pico, pero también por lípidos tóxicos; y podría ocurrir ya dentro de los ovarios, pero también afectar el óvulo fertilizado o etapas posteriores de desarrollo dentro de las trompas de Falopio o el útero. Esto también se aplica a las malformaciones, aunque es más probable que sean causadas por daños posteriores en el desarrollo embrionario, lo que sugiere la transferencia de toxicidad a través de la placenta.
3.6 Dos posibles vías de toxicidad de la vacuna para los lactantes amamantados
La absorción de la vacuna por las células de la glándula mamaria abre dos posibles vías de toxicidad para el niño amamantado: en primer lugar, la expresión de la proteína de pico y su secreción en la leche materna, y en segundo lugar, la transferencia total de la vacuna a la leche.
Las glándulas mamarias son apocrinas , lo que significa que pellizcan y liberan fragmentos de su propio citoplasma en la leche; por lo tanto, cualquier cosa que haya alcanzado el citoplasma también podría llegar a la leche materna. A este respecto, observamos que tanto la base de datos VAERS como el registro de eventos adversos de medicamentos de la UE (EudraVigilance) informan muertes en recién nacidos amamantados poco después de la vacunación de sus madres. Al menos en algunos casos, el cuadro clínico incluyó hemorragia difusa, que también se ha observado en adultos vacunados e infectados con SARS-CoV-2. Por supuesto, estos casos deberían haber desencadenado una búsqueda cuidadosa de los componentes de la vacuna en la leche materna y un estudio específico de los bebés amamantados de madres vacunadas. Un estudio reciente basado en PCR no encontró ARNm en la leche materna, pero la metodología de ese el estudio es cuestionable [ 12 ]. Los estudios sobre la presencia de proteína de pico en la leche parecen faltar por completo.
4 Resumen
Los datos sobre animales de Pfizer presagiaban claramente los siguientes riesgos y peligros:
- coagulación de la sangre poco después de la vacunación, lo que puede provocar ataques cardíacos, derrames cerebrales y trombosis venosa
- grave daño a la fertilidad femenina
- daño grave a los lactantes amamantados
- Toxicidad acumulativa después de múltiples inyecciones.
Con la excepción de la fertilidad femenina, que simplemente no puede evaluarse en el corto período de tiempo durante el cual se han utilizado las inyecciones, todos los riesgos anteriores se han comprobado desde que se lanzaron las vacunas; todos se manifiestan en los informes. a los diversos registros de eventos adversos [ 9 ]. Esos registros también contienen un número muy considerable de informes sobre abortos y muertes poco después de la vacunación, lo que debería haber dado lugar a una investigación urgente.
Debemos enfatizar nuevamente que cada uno de estos riesgos podría inferirse fácilmente a partir de los limitados datos preclínicos citados, pero no fueron seguidos con investigaciones adecuadas en profundidad. En particular, los ensayos clínicos no controlaron ningún parámetro de laboratorio que pudiera haber proporcionado información sobre estos riesgos, como los relacionados con la coagulación sanguínea (p. Ej., Dímeros D / trombocitos), daño de las células musculares (p. Ej. troponina / creatina quinasa) o daño hepático (por ejemplo, γ-glutamiltransferasa).
Varias agencias reguladoras otorgaron autorización de uso de emergencia en base a datos tan incompletos e insuficientes que equivalen a nada menos que negligencia grave.
De particular preocupación es la eliminación muy lenta de los lípidos catiónicos tóxicos en personas inyectadas repetidamente con vacunas de ARNm que contienen estos lípidos, ya sean dirigidas contra K0 B¡T o cualquier otro patógeno o enfermedad, esto resultaría en toxicidad acumulativa. Existe una posibilidad real de que los lípidos catiónicos se acumulen en los ovarios. El grave riesgo implícito para la fertilidad femenina exige la más urgente atención de la ciudadanía y de las autoridades sanitarias.
Dado que los llamados ensayos clínicos se llevaron a cabo con tanta negligencia, los ensayos reales están ocurriendo solo ahora, a una escala masiva y con resultados devastadores. Esta vacuna, y otras, a menudo se denominan «experimentales». Continuar o incluso exigir el uso de esta inyección tóxica, y la aparentemente inminente emisión de su aprobación total son crímenes de lesa humanidad.
Referencias
- [1] Anonymous: SARS-CoV-2 mRNA Vaccine (BNT162, ffF-07302048) 2.6.4 [Summary state- ment of the pharmacokinetic study] (Japanese). 2020. url: https://www.pmda.go. jp/drugs/2021/P20210212001/672212000_30300AMX00231_I100_1.pdf.
- [2] Anonymous: SARS-CoV-2 mRNA Vaccine (BNT162, ffF-07302048) 2.6.4 Summary state- ment of the pharmacokinetic study [English translation]. 2020. url: https://archive. org/details/pfizer-confidential-translated.
- [3] V. Francia et al.: The Biomolecular Corona of Lipid Nanoparticles for Gene Therapy.
- Bioconjug. Chem. 31 (2020), 2046–2059. pmid: 32786370.
- [4] M. A. Piatyszek et al.: Iodo-Gen-mediated radioiodination of nucleic acids. Anal. Biochem. 172 (1988), 356–9. pmid: 3189783.
- [5] Anonymous: Assessment report/Comirnaty. 2021. url: https://www.ema.europa. eu/en/documents/assessment-report/comirnaty-epar-public-assessment- report_en.pdf.
- [6] A. F. Ogata et al.: Circulating SARS-CoV-2 Vaccine Antigen Detected in the Plasma of mRNA-1273 Vaccine Recipients. Clin. Infect. Dis. (2021). pmid: 34015087.
- [7] S. Bhakdi and J. Tranum-Jensen: Molecular nature of the complement lesion. ffroc. Natl. Acad. Sci. U. S. A. 75 (1978), 5655–5659. pmid: 281714.
- [8] S. Bhakdi et al.: Urgent Open Letter from Doctors and Scientists to the European Medicines Agency regarding COVID-19 Vaccine Safety Concerns. 2021. url: https://tinyurl.com/d4ce-letter.
- [9] L. Johnson: Official Vaccine Injury and Fatality Data: EU, UK and US. 2021. url: https://doctors4covidethics.org/official-eu-adverse-event-data-eu-uk-us/.
- [10] J. Tranum-Jensen et al.: Complement lysis: the ultrastructure and orientation of the C5b-9 complex on target sheep erythrocyte membranes. Scandinavian journal of immunology 7 (1978), 45–6. pmid: 635472.
- [11] K. Romøren et al.: Transfection efficiency and cytotoxicity of cationic liposomes in salmonid cell lines of hepatocyte and macrophage origin. Biochim. Biophys. Acta 1663 (2004), 127–34. pmid: 15157615.
- [12] Y. Golan et al.: Evaluation of Messenger RNA From COVID-19 BTN162b2 and mRNA- 1273 Vaccines in Human Milk. JAMA pediatrics (2021). pmid: 34228115.