COVID-19 mRNA Vaccines: Lessons Learned from the Registrational Trials and Global Vaccination Campaign – Nathaniel Mead• Stephanie Seneff • Russ Wolfinger • Jessica Rose • Kris Denhaerynck • Steve Kirsch • Peter A. McCullough – DOI: 10.7759/cureus.52876 – https://www.cureus.com/articles/203052-covid-19-mrna-vaccines-lessons-learned-from-the-registrational-trials-and-global-vaccination-campaign#!/

Abstracto
Nuestra comprensión de las inyecciones contra la COVID-19 y su impacto en la salud y la mortalidad ha evolucionado sustancialmente desde los primeros lanzamientos de inyecciones. Los informes publicados de los ensayos aleatorios originales de fase 3 concluyeron que las inyecciones de ARNm contra la COVID-19 podrían reducir en gran medida los síntomas de la COVID-19. Mientras tanto, han surgido problemas con los métodos, la ejecución y la presentación de informes de estos ensayos fundamentales.
Un nuevo análisis de los datos del ensayo de Pfizer identificó aumentos estadísticamente significativos en los eventos adversos graves (serious adverse events, SAEs) en el grupo de la inyección. Se identificaron numerosos eventos adversos graves, EAG tras la Autorización de uso de emergencia (Emergency Use Authorization EUA), incluidos muerte, cáncer, eventos cardíacos y diversos trastornos autoinmunes, hematológicos, reproductivos y neurológicos.
Además, estos productos nunca se sometieron a pruebas toxicológicas y de seguridad adecuadas de acuerdo con estándares científicos previamente establecidos.
Entre los otros temas importantes abordados en esta revisión narrativa se encuentran los análisis publicados sobre daños graves a los seres humanos, cuestiones de control de calidad e impurezas relacionadas con los procesos, mecanismos subyacentes a los eventos adversos (EA), la base inmunológica de la ineficacia de las inyecciones y las tendencias de mortalidad basadas en los datos del ensayo de registro.
El desequilibrio riesgo-beneficio respaldado por la evidencia hasta la fecha contraindica nuevas inyecciones de refuerzo y sugiere que, como mínimo, las inyecciones de ARNm deben eliminarse del programa de inmunización infantil hasta que se realicen estudios toxicológicos y de seguridad adecuados.
La aprobación por parte de la agencia federal de las inyecciones de ARNm contra el COVID-19 con una cobertura general para toda la población no estuvo respaldada por una evaluación honesta de todos los datos de registro relevantes y una consideración proporcional de los riesgos frente a los beneficios.
Dados los extensos y bien documentados EAG y la relación daño-recompensa inaceptablemente alta, instamos a los gobiernos a respaldar una moratoria global sobre los productos de ARNm modificado hasta que se respondan todas las preguntas relevantes relacionadas con la causalidad, el ADN residual y la producción aberrante de proteínas.
Introducción y antecedentes
Nuestra comprensión de las inyecciones de ARNm de la enfermedad por coronavirus 2019 (COVID-19) y su impacto en la mortalidad ha evolucionado sustancialmente desde el primer lanzamiento de la vacuna en diciembre de 2020. Las primeras investigaciones indicaron el potencial de estos productos biológicos para prevenir la infección del síndrome respiratorio agudo severo por coronavirus 2 (SARS-CoV). -2).
Con base en los primeros ensayos controlados aleatorios patrocinados por Pfizer-BioNTech ((Nueva York, Estados Unidos (EE. UU.); Mainz, Alemania) y Moderna Inc. (Massachusetts, EE. UU.), los investigadores concluyeron que existía un notable riesgo relativo del 95% (RR ) reducción de COVID-19 sintomático [1,2]
El hallazgo superpuesto entre los dos ensayos llevó a la Administración de Medicamentos y Alimentos de EE. UU. (FDA) a permitir el uso de las inyecciones de ARNm COVID-19 bajo Autorización de uso de emergencia (EUA) en diciembre 11 de diciembre de 2020, decisión a la que siguió la revelación anticipada y el cese de los ensayos [3] .
Antes del proceso de autorización rápida, no se había permitido la comercialización de ninguna vacuna o inyección sin pasar por un período de prueba de al menos cuatro años, el récord establecido por Merck & Co., Inc. (Nueva Jersey, EE. UU.) en 1967 con el desarrollo de la La primera vacuna contra las paperas del mundo [4] .
La inyección de Pfizer (BNT162b2) completó el proceso en siete meses. Los plazos anteriores para las pruebas de fase 3 promediaban 10 años [5] . Los departamentos de salud han declarado que el plazo normal para evaluar la seguridad de las vacunas es de 10 a 15 años [6] .
Con las vacunas contra la COVID-19, la seguridad nunca se evaluó de manera acorde con los estándares científicos previamente establecidos, ya que se eludieron numerosas pruebas de seguridad y protocolos de toxicología que normalmente sigue la FDA [7,8] .
Se eludieron los estudios preclínicos sobre la biodistribución del producto de ARNm y las posibles toxicidades de dosis repetidas (para imitar vacunas múltiples) para permitir pruebas clínicas aceleradas [9] . Quizás el punto de referencia del ensayo más importante obviado por el rápido proceso de autorización fue el período mínimo de observación de 6 a 12 meses que normalmente se recomienda para identificar posibles efectos adversos (EA) relacionados con la inyección a largo plazo en los grupos de vacuna versus placebo [9] .
El plazo previamente establecido de 10 a 15 años para la evaluación clínica de las vacunas se consideró necesario para garantizar el tiempo adecuado para monitorear el desarrollo de EA como el cáncer y los trastornos autoinmunes [10,11] .
Para ser más rápidos, los coordinadores de los ensayos de Pfizer y Moderna priorizaron la reducción del riesgo sintomático de COVID-19 sobre los EA graves y las preocupaciones sobre la mortalidad. En retrospectiva, este fue un grave paso en falso.
Los relatos históricos dan testimonio de casos en los que las vacunas se introdujeron prematuramente en el mercado bajo una inmensa presión, sólo para revelar EA incapacitantes o incluso mortales más adelante. Los ejemplos incluyen la contaminación de las vacunas contra la polio en 1955, los casos del síndrome de Guillain-Barré observados en los receptores de la vacuna contra la gripe en 1976 y la conexión entre la narcolepsia y una vacuna contra la gripe específica en 2009 [12-14] .
En este contexto, no sorprende que tantos expertos médicos y de salud pública hayan expresado su preocupación por el hecho de que las inyecciones de ARNm contra la COVID-19 pasen por alto el proceso normal de pruebas de seguridad [15-17] .
Los incentivos políticos y financieros pueden haber jugado un papel clave al socavar el proceso de evaluación científica que condujo a la EUA. Lalani y sus colegas documentaron las principales inversiones realizadas por el gobierno de Estados Unidos mucho antes de la autorización [18] . Incluso antes de la pandemia, los Institutos Nacionales de Salud de EE. UU. invirtieron 116 millones de dólares (35 %) en tecnología de inyecciones de ARNm, la Autoridad de Investigación y Desarrollo Biomédico Avanzado (BARDA) había invertido 148 millones de dólares (44 %), mientras que el Departamento de Defensa (DOD ) contribuyó con 72 millones de dólares (21%) al desarrollo de la inyección de ARNm. BARDA y el DOD también colaboraron estrechamente en el desarrollo conjunto de la inyección de ARNm de Moderna, dedicando más de 18 mil millones de dólares, que incluyeron compras garantizadas de inyecciones [18] .
Esto implicó la precompra de cientos de millones de dosis de inyecciones de ARNm, junto con apoyo financiero directo para los ensayos clínicos y la expansión de las capacidades de fabricación de Moderna. La financiación pública proporcionada para el desarrollo de estos productos a través de la Operación Warp Speed superó las inversiones en cualquier iniciativa pública anterior [19] .
Una vez iniciada la pandemia, se dedicaron 29.200 millones de dólares (el 92% de los cuales provinieron de fondos públicos estadounidenses) a la compra de productos de ARNm de COVID-19; otros 2.200 millones de dólares (7%) se canalizaron para apoyar los ensayos clínicos, y 108 millones de dólares (menos del 1%) se asignaron a la fabricación y la investigación básica [18] . Este profuso gasto de dinero de los contribuyentes continuó durante toda la pandemia: BARDA gastó otros 40 mil millones de dólares solo en 2021 [20] .
Utilizar el dinero de los contribuyentes estadounidenses para comprar tantas dosis por adelantado sugeriría que, antes del proceso de EUA, las agencias federales estadounidenses estaban fuertemente sesgadas hacia resultados exitosos para los ensayos de registro. Además, es razonable suponer que intereses creados tan amplios podrían haber influido en la decisión de detener prematuramente los ensayos de registro.
El desenmascaramiento esencialmente anuló el elemento «controlado con placebo» de los ensayos, eliminando el grupo de control y socavando así la capacidad de evaluar objetivamente el perfil de seguridad de las vacunas de ARNm y los posibles AA graves (EAG).
Por lo tanto, si bien la autorización acelerada mostró la dedicación del gobierno para proporcionar estos nuevos productos, también generó preocupaciones entre muchos expertos con respecto a cuestiones de riesgo-beneficio y eliminó efectivamente la oportunidad de conocer los posibles daños a largo plazo de las inoculaciones de ARNm.
Las presiones políticas para ofrecer rápidamente una solución pueden haber comprometido la minuciosidad y la integridad del proceso de evaluación científica, al tiempo que restaron importancia y ofuscaron las preocupaciones científicas sobre los riesgos potenciales asociados con la tecnología de ARNm.
Las preocupaciones sobre pruebas de seguridad inadecuadas se extienden más allá de los estándares y prácticas habituales de aprobación regulatoria. Aunque empleamos los términos «vacuna» y «vacunación» a lo largo de este documento, los productos de ARNm de COVID-19 también se denominan con precisión productos de terapia génica (GTP) porque, en esencia, este fue un caso de tecnología GTP aplicada a la vacunación [21 ] .
Las regulaciones europeas exigen la inclusión de un antígeno en las vacunas, pero estas proteínas inmunogénicas no son intrínsecas a las vacunas de ARNm [22] . La plataforma de productos de terapia génica GTP se ha estudiado durante más de 30 años como tratamiento experimental contra el cáncer, y los términos terapia génica y vacunación con ARNm se utilizan a menudo indistintamente [23] .
Esto se debe al modo de acción específico de los productos de ARNm: las hebras de ARNm sintético, encapsuladas dentro de un vehículo protector de nanopartículas lipídicas (LNP), se traducen dentro de las células en una proteína específica que posteriormente estimula el sistema inmunológico contra una enfermedad específica. Otra etiqueta precisa sería profármacos porque estos productos estimulan el cuerpo del receptor para que fabrique la proteína objetivo [24] .
Como no había regulaciones específicas en el momento del proceso de aprobación rápida, las agencias reguladoras rápidamente “adaptaron” los productos, generalizaron la definición de “vacuna” para acomodarlos y luego los autorizaron para EUA por primera vez contra una enfermedad viral. Sin embargo, la justificación para regular estos productos como vacunas y excluirlos de la supervisión regulatoria como GTP carece de justificación tanto científica como ética [21] . (Nota: a lo largo de esta revisión, los términos vacunas y vacunaciones se utilizarán indistintamente con inyecciones, inoculaciones, productos biológicos o simplemente productos).
Debido a la reclasificación de los productos de terapia génica, GTP como vacunas, la seguridad de ninguno de sus componentes ha sido evaluada exhaustivamente. La principal preocupación, en pocas palabras, es que los productos de ARNm de COVID-19 puedan transformar las células del cuerpo en fábricas de proteínas virales que no tienen un interruptor de apagado (es decir, ningún mecanismo incorporado para detener o regular dicha proliferación), con la proteína de pico, (Proteína S) o Spike que se genera durante períodos prolongados, causando inflamación sistémica crónica y disfunción inmune [25,26] .
Esta proteína S o Spike
Esta proteína S es el denominador común entre el coronavirus y la inyección, lo que ayuda a explicar la frecuente superposición de eventos adversos, EA generados tanto por la infección como por la inoculación [25] . La proteína S inducida por la vacuna es más inmunogénica que su contraparte viral; y, sin embargo, el aumento de la producción de anticuerpos también se asocia con una inmunopatología más grave y otros efectos adversos [27] .
Los productos de ARNm de Pfizer y Moderna contienen ARNm con dos codones modificados que dan como resultado una versión de la proteína S que se estabiliza en su estado de prefusión [28] . Esta tecnología de ARN mensajero modificado con nucleósidos tiene como objetivo extender la persistencia del ARNm sintético en el cuerpo. Cuando la proteína S ingresa al torrente sanguíneo y se disemina sistémicamente, puede convertirse en un factor que contribuye a diversos EA en individuos susceptibles [25] .
En esta revisión narrativa, revisamos los ensayos de registro y revisamos los análisis de los EA de estos ensayos y otros estudios relevantes. La mayoría de las revelaciones han salido a la luz recientemente, debido a los últimos años de extensa censura de los profesionales de la salud y los científicos investigadores que desafiaron la narrativa predominante establecida por la empresa de vacunas e inyecciones génicas[29,30] .
Comenzamos centrándonos en los dos ensayos aleatorios, doble ciego y controlados con placebo que dieron lugar a la EUA, seguidos de una exploración en profundidad de los diversos impactos adversos de las inoculaciones de ARNm, con referencias frecuentes a los ensayos originales.
En un contexto pospandémico en el que la urgencia inmediata ha disminuido, las revisiones narrativas exploratorias como esta pueden desempeñar un papel importante para ayudarnos a reevaluar la base científica de las preocupaciones de seguridad bien fundadas del público en general con respecto a las vacunas de ARNm contra la COVID-19.
Revisando las pruebas de registro
Al principio de la pandemia, los funcionarios de salud pública de EE. UU. prometieron que los ensayos de fase 3 demostrarían que las inyecciones de ARNm contra la COVID-19 eran “seguras y efectivas”, incluida una reducción de las enfermedades graves, las hospitalizaciones y las muertes, con un objetivo secundario de prevenir la transmisión y infección [31] .
Nueve fabricantes de inyecciones emitieron una declaración conjunta sin precedentes en la que se comprometían a no solicitar prematuramente una revisión regulatoria [32] . Ambos conjuntos de garantías se entregaron a una población que ya padecía fatiga pandémica, atribuible principalmente a los confinamientos, el uso de mascarillas, el distanciamiento social y otras restricciones impuestas por los mismos organismos responsables de iniciar el programa de vacunación. A pesar de la retórica, ningún gran ensayo aleatorio, doble ciego y controlado con placebo ha demostrado reducciones en la transmisión, hospitalización o muerte del SARS-CoV-2.
Es importante destacar que los diseños de los estudios fundamentales que condujeron a la EUA nunca tuvieron como objetivo determinar si las inoculaciones de ARNm podrían ayudar a prevenir enfermedades graves o la muerte prematura [31] .
Esto se debió principalmente a un poder estadístico insuficiente para evaluar estos resultados [33] . (El cálculo del poder estadístico se basó únicamente en la reducción de los síntomas de COVID-19, el resultado primario).
La limitación surgió del reclutamiento de participantes del ensayo jóvenes y sanos en el grupo de edad de 18 a 55 años y el número relativamente bajo de casos clínicos informados, casos de infección en los grupos de intervención de los ensayos, con solo ocho casos en Pfizer y 11 en Moderna [1,2] .
Mientras que el ensayo de Pfizer registró solo un caso de COVID-19 grave, el ensayo de Moderna no informó ninguno, lo que llevó a la empresa a proclamar una eficacia del 100% contra enfermedades graves [34] . Moderna también informó de una muerte por COVID-19 en el grupo de placebo [2] . Así, entre los dos ensayos, solo hubo una muerte atribuida a la COVID-19 entre los más de 73.000 participantes del ensayo [1,2] .
Después de anunciar los resultados del ensayo, Pfizer amplió su estudio cuatro meses. A los participantes del ensayo se les abrió el cegamiento en la semana 20 y se invitó a voluntarios que recibieron placebo a recibir la inyección de ARNm.
El anuncio de Pfizer sobre la eficacia de su producto de ARNm se basó en que 162 de 22.000 receptores de placebo contrajeron COVID-19, en comparación con sólo ocho de 22.000 receptores de la inyección. Ninguno de los 162 receptores de placebo que contrajeron COVID-19 murió a causa de la enfermedad [35] . Estas cifras son demasiado pequeñas para sacar conclusiones significativas, pragmáticas o amplias con respecto a la morbilidad y mortalidad de la COVID-19 [36] .
Además, el recuento de 170 casos confirmados por reacción en cadena de la polimerasa (PCR) desvía la atención de otro hallazgo: un número mucho mayor de casos identificados durante el estudio cayeron bajo la categoría de «sospechoso de COVID-19», donde los individuos presentaban COVID-19 sintomático pero carecía de una prueba de PCR positiva [37] . (Nota: las pruebas de PCR utilizadas en estos ensayos fueron las ampliamente aceptadas para detectar el SARS-CoV-2 y aparentemente cumplieron con ciertos estándares de rendimiento y confiabilidad para la detección precisa del coronavirus).
Un total de 3.410 casos de COVID-19 sospechoso y no confirmado. fueron identificados, una diferencia de 20 veces entre los casos sospechosos y confirmados. Hubo 1.594 casos de este tipo en el grupo vacunado y 1.816 en el grupo placebo. Cuando se tienen en cuenta los casos confirmados y sospechosos, la eficacia de la inyección contra los síntomas en desarrollo cae a sólo el 19 %, muy por debajo del umbral de reducción del riesgo relativo, RR del 50 % requerido para la autorización regulatoria [37] .
Incluso si se excluyeran los casos que ocurren dentro de los siete días posteriores a la vacunación para tener en cuenta la reactogenicidad de la inyección a corto plazo (en lugar de las infecciones verdaderas), la eficacia sería de un magro 29%. Cualquier falso negativo entre los casos sospechosos tendería a disminuir aún más el beneficio. Por lo tanto, al considerar tanto los casos confirmados como los sospechosos, la eficacia de la inyección parece haber sido dramáticamente menor que la afirmación oficial del 95%.
De manera similar, es importante enfatizar que los “casos” que se contaron en los ensayos fueron pacientes con PCR positiva con infecciones leves, no con enfermedades de moderadas a graves. Por lo tanto, la tos u otros síntomas respiratorios leves calificaron como criterios de valoración primarios [38,39] .
La conclusión del ensayo se basó en apenas 100 de esos “casos” de COVID-19 registrados dentro del grupo de placebo [31] . Una vez que el ensayo llegara a este punto, se anticipó que se declararía la eficacia y se ofrecería la vacuna activa a los participantes del grupo placebo.
Este fue el escenario preciso que ocurrió, con la fase ciega de Pfizer concluyendo a los dos meses y la de Moderna terminando a los tres, terminando efectivamente el período de seguimiento aleatorio ciego y limitando en gran medida cualquier evaluación de riesgo-beneficio.
La falta de capacidad para evaluar enfermedades graves en los ensayos reflejó el contexto del mundo real, es decir, que la probabilidad de sufrir COVID-19 grave, hospitalización y muerte a causa de la infección siempre ha sido muy baja.
Estratificando por edad, la tasa de letalidad por infección (IFR) en 2021 mostró un gradiente de edad con un aumento de aproximadamente tres a cuatro veces por cada década, comenzando tan bajo como 0,0003% (casi cero) entre niños y adolescentes, aumentando hasta 0,5% en aquellos de 60 a 69 años [40] .
Incluso en grupos de mayor edad (>70 años), la IFR varía del 1 al 5% dependiendo de las comorbilidades y el acceso al tratamiento.
Como principio básico, la mortalidad por todas las causas (all-cause mortality, ACM) tiende a aumentar con la edad. En el caso de la COVID-19, la presencia de enfermedades comórbidas modifica en gran medida la influencia de la edad en la mortalidad [41] .
Para las generaciones más jóvenes (<40 años), la gravedad de la infección por SARS-CoV-2 y las tasas de mortalidad desde 2020 han sido comparables a las de la influenza [42] . Incluso en los países que mostraron un exceso de mortalidad en 2020, las tasas de mortalidad infantil fueron extremadamente bajas [43] . En Suecia, donde a 1,8 millones de niños se les permitió asistir libremente a la escuela en 2020, en el verano de 2021 no se registraron muertes por COVID-19 entre ellos [44] .
Aunque los ensayos controlados aleatorios se consideran el estándar de oro para probar la seguridad y eficacia de los productos médicos (debido a que minimizan el sesgo), los ensayos de alcance limitado pueden oscurecer fácilmente los verdaderos problemas de seguridad y eficacia con respecto a diferentes segmentos de la población. En este caso, los ensayos excluyeron subgrupos clave, en particular niños, mujeres embarazadas, personas mayores frágiles e individuos inmunocomprometidos, así como aquellos con cáncer, enfermedades autoinmunes y otras afecciones inflamatorias crónicas [45] .
Mientras que los ensayos iniciales no reclutaron personas con comorbilidades, los receptores de la inyección en los lanzamientos mostraron la presencia real de estas condiciones subyacentes. En lugar de evaluar estas preocupaciones bien conocidas sobre la seguridad y el riesgo de comorbilidad, la atención se centró estrictamente en la posibilidad de lesión pulmonar inflamatoria como se había observado en pacientes con COVID-19 y, muchos años antes, en modelos animales inmunizados infectados con SARS-CoV [ 46] .
Ahora estamos empezando a reconocer la locura de este enfoque limitado de seguridad, a medida que millones de eventos graves y potencialmente mortales asociados con las vacunas COVID-19 continúan documentándose en la literatura médica [47-51] .
¿Qué revelaron los ensayos fundamentales sobre la mortalidad general (por todas las causas)? Después de analizar cuidadosamente la mortalidad por todas las causas (all-cause mortality, ACM) para los ensayos de Pfizer y Moderna, Benn y sus colegas encontraron 61 muertes en total (31 en la vacuna, 30 en el placebo) y un RR de mortalidad de 1,03 (0,63-1,71), comparando a los vacunados con el placebo [52] .
Estos hallazgos pueden interpretarse como “ninguna diferencia significativa” o que no hay evidencia estándar que demuestre que estas inyecciones de ARNm reducen la mortalidad. Es de destacar la falta de diferencias significativas en las muertes entre los brazos del estudio. El verdadero impacto en la mortalidad sigue siendo desconocido en este contexto, y este hecho por sí solo es relevante, ya que sería preferible tomar una vacuna con buena evidencia de mortalidad reducida que tomar una vacuna donde la evidencia de prueba no muestra pruebas convincentes de una mejor supervivencia [ 53] .
De manera similar, un análisis posterior de los datos del ensayo de Pfizer concluyó que las tasas de mortalidad eran comparables entre los grupos vacunados y con placebo durante el período inicial de 20 semanas del ensayo aleatorizado [54] . El hecho de que las vacunas de ARNm no condujeran a una reducción de la mortalidad general implica que, si las inyecciones realmente evitaran muertes específicamente atribuibles a la COVID-19, cualquier reducción de ese tipo podría verse compensada por un aumento de la mortalidad derivada de otras causas, como eventos adversos serios, EAS.
Incluso el ensayo de seis meses de Pfizer no logró mostrar ninguna reducción en la mortalidad por todas las causas [35] . De hecho, un nuevo análisis de los datos posteriores a la comercialización proporcionados a la FDA sugiere el efecto contrario.
La parte ampliada del ensayo incluyó cuatro meses de un período no ciego, en el que la mayoría de los participantes que recibieron placebo pasaron al grupo de vacunación. Durante esta fase, hubo cinco muertes adicionales, incluidas tres en el grupo de la vacuna original y dos entre los participantes del placebo que eligieron la vacunación [35] .
Cuando estas cinco muertes se incluyen como muertes de “vacunados”, el recuento total pasa a ser 20 muertes en el grupo de la vacuna y 14 muertes en el grupo del placebo, lo que representaría un aumento del 43 % en las muertes (no estadísticamente significativo debido a los recuentos pequeños). Sin embargo, en los documentos de la FDA se informó un total de 38 muertes, 21 en el grupo de la vacuna y 17 en el grupo del placebo, lo que representa un aumento del 23,5% en las muertes por todas las causas entre quienes recibieron la serie primaria de dos dosis de BNT162b2. [55,56] .
Esto sugiere que los dos participantes del placebo que murieron después de la vacunación con ARNm se contaron dos veces (es decir, ambas muertes se contaron en cada brazo del ensayo). Sin embargo, para contabilizar adecuadamente las cinco muertes adicionales, se debe ajustar el análisis en función de los meses-persona pasados en cada grupo.
Al aplicar este método, el recuento total fue de 36 muertes: 21 en el grupo de BNT162b2 y 16 en el grupo de placebo. Al calcular el riesgo relativo de ACM , el grupo de la vacuna tuvo una tasa de mortalidad del 0,105% (21 muertes de 20.030), mientras que el grupo de placebo tuvo una tasa de mortalidad del 0,0799% (16 muertes de 20.030). La ecuación RR arrojó un valor de 1,3125 (IC del 95%: 0,6851-2,5144, p=0,41), lo que indica un riesgo de MCA un 31% mayor en el grupo de BNT162b2 en comparación con el grupo de placebo. La estimación puede considerarse conservadora, ya que no supone que todos los que recibieron placebo eligieron vacunarse durante la fase abierta del ensayo.
Para los ensayos de registro de Pfizer y Moderna, Benn et al. También informaron un aumento no significativo del 45 % en las muertes cardiovasculares (RR = 1,45; IC del 95 %: 0,67-3,13) en los brazos de vacunas de los ensayos [52] . Este resultado fue consistente con numerosos informes sobre patología cardiovascular relacionada con la vacuna COVID-19 entre segmentos de la población jóvenes y mayores [57-63] . Ninguna de las estimaciones de mortalidad de los ensayos es estadísticamente significativa. Sin embargo, las tendencias al alza tanto de la MCA como de las muertes cardiovasculares son preocupantes. Si el ensayo de Pfizer no se hubiera interrumpido prematuramente y suponiendo que las tasas de mortalidad siguieran siendo las mismas en ambos brazos como se observó en los primeros seis meses, la diferencia en la mortalidad por todas las causas, ACM alcanzaría el umbral estándar de significación estadística (p < 0,05) aproximadamente a los 2,8 años (34). meses). El valor p es 0,065 a los 2,5 años y 0,053 a los 2,75 años (ver Apéndice 1). Estos cálculos fueron confirmados de forma independiente por Masterjohn [64] .
Riesgo absoluto y el número necesario a vacunar (“number needed to vaccinate, NNV)
Una de las deficiencias de los ensayos de registro que a menudo se pasa por alto fue el enfoque exclusivo de los informes finales en el RR y se omite la reducción absoluta del riesgo. La última medida proporciona una mejor indicación de la utilidad clínica de un fármaco que la primera medida relativa, ya que se escala según el tamaño de la muestra [65] .
RR es la proporción de tasas de síntomas de COVID-19 en los grupos de vacuna versus placebo, que se informó como 95 % y 94,5 % para los productos de Pfizer y Moderna, BNT162b2 y mRNA-1273, respectivamente [1,2] .
El riesgo absoluto se refiere a la probabilidad de un resultado (en este caso, síntomas de infección clínica), en función del número de personas que experimentan el resultado en relación con la población en general. Por lo general, se calcula como la cantidad de eventos que ocurrieron en una población de estudio dividida por la cantidad de personas en esa población.
Se requieren ambos tipos de estimación del riesgo para evitar sesgos en la notificación y proporcionar una perspectiva más completa sobre la eficacia de la vacuna [65] . Omitir las estadísticas de riesgo absoluto conduce a una sobreestimación de los beneficios clínicos de las vacunas [66] .
En contraste con la cifra del RR del 95 %, las reducciones del riesgo absoluto para BNT162b2 y mRNA-1273 fueron del 0,7 % y el 1,1 %, respectivamente [67] . Estas estimaciones se derivaron de datos disponibles públicamente que finalmente permitieron que el Comité Asesor de Vacunas y Productos Biológicos Relacionados (VRBPAC) de la FDA concediera la EUA para las vacunas [68] .
Sin embargo, los datos revisados por el VRBPAC no incluyeron medidas absolutas de reducción del riesgo, desviándose así de las directrices de la FDA, que establecen que ambos enfoques son cruciales para evitar el uso equivocado de productos farmacéuticos [69] .
Una vez más, no proporcionar el riesgo absoluto y centrarse únicamente en el RR generalmente da como resultado una sobreestimación de los beneficios de la vacuna. Las estadísticas de riesgo absoluto también son valiosas al evaluar y comparar medidas de seguridad como las tasas de eventos adversos, EA.
Una reducción del riesgo absoluto de aproximadamente el 1% para las vacunas de ARNm contra la COVID-19 significaba que sería necesario inyectar a un número sustancial de personas para prevenir un solo caso leve a moderado de COVID-19.
Específicamente, el número necesario a vacunar, NNV para prevenir un caso de COVID-19 sería 142 (rango 122-170) para la inyección de BNT162b2 y 88 (rango 76-104) para la inyección de ARNm-1273, respectivamente [65] . Estos números aumentan con la edad y dependiendo de la variante [70] . El NNV es una métrica interpretable y destacada para evaluar el impacto en el mundo real, lo que nos permite evaluar los beneficios potenciales derivados de la vacunación. Para cualquier población relativamente sana (con comorbilidades mínimas), el perfil riesgo-beneficio con un número necesario a vacunar (NNV) alto podría fácilmente indicar daños excesivos.
Es imperativo sopesar cuidadosamente todos los riesgos potenciales asociados con los productos de ARNm de COVID-19. Si se vincularan daños sustanciales a su uso, la “recompensa” percibida que transmite el número necesario a vacunar, NNV requeriría una reevaluación.
Por ejemplo, suponiendo un NNV de 119 y un IFR de 0,23% (ambas estimaciones conservadoras), se necesitarían aproximadamente 52.000 vacunas para prevenir una muerte relacionada con la COVID-19.
Así, para la inyección de BNT162b2, una estimación generosa sería dos vidas salvadas de COVID-19 por cada 100.000 ciclos del biológico. Dada la evidencia de mala conducta en los ensayos y problemas de integridad de los datos (ver la siguiente sección), conjeturamos que esta estimación es un “límite superior” y, por lo tanto, es probable que el beneficio real sea mucho menor.
En cuanto a los daños potenciales, suponiendo un 30% de informes de falsos positivos y un factor de subregistro moderado de 21, calculamos un riesgo de 27 muertes por cada 100.000 dosis de BNT162b2. Por lo tanto, aplicando estos supuestos razonables y conservadores, los daños estimados de las vacunas de ARNm contra el COVID-19 superan con creces las recompensas: por cada vida salvada, hubo casi 14 veces más muertes causadas por las inyecciones de ARNm modificado (para más detalles, consulte el Apéndice 2).
Subnotificación de daños y problemas de integridad de datos
La falta de notificación de daños graves, incluidos los efectos adversos graves, EAG, es otra preocupación importante que a menudo atrae escasa atención en el dominio público. En particular, los daños graves que impiden significativamente las actividades diarias y la calidad de vida no se informan universalmente en los ensayos aleatorios, en particular en los estudios patrocinados por la industria [71] .
Estos EA pueden ser más comunes en personas vacunadas con ARNm que posteriormente se infectan con SARS-CoV-2. Si bien, en principio, las revisiones sistemáticas de ensayos aleatorios sirven como una fuente confiable de evidencia, la información sobre daños graves siempre falta en los informes de ensayos farmacológicos [72] .
Esta escasez de informes parece excepcionalmente evidente en el contexto de los ensayos de vacunas [73-75] . En el caso de los ensayos de la vacuna COVID-19, el subregistro también fue situacional, ya que a los participantes se les reveló el cegamiento en la fase abierta del ensayo de Pfizer y a los receptores del placebo se les ofreció la vacuna apenas unas semanas después de la EUA.
El desenmascaramiento temprano se produjo sin dar tiempo suficiente para identificar los daños diagnosticados o de aparición tardía asociados con las vacunas [15] . ¿Era esto necesario, dado que ninguna de las muertes en el ensayo de Pfizer se atribuyó a la COVID-19 como causa principal y dada la tasa de letalidad por infección (IFR) muy baja para una población relativamente sana [40] ?
Classen señala que los coordinadores del ensayo emplearon un enfoque desordenado para el seguimiento de los EA y, por lo tanto, el posible impacto dañino de estos productos biológicos en los resultados de salud fue más sustancial de lo que generalmente se reconoce [49] . Los investigadores dieron prioridad a la documentación de los eventos de COVID-19 mientras rastreaban prospectivamente a los pacientes en busca de EA «solicitados» durante aproximadamente siete días después de la inmunización.
Posteriormente se informaron EA “no solicitados” durante un período de 30 a 60 días. Entre los participantes del ensayo había personas con educación limitada y personas de edad avanzada (posiblemente con deterioro cognitivo) [49] .
La capacidad de estas personas para reconocer e informar de forma competente los EA graves es cuestionable. Además, los informes de los ensayos originales no incluían datos sobre eventos graves no infecciosos, incluidas muertes, que ocurrieron más allá del período de informe de 30 a 60 días [49] .
Por el contrario, las infecciones por COVID-19 fueron monitoreadas continuamente desde el momento de la inmunización (una forma de sesgo de información). Tanto Pfizer como Janssen mostraron indulgencia al registrar los EA, restringiendo la documentación de eventos «solicitados» a una cohorte de seguridad que representa menos del 20% de la población general del estudio.
Estos hallazgos se alinean con estudios anteriores que muestran que sólo una pequeña proporción, generalmente el 5%, de los EA se informan típicamente en ensayos patrocinados por compañías farmacéuticas [76] .
Para empeorar las cosas, al público nunca se le permitió el acceso a los datos brutos de los ensayos de registro, lo que impidió la verificación independiente de los EA por parte de la comunidad científica (estos fueron revelados más tarde, después de la distribución generalizada de las inoculaciones) [77] . Tal secretismo puede haber permitido a la industria presentar más fácilmente una estimación inflada y distorsionada de los beneficios de las inyecciones genéticas, junto con una enorme subestimación de los daños potenciales.
Un análisis forense reciente de los datos del ensayo de seis meses de Pfizer reveló que muchas muertes en el ensayo ocurrieron después de la fecha límite utilizada para crear el folleto informativo revisado por la FDA y que resultó en la autorización de la vacuna; esto ocultó efectivamente los datos de mortalidad de la parte de toma de decisiones del proceso de EUA [54] .
La solicitud original de Pfizer para la EUA describía los resultados del ensayo solo hasta la fecha límite de datos del 14 de noviembre de 2020. Sin embargo, continuaron ocurriendo muertes y otros EAG después, incluso antes de la reunión definitiva del VRBPAC para autorizar la vacuna de ARNm.
Durante las 33 semanas iniciales del ensayo clínico CA4591001 de Pfizer-BioNTech, que abarcó 153 sitios de ensayos clínicos en más de siete países diferentes, fallecieron un total de 38 sujetos. Los 38 sujetos del ensayo figuraban en el informe provisional de seis meses de Pfizer-BioNTech [35] .
Estos eventos ocurrieron en orden cronológico dentro del período de 33 semanas que comenzó el 27 de julio de 2020 y concluyó el 13 de marzo de 2021. Para representar visualmente estos datos, Michels et al. Creó un gráfico de barras que ilustra el número de muertes de sujetos por semana (Figura 1 ). El número de muertes de sujetos tanto en el grupo BNT162b2 (“vacunados”) como en el grupo placebo del ensayo se representa por separado.
El gráfico también incluye un gráfico que ilustra el número acumulado de muertes en cada grupo, medido al final de cada semana. Las barras sólidas representan sujetos que recibieron la inyección de BNT162b2, mientras que las barras grises representan aquellos que recibieron un placebo, y las barras sombreadas representan sujetos que inicialmente recibieron un placebo pero no fueron cegados y posteriormente se les administró BNT162b2. Además, los autores incluyeron un gráfico lineal que muestra el número acumulado de muertes en cada brazo del ensayo. Una línea continua corresponde a los sujetos inyectados con BNT162b2, mientras que una línea de puntos representa el grupo de placebo [54] .
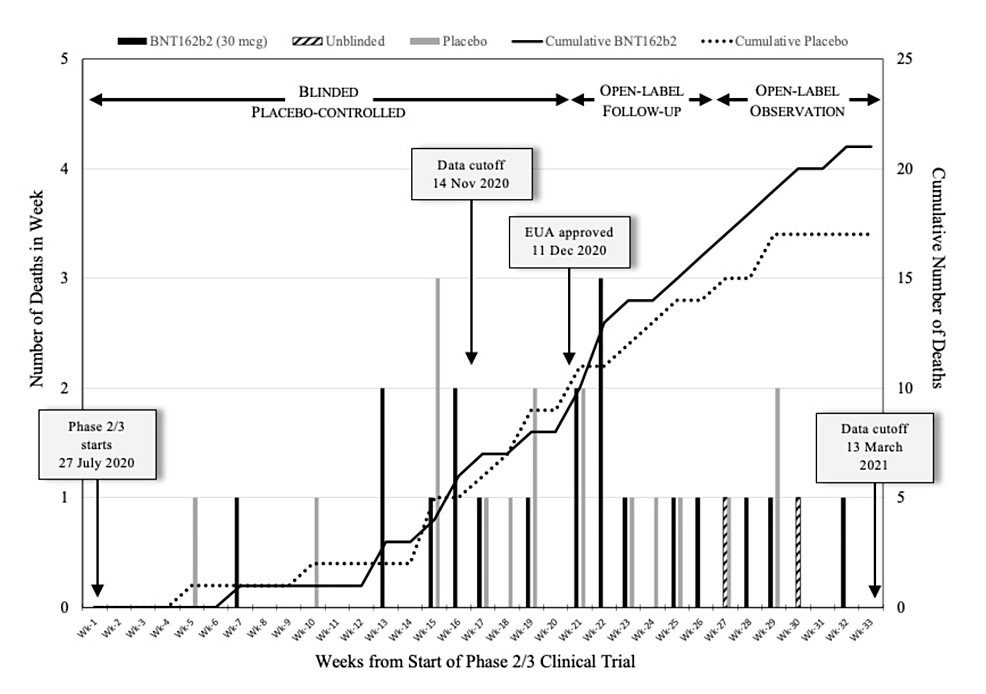
Figura 1: Análisis de la mortalidad semanal del ensayo de Pfizer durante un período de 33 semanas
Esta representación del ensayo de Pfizer de Michels et al. [54] muestra el recuento semanal de muertes de sujetos desde el 27 de julio de 2020 hasta el 13 de marzo de 2021. Las barras sólidas indican los receptores de BNT162b2, las barras grises indican el grupo de placebo y las barras sombreadas representan sujetos de placebo previamente no cegados que luego recibieron BNT162b2. La línea continua representa el recuento acumulado de muertes para el grupo BNT162b2 y la línea de puntos para el grupo placebo.
Fuente de la imagen: Michels et al., 2023 [54] ; Publicado con permiso de los autores bajo CC BY-NC-ND 4.0 Deed (Atribución-No Comercial-SinDerivadas 4.0 Internacional)
En particular, los receptores de placebo no cegados que luego recibieron BNT162b2 se combinan con el “grupo de vacuna” BNT162b2 para este análisis [54] . Para proporcionar contexto, el proceso de registro se puede dividir en tres períodos distintos.
- La primera es el «período ciego controlado con placebo», que se extendió desde el 27 de julio de 2020 hasta el 10 de diciembre de 2020.
- La segunda fase es el «período de seguimiento abierto», que abarca el período desde el 11 de diciembre de 2020. al 24 de enero de 2021.
- El período final es el “período de observación de etiqueta abierta”, que se extendió desde el 25 de enero de 2021 hasta el 13 de mayo de 2021 [35,78] .
La muerte inicial de los sujetos que recibieron placebo se registró en la semana 5, mientras que la primera muerte entre los sujetos con BNT162b2 ocurrió en la semana 7.
En las primeras 12 semanas del ensayo se produjeron muy pocas muertes, probablemente debido a la inscripción continua de nuevos sujetos. Los gráficos que ilustran el número acumulado de muertes en ambos brazos parecen estar estrechamente alineados hasta aproximadamente la semana 20, después de lo cual divergen (Figura 1 ). Más allá de la semana 20, la tasa de muertes en el grupo de placebo disminuyó y finalmente se estabilizó en la semana 30.
Por el contrario, la cantidad de muertes entre los sujetos con BNT162b2 continuó aumentando a un ritmo constante. Esta tasa reducida en el grupo de placebo fue probablemente el resultado de la disminución del número de sujetos con placebo no vacunados que permanecían en el ensayo, como resultado del proceso de desenmascaramiento y vacunación iniciado después del 11 de diciembre.
A pesar del bajo recuento general de muertes, es probable que el público en general la percepción de las vacunas habría sido mucho menos favorable si hubieran sabido que la tasa de mortalidad había seguido aumentando entre los participantes vacunados con ARNm [54] .
Los datos de la Figura 1 de Michels et al. [54] se obtuvieron directamente del informe provisional de seis meses de Pfizer [35] . Además, Michels et al. [54] compararon el número de muertes reportado con un número estimado estratificado por edad basado en datos de EE. UU. de 2019 [79] y determinaron que el número de muertes reportado por Pfizer de 38 es aproximadamente el 17 % de lo que se esperaría para la población de EE. UU.
De manera alarmante, a partir del informe provisional de seis meses de Pfizer, Michels y sus colegas encontraron evidencia de un aumento sustancial en el número de muertes debidas a eventos cardiovasculares en sujetos vacunados con BNT162b2 que el fabricante de la vacuna no informó [54] .
Para su análisis publicado y revisado por pares, los investigadores pudieron acceder a los informes narrativos sobre algunos temas críticos que proporcionaban una notificación explícita de la fecha de muerte del sujeto antes del 14 de noviembre de 2020 [54] .
El protocolo C4591001 requería la notificación inmediata de los EAG, incluida la muerte u hospitalización, dentro de un período de 24 horas, una pauta que probablemente siguió el personal del sitio del ensayo. Sin embargo, Pfizer utilizó las fechas en que se registró la muerte en los formularios de informe de casos. Michels et al. descubrió un patrón constante de retrasos en la notificación de la fecha de muerte en los formularios de informes de casos de los sujetos durante todo el ensayo [54] .
Estos retrasos fueron mayores en los sujetos vacunados que murieron antes del 14 de noviembre de 2020. Si Pfizer hubiera utilizado las fechas de muerte reales en su solicitud de EUA, se habrían incluido dos sujetos vacunados adicionales en la solicitud de EUA.
Esta discrepancia fue crucial, ya que todas las muertes de sujetos vacunados (cuatro de cuatro) y la mitad de las muertes que recibieron placebo (dos de cuatro) estuvieron relacionadas con el corazón. El análisis forense reveló que el 75% de las muertes en los sujetos vacunados y el 33,3% de los del grupo placebo estaban relacionadas con el corazón [54] .
Entre los 14 sujetos que experimentaron EAG cardíacos, 11 eran individuos que recibieron la vacuna BNT162b2 y tres pertenecían al grupo de ensayo de solo placebo, un aumento de 3,7 veces (OR 3,7, IC del 95%: 1,02-13,2, p = 0,03) [54] . Es de destacar que ni el artículo del ensayo original de Thomas et al. ni el informe resumido de seguridad clínica de Pfizer reconoció ni comentó esta señal de seguridad crucial [35,78] .
En retrospectiva, la observación no revelada previamente de que en el ensayo de Pfizer se produjeron el doble de muertes cardíacas proporcionalmente entre los sujetos vacunados en comparación con los no vacunados probablemente habría provocado la reevaluación de la FDA, especialmente teniendo en cuenta los datos acumulados posteriores hasta el 10 de diciembre de 2020, donde se habían producido 17 muertes. [54] .
Los retrasos en la documentación de las muertes de estos pacientes en su expediente de informe de caso, junto con la omisión de la fecha real de muerte, ocultaron efectivamente sus muertes durante la fase crucial del proceso de aprobación de la EUA, enmascarando la señal cardíaca de SAE [54] .
En resumen, las diversas demoras y omisiones en la presentación de informes, si hubieran sido discutidas y consideradas abiertamente por el VRBPAC, podrían haber prolongado el proceso de autorización. Los informes inadecuados y el escrutinio insuficiente por parte del VRBPAC pueden haber permitido en última instancia a Pfizer manipular los resultados del ensayo y oscurecer la señal de muerte cardíaca.
Estudios recientes en animales in vivo demuestran que “en cardiomiocitos aislados, tanto el ARNm-1273 como el BNT162b2 inducen disfunciones específicas que se correlacionan fisiopatológicamente con la miocardiopatía” [80] .
Entonces, en principio, los cardiomiocitos no pueden excluirse de la biodistribución del ARNm de LNP, y cada nuevo producto de ARNm tiene el potencial de causar problemas cardíacos potencialmente mortales, incluidas miocardiopatía y paro cardíaco.
Más allá de estas omisiones en los informes SAE, la notificación oficial de los resultados de los ensayos también fue problemática. Los datos del ensayo que Pfizer presentó para la solicitud de EUA revelaron una tendencia desconcertante al comparar la incidencia de COVID-19 entre los grupos inyectados con ARNm y placebo: una divergencia sorprendente después del día 12 después de la primera dosis de BNT162b2 [81,82] .
Mientras que el grupo de placebo continuó viendo nuevos casos, la tasa de infección del grupo BNT162b2 se detuvo abruptamente, lo que sugiere un inicio repentino y uniforme de la inmunidad el día 12. Una respuesta tan abrupta y completa el día 12 contradice la plausibilidad biológica, dado que tales respuestas inmunológicas tenderían de manera realista a registrarse de manera más gradual en un contexto grupal.
Además, Pfizer no proporcionó datos sobre las personas que recibieron solo una dosis. Figura 2 del mismo informe del ensayo [83] , adaptado por Palmer et al. [82] , que muestra los títulos de anticuerpos neutralizantes el día de la primera inyección (D1) y varios días posteriores, muestra el aumento gradual de los anticuerpos neutralizantes contra el SARS-CoV-2 después de la inoculación de ARNm.
Esto contradice la noción de inmunidad clínica completa y rápida. Para el día 21, después de la primera dosis, los anticuerpos neutralizantes aumentaron solo ligeramente, alcanzando su punto máximo el día 28, mucho después de que la mayoría de las personas hubieran recibido su segunda dosis. Esta inconsistencia entre los datos clínicos y de anticuerpos plantea dudas sobre la representación gráfica de la inmunidad repentina el día 12, lo que genera sospechas sobre su validez. La Figura 2 muestra dos gráficos extraídos del informe de evaluación de la Agencia Europea de Medicamentos (EMA) sobre los datos del ensayo de Pfizer [83] .
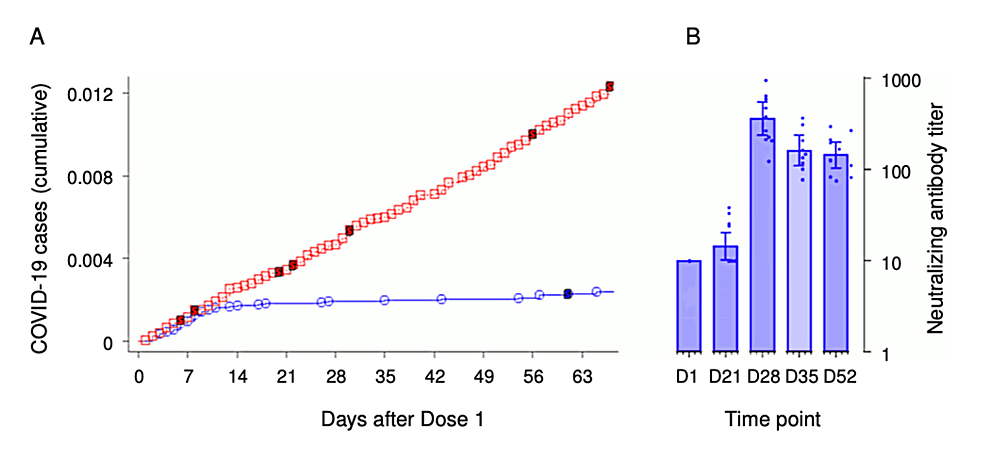
Figura 2: Gráficos que ilustran las irregularidades del ensayo de Pfizer en la notificación de casos de COVID-19 y las respuestas inmunitarias humorales (títulos de anticuerpos)
Esto indica un patrón inusual después del día 12 después de la inyección de BNT162b2. Mientras que el grupo de placebo continuó experimentando casos, el grupo BNT162b2 mostró una disminución repentina en las tasas de infección, lo que sugiere una inmunidad inmediata inesperada.
Fuente de la imagen: Palmer M, et al., 2023 [82] ; Reproducido bajo licencia internacional Creative Commons Attribution-NonCommercial-ShareAlike 4.0 (CC BY-NC-SA 4.0). Los datos se extrajeron del informe de la Agencia Europea de Medicamentos (EMA), haciendo referencia a las Figuras 9 (A) y 7 (B) [83] .
Cuando el informe provisional de seis meses de eventos adversos de Pfizer (C4591001) reveló un recuento total de muertes de 38 [35] , el número parecía inesperadamente bajo para un ensayo clínico que involucraba a 44.060 participantes en medio de una pandemia.
Para investigar, Michels y sus colegas estimaron las muertes previstas basándose en las tasas de mortalidad de EE. UU. en 2020, suponiendo comparabilidad entre los países participantes [54] . Con 132 sitios de ensayo en los EE. UU. y el 80 % de los sujetos, estimaron que deberían haber ocurrido 222 muertes entre el 27 de julio de 2020 y el 13 de marzo de 2021, lo que hace que las 38 muertes observadas sean solo el 17 % del número proyectado.
La mayoría de los sitios del ensayo tuvieron menos muertes de lo previsto, posiblemente atribuidas a un porcentaje considerable de sujetos «perdidos durante el seguimiento» (4,2% de los sujetos aleatorizados), incluidos 395 sujetos únicos dentro del período de estudio.
Mientras que algunos sitios registraron pérdidas insignificantes, otros exhibieron cifras sustanciales, hasta el 5% de los sujetos del sitio [54] . Estas cifras probablemente contribuyeron al recuento general de muertes aparentemente bajo y deberían haber provocado mayores esfuerzos para localizar a estas personas. Perder la pista de casi 400 participantes del estudio en el período de observación de seguimiento podría haber comprometido sustancialmente la validez y generalización de los resultados.
Los datos faltantes pueden producir estimaciones sesgadas y llevar a conclusiones inválidas. Esto podría dar como resultado una distorsión de la eficacia de la vacuna y una subestimación de los EAG (incluidas las muertes), tergiversando así el perfil de seguridad de los productos de ARNm. En resumen, el hecho de que Pfizer no minimizara la deserción de participantes socavó gravemente la precisión y confiabilidad de las conclusiones del estudio de seis meses.
Según un análisis retrospectivo realizado por Gulbrandsen y sus colegas, los datos del ensayo de Pfizer mostraron una asociación significativa entre la tasa de mortalidad y el tiempo transcurrido desde la inyección tanto en el grupo de vacuna como en el de placebo [84] .
Se registró un número mínimo de muertes durante los primeros 80 días, pero se observó un aumento significativo de la mortalidad alrededor de los 100 días posteriores a la inyección, lo que indica un patrón que no puede atribuirse al azar. También son evidentes tendencias notablemente irregulares en los efectos adversos graves EAG cardíacos dentro del ensayo.
Casi la mitad de todos los eventos cardíacos se manifestaron dentro de los primeros 50 días posteriores a la inyección, a pesar de la exposición constante al riesgo prevista para los primeros 140 días. Curiosamente, se observó un aumento dramático en los EAG cardíacos alrededor de los 100 días desde la primera inyección tanto en el grupo de placebo como en el de vacuna, coincidiendo con el aumento de la tasa de mortalidad.
El examen de los diagnósticos médicos predominantes antes de participar en el ensayo reveló otra tendencia aberrante: los nueve diagnósticos preexistentes más prevalentes se encontraron con mayor frecuencia entre los participantes del grupo de placebo.
Además, hubo un contraste notable en las edades de los participantes fallecidos entre los dos grupos. Era poco probable que estos patrones observados ocurrieran al azar. La única explicación plausible que se alineaba con estas tendencias anómalas fue que los registros de efectos adversos graves entre los receptores de la vacuna se alteraron, reubicándolos en el grupo de placebo después de la aparición [84] .
Estas preocupaciones se ven agravadas por las revelaciones sobre prácticas de investigación deficientes y una gestión inadecuada de los datos en los ensayos fundamentales. Un informe de denuncia de un ex empleado de la organización de investigación por contrato responsable de inscribir a los pacientes en el ensayo fundamental de Pfizer plantea cuestiones importantes sobre la integridad de los datos y la seguridad de los participantes del ensayo [85] .
Entre los problemas de conducta del ensayo documentados se encuentran:
- la falta de notificación de desviaciones del protocolo,
- el almacenamiento inadecuado de las vacunas,
- el etiquetado incorrecto de las muestras de laboratorio y
- la falta de seguimiento oportuno de los pacientes que experimentan EA, lo que posiblemente conduzca a una notificación insuficiente.
En términos de supervisión regulatoria, la FDA inspeccionó sólo nueve de los 153 sitios de estudio involucrados en el ensayo de Pfizer [86] .
Falta de consentimiento informado
Finalmente, al principio del ensayo se produjo el desenmascaramiento de los participantes, potencialmente a gran escala en diferentes sitios del estudio. A los participantes no se les presentó información clara sobre los posibles efectos adversos ni en los protocolos del ensayo ni en los formularios de consentimiento [87] .
Algunas partes del formulario de consentimiento eran engañosas y simplemente pretendían provocar una participación que de otro modo no habría ocurrido si los voluntarios hubieran sido conscientes de que lo prometido en teoría o “en papel” era poco probable que sucediera en la realidad [87] . Como resultado, a los participantes no se les otorgaba un consentimiento verdaderamente informado; Las posibles lesiones y EA que probablemente sean causados por las vacunas nunca se mencionaron abiertamente.
Esta falta de consentimiento informado se trasladó al entorno del mundo real después de la EUA. Por ejemplo, no revelar públicamente la exclusión de mujeres embarazadas del ensayo de Pfizer es posiblemente uno de los descuidos más atroces de los CDC al afirmar la seguridad de la administración de la vacuna COVID-19 durante el embarazo [1] .
El Código de Nuremberg estableció los derechos de los pacientes al consentimiento informado voluntario después de la Segunda Guerra Mundial [88] . Los tribunales estadounidenses apoyan sistemáticamente el consentimiento informado como un derecho fundamental para la autonomía de los pacientes [89] .
Los procedimientos de consentimiento informado deben proporcionar distinciones claras entre los riesgos que se observan con frecuencia, los riesgos que ocurren raramente y el riesgo más obvio de falta de eficacia o inmunidad menguante, que es independiente del riesgo de EAG. Ya sea en un ensayo clínico o en un entorno de vida libre en el mundo real, el consentimiento informado es esencial para proporcionar una comprensión clara de los riesgos potenciales asociados con la recepción de una vacuna genética. Durante toda la pandemia, los trabajadores de la salud tenían el deber de proporcionar información clara sobre riesgos y beneficios a los pacientes.
Sin embargo, en la práctica, el consentimiento informado no existía, ya que las hojas de información estaban en blanco [90] y los vacunados nunca fueron informados de los riesgos potenciales de antemano.
Narrativas cambiantes, ilusiones de protección
La capacidad de detener o limitar en gran medida la infección generalmente se considera esencial para la eficacia de la vacuna. Sin embargo, los ensayos de registro de Pfizer y Moderna no fueron diseñados para abordar esta cuestión. El criterio de valoración de los ensayos fue la reducción de los síntomas asociados con la COVID-19 [1,2] , a pesar de que posteriormente los CDC dijeron al público que los productos COVID-19 detendrían la transmisión [91] .
No previenen ni la transmisión ni la infección
Además, se demostró que la transmisión asintomática era extremadamente minúscula [92] . Desde 2021, la comunidad científica sabe que los productos de ARNm de COVID-19 no previenen ni la transmisión ni la infección [93] . Incluso los expertos patrocinados por la industria de las vacunas admitieron una reducción máxima de la transmisión del 61% en 2021 [94] .
Las subvariantes de Omicron se asocian con una reducción del 30 al 50 % en la transmisión después de la administración de los refuerzos [95-97]. El beneficio es incremental y transitorio, y la protección contra la infección por Omicron dura sólo unos pocos meses [93] .
Aunque los títulos de anticuerpos contra el SARS-CoV-2 son más altos después de la inyección, estos niveles disminuyen más rápidamente en los receptores de ARNm en comparación con los individuos con infección natural [98] .
El impacto de la reducción de la gravedad de la enfermedad entre las personas vacunadas contra la COVID-19 sobre el riesgo de causar infecciones secundarias nunca se ha investigado sistemáticamente en ensayos clínicos controlados [93] .
Sistema de Salud de la Clínica Cleveland (CCHS)
La mejor evidencia del fracaso de la capacidad de la vacuna de ARNm contra la COVID-19 para conferir protección contra la COVID-19 proviene de dos grandes estudios de cohortes de empleados del Sistema de Salud de la Clínica Cleveland (CCHS) después de que los refuerzos de ARNm bivalente estuvieron disponibles [99,100] .
En el primer estudio (n=51.017), la COVID-19 ocurrió en 4.424 (8,7%) durante el período de observación de 26 semanas [99] . En términos de prevención de infecciones por las tres subvariantes predominantes de Omicron, la eficacia de la vacuna fue del 29%, 20% y un 4% no significativo, respectivamente [99] .
No se proporcionó protección cuando los linajes XBB eran dominantes. En particular, el riesgo de infección “irruptiva” fue significativamente mayor entre quienes recibieron la vacuna anterior, y una mayor frecuencia de vacunación resultó en un mayor riesgo de COVID-19 [100] .
En un segundo estudio de cohorte del CCHS (n= 48,344), los adultos que “no estaban al día” según la definición de los CDC tuvieron una incidencia 23% menor de COVID-19 que aquellos “al día” con sus vacunas [100] . Estos hallazgos se ven reforzados aún más por múltiples estudios del mundo real que muestran una rápida disminución de la protección contra la infección por Omicron después de los refuerzos [101] .
La eficacia de la vacuna contra la infección por Omicron confirmada por laboratorio y la enfermedad sintomática disminuye rápidamente dentro de los tres meses posteriores al ciclo de vacunación primaria y la dosis de refuerzo [97] .
Las Figuras 3 y 4 presentan los sorprendentes hallazgos de estos dos estudios de la Clínica Cleveland. La Figura 3 muestra los hallazgos del estudio anterior, con una incidencia acumulada de COVID-19 para los participantes del estudio estratificada por la cantidad de dosis de vacuna de ARNm recibidas previamente.
El día 0 fue el 12 de septiembre de 2022, fecha en que se ofreció por primera vez la vacuna bivalente a los empleados de CCHS. Las tasas de casos estaban claramente aumentando junto con una mayor frecuencia de inyecciones de ARNm [99] .
La Figura 4 presenta otro hallazgo inesperado, esta vez del segundo estudio de la Clínica Cleveland, con un gráfico de riesgo de Simon-Makuch que compara la incidencia acumulada de COVID-19 en los grupos “actualizados” y “no actualizados” con respecto al estado de vacunación definido por los CDC. El día cero fue el 29 de enero de 2023, el día en que los linajes XBB de la variante Omicron se volvieron dominantes en Ohio. Para ambos gráficos, las estimaciones puntuales y los IC del 95 % se muestran a lo largo del eje x [100] .
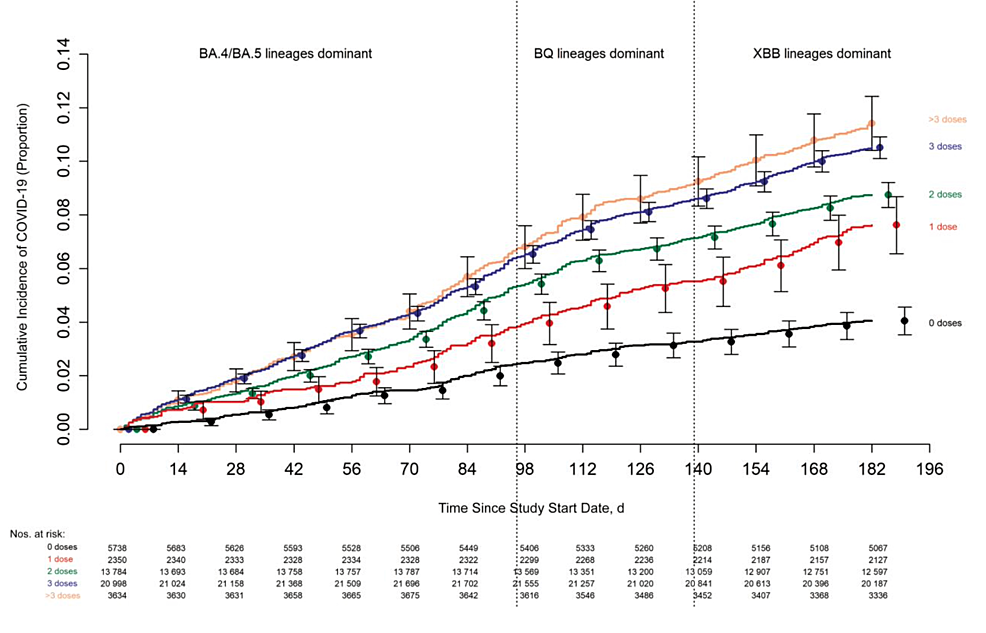
Figura 3: Estudio de la Clínica Cleveland que muestra un aumento de casos de COVID-19 con un aumento de las vacunas de ARNm
Estudio de la Clínica Cleveland que demuestra la incidencia de COVID-19 entre los participantes según la cantidad de dosis previas de vacuna de ARNm recibidas. El estudio muestra tasas de casos crecientes asociadas con mayores dosis de la vacuna de ARNm COVID-19.
Fuente de la imagen: Shrestha et al., 2023 [99] ; Artículo de acceso abierto con información del sector público, bajo la licencia Open Government License v3.0 ( http://www.nationalarchives.gov.uk/doc/open-government-licence/version/3/ )
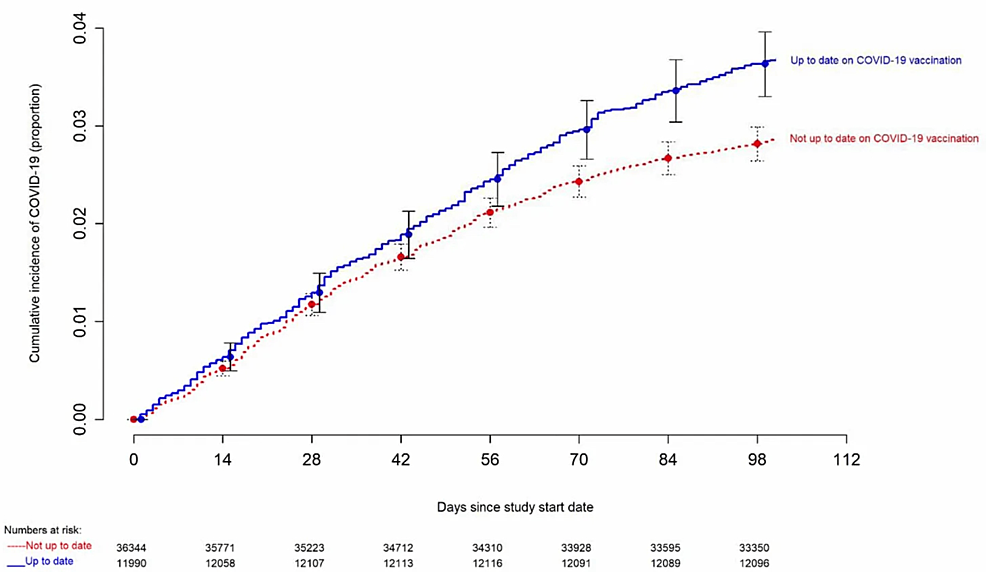
Figura 4: Estudio de la Clínica Cleveland que muestra un aumento de casos de COVID-19 en sujetos más «al día» con las vacunas de ARNm
Estudio de la Clínica Cleveland que compara la incidencia acumulada de COVID-19 entre personas «actualizadas» y «no actualizadas» según el estado de vacunación definido por los CDC. El gráfico incluye estimaciones puntuales e intervalos de confianza del 95% a lo largo del eje x.
Crédito de imagen: Shrestha et al., 2023 [100] ; Acceso abierto, licenciado bajo CC BY 4.0 Deed (Atribución 4.0 Internacional)
Ahora que el perfil de eficacia del producto está firmemente en duda, la empresa de vacunas ha adoptado dos narrativas para justificar el uso continuo de las vacunas COVID-19. La primera es que, si bien es posible que los productos de ARNm de COVID-19 no bloqueen las infecciones, sí protegen contra enfermedades graves, hospitalizaciones y mortalidad. La segunda narrativa afirma que la protección asociada con la inoculación de ARNm, cuando se combina con la infección natural, es superior a la infección natural (y, por tanto, a la inmunidad natural) sola.
La primera narrativa plantea una dicotomía contraintuitiva entre las dos formas de protección, protección contra infecciones versus protección contra enfermedades graves, y parece implicar su independencia. Como resumen de esta dicotomía, un informe de un estudio israelí de 2022 afirma que “la protección contra la infección confirmada pareció de corta duración, mientras que la protección contra enfermedades graves no disminuyó durante el período del estudio” [ 102] .
Sin embargo, ¿es razonable sostener que ¿La protección contra enfermedades graves y la mortalidad permanece intacta incluso después de la rápida disminución de la protección contra infecciones? Para abordar este problema, Ophir y sus colegas realizaron un análisis meticuloso de datos destacados de ensayos clínicos, grandes estudios observacionales de Israel y paneles de estadísticas contemporáneos [103]
Los autores observaron «múltiples limitaciones metodológicas y de representación, incluidos períodos de seguimiento cortos, y a veces arbitrarios o desiguales, criterios de exclusión y niveles de pruebas de COVID-19 desiguales, sesgos de selección y notificación selectiva de los resultados. Pero lo más importante, la documentación documentada , la probabilidad condicional de muerte y enfermedad grave (es decir, el porcentaje de casos de enfermedad grave y muerte entre aquellos infectados con el virus) no difirió entre los grupos de tratamiento y control de los diversos estudios de eficacia clínica y observacional» [ 103] .
Los autores concluyeron que no había pruebas válidas para fundamentar la afirmación de que recibir un segundo refuerzo de ARNm de COVID-19 previene eficazmente enfermedades graves y la mortalidad [103] .
La segunda narrativa alternativa se centra en el fenómeno de la inmunidad híbrida, la protección combinada que se obtiene de la infección natural seguida de la dosis de refuerzo. En aquellas personas expuestas recientemente a infecciones por SARS-CoV-2, se cree que la inmunidad inducida por la vacuna COVID-19 supera la inmunidad natural porque genera una respuesta de anticuerpos más sólida y amplía el espectro de anticuerpos generados [104] .
Estas respuestas humorales sólidas y de base amplia implican la producción de células B de memoria en niveles de 5 a 10 veces superiores a los logrados mediante infección o vacunación solas [105] . A estas alturas, la mayoría, si no todas, las personas en los países desarrollados han sido infectadas por el SARS-CoV-2.
Una vez informados de la protección adicional que ofrece la inmunidad híbrida, las personas que saben que tienen antecedentes de infección pueden estar más inclinadas a aceptar refuerzos continuos. No obstante, dada la gravedad relativamente baja de Omicron, ¿es realmente necesaria la producción adicional de anticuerpos?
También es necesario considerar los riesgos potenciales de este aumento de la producción de anticuerpos. Debido a que las subvariantes de Omicron mutan constantemente, muchos de los anticuerpos generados por las vacunas actuales no son neutralizantes.
La posible sobreproducción de anticuerpos no neutralizantes podría conducir al fenómeno de la enfermedad potenciada asociada a la vacuna (VAED), que se basa en parte en la mejora dependiente de anticuerpos [106] . Hasta la fecha, ha habido solo unos pocos informes de VAED leve en la vacunación contra la COVID-19 en modelos animales y ningún caso documentado en humanos [107] . Sin embargo, con refuerzos repetidos, VAED podría eventualmente afectar la seguridad a largo plazo de las vacunas de ARNm.
En el contexto de la inmunidad híbrida, el problema inmunológico más grave se refiere a la infección por SARS-CoV-2 que se produce después de la inyección de ARNm de COVID-19, cuando la producción de proteína S ya aumenta sistémicamente.
Originalmente se asumió que la vacunación previa podría disminuir la gravedad de la infección y reducir el riesgo de enfermedad grave por COVID-19. En el período posterior a la vacunación, el sistema inmunológico estaría preparado para responder con más fuerza a una infección posterior unas pocas semanas después de completar la serie completa. Sin embargo, también puede ocurrir el escenario opuesto debido a la elusión de las respuestas inmunes innatas, junto con la sobreproducción mencionada anteriormente de anticuerpos no neutralizantes y una protección inadecuada contra enfermedades graves [108] .
Se sabe que las vacunas contra la COVID-19 causan una supresión inmune innata a través de un deterioro profundo en la señalización del interferón tipo I junto con una interrupción del control regulatorio de la síntesis de proteínas y la vigilancia del cáncer [26] . La producción excesiva de anticuerpos no neutralizantes podría aumentar el riesgo de reacciones autoinmunes al reaccionar cruzadamente con los tejidos del huésped en lugar del virus, desencadenando así reacciones autoinmunes inflamatorias mediante mimetismo molecular [109-111] . Estos mecanismos pueden aumentar colectivamente el riesgo de patologías inflamatorias autoinmunes, incluidos cánceres, enfermedades cardiovasculares y muchas otras enfermedades con una etiología inflamatoria crónica [112,113] . (Para una discusión sobre la base mecanicista de los eventos adversos, consulte la sección “Mecanismos subyacentes a los EA”.)
Hasta este punto, al considerar los EAG, nos hemos centrado principalmente en los efectos asociados con el producto de ARNm de Pfizer, BNT162b2, a partir de los datos del ensayo de seis meses, así como del documento confidencial de 393 páginas publicado en agosto de 2022, que revela cerca de 1,6 millones de EA [114] .
En el contexto de la inmunidad híbrida, es importante señalar que el producto de Moderna, mRNA-1273, genera una respuesta inmune sustancialmente más fuerte, lo que resulta en tasas más bajas de infección sintomática y resultados graves de COVID-19 en comparación con BNT162b2 [115] .
Sin embargo, quienes se concentran en estos beneficios para la prevención de infecciones pueden tender a pasar por alto los daños potenciales: el ARNm-1273 ha mostrado riesgos significativamente mayores de EAG en comparación con el BNT162b2, según ensayos clínicos, estudios basados en encuestas y un estudio de vigilancia patrocinado por el gobierno. estudio [1,2,116-120] . Esto muestra el desagradable equilibrio entre una mayor protección contra la infección por Omicron, por un lado, y un riesgo sustancial de EAG inducidos por la vacuna, por el otro.
En un estudio reciente de casi cinco millones de adultos, aquellos que tuvieron una infección por SARS-CoV-2 dentro de los 21 días posteriores a la inyección mostraron un riesgo ocho veces mayor de accidente cerebrovascular isquémico (OR = 8,00, IC del 95%: 4,18-15,31) y cinco riesgo de accidente cerebrovascular hemorrágico dos veces mayor en comparación con los vacunados sin infección concurrente (OR = 5,23; IC del 95 %: 1,11 a 24,64) [121] .
El riesgo fue mayor para quienes recibieron las inyecciones de ARNm-1273. Por tanto, la infección por SARS-CoV-2 cerca del momento de la vacunación produjo una fuerte asociación con la incidencia temprana de accidentes cerebrovasculares isquémicos y hemorrágicos [121] . Una vez más, con un enfoque de inmunidad híbrida, los daños potenciales pueden superar con creces las recompensas.
La inmunidad natural
La inmunidad natural no conlleva ninguno de estos riesgos y es más que suficiente contra la leve virulencia de las subvariantes de Omicron. Mucha evidencia indica ahora que la inmunidad natural confiere una protección sólida, duradera y de alto nivel contra la enfermedad grave de COVID-19 [122-126] .
Un gran estudio del Reino Unido en el que participaron más de 30.000 trabajadores sanitarios con antecedentes de infección por SARS-CoV-2 mostró una reducción del 84 % en el riesgo de reinfección, con un período de protección medio de siete meses [125] .
En un gran estudio observacional realizado en Israel, las personas previamente infectadas que no estaban vacunadas tenían entre 6 y 13 veces menos probabilidades de contraer el virus en comparación con las que estaban vacunadas [122] .
Entre 32.000 personas dentro del mismo sistema sanitario, las personas vacunadas tenían un riesgo 27 veces mayor de desarrollar COVID-19 sintomático y un riesgo ocho veces mayor de hospitalización en comparación con sus homólogos no vacunados [122] .
Después de recuperarse de la COVID-19, el cuerpo alberga células inmunitarias con memoria de larga duración, lo que indica una capacidad duradera para responder a nuevas infecciones, que puede durar muchos años [127] . Cada vez hay más pruebas que sugieren que el entrenamiento de anticuerpos y la inducción de la memoria de las células T como resultado de una infección natural repetida con Omicron puede aumentar la mitigación de futuras infecciones [128,129] .
En un estudio de cohorte reciente, los niños que habían experimentado una infección previa mostraron una protección duradera contra la reinfección por SARS-CoV-2 durante un mínimo de 18 meses [130] . Estos niños de entre cinco y 11 años no demostraron ninguna disminución en la protección durante todo el estudio, mientras que los de 12 a 18 años experimentaron una disminución leve pero mensurable en la protección con el tiempo [130] . Especialmente para estas generaciones más jóvenes, la inmunidad natural es más que suficiente y, por supuesto, mucho más segura que las inoculaciones de ARNm.
Análisis de daños graves a los seres humanos.
Ahora revisamos lo que se sabe sobre los EA y los EAG informados en los ensayos de registro, incluidos los datos que las agencias reguladoras y los estudios de vigilancia de la seguridad de los medicamentos revelaron después de la EUA.
Ya en 2014, Sahin y sus colegas habían advertido sobre los peligros potenciales de la tecnología de la vacuna de ARNm, advirtiendo específicamente que el antígeno codificado debería investigarse para detectar múltiples riesgos de enfermedad [131] .
Las encuestas muestran que la principal preocupación expresada por los padres acerca de que sus hijos reciban las vacunas contra la COVID-19 no es la eficacia de la vacuna sino más bien los posibles efectos adversos [132,133] .
En una encuesta realizada a padres estadounidenses, las preocupaciones sobre la velocidad sin precedentes del desarrollo de las vacunas de ARNm (y, por implicación, el rápido proceso de autorización) se ubicaron justo por encima de las preocupaciones sobre los efectos secundarios dañinos [133] .
Los riesgos pueden variar según la cantidad y la frecuencia de las dosis de la vacuna COVID-19. Mientras que algunos autores han observado menos EA después de la segunda dosis [134] , otros han informado de una mayor incidencia [116] .
Sultana et al. informaron tendencias variables en los EA después de la segunda dosis para ambos productos de ARNm, aunque con una mayor frecuencia de EA después de la administración de la segunda dosis de la vacuna Moderna [135] .
Las revelaciones más convincentes sobre los impactos adversos de estos productos provienen de un nuevo análisis exhaustivo de los datos de los ensayos, centrándose principalmente en los resultados más graves, incluidas las muertes.
Aplicando una metodología rigurosa, Fraiman y sus colegas llevaron a cabo una investigación en profundidad y analizaron los conjuntos de datos provisionales de los ensayos de Pfizer y Moderna, que abarcaron aproximadamente cuatro meses de observación después del inicio de los ensayos [50] .
Los EAG se definieron como eventos que condujeron a cualquiera de los siguientes resultados: muerte, condiciones potencialmente mortales, hospitalización o extensión de la hospitalización existente, discapacidad/incapacidad persistente o significativa, una anomalía congénita/defecto de nacimiento o un evento médicamente significativo basado en criterio médico.
El riesgo de Efectos Adversos Graves, EAG relacionados con las vacunas se dividió en EAG generales y EA de interés especial (AESI), según lo identificado por los criterios de Brighton Collaboration adoptados por la Organización Mundial de la Salud [136] .
Tanto en los ensayos de Pfizer como de Moderna combinados, hubo alrededor de 125 EAG por cada 100.000 receptores de la vacuna, lo que se traduce en un Efecto Adverso Grave, EAG por cada 800 vacunados [50] .
Debido a que los ensayos evitaron a los participantes más frágiles, uno esperaría ver proporciones aún mayores de EAG en los lanzamientos a toda la población. Sorprendentemente, el ensayo de Pfizer mostró un riesgo 36% mayor de EAG en el grupo de la vacuna en comparación con el grupo de placebo, con una diferencia de riesgo de 18,0 (IC del 95%: 1,2-34,9) por 10.000 vacunados; ratio de riesgo 1,36 (IC95% 1,02-1,83).
Estos hallazgos contrastan marcadamente con la afirmación inicial de la FDA de que los EAG informados en los dos ensayos fundamentales estaban “equilibrados entre los grupos de tratamiento” [15,50] . La discrepancia puede explicarse en parte por el hecho de que la FDA se centraba únicamente en los datos de los participantes individuales y, sin embargo, muchos de esos individuos experimentaban múltiples EAG.
En lugar de analizar individuos, Fraiman et al. se centró en el total de EAG para tener en cuenta los múltiples eventos concurrentes [50] . Cuando los EAG se consideraron colectivamente, los riesgos en el grupo de la vacuna fueron sustancialmente elevados más allá de los determinados previamente por la FDA.
Para su evaluación de riesgo-beneficio, el equipo de Fraiman consideró el riesgo excesivo de AESI graves en el grupo de la vacuna frente al riesgo de hospitalización por COVID-19 en el grupo del placebo [50] . Este análisis se basó en informes publicados por los patrocinadores de las empresas de vacunas y presentaciones de la FDA.
Sorprendentemente, según Fraiman et al., el ensayo de Pfizer mostró un riesgo cuatro veces mayor de AESI graves en comparación con el riesgo de hospitalizaciones por COVID-19 (10,1 AESI frente a 2,3 hospitalizaciones por cada 10.000 participantes, respectivamente), mientras que el ensayo de Moderna demostró un riesgo más del doble (15,1 AESI frente a 6,4 hospitalizaciones por 10.000 participantes, respectivamente) [50] .
Estos hallazgos indican un grado mucho mayor de daño relacionado con la vacuna de lo que se estimó inicialmente durante la época de la EUA. Para poner estos hallazgos en perspectiva, la tasa oficial de EAG para otras vacunas es sólo de 1 a 2 por millón [137] . La estimación de Fraiman et al. basada en los datos del ensayo de Pfizer (1250 EAG por millón) supera este punto de referencia en al menos 600 veces.
Los análisis de dos grandes sistemas de notificación de seguridad de los medicamentos en EE. UU. y Europa revelaron más de 7,8 millones de EA notificados por aproximadamente 1,6 millones de personas después de la vacunación contra la COVID-19 [47] .
En comparación con las personas de 18 a 64 años, los grupos de mayor edad exhibieron una mayor frecuencia de muerte, hospitalizaciones y reacciones potencialmente mortales, con estimaciones de RR que oscilaron entre 1,49 (IC del 99%: 1,44-1,55) y 8,61 (IC del 99%: 8,02). -9.23).
Se identificaron señales de infarto de miocardio, embolia pulmonar, paro cardiorrespiratorio, infarto cerebral y hemorragia cerebral asociadas con ambas vacunas de ARNm. Estas señales, junto con los accidentes cerebrovasculares isquémicos, fueron confirmadas mediante un amplio análisis de desproporcionalidad [48] .
En un análisis independiente de riesgo-beneficio, BNT162b2 produjo 25 veces más EAG que el número de casos graves de COVID-19 evitados [51] . Un cálculo de riesgo-beneficio tan desigual refuerza los hallazgos de la encuesta Skidmore, que estimó que el número total de muertes en EE. UU. debido a las vacunas de ARNm contra la COVID-19 solo en 2021 fue de 289 789 (IC del 95 %: 229 319-344 319) [138] .
Un médico y un especialista en investigación ayudaron a validar la encuesta, y la muestra (obtenida por Dynata, la plataforma de datos propios más grande del mundo, con sede en Connecticut, EE. UU.) se consideró representativa de la población estadounidense [138] .
Estudios de autopsia
Finalmente, los estudios de autopsia han proporcionado evidencia adicional de daños graves. En una revisión sistemática integral con adjudicación totalmente independiente, se consideró que el 74% de los hallazgos de las autopsias (240 de 325 casos) habían sido causados por los productos de ARNm de COVID-19 [139] .
El tiempo medio desde la inyección hasta la muerte fue de 14,3 días, y en la gran mayoría de las muertes el sistema cardiovascular fue la única lesión mortal del sistema orgánico del cuerpo. Estos hallazgos se ven reforzados por los de una revisión de autopsia adjudicada más reciente de miocarditis inducida por la vacuna de ARNm (28 muertes, todas ellas atribuidas a las inyecciones) [140] , así como por un estudio de autopsia previo de receptores de la vacuna de ARNm que no tenían la ventaja de una decisión independiente [141] .
Basándose en múltiples estudios de autopsias, patólogos alemanes dirigidos por el fallecido Arne Burkhardt han documentado la presencia de proteínas S producidas por ARNm de vacunas en las paredes de los vasos sanguíneos y en los tejidos cerebrales mediante tinción inmunohistopatológica [142,143] .
Estos hallazgos ayudan a explicar la amplia gama de toxicidades bien documentadas inducidas por la vacuna COVID-19 que afectan los sistemas nervioso, gastrointestinal, hepático, renal, hematológico, inmunológico y reproductivo [25,144,145] . Los exámenes post mortem son fundamentales para identificar posibles EAG de las inoculaciones de ARNm.
Sin embargo, como las clínicas y las administraciones hospitalarias tienen un gran interés en la distribución de las vacunas COVID-19, la práctica administrativa común de desalentar las autopsias y posponer los informes de las autopsias solo sirve para socavar la evaluación integral de riesgos, perpetuar las ideas erróneas del público sobre la seguridad y debilitar la salud pública. formulación de políticas [145] .
Problemas de control de calidad e impurezas relacionadas con el proceso
Dada la novedad de la tecnología de ARNm utilizada en las vacunas contra el SARS-CoV-2, sería prudente establecer inspecciones periódicas de la producción y garantía de calidad junto con protocolos de seguimiento de la seguridad a largo plazo y realizar los estudios necesarios de:
- tumorigenicidad,
- genotoxicidad,
- neurotoxicidad,
- inmunotoxicidad, y
- estudios de toxicidad reproductiva.
Es preocupante el hecho de que nunca se hayan realizado estudios de seguridad y toxicidad apropiados para estos productos basados en genes o GTP (inyecciones de terapia génica).
Una cuestión clave que podría ayudar a explicar por qué algunas personas sucumben mientras que otras no es la variabilidad del tipo de vacuna y del lote. Debido a la inestabilidad inherente de la tecnología de ARNm, algunos lotes pueden contener niveles extremadamente bajos de ARNm intacto [146] .
Algunos lotes estaban contaminados con ARN bicatenario (ARNds), como lo documentó la EMA tanto para los productos de Pfizer como para los de Moderna [147,148] . El dsRNA tiene un alto potencial para desencadenar reacciones inmunoinflamatorias como la miocarditis [149] .
El control de calidad es fundamental para cualquier discusión sobre la variabilidad de los lotes y las impurezas relacionadas con el proceso y, sin embargo, en términos prácticos, evaluar dicho control para viales individuales no es factible.
En un artículo publicado en 2021, Yu et al. Plantearon la hipótesis de que la variabilidad en las reacciones adversas podría deberse a diferencias de calidad entre diferentes lotes o incluso diferentes viales individuales, debido a variabilidades tanto en los contaminantes como en los historiales de manipulación [150] . El requisito de mantenimiento a temperaturas extremadamente bajas puede no siempre ser práctico y las consecuencias de una manipulación inadecuada (por ejemplo, ruptura de la cadena de frío) no están bien caracterizadas.
La cuestión de la variabilidad de los lotes se complica aún más por los recientes hallazgos de contaminación del ADN en las vacunas de ARNm [151] .
En un análisis de múltiples viales de los productos bivalentes de ARNm de Pfizer y Moderna, McKernan et al. encontró “altos niveles de contaminación del ADN tanto en las vacunas monovalentes como en las bivalentes” que eran “órdenes de magnitud superiores al límite de la EMA” de 330 nanogramos de ADN por miligramo de ARN [152] . Las impurezas relacionadas con el proceso de ADN también excedieron los límites de seguridad de la FDA (10 ng/dosis).
En un intento posterior de refutar esta afirmación, Buckhaults y su equipo de investigación genómica examinaron dos lotes de viales de ARNm de Pfizer y confirmaron la contaminación con el vector de ADN plasmídico que se había utilizado como plantilla para la producción de la vacuna de ARNm [8,153] . En una audiencia en el Senado de Carolina del Sur, Buckhaults informó haber secuenciado consistentemente cantidades sustanciales de ADN plasmídico, 200 mil millones de fragmentos de ADN por vial [153] .
Un descubrimiento sorprendente y potencialmente alarmante fue la presencia del promotor del virus Simian 40 (SV40) en muestras de la vacuna Pfizer, que estaba notablemente ausente en las muestras de la vacuna Moderna [151] .
En octubre de 2023, la agencia reguladora Health Canada confirmó la presencia de esta secuencia genética en muestras de vacunas de ARNm [154] . El SV40, un virus de ADN oncogénico aislado originalmente en 1960 a partir de vacunas contra la polio contaminadas, induce:
- linfomas,
- tumores cerebrales y
- otras neoplasias malignas en animales de laboratorio [155] .
Los datos inmunológicos de pacientes con cáncer han indicado que sus sueros tenían una mayor prevalencia de anticuerpos contra SV40 en comparación con los sujetos sanos [156] . Un metanálisis basado en la combinación de datos diversos de 1.793 pacientes con cáncer identificó un exceso de riesgo significativo de SV40 en asociación con tumores cerebrales, cánceres de huesos, linfoma no Hodgkin y mesotelioma maligno [157] .
Sin embargo, parece improbable que la exposición al SV40 por sí sola provoque enfermedades malignas en humanos, como lo sugiere la ausencia de una epidemia de cáncer tras la distribución de vacunas contra la polio contaminadas con SV40.
Un escenario más probable es que SV40 funcione como cofactor en la génesis y progresión de tumores, como lo indican estudios de laboratorio que revelan su potencial cocarcinogénico con el amianto, un carcinógeno establecido [158] .
El promotor SV40 ha encontrado un uso potencial como potenciador en tratamientos de terapia génica basados en plásmidos de ADN. En un estudio de 2001 sobre la administración de genes somáticos a células del músculo esquelético, se demostró que la incorporación del potenciador SV40 en plásmidos de ADN podría aumentar el nivel de expresión de genes exógenos en un factor de 20 [159] .
Según un esclarecedor editorial sobre las implicaciones de las impurezas relacionadas con el proceso, el empaquetamiento de fragmentos de ADN en partículas de lípidos aumenta la posibilidad de que los fragmentos de ADN se integren en el genoma humano [160] .
Si bien estuvo ausente en los viales utilizados durante las pruebas de registro, el promotor SV40 se identificó en todos los viales de BioNTech analizados y extraídos de lotes que se distribuyeron al público. El 6 de diciembre de 2023, el cirujano general de Florida, Joseph Ladapo, se puso en contacto con la FDA y los CDC con preguntas sobre las evaluaciones de seguridad y el descubrimiento de miles de millones de fragmentos de ADN por dosis de productos de vacunas de ARNm [161,162] .
Una semana después, la FDA respondió por escrito citando estudios de genotoxicidad (que son inadecuados para evaluar el riesgo de integración del ADN) y borrando la distinción entre el promotor/potenciador SV40 y las proteínas SV40, tratando erróneamente estos elementos como intercambiables [162] .
Debido a que hasta ahora la agencia no ha proporcionado ninguna evidencia de haber realizado evaluaciones de integración del ADN para abordar los riesgos destacados por la propia agencia en 2007, Ladapo pidió un cese total del uso de todas las vacunas de ARNm contra la COVID-19 [161,162] .
En un artículo del Instituto Brownstone, el desarrollador de la vacuna de ARNm, Robert Malone, criticó duramente la falta de voluntad de la FDA para evaluar los riesgos potenciales del ADN contaminante [163] .
Una declaración conjunta ofrecida por un panel asesor internacional de expertos patrocinado por el Consejo Mundial para la Salud incluía lo siguiente: “Hay múltiples secuencias genéticas completamente no declaradas tanto en los viales de Moderna como en los de Pfizer, y la secuencia SV40 se encuentra sólo en los viales de Pfizer. Sin embargo, las infecciones latentes por SV40 en una parte importante de la población podrían presentar el mismo riesgo para los receptores de Moderna. Incluso en ausencia de integración cromosómica, los plásmidos de ADN podrían generar ARNm para la toxina de la proteína S y otras proteínas dañinas durante períodos de tiempo prolongados e impredecibles.
La integración de ADN extraño en el genoma humano
La integración de ADN extraño en el genoma humano altera las secuencias genéticas naturales existentes; esto conlleva un mayor riesgo de enfermedades, incluido el cáncer” [164] . Debido a la falta de una evaluación formal y transparente por parte de los reguladores, los expertos también señalaron que actualmente es imposible otorgar un consentimiento informado para estos productos, ya que sus riesgos completos siguen sin revelarse ni comprenderse completamente.
¿Cómo escapó una contaminación tan peligrosa y a gran escala al escrutinio de los funcionarios de salud pública? ¿Estaban los fabricantes conscientes del problema? Es importante señalar que las impurezas relacionadas con el proceso estuvieron ausentes en los productos de ARNm de COVID-19 utilizados en los ensayos de registro.
Cambios en la fase de purificación y ajustes en el proceso de fabricación de LNP Proceso 1 y Proceso 2
Prácticamente todas las dosis utilizadas en esos ensayos se originaron a partir de “lotes clínicos” producidos mediante lo que se conoce como Proceso 1 [1] . Sin embargo, como medida de suministro de emergencia posterior a la autorización para la distribución global, se ideó un método mucho más adecuado para la producción en masa conocido como Proceso 2 que utiliza ADN plasmídico bacteriano [165]. Las alteraciones del Proceso 2 incluyen modificaciones en la plantilla de ADN empleada para la transcripción de ARN, cambios en la fase de purificación y ajustes en el proceso de fabricación de LNP [165] .
En particular, los lotes producidos mediante el Proceso 2 mostraron una integridad del ARNm significativamente reducida [146,166]. Según la enmienda del protocolo, cada lote del producto de Pfizer fabricado mediante el Proceso 2 se administró a aproximadamente 250 participantes de entre 16 y 55 años, y se realizaron análisis comparativos posteriores de inmunogenicidad y seguridad en 250 receptores elegidos al azar de los lotes del Proceso 1 [165]. . Al momento de escribir este artículo, no hay análisis disponibles públicamente que comparen la seguridad y la reactogenicidad de los lotes del Proceso 1 y 2.
Reemplazo de las uridinas
Otra preocupación relevante es el posible impacto biológico de reemplazar todas las uridinas en la molécula de ARN con N1-metilpseudouridina. Esta estrategia se considera una forma útil de mejorar la expresión de proteínas como parte de la terapia con ARNm [167] .
Esto también se consideró una innovación revolucionaria, ya que la vacuna de ARNm de CureVac (CureVac NV. Tübingen, Alemania), al carecer de esta innovación, era menos eficaz que las formulaciones de Pfizer y Moderna [168] .
Es probable que el aumento de la eficacia se deba a que dicha alteración retarda el proceso de degradación y, por tanto, hace que el ARNm dure mucho más. Si bien la N1-metilpseudouridina es una molécula natural, normalmente solo está presente como sustituto de la uridina en un pequeño porcentaje de las uridinas en una secuencia. Aún está por determinar qué efecto podría tener la introducción masiva de N1-metilpseudouridina en la célula sobre su propia síntesis de nuevas moléculas de ARNm [169] .
En un descubrimiento notable, Mulroney et al. observaron que las vacunas de ARNm inducían anticuerpos en ratones contra proteínas que podrían sintetizarse a partir del código de ARNm si se desplazara su marco de lectura en un nucleótido.
Esto no se observó en células expuestas solo a la proteína S ni en ratones vacunados con la vacuna Astra-Zeneca (AstraZeneca plc, Cambridge, Reino Unido), que es una vacuna basada en ADN [170] . Sugirieron que fue la N1-metilpseduuridilación la que causó el cambio de marco.
Estas proteínas no deseadas y no deseadas tienen, en términos de Mulroney et al., “un enorme potencial de ser dañinas”, en parte debido a la potencial homología con proteínas humanas que podrían, a su vez, inducir enfermedades autoinmunes [170-172] .
Según una consulta del código MedDRA “Trastorno autoinmune” en el Sistema de notificación de eventos adversos a las vacunas (VAERS), hubo un aumento del 803 % en los trastornos autoinmunes por millón de dosis administradas al comparar la administración de vacunas contra la influenza de 2018 a 2020 con la vacuna contra la COVID-19. 19 vacunas de 2021 a 2023 (Figura 5 ) [173] .
Esto representa una inmensa señal de seguridad. Estas cuestiones y preocupaciones fundamentales sobre la tecnología deberían haberse abordado antes de que los productos llegaran a cientos de millones de personas [174] .
Figura 5: Informes VAERS de enfermedades autoinmunes por millón de dosis de ARNm de COVID-19 (2021-2023) en comparación con las vacunas contra la influenza (2018-2020)
Según una consulta del VAERS ( https://vaers.hhs.gov/ ) que utiliza el código MedDRA “Trastorno autoinmune”, hubo un aumento del 803 % en la tasa de notificación por millón de dosis administradas al comparar las vacunas contra la influenza administradas entre 2018 y 2020 con las de COVID. -19 inyecciones de ARNm administradas entre 2021 y 2023. En particular, los informes excluyen a personas con antecedentes de un trastorno autoinmune. Crédito de la imagen: Jessica Rose (coautora), [173]
Mecanismos subyacentes a los Efectos Adversos
Una discusión completa de los mecanismos biológicos que pueden explicar los diversos EA de las vacunas COVID-19 está fuera del alcance de este artículo. Por lo tanto, remitimos a los lectores a estos artículos [26,175-181] . Los mecanismos de:
- mimetismo molecular,
- reactividad cruzada de antígenos,
- preparación patogénica,
- reactivación viral,
- agotamiento inmunológico y
- otros factores relacionados con la disfunción inmune
refuerzan la plausibilidad biológica de la patogénesis de enfermedades malignas y autoinmunes inducida por vacunas [26, 182-185] . Tanto las vacunas contra el SARS-CoV-2 como las de ARNm pueden desencadenar una disfunción inmunitaria junto con una serie de efectos fisiopatológicos, que incluyen inflamación crónica, trombogénesis, desregulación relacionada con priones y daño tisular relacionado con la endotelitis [180] .
Las vacunas de ARNm ofrecen mecanismos únicos de activación inmune que son bastante distintos de la respuesta a una infección viral. Estos mecanismos ayudan a explicar el perfil EA de estos productos basados en genes. La propia proteína S o spike es posiblemente la proteína más tóxica producida por el virus [180] .
La distribución de ARNm-LNP en una amplia gama de tejidos facilita la expresión de proteínas S en las superficies celulares de múltiples tipos de células [186] . Esto, a su vez, hace que los tejidos diana sean susceptibles al ataque mediado por células T y su posterior destrucción [109-111].
Particularmente vulnerables son tejidos como el músculo cardíaco y los tejidos neuronales [80,144] , ambos caracterizados por una capacidad de reparación y regeneración limitada. Además, los tejidos vasculares muestran ataques y ataques generalizados en todo el cuerpo [180] .
Nanopartículas lipídicas
Otros componentes de las vacunas contribuyen a efectos adversos complejos, poco conocidos e impredecibles. Estos componentes incluyen las nanopartículas lipídicas, en particular los lípidos catiónicos ionizables, el polietilenglicol (PEG) y diversas impurezas relacionadas con el proceso, como los plásmidos de ADN (analizados en la sección anterior) detectados recientemente por investigadores independientes [151,186 ] .
Se sabe que los lípidos catiónicos ionizables son tóxicos e inducen cascadas proapoptóticas y proinflamatorias [187]. Sin embargo, son un componente esencial de las vacunas y apoyan la síntesis más prolífica de abundante proteína S a partir del ARNm.
Hace más de tres décadas, los investigadores eran conscientes del potencial inusual de las nanopartículas de lípidos catiónicos sintéticos para formar agregados anfifílicos, alterar la membrana celular, inducir una respuesta inflamatoria y suprimir la función inmune [188] .
De hecho, existe un interés creciente en una nueva teoría emergente sobre la función inmune que pueda explicar la activación inmune en ausencia de infección manifiesta. La investigación fundamental realizada por Matzinger y su equipo de investigación de inmunogenética en el Instituto Nacional de Alergias y Enfermedades Infecciosas de EE. UU. ha sido pionera en el concepto de que las respuestas inmunes están impulsadas principalmente por la necesidad de defenderse contra lo que es peligroso en lugar de lo que es extraño [189] .
Se cree que el PEG, uno de los principales componentes adyuvantes de las vacunas de ARNm contra la COVID-19, es un factor importante en el shock anafiláctico inducido por la vacuna, un posible EAG inmediato bien establecido en personas susceptibles [190] .
La conjugación de PEG con las nanopartículas aumenta su inmunogenicidad, provocando la activación del complemento y una reacción aguda posterior que pone en peligro la vida [191] . Además, la combinación de PEG con la proteína S generada por la vacuna puede contribuir a trastornos hipofisarios de aparición repentina (apoplejía hipofisaria, con transición a hipofisitis aguda) que ocurren dentro de una semana después de la vacunación contra la COVID-19 [192,193] .
Taieb y sus colegas postulan que estos componentes de la vacuna podrían desencadenar una respuesta inflamatoria sistémica y problemas circulatorios asociados con la trombocitopenia trombótica inducida por la vacuna (TTVI), lo que resultaría en hemorragia o infarto hipofisario [192] .
Debido a que los síntomas de la apoplejía hipofisaria incluyen dolor de cabeza, vértigo, fiebre y mialgia (todas reacciones adversas comunes a las vacunas), los autores sospechan que la tasa real de trastornos hipofisarios posteriores a la vacuna es mucho más alta de lo que se ha registrado habitualmente.
En un estudio de Taiwán, la tasa de vértigo/mareos posvacunación pareció ser sustancialmente mayor entre los receptores de ARNm-1273 de Moderna en comparación con BNT162b2 de Pfizer, siendo el tiempo medio hasta la aparición del vértigo/mareos de 12 días y seis días, respectivamente. [194] .
La proteína S. (spike, o pico, o espiga)
Existe una gran y creciente literatura que describe los notables efectos tóxicos de la proteína S. (spike, o pico, o espiga) Su persistencia hasta 30 días después de la vacunación es motivo de gran preocupación [195] . La proteína S provoca una respuesta inflamatoria aguda mediante la activación de la vía de señalización NF-κB [196] .
Se ha demostrado que induce senescencia en las células endoteliales, y esto probablemente contribuye a los diversos EA relacionados con los vasos [197] . Es motivo de gran preocupación su potencial amiloidogénico, que puede desempeñar un papel importante en el amplio espectro de síntomas neurológicos [198] .
Después de la vacunación con ARNm de COVID-19, particularmente en adultos jóvenes, muchos estudios han encontrado mayores riesgos de miocarditis y arritmias cardíacas, que en algunos casos conducen a muerte súbita [57,60,140,149,199-202] .
La proteína S persiste en la circulación en adultos jóvenes que desarrollaron miocarditis después de la vacunación, pero no en individuos vacunados que no desarrollaron miocarditis [202] . El ARNm de la vacuna se aisló en el corazón humano en la autopsia hasta los 30 días [195] .
Se ha documentado la cardiotoxicidad directa de las vacunas de ARNm de Pfizer y Moderna en cardiomiocitos de rata 48 horas después de la inyección [80] . Se observaron proteína S e inflamación activa en la biopsia en individuos jóvenes hospitalizados con miocarditis por vacuna COVID-19 [203] . Cadegiani ha propuesto que un aumento de adrenalina es un factor precipitante importante para desencadenar un paro cardíaco en personas jóvenes que sufren un paro cardíaco en el contexto de una miocarditis clínica o subclínica [204] .
Un mecanismo cardiotóxico adicional puede implicar la regulación negativa de la expresión del receptor de la enzima convertidora de angiotensina 2 (ACE2) después de su unión a la proteína S. Esto puede provocar una expresión de ECA sin oposición, aumento de los niveles de angiotensina-2, inflamación y, en última instancia, apoptosis [201] . La angiotensina-2 elevada provoca inflamación y estrés oxidativo, que son factores importantes que contribuyen a la progresión de la miocardiopatía [205] .
La supresión inmune genérica que surge después de repetidas inyecciones de refuerzo plantea otra preocupación importante. El agotamiento de las células T se refiere a una condición inmunológica en la que las células T CD8+ muestran una pérdida progresiva de la producción de citocinas y de su potencial citotóxico [206] .
Cáncer
Se sabe que esta disfunción se produce en enfermedades como infecciones crónicas, cáncer y enfermedades autoinmunitarias [207,208] . Después de tres y cuatro dosis de la vacuna de ARNm contra la COVID-19, los investigadores observaron una respuesta disminuida de las células T contra la proteína S, asociada con un cambio de clase a IgG4 [209] .
La IgG4 no sólo no protege contra la infección, sino que bloquea activamente otras IgG para suprimir su acción, lo que lleva a la inmunosupresión [210] . En particular, se observó una respuesta reducida de las células T contra el SARS-CoV-2 un mes después de recibir la tercera y cuarta dosis [211] .
Este agotamiento de las células T tras múltiples inoculaciones de ARNm de COVID-19 podría ayudar a explicar los hallazgos de estudios que muestran tasas aumentadas de COVID-19 con una mayor frecuencia de refuerzos [99,100] .
Loacker et al. demostraron un aumento significativo en la expresión del ligando 1 de muerte programada (PD-L1) en la superficie de las células inmunes, medido dos días después de la segunda inyección de ARNm [212] . La unión de PD-L1 a PD-1 que se encuentra en las células cancerosas restringe la capacidad de las células T para eliminar las células cancerosas, facilitando así la evasión inmune del tumor [213] .
Los niveles elevados de PD-L1 en las células inmunitarias pueden predisponer a los pacientes con cáncer a resultados desfavorables, y los tratamientos dirigidos a la supresión de PD-L1 (bloqueo anti-PD1) están ganando terreno como opciones terapéuticas viables [214] . La rápida progresión de varios linfomas se ha relacionado con las vacunas de ARNm contra la COVID-19 [215-218] , y la elevación de PD-L1 puede desempeñar un papel en este contexto.
Otros factores relacionados con el potencial oncogénico y de hiperprogresión tumoral de las vacunas contra la COVID-19 se han convertido en un foco de investigación intensiva. Una revisión reciente de Angues y Bustos explora la capacidad hipotética de las vacunas COVID-19 para activar mecanismos biológicos que pueden crear colectivamente un microambiente propicio para la progresión del cáncer, ya sea acelerando la enfermedad macroscópica existente o despertando micrometástasis latentes [219] .
Estos mecanismos se relacionan principalmente con los efectos proinflamatorios de la proteína S y las LNP, las alteraciones en la capacidad del cuerpo para generar interferón tipo I y las alteraciones en la regulación de los microARN celulares causadas por la estructura alterada del ARNm dentro de las vacunas [219]. . Además, las vacunas de ARNm contra la COVID-19 provocan concentraciones elevadas de interleucina-17 (IL-17) y una regulación positiva de Th17, lo que altera la inmunidad Th1-Th2, intensifica la condición inflamatoria crónica de los pacientes con cáncer y amplifica aún más el crecimiento y la progresión del tumor [220 -222] .
Bases inmunológicas de la ineficacia de la vacuna
El propósito biomédico de la vacuna de ARNm contra la COVID-19 es básicamente doble: (1) aprovechar las defensas inmunitarias del cuerpo contra la infección por SARS-CoV-2 y (2) reducir el riesgo de enfermedad grave y sus consecuencias. Después de la inyección intramuscular con el producto de ARNm, el ARNm que codifica la proteína S se administra a través de LNP a células humanas que generan proteínas S y/o antígenos relacionados que se asemejan a los presentes en la superficie del coronavirus [25] . Luego, estos antígenos estimulan la producción de células T y B de memoria, y estas últimas producen posteriormente anticuerpos que se unen a epítopos específicos del virus. En consecuencia, si un individuo vacunado se encuentra con el SARS-CoV-2, su sistema inmunológico generará una respuesta inmune adaptativa a corto plazo, lo que en teoría reducirá la gravedad de la infección. Esta reducción de los síntomas de COVID-19 representa el beneficio clínico previsto de estos productos biológicos.
Sin embargo, la explicación anterior connota una desconexión inmunológica entre los efectos sistémicos de la vacuna COVID-19 y la protección que brinda naturalmente la inmunidad de la mucosa pulmonar.
Sobre el virus SARS-CoV-2
El SARS-CoV-2 es principalmente un virus que se transmite por el aire y ingresa al cuerpo humano a través del tracto respiratorio superior. Por lo tanto, el primer encuentro del sistema inmunológico con el patógeno generalmente ocurre en los conductos nasales y las amígdalas, induciendo la producción de anticuerpos IgA secretores en la saliva, el líquido nasal, las lágrimas y otras secreciones dentro de solo cuatro días de la exposición inicial [223] . Luego, el virus se limita con éxito al tracto respiratorio superior, lo que produce una infección asintomática o síntomas leves como tos o estornudos [223] .
La combinación de IgA secretora y células T activadas residentes en tejidos en áreas mucosas puede detener la infección por completo, en lugar de simplemente limitarla y frenar los síntomas de la enfermedad [224] . Además, según estudios del SARS-CoV (el presunto predecesor del SARS-CoV-2), la inmunidad celular que acompaña a la infección respiratoria inicial puede persistir hasta 17 años, incluso sin un componente humoral detectable [225] .
En una investigación en la que participaron participantes humanos que dieron su consentimiento para exponerse al virus de la gripe H1N1, la IgA mucosa preexistente proporcionó una mejor protección contra enfermedades graves que la IgG sistémica [226] , lo que sugiere que los títulos elevados de IgG circulantes podrían no correlacionarse con una protección sólida.
La mucosa pulmonar produce una serie de factores inmunes innatos (p. ej., complemento, proteasas, lactoferrina y péptidos antimicrobianos) que funcionan en sincronía con los anticuerpos secretores (sIgA y sIgM) para limitar la entrada de microbios y partículas extraños [227] . Durante la infección, los neutrófilos son los que responden predominantemente, liberando IL-8 y elastasa para mejorar el reclutamiento de células asesinas naturales, monocitos y eosinófilos de la circulación [227] .
Dado este contexto inmunológico, es razonable suponer que la inmunidad natural de las mucosas contra el SARS-CoV-2 y otros virus respiratorios normalmente puede conducir a una protección más completa y duradera en comparación con las respuestas inmunes sistémicas provocadas por las vacunas contra la COVID-19. Mientras que la infección por SARS-CoV-2 induce respuestas inmunitarias tanto mucosas como sistémicas, las vacunas de ARNm contra la COVID-19, tal como se administran actualmente, son ineficaces en términos de inducir inmunidad mucosa [227,228]. Los supuestos beneficios de la inmunidad inducida por vacunas se ven contrarrestados aún más por los riesgos de EAG discutidos anteriormente. No se puede dejar de enfatizar que estos riesgos afectan a toda la población, la gran mayoría de la cual tiene la capacidad de eliminar el SARS-CoV-2 sin sucumbir a una morbilidad grave o una muerte prematura.
Cuando los funcionarios federales decían que las vacunas de ARNm contra la COVID-19 eran “seguras y eficaces”, a menudo añadían que los productos tenían “una eficacia del 95% contra la infección”. No obstante, estudios posteriores demostraron que cualquier beneficio protector era de corta duración y que la inmunidad disminuía al cabo de sólo unos meses [229,230] .
Este efecto decreciente se vuelve más pronunciado con refuerzos sucesivos [231] . Hay una explicación lógica para este fenómeno. En primer lugar, debido a la evolución viral, las variantes del SARS-CoV-2 están mutando constantemente y se han producido numerosas mutaciones en la proteína S, el objetivo previsto para los anticuerpos neutralizantes.
Estas mutaciones, concentradas principalmente en las proximidades del dominio de unión al receptor (RBD), crean oportunidades constantes para la generación de nuevas variantes de escape (es decir, aquellas que evaden los anticuerpos neutralizantes), permitiendo así la evasión inmune en vacunaciones posteriores. En segundo lugar, la confrontación con nuevos antígenos en variantes de escape se asocia con el “pecado antigénico original”, la producción de anticuerpos de reacción cruzada que pueden no ser efectivos contra el nuevo antígeno o patógeno debido a la exposición previa a cepas predecesoras [ 232,233] .
Aunque la neutralización cruzada es un evento poco común, la reactividad cruzada en la unión de anticuerpos a la proteína S es común en el contexto de la infección por SARS-CoV-2 [234] . Además, otras investigaciones indican cierto grado de reactividad cruzada entre los coronavirus estacionales y el SARS-CoV-2 [235] .
Cuando el sistema inmunológico se ve arrastrado por variantes preexistentes del SARS-CoV-2, se produce un estrechamiento progresivo de la respuesta de anticuerpos a las variantes actuales que prevalecen. Este fenómeno de impronta se ha demostrado tanto con respecto a la infección natural como a la vacunación contra la COVID-19 [236] .
Un estudio piloto de 2021 encontró aumentos sólidos en las respuestas humorales en personas que no habían recibido previamente SARS-CoV-2 después de cada dosis de BNT162b2, mientras que las personas previamente infectadas mostraron fuertes respuestas humorales a la primera dosis de la inyección de ARNm pero respuestas silenciadas a la segunda dosis [237 ] .
La impronta inmune también se identificó como el factor subyacente que contribuyó a la disminución imprevista de la eficacia de las vacunas bivalentes contra la COVID-19, ya que “los sistemas inmunológicos de las personas inmunizadas con la vacuna bivalente, todas las cuales habían sido vacunadas previamente, estaban preparadas para responder a la cepa ancestral del SARS-CoV-2” [238] .
El fracaso de la vacuna COVID-19 se puede resumir de la siguiente manera
Al menos parte de la base inmunológica del fracaso de la vacuna COVID-19 se puede resumir de la siguiente manera. La proteína S del SARS-CoV-2 se une al receptor ACE2, creando un escenario en el que una fuerte presión inmune selectiva incita al gen S a mutar y desarrollar mecanismos de escape viral. Dado que la mayoría de las vacunas contra el SARS-CoV-2 están diseñadas utilizando la secuencia de la proteína S de la cepa inicial de Wuhan, estos mutantes de escape pueden evadir eficazmente las respuestas inmunitarias desencadenadas por estas vacunas.
Esto conduce a una eficacia reducida de todas las inyecciones posteriores con productos de ARNm que utilizan la secuencia de proteína S original [236,239,240] . Las inoculaciones periódicas de ARNm de COVID-19 pueden afectar negativamente a la ecología viral y fomentar la aparición continua de variantes de escape inmunológico (es decir, variantes que escapan de la presión selectiva a través de una mutación) que, en última instancia, hacen que las vacunas sean ineficaces.
Estos rendimientos decrecientes se observaron en los estudios de la Clínica Cleveland comentados anteriormente en este artículo [99,100] . Además, es probable que los refuerzos continuos causen disfunción inmune, disminuyendo así la protección antiviral y microbiana al tiempo que promueven enfermedades autoinmunes y una progresión acelerada del cáncer.
Sin embargo, la impronta inmune mencionada anteriormente podría limitar la capacidad de lograr una protección sólida y podría potencialmente facilitar la transmisión viral incluso con la vacunación en toda la población [239] . La evasión inmune por variantes nuevas o emergentes del SARS-CoV-2 en personas vacunadas contra variantes anteriores continuará indefinidamente, debido a la reactividad cruzada de los anticuerpos y la impronta inmune.
Entonces, de manera un tanto irónica, la capacidad de las vacunas de ARNm para perpetuar la aparición de nuevas variantes también tiende a generar la percepción entre el público general de que es necesaria una nueva ronda de refuerzos.
Esto, a su vez, establece un ciclo interminable de variantes de escape de las vacunas, un circuito de retroalimentación mediante el cual las medidas adoptadas para abordar el problema (más vacunas) contribuyen inadvertidamente a una ineficacia constante.
Las mutaciones en la proteína S viral proporcionan resistencia contra las respuestas de anticuerpos, y este proceso de selección subyace al fenómeno más amplio en el que están surgiendo nuevas variantes dominantes [241-243] . Las inoculaciones masivas de ARNm dan como resultado la selección natural de variantes del coronavirus del SARS altamente infecciosas que evaden el sistema inmunológico y que evitan con éxito la inmunidad inducida por la vacuna, lo que lleva a un aumento dramático en la prevalencia de estas variantes [108] .
En resumen, la aparición a gran escala de variantes dominantes fue una respuesta adaptativa a la presión de selección ejercida por la campaña de vacunación masiva, una respuesta aún mayor en individuos inmunodeprimidos [244] . Es importante destacar que los mutantes de escape inmunológico se desarrollan principalmente en individuos vacunados, no en los no vacunados [245,246] [241,242] .
Los mecanismos subyacentes a la disfunción inmune inducida por la vacuna (ver sección anterior) contribuyen aún más a la ineficacia. Los principales factores implicados en la ineficacia de la vacuna de ARNm contra la COVID-19 se resumen en la Figura 6 [247] .
Figura 6: Factores que contribuyen a la ineficacia de la vacuna de ARNm contra la COVID-19
Las vacunas contra la COVID-19 pueden perder eficacia en parte al inducir mutaciones del SARS-CoV-2 que conducen a nuevas variantes de escape inmunológico, lo que en última instancia limita la protección relacionada con la vacuna contra infecciones posteriores por coronavirus. Las inyecciones periódicas de ARNm de COVID-19 podrían provocar una amplia gama de mecanismos asociados con la disfunción inmune (principalmente debido a la subversión de la inmunidad innata), lo que resultaría en un mayor riesgo de cánceres, infecciones y trastornos autoinmunes. Crédito de imagen: Majumder y Razzaque, 2022 [247] ; Adaptado con permiso de los autores.
Discusión
En esta revisión, consideramos narrativas alternativas basadas en una evaluación directa de los datos disponibles y los estudios publicados. Al hacerlo, nuestra intención es fomentar la transparencia, la confianza y la toma de decisiones informadas, garantizando que se aborden las preguntas legítimas del público sobre la seguridad de la vacuna COVID-19.
Este enfoque no sólo contribuye al discurso actual en torno a la seguridad, sino que también allana el camino para mejorar las estrategias de salud pública en el futuro. Las implicaciones éticas de nuestra investigación se relacionan con las desigualdades epidemiológicas: mientras que el COVID-19 ha afectado principalmente a personas inmunodeprimidas, ancianos y personas con múltiples comorbilidades, las vacunas contra el COVID-19 tienen el potencial de afectar negativamente a personas de todas las edades, no solo a los ancianos frágiles. (el subgrupo más vulnerable), sino también personas jóvenes y relativamente sanas, la mayoría de las cuales tienen un riesgo casi nulo de sufrir consecuencias graves por COVID-19 [40] .
Cuando consideramos la probabilidad de que se produzcan EAG más frecuentes como resultado de interacciones entre la vacuna de ARNm de COVID-19 y las infecciones posteriores por SARS-CoV-2, es importante tener en cuenta que las infecciones de la subvariante Omicron que han sido dominantes desde principios de 2022 siguen un curso leve. y son invariablemente no letales [248] . Además, mientras que las infecciones por su propia naturaleza son involuntarias y accidentales, las inyecciones de ARNm son una opción con repercusiones potencialmente mortales.
El papel fundamental de los ensayos clínicos aleatorios controlados con placebo en la evaluación de la eficacia de las vacunas y otras intervenciones ha sido reconocido desde hace mucho tiempo dentro de las comunidades médica y de salud pública. El valor de los ensayos controlados bien diseñados se destacó en un informe del Grupo Ad Hoc de Expertos de la OMS sobre los próximos pasos para la evaluación de la vacuna COVID-19 publicado en enero de 2021 [249] .
Garantizar la credibilidad de los resultados observados, particularmente en el contexto de nuevos fármacos experimentales como los productos ARN-LNP modificados, implica un proceso meticuloso de asignación aleatoria de sujetos que cumplen varios criterios a grupos de intervención o de placebo.
La aleatorización no sólo establece una línea de base para la comparación sino que también facilita la atribución de cualquier diferencia en los resultados a la intervención misma. El control con placebo minimiza las posibilidades de sacar conclusiones erróneas sobre los efectos de la intervención. Aunque son invaluables como herramientas para detectar señales de seguridad, las bases de datos nacionales de vigilancia de la salud como VAERS y Yellow Card no cumplen con los estándares rigurosos establecidos por los ensayos controlados, lo que subraya aún más la necesidad de este enfoque para la evaluación de intervenciones médicas y de salud pública.
En retrospectiva, la revelación más preocupante de los ensayos de registro que condujeron a la EUA no fue la aparente exageración de una eficacia del 95%, sino más bien la indicación dentro de esos ensayos de que las vacunas conllevaban un riesgo significativo de EAG y muerte prematura, incluso entre un grupo relativamente pequeño. grupo sano de participantes.
Según los resultados del ensayo ampliado de Pfizer, nuestra estimación de años-persona arrojó un aumento del 31% en la mortalidad general entre los receptores de la vacuna, una clara tendencia en la dirección equivocada. Además, Fraiman et al. El análisis mostró un riesgo significativamente 36 % mayor de sufrir EAG (incluidas muertes y muchas afecciones potencialmente mortales) en el grupo de la vacuna del ensayo de Pfizer [50] .
El análisis de Michels et al. encontró un aumento de casi cuatro veces en los EAG cardiovasculares entre los sujetos del ensayo de Pfizer que recibieron la inyección de BNT162b2 en comparación con el placebo, un hecho nunca informado al público en el momento del lanzamiento en diciembre de 2020 [54] .
A pesar de estas graves preocupaciones, el producto Moderna ha mostrado efectos adversos, EA aún más frecuentes en comparación con su homólogo de Pfizer [116-120,135] . Ambos productos de ARNm se relacionaron con mayores riesgos de:
- accidente cerebrovascular isquémico,
- hemorragia cerebral,
- síndrome coronario agudo y
- otras afecciones que se sabe que reducen la esperanza de vida.
En este contexto, y, en particular, dado el alto número necesario a vacunar, NNV (~52.000 vacunas necesarias para prevenir una muerte por COVID-19), la razón detrás de la decisión de la FDA de declarar las vacunas de ARNm contra el COVID-19 “seguras y efectivas” para su distribución mundial después de sólo 20 semanas de observación parecen, en el mejor de los casos, dudosas.
De hecho, uno podría haber esperado que las vacunas de ARNm contra la COVID-19 se hubieran retirado del mercado tras la revelación del estudio Fraiman de un SAE en 800. La vacuna contra la gripe porcina de 1976 se retiró después de asociarse con el síndrome de Guillain-Barré a una tasa de aproximadamente uno entre 100.000 [250] . La vacuna contra rotavirus Rotashield se retiró tras informes de invaginación intestinal en uno o dos de cada 10.000 vacunados [251] . En el caso de las vacunas de ARNm, el equipo de Fraiman informó sus hallazgos preliminares tanto a la FDA como a la EMA. Los líderes de ambas agencias se reunieron con el equipo y brindaron comentarios que resultaron en un análisis revisado [50] . Sin embargo, los reguladores no tomaron ninguna medida posteriormente para advertir al público y restringir el acceso a las inyecciones.
En una línea similar, el análisis forense de Michels et al. expuso graves fallas en los métodos utilizados por la FDA, CDC y NIH en el desarrollo y evaluación de seguridad/eficacia de nuevos productos farmacéuticos [54] . Los autores concluyeron que “la decisión de aprobar la vacuna de ARNm BNT162b2 por parte de la FDA de EE. UU. y otras agencias reguladoras internacionales no fue una decisión informada basada en una evaluación imparcial, exhaustiva y transparente de la evidencia destinada a demostrar que esta vacuna cumplía con los criterios que era un medio ‘seguro y eficaz’ para controlar la pandemia de COVID-19″ [54] .
Pfizer tenía la responsabilidad ética de revelar de forma proactiva cualquier información nueva que pudiera afectar el proceso de toma de decisiones de la FDA. El hecho de no hacerlo era engañoso. Por el contrario, es razonable esperar que todos los participantes en la reunión del VRBPAC deberían haber sido conscientes de que los datos de mortalidad del ensayo del 14 de noviembre de 2020 estaban desactualizados. Sorprendentemente, ningún miembro del VRBPAC preguntó sobre las actualizaciones sobre los EA que ocurrieron entre los datos de la EUA. fecha de corte (14 de noviembre de 2020) y la fecha de la reunión (10 de diciembre de 2020) [54] .
Según un documento confidencial de 393 páginas solicitado por la EMA y publicado en agosto de 2022 [114] , en ese momento Pfizer había documentado aproximadamente 1,6 millones de EA que cubrían casi todos los sistemas de órganos [114, 252,253] .
Un tercio de los EA fueron clasificados como graves. Entre los muchos hallazgos se encuentran:
- 3.711 tumores,
- 264 categorías de trastornos vasculares (73.542 casos en total),
- más de 100.000 trastornos sanguíneos y linfáticos,
- 127.000 trastornos cardíacos (incluidas 270 categorías de daño cardíaco además de miocarditis y pericarditis),
- 77.000 trastornos psiquiátricos (incluidas psicosis). , depresión, suicidio y conductas suicidas) y
- cientos de categorías de trastornos neurológicos (696.508 casos en total), muchos de los cuales se consideran muy raros, una clara indicación de peligros graves.
Estas estimaciones ofrecen un sorprendente contraste con el documento oficial de la FDA titulado “Resumen de bases para la acción regulatoria” del 8 de noviembre de 2021, en el que el comité de revisión votó a favor de aprobar el producto de Pfizer-BioNTech [56] .
Toda la sección «Evaluación de riesgos-beneficios» del informe consta de una sola frase: «Considerando los datos presentados para respaldar la seguridad y eficacia de COMIRNATY que se han presentado y discutido en este documento, así como la gravedad del COVID-19, la El Comité de Revisión está de acuerdo en que el equilibrio riesgo/beneficio de COMIRNATY es favorable y respalda la aprobación para su uso en personas de 16 años de edad y mayores» [56] .
Los análisis internacionales sobre el exceso de mortalidad indican que las vacunas contra la COVID-19 pueden haber tenido consecuencias graves a gran escala. En un estudio cuidadoso de las vacunaciones masivas en toda Europa en 2021-2022, Aarstad y Kvitastein analizaron la posible interacción entre la cobertura de vacunación contra la COVID-19 en 2021 en toda Europa y el posterior exceso de mortalidad mensual hasta 2022 [254] .
Utilizando un conjunto de datos bien seleccionado que abarca 31 países, los autores aplicaron análisis ponderados por población y encontraron lo siguiente:
- (a) los aumentos en ACM durante el período inicial de nueve meses de 2022 se correlacionaron positivamente con los aumentos en la distribución de la vacunación en 2021; y
- (b) cada aumento de punto porcentual en la cobertura de vacunación en 2021 se asoció con un aumento del 0,105 % (IC del 95 %: 0,075-0,134) en la mortalidad mensual durante 2022.
17 millones de muertes por la inyección Covid
Un extenso análisis ecológico realizado en varios países realizado por Rancourt y sus colegas estimó que la COVID-19 la vacunación provocó un exceso de 17 millones de muertes, con una tasa global de letalidad por dosis de vacuna (vDFR) de 0,1257 ± 0,0035 %, o aproximadamente 0,1 % [251] . El informe de 180 páginas de Rancourt mostró que los lanzamientos de la vacuna COVID-19 fueron seguidos sincrónicamente por picos de mortalidad por todas las causas en muchos países [255,256] .
Si bien la mayoría de los vacunados tienen un riesgo extremadamente bajo de hospitalización y muerte por COVID-19, enfrentan un riesgo relativamente alto de sufrir EAG (un EAG por cada 800 inyecciones) después de la vacunación con ARNm de COVID-19 [50] .
El incomprensible programa de inmunización infantil
Esta inquietante dicotomía es más pronunciada en el contexto de los programas de inmunización infantil, aunque de hecho todas las edades menores de 40 años muestran IFR cercanas a cero. Pezzullo et al. IFR medianas calculadas de 0,0003% entre 0 y 19 años, 0,002% entre 20 y 29 años y 0,011% entre 30 y 39 años [40] .
Como se señaló anteriormente, las tasas de mortalidad entre los niños han sido extremadamente bajas incluso en países que mostraron un exceso de mortalidad durante la pandemia [43] , y permitir que los niños asistieran a la escuela libremente, como ocurrió en Suecia, resultó en cero muertes por COVID-19 entre este grupo de edad más joven. [44] .
Dado este riesgo tan bajo para los niños, debemos rechazar la política de administrar una vacuna experimental a estos grupos de edad. Contra la subvariante Omicron (entonces dominante), BA.5, las vacunas bivalentes de ARNm sólo se probaron en ocho ratones, nunca en humanos [257] .
Tras esta autorización, el vacunólogo Paul Offit, miembro del VRBPAC, escribió: «Deberíamos dejar de intentar prevenir todas las infecciones sintomáticas en jóvenes sanos reforzándolos con vacunas que contienen ARNm de cepas que podrían desaparecer unos meses más tarde» [ 237]
Según la mejor evidencia disponible, los riesgos potenciales de estas inoculaciones de ARNm han superado sistemáticamente los beneficios para las generaciones más jóvenes [258,259] La consideración de un cálculo de daño-recompensa pesa mucho sobre factores como los linfomas [215-218] y daño cardíaco [57-63] en estos grupos de edad más jóvenes.
Con respecto a los riesgos cardíacos, estudios prospectivos con evaluaciones cuidadosas del daño potencial al miocardio han encontrado que el riesgo de que los individuos jóvenes ambulatorios desarrollen miocarditis es aproximadamente del 2,5 % (2500 por 100 000 receptores) para ya sea BNT162b2 o ARNm-1273 después de la segunda o tercera inyección [260,261]
El riesgo de miocarditis del 2,2% en adolescentes después de la inyección de ARNm de COVID-19 es aproximadamente 37 veces el riesgo asociado con la infección por SARS-CoV-2 (0,06%) en ese mismo grupo de edad [260,262] . Dadas estas estimaciones, no existe ninguna razón válida para vacunar a este grupo de edad.
La Figura 7 muestra un gráfico basado en informes de miocarditis en VAERS Domestic Data al 29 de septiembre de 2023, que ofrece una indicación de la gravedad de esta situación. Todos los informes de miocarditis se representan según la edad y la dosis (dosis 1 (rosa), dosis 2 (verde) y dosis 3 (azul)). Después de la segunda dosis, se quintuplicó el número de casos de miocarditis entre los varones de 15 años. Independientemente de la edad, los casos de miocarditis fueron más frecuentes después de la segunda dosis, lo que sugiere un vínculo causal entre la miocarditis y las inoculaciones de ARNm de COVID-19.
Los datos representados en el gráfico se ven reforzados aún más por un análisis de desproporcionalidad reciente de los datos del VAERS que muestra una asociación estadísticamente significativa entre los eventos cardiovasculares y las vacunas contra la COVID-19 [263] .
Figura 7: Informes de miocarditis en datos nacionales del VAERS al 29 de septiembre de 2023, representados por edad y dosis
Dosis 1: rosa, Dosis 2: verde, Dosis 3: azul
Los datos indican un aumento de cinco veces en los casos de miocarditis después de la segunda inyección de COVID-19 en hombres de 15 años y, en general, las segundas dosis se relacionaron con más casos de miocarditis [263] .
VAERS: Sistema de notificación de reacciones adversas a las vacunas; COVID-19: enfermedad por coronavirus 2019. Crédito de la imagen: Jessica Rose (coautora).
Aumento en la mortalidad
Los impactos adversos en los segmentos más jóvenes de la población también se reflejaron en los informes extraordinarios de las compañías de seguros de vida de EE. UU. para la segunda mitad de 2021. Según los datos de la encuesta Group Life, durante el tercer y cuarto trimestre de 2021, la población general de EE. UU. experimentó un 32 % de aumento en la mortalidad en comparación con el 40 % en el recuento de Vida Grupal (8 % de diferencia) [264] .
Los titulares de pólizas de vida colectiva son adultos jóvenes, bien empleados y generalmente sanos, que anteriormente morían a aproximadamente un tercio de la tasa de la población de EE. UU., según un análisis de la Sociedad de Actuarios (SOA) de 2016 [ 264] . Por tanto, la mortalidad observada entre la cohorte de Vida Grupal en 2021 representa una inversión de tendencias anteriores.
El exceso de muertes en los datos de Group Life se determinó comparando las tasas de mortalidad promedio en los datos de Group Life de la línea de base de 2017-2019, ajustadas por estacionalidad y combinadas con datos de los CDC. Entre el segundo y el tercer trimestre, el comienzo del segundo lanzamiento de vacunación en EE. UU., el análisis SOA mostró un aumento del 36% en el exceso de mortalidad entre las edades de 25 a 34 años, un aumento del 50% para el grupo de edad de 35 a 44 años y un aumento del 52% para el grupo de edad de 35 a 44 años. Grupo de edad de 45 a 54 años [264].
Estas cifras representan aumentos colosales y sin precedentes en el exceso de mortalidad para el rango de edad de 25 a 54 años, con un aumento promedio del 46% (aunque el promedio de los porcentajes tiende a enmascarar la gravedad del impacto en cohortes de edad específicas) [264] .
Como se mencionó anteriormente, se trataba de adultos más jóvenes y más sanos y, por lo tanto, es ilógico sugerir que la COVID-19 tuvo alguna influencia sustancial en la mortalidad, especialmente teniendo en cuenta la IFR extremadamente baja asociada con los grupos de edad más jóvenes.
De hecho, según el informe más reciente de Group Life, el exceso de mortalidad en cada uno de los grupos de edad se aplicó únicamente a las muertes “no relacionadas con la COVID-19”; no hubo un exceso de mortalidad atribuido directamente a la COVID-19 [264] .
Es importante destacar que el aumento del exceso de mortalidad entre el grupo de edad de 25 a 54 años también se asoció temporalmente con la introducción de mandatos de vacunación en Estados Unidos entre el personal militar y hospitalario desde el verano hasta el otoño de 2021 [265] .
Desde marzo de 2021 hasta febrero de 2022, hubo aproximadamente 61.000 muertes adicionales entre estadounidenses menores de 40 años, el equivalente a todas las vidas de militares estadounidenses perdidas durante la Guerra de Vietnam [266] . Esta tragedia nunca fue reportada por ninguno de los principales medios de comunicación estadounidenses.
Las repercusiones para la salud de estos riesgos cardíacos relacionados con las vacunas se han manifestado en el escenario público desde 2021. Antes de ese año, el número promedio anual de paros cardíacos en el campo para atletas profesionales en Europa era 29; este número ha aumentado a 283 por año, un aumento de aproximadamente 10 veces, según la tasa anualizada de paros cardíacos tras el inicio del programa de vacunación para jugadores activos de 35 años [267] .
Dos tercios de los jugadores no fueron resucitados [267] . Investigaciones recientes sugieren que puede haber una base genética (variantes de SCN5A) para las muertes súbitas que ocurren dentro de los siete días posteriores a la vacunación contra la COVID-19, independientemente del tipo de vacuna, la cantidad de dosis y las enfermedades subyacentes [268] .
Al identificar los factores de riesgo genéticos (p. ej., polimorfismos de MTHFR) antes de recibir la vacuna contra la COVID-19, se pueden abordar de forma más eficaz los riesgos de tromboembolismo venoso y otras lesiones vasculares relacionadas con la vacuna [269,270] .
El Consejo Mundial para la Salud ha exigido una moratoria inmediata sobre estos nuevos productos [164] , debido en parte al problema de la amplia contaminación del ADN. Como medida de precaución, estamos de acuerdo con las recomendaciones para la eliminación inmediata de las vacunas contra el COVID-19 del calendario de vacunación infantil junto con la suspensión de los refuerzos y una investigación completa de la mala conducta de la industria de las vacunas y de las agencias reguladoras con respecto a las evaluaciones de seguridad y los datos del juicios fundacionales.
No es ético ni escrupuloso administrar una vacuna experimental a un niño que tiene un riesgo casi nulo de morir por COVID-19 (IFR, 0,0003 %) pero un riesgo bien establecido del 2,2 % de sufrir daño cardíaco permanente según los mejores datos prospectivos. disponible. Los riesgos adicionales para estos jóvenes sanos incluyen convulsiones, cánceres, trastornos autoinmunes y muchas otras afecciones que les roban la vida después de la vacunación.
Otro aspecto relevante de esta tragedia que se está desarrollando es la historia no contada de la reducción de la esperanza de vida. En muchos países desarrollados, las principales causas de la reducción de la esperanza de vida (tabaquismo, obesidad, sobredosis de opioides, homicidios, suicidios y mortalidad infantil) son las principales causas de muerte prematura a escala poblacional [271] .
Sin embargo, también está claro que varios riesgos asociados con las vacunas contra la COVID-19 pueden traducirse en una muerte prematura a largo plazo. Entre los pobres, la neumonía bacteriana no tratada es una de las principales causas de reducción de la esperanza de vida y puede verse agravada aún más por la vacunación contra la COVID-19 [272] . Los accidentes cerebrovasculares y la miocarditis asociados con las vacunas COVID-19 pueden causar muerte prematura años después del evento inicial.
Un estudio longitudinal de pacientes con accidente cerebrovascular encontró que menos de 28 días después de un accidente cerebrovascular, el riesgo de muerte era del 28%; esto aumentó al 41% al año y al 60% a los cinco años [273] .
Los problemas cardíacos y de coagulación no diagnosticados pueden persistir asintomáticamente durante años. Múltiples estudios de autopsia proporcionan evidencia definitiva de daños graves en el corazón posteriores a la inyección, incluidos paro cardíaco repentino y muerte súbita, todos ellos asociados con las vacunas de ARNm contra la COVID-19 [140] .
Sin embargo, en los varones adolescentes, la miocarditis puede tener una apariencia clínica leve pero provocar fibrosis cardíaca (cicatrización) grave, con daño permanente al músculo cardíaco [274,275] . Dicho daño puede eventualmente provocar insuficiencia cardíaca congestiva y la muerte muchos años después [276] .
Los ensayos de registro fueron insuficientes para detectar estos peligros a largo plazo, la mayoría de los cuales sólo se hicieron evidentes después de dos años y medio de observación de seguimiento y más de mil millones de inyecciones de ARNm.
COVID prolongado
También es pertinente para esta discusión el fenómeno médicamente intratable conocido como “COVID prolongado”. Después de la fase aguda de una infección por SARS-CoV-2, algunas personas experimentan síntomas persistentes como:
- fatiga,
- confusión mental,
- dolor muscular,
- dificultades para respirar,
- hormigueo en las extremidades y
- malestar en el pecho y la garganta durante períodos prolongados.
Esto se conoce como síndrome posagudo de COVID-19 (PACS), una afección multifactorial y multisistémica que abarca:
- disautonomía,
- encefalitis,
- síndrome de fatiga crónica,
- disfunción inmune,
- anomalías cardiovasculares y de coagulación, e
- impactos en múltiples sistemas orgánicos [277] .
Se pueden definir tipos específicos de PACS según la presentación de los síntomas [278,279]. No es sorprendente que, debido al denominador común entre la infección y la inoculación de ARNm (la proteína S), la vacunación contra la COVID-19 produzca síntomas a largo plazo que comparten muchas características con la PACS [280,281] .
La afección puede desencadenarse por una reacción inmune exagerada a la proteína S generada por la vacuna [282] , que se ha demostrado que persiste al menos seis meses después de la inyección [283] . Se ha encontrado proteína S asociada a la vacuna en pacientes con PACS [284,285] . Diexer et al. observaron que el 70 % de los casos de PACS se produjeron en personas que habían recibido la vacunación completa contra la COVID-19, lo que indica que las inyecciones pueden exacerbar la PACS en la mayoría de los casos [286] .
Menor riesgo en personas no vacunadas
El grupo con menor riesgo de PACS fue el de las personas no vacunadas que contrajeron Omicron como su primera infección. Por lo tanto, contrariamente a las creencias populares y los mensajes de los medios, las personas vacunadas pueden experimentar resultados a largo plazo más graves de COVID-19 en comparación con las no vacunadas.
Se han introducido varios síndromes nuevos asociados con las inoculaciones de ARNm que abarcan condiciones muy similares a las PACS:
- síndrome de vacunación post-COVID-19 (PCVS),
- síndrome de vacunación agudo contra COVID-19 (ACVS) y
- síndrome de vacunación posagudo contra COVID-19 ( PACVS) [287] .
Se ha propuesto que la próxima versión de los códigos de diagnóstico de la Clasificación Internacional de Enfermedades (CIE) incorpore un nuevo código específico para la «condición posterior a la vacunación COVID-19, no especificada» [287] .
Además de abordar las complejas condiciones relacionadas con la vacuna COVID-19 mencionadas anteriormente, es nuestro imperativo bioético considerar cuidadosamente otras consecuencias de las dosis de refuerzo continuas y repetidas. En términos generales, estas consecuencias se pueden dividir en dos categorías: (1) rendimientos decrecientes después de las inyecciones debido a diversos efectos inmunosupresores junto con presiones selectivas extrínsecas que en última instancia aceleran la evolución y la resistencia viral; y (2) EAG, en particular el sufrimiento profundo y la muerte prematura que resultan principalmente de trastornos autoinmunes, neurológicos, malignos y cardiovasculares.
La consideración de los posibles impactos inmunológicos de las dosis de refuerzo repetidas en la evolución y la resistencia viral junto con los riesgos de muerte prematura y otros EAG es crucial para una evaluación integral de riesgos y beneficios de las vacunas de ARNm contra la COVID-19, garantizando decisiones de salud pública informadas.
Según la investigación presentada en esta revisión narrativa, la campaña mundial de vacunación contra la COVID-19 debe considerarse un grave error médico. Los errores médicos representan una amenaza sustancial para la seguridad personal y pública y han constituido durante mucho tiempo una de las principales causas de muerte [288-290] .
Se tomaron decisiones políticas y regulatorias equivocadas en los niveles más altos y pueden haber estado fuertemente influenciadas por incentivos financieros.
Las agencias gubernamentales deberían haber considerado todas las alternativas de tratamiento razonables y desviar las presiones de la industria médico-farmacéutica en lugar de permitir la distribución de inyecciones genéticas experimentales a toda la población.
Si la FDA hubiera reconocido el aumento de casi cuatro veces en los EAG cardíacos (incluidas las muertes) identificados posteriormente en el grupo de vacunas del ensayo de Pfizer [54] , es dudoso que la EUA hubiera ocurrido en diciembre de 2020.
Una investigación en profundidad de la COVID -19 ahora se necesita con urgencia el perfil de seguridad a largo plazo de la vacuna. A pesar de las muchas revelaciones sorprendentes discutidas en esta revisión, la mayoría de los países desarrollados continúan abogando por la adopción continua de refuerzos de ARNm de COVID-19 para toda la población elegible.
Las agencias federales estadounidenses todavía enfatizan la seguridad de las vacunas para reducir las enfermedades graves y las muertes causadas por el coronavirus, a pesar de la ausencia de ensayos aleatorios, doble ciego y controlados con placebo que respalden tales afirmaciones. Esto refleja una desconcertante desconexión entre el pensamiento científico basado en evidencia y las políticas de salud pública.
Conclusiones
La evaluación cuidadosa y objetiva de la seguridad de los productos de ARNm de COVID-19 es crucial para mantener los estándares éticos y la toma de decisiones basada en evidencia. Nuestra revisión narrativa sobre los ensayos de registro y las consecuencias de la EUA ofrece información basada en evidencia sobre cómo estas inyecciones genéticas pudieron ingresar al mercado.
En el contexto de los dos ensayos fundamentales, la seguridad nunca se evaluó de manera acorde con los estándares científicos previamente establecidos, ni para las vacunas ni para los inyecciones de terapia génica, GTP, la clasificación más precisa de estos productos.
Muchos hallazgos clave de los ensayos se informaron erróneamente o se omitieron por completo en los informes publicados. La FDA y los fabricantes de vacunas pasaron por alto los protocolos habituales de pruebas de seguridad y los requisitos toxicológicos, y la terminación prematura de ambos ensayos evitó cualquier evaluación imparcial de posibles EAG debido a un plazo insuficiente para una evaluación adecuada del ensayo.
Sólo después de la EUA se hicieron evidentes las graves consecuencias biológicas de apresurar los ensayos, con numerosos EAG cardiovasculares, neurológicos, reproductivos, hematológicos, malignos y autoinmunes identificados y publicados en la literatura médica revisada por pares.
Además, las vacunas de ARNm contra la COVID-19 producidas mediante el Proceso 1 y evaluadas en los ensayos no eran los mismos productos que finalmente se distribuyeron en todo el mundo; Todos los productos de ARNm de COVID-19 lanzados al público se produjeron mediante el Proceso 2 y se ha demostrado que tienen distintos grados de contaminación del ADN.
El hecho de que las autoridades reguladoras no hayan revelado hasta ahora las impurezas relacionadas con el proceso (por ejemplo, SV40) ha aumentado aún más las preocupaciones con respecto a la supervisión del control de calidad y seguridad de los procesos de fabricación de vacunas de ARNm.
Desde principios de 2021, el exceso de muertes, eventos cardíacos, accidentes cerebrovasculares y otros EAG a menudo se han atribuido erróneamente a la COVID-19 en lugar de a las vacunas de ARNm contra la COVID-19.
La atribución errónea de EAG al COVID-19 a menudo puede deberse a la amplificación de los efectos adversos cuando las inyecciones de ARNm van seguidas de una infección subvariante del SARS-CoV-2. Las lesiones causadas por los productos de ARNm se superponen tanto con la PACS como con la enfermedad aguda grave de COVID-19, lo que a menudo oscurece las contribuciones etiológicas de las vacunas.
Múltiples inyecciones de refuerzo parecen causar disfunción inmune, contribuyendo así, paradójicamente, a una mayor susceptibilidad a las infecciones por COVID-19 con dosis sucesivas. Para la gran mayoría de los adultos menores de 50 años, los beneficios percibidos de los refuerzos de ARNm se ven ampliamente superados por sus posibles daños incapacitantes y potencialmente mortales.
Los daños potenciales a los adultos mayores también parecen ser excesivos. Dados los EAG bien documentados y la inaceptable relación daño-recompensa, instamos a los gobiernos a respaldar y hacer cumplir una moratoria global sobre estos productos de ARNm modificado hasta que se respondan todas las preguntas relevantes relacionadas con la causalidad, el ADN residual y la producción aberrante de proteínas.
Colabore por favor con nosotros para que podamos incluir mas información y llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
Via PAYPAL: Euros o dólares click aqui
ARGENTINA 10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Solicite nuestro CBU contactenos
Referencias
- Polack FP, Thomas SJ, Kitchin N, et al.: Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med. 2020, 383:2603-15. 10.1056/NEJMoa2034577
- Baden LR, El Sahly HM, Essink B, et al.: Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med. 2021, 384:403-16. 10.1056/NEJMoa2035389
- Singh JA, Kochhar S, Wolff J: Placebo use and unblinding in COVID-19 vaccine trials: recommendations of a WHO Expert Working Group. Nat Med. 2021, 27:569-70. 10.1038/s41591-021-01299-5
- Kaplan KM, Marder DC, Cochi SL, et al.: Mumps in the workplace. Further evidence of the changing epidemiology of a childhood vaccine-preventable disease. JAMA. 1988, 260:1434-8. 10.1001/jama.260.10.1434
- Vaccine Research & Development: How can COVID-19 vaccine development be done quickly and safely?. (2013). Accessed: October 16, 2023: https://coronavirus.jhu.edu/vaccines/timeline.
- New York State Department of Health: The science behind vaccine research and testing. (2023). Accessed: October 16, 2023: https://www.health.ny.gov/prevention/immunization/vaccine_safety/science.htm.
- Did National Security Imperatives Compromise COVID-19 Vaccine Safety?. (2022). Accessed: September 30, 2023: https://www.trialsitenews.com/a/did-national-security-imperatives-compromise-covid-19-vaccine-safety-adfea242.
- America’s Long, Expensive, and Deadly Love Affair with mRNA. (2023). Accessed: March 15, 2023: https://petermcculloughmd.substack.com/p/americas-long-expensive-and-deadly.
- Wagner R, Hildt E, Grabski E, et al.: Accelerated development of COVID-19 vaccines: technology platforms, benefits, and associated risks. Vaccines (Basel). 2021, 9:747. 10.3390/vaccines9070747
- Conklin L, Hviid A, Orenstein WA, Pollard AJ, Wharton M, Zuber P: Vaccine safety issues at the turn of the 21st century. BMJ Glob Health. 2021, 6:10.1136/bmjgh-2020-004898
- Alqatari S, Ismail M, Hasan M, et al.: Emergence of post COVID-19 vaccine autoimmune diseases: a single center study. Infect Drug Resist. 2023, 16:1263-78. 10.2147/IDR.S394602
- Immunization Safety Review: SV40 Contamination of Polio Vaccine and Cancer. Stratton K, Almario DA, McCormick MC (ed): National Academies Press (US), Washington DC; 2002. https://www.ncbi.nlm.nih.gov/books/NBK221112/.
- Buonocore SM, van der Most RG: Narcolepsy and H1N1 influenza immunology a decade later: what have we learned?. Front Immunol. 2022, 13:902840. 10.3389/fimmu.2022.902840
- Greenstreet RL: Estimation of the probability that Guillain-Barre syndrome was caused by the swine flu vaccine: US experience (1976-77). Med Sci Law. 1984, 24:61-7. 10.1177/002580248402400110
- Doshi P: Covid-19 vaccines: in the rush for regulatory approval, do we need more data?. BMJ. 2021, 373:n1244. 10.1136/bmj.n1244
- Thorp HH: A dangerous rush for vaccines. Science. 2020, 369:885. 10.1126/science.abe3147
- Torreele E: The rush to create a COVID-19 vaccine may do more harm than good. BMJ. 2020, 370:m3209. 10.1136/bmj.m3209
- Lalani HS, Nagar S, Sarpatwari A, Barenie RE, Avorn J, Rome BN, Kesselheim AS: US public investment in development of mRNA covid-19 vaccines: retrospective cohort study. BMJ. 2023, 380:e073747. 10.1136/bmj-2022-073747
- Nayak RK, Lee CC, Avorn J, Kesselheim AS: Public-sector contributions to novel biologic drugs. JAMA Intern Med. 2021, 181:1522-5. 10.1001/jamainternmed.2021.3720
- BARDA Strategic Plan, 2022-2026: Fortifying the Nation’s Health Security. Biomedical Advanced Research and Development Authority, Washington, D.C.; 2022. https://www.medicalcountermeasures.gov/media/38717/barda-strategic-plan-2022-2026.pdf.
- Banoun H: mRNA: vaccine or gene therapy? he safety regulatory issues. Int J Mol Sci. 2023, 24:10514. 10.3390/ijms241310514
- Guerriaud M, Kohli E: RNA-based drugs and regulation: toward a necessary evolution of the definitions issued from the European Union legislation. Front Med (Lausanne). 2022, 9:1012497. 10.3389/fmed.2022.1012497
- Van Lint S, Renmans D, Broos K, et al.: The ReNAissanCe of mRNA-based cancer therapy. Expert Rev Vaccines. 2015, 14:235-51. 10.1586/14760584.2015.957685
- Cosentino M, Marino F: Understanding the pharmacology of COVID-19 mRNA vaccines: playing dice with the spike?. Int J Mol Sci. 2022, 23:10881. 10.3390/ijms231810881
- Trougakos IP, Terpos E, Alexopoulos H, et al.: Adverse effects of COVID-19 mRNA vaccines: the spike hypothesis. Trends Mol Med. 2022, 28:542-54. 10.1016/j.molmed.2022.04.007
- Seneff S, Nigh G, Kyriakopoulos AM, McCullough PA: Innate immune suppression by SARS-CoV-2 mRNA vaccinations: the role of G-quadruplexes, exosomes, and microRNAs. Food Chem Toxicol. 2022, 164:113008. 10.1016/j.fct.2022.113008
- Çalık Ş, Demir İ, Uzeken E, Tosun S, Özkan Özdemir H, Coşkuner SA, Demir S: Investigation of the relationship between the immune responses due to COVID-19 vaccine and peripheral bloodlymphocyte subtypes of healthcare workers [Article in Turkish]. Mikrobiyol Bul. 2022, 56:729-39.
- Heinz FX, Stiasny K: Distinguishing features of current COVID-19 vaccines: knowns and unknowns of antigen presentation and modes of action. NPJ Vaccines. 2021, 6:104. 10.1038/s41541-021-00369-6
- Shir-Raz Y, Elisha E, Martin B, Ronel N, Guetzkow J: Censorship and suppression of Covid-19 heterodoxy: tactics and counter-tactics. Minerva. 2022, 1-27. 10.1007/s11024-022-09479-4
- We’re Fighting the Covid Censors. (2023). Accessed: January 3, 2024: https://thespectator.com/topic/were-fighting-the-covid-censors-censorship/.
- Doshi P: Will COVID-19 vaccines save lives? Current trials aren’t designed to tell us. BMJ. 2020, 371:m4037. 10.1136/bmj.m4037
- Pfizer: COVID-19 vaccine maker pledge. (2020). Accessed: November 24, 2023: https://www.pfizer.com/news/announcements/covid-19-vaccine-maker-pledge.
- Meo SA, Bukhari IA, Akram J, Meo AS, Klonoff DC: COVID-19 vaccines: comparison of biological, pharmacological characteristics and adverse effects of Pfizer/BioNTech and Moderna vaccines. Eur Rev Med Pharmacol Sci. 2021, 25:1663-9. 10.26355/eurrev_202102_24877
- ‘Absolutely remarkable’: No one who got Moderna’s vaccine in trial developed severe COVID-19. (2020). Accessed: October 16, 2023: https://www.science.org/content/article/absolutely-remarkable-no-one-who-got-modernas-vaccine-trial-developed-severe-….
- Thomas SJ, Moreira ED Jr, Kitchin N, et al.: Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine through 6 months. N Engl J Med. 2021, 385:1761-73. 10.1056/NEJMoa2110345
- Plausibility But Not Science Has Dominated Public Discussions of the Covid Pandemic. (2022). Accessed: October 16, 2023: https://brownstone.org/articles/plausibility-but-not-science-has-dominated-public-discussions-of-the-covid-pandemic/.
- Peter Doshi: Pfizer and Moderna’s “95% effective” vaccines—we need more details and the raw data. (2021). Accessed: October 16, 2023: https://blogs.bmj.com/bmj/2021/01/04/peter-doshi-pfizer-and-modernas-95-effective-vaccines-we-need-more-details-and-t….
- Interim Report – Adolescent 6-Month Update: A Phase 1/2/3, Placebo-Controlled, Randomized, Observer-Blind, Dose-Finding Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of SARS-CoV-2 RNA Vaccine Candidates Against COVID-19 in Healthy Individuals. Pfizer Inc, New York, NY; 2021. 10.17226/10534https://data.parliament.uk/DepositedPapers/Files/DEP2023-0138/Clinical_Study_Report_Part_2.pdf.
- Moderna Clinical study protocol: A phase 3, randomized, stratified, observer-blind, placebo-controlled study to evaluate the efficacy, safety, and immunogenicity of mRNA-1273 SARS-CoV-2 vaccine in adults aged 18 years and older. Protocol No. mRNA-1273-P301. (2020). (2020). Accessed: December 20, 2023: https://www.modernatx.com/sites/default/files/mRNA-1273-P301-Protocol.pdf .
- Pezzullo AM, Axfors C, Contopoulos-Ioannidis DG, Apostolatos A, Ioannidis JP: Age-stratified infection fatality rate of COVID-19 in the non-elderly population. Environ Res. 2023, 216:114655. 10.1016/j.envres.2022.114655
- Chenchula S, Vidyasagar K, Pathan S, et al.: Global prevalence and effect of comorbidities and smoking status on severity and mortality of COVID-19 in association with age and gender: a systematic review, meta-analysis and meta-regression. Sci Rep. 2023, 13:6415. 10.1038/s41598-023-33314-9
- Thornley S, Morris AJ, Sundborn G, Bailey S: How fatal is COVID-19 compared with seasonal influenza? The devil is in the detail [Rapid Response]. BMJ. 2020,
- Islam N, Shkolnikov VM, Acosta RJ, et al.: Excess deaths associated with covid-19 pandemic in 2020: age and sex disaggregated time series analysis in 29 high income countries. BMJ. 2021, 373:n1137. 10.1136/bmj.n1137
- Baral S, Chandler R, Prieto RG, Gupta S, Mishra S, Kulldorff M: Leveraging epidemiological principles to evaluate Sweden’s COVID-19 response. Ann Epidemiol. 2021, 54:21-6. 10.1016/j.annepidem.2020.11.005
- Barbari A: COVID-19 vaccine concerns: fact or fiction?. Exp Clin Transplant. 2021, 19:627-34. 10.6002/ect.2021.0056
- Thames AH, Wolniak KL, Stupp SI, Jewett MC: Principles learned from the international race to develop a safe and effective COVID-19 vaccine. ACS Cent Sci. 2020, 6:1341-7. 10.1021/acscentsci.0c00644
- Montano D: Frequency and associations of adverse reactions of COVID-19 vaccines reported to pharmacovigilance systems in the European Union and the United States. Front Public Health. 2021, 9:756633. 10.3389/fpubh.2021.756633
- Yan MM, Zhao H, Li ZR, et al.: Serious adverse reaction associated with the COVID-19 vaccines of BNT162b2, Ad26.COV2.S, and mRNA-1273: gaining insight through the VAERS. Front Pharmacol. 2022, 13:921760. 10.3389/fphar.2022.921760
- Classen B: US COVID-19 vaccines proven to cause more harm than good based on pivotal clinical trial data analyzed using the proper scientific endpoint, “all cause severe morbidity”. Trends Int Med. 2021, 1:1-6.
- Fraiman J, Erviti J, Jones M, Greenland S, Whelan P, Kaplan RM, Doshi P: Serious adverse events of special interest following mRNA COVID-19 vaccination in randomized trials in adults. Vaccine. 2022, 40:5798-805. 10.1016/j.vaccine.2022.08.036
- Mörl F, Günther M, Rockenfeller R: Is the harm-to-benefit ratio a key criterion in vaccine approval?. Front Med (Lausanne). 2022, 9:879120. 10.3389/fmed.2022.879120
- Benn CS, Schaltz-Buchholzer F, Nielsen S, et al.: Randomised clinical trials of COVID-19 vaccines: do adenovirus-vector vaccines have beneficial non-specific effects?. Lancet preprint. April. 5:2022. 10.2139/ssrn.4072489
- Have People Been Given the Wrong Vaccine?. (2022). Accessed: October 16, 2023: https://brownstone.org/articles/have-people-been-given-the-wrong-vaccine/.
- Michels CA, Perrier D, Kunadhasan J, et al.: Forensic analysis of the 38 subject deaths in the 6- month interim report of the Pfizer/BioNTech BNT162b2 mRNA vaccine clinical trial. IJVTPR. 2023, 3:973-1009. 10.56098/ijvtpr.v3i1.85
- Vaccines and Related Biological Products Advisory Committee Meeting, September 17, 2021. FDA Briefing Document: Application for Licensure of a Booster Dose for COMIRNATY (COVID-19 Vaccine, mRNA). US Food and Drug Administration, White Oak, MD; 2021. https://www.fda.gov/media/152176/download.
- Summary Basis for Regulatory Action. Review Committee’s Recommendation to Approve Pfizer-BioNTech product, COMIRNATY (COVID-19 Vaccine, mRNA). US Food and Drug Administration, White Oak, MD; 2021. https://www.fda.gov/media/151733/download.
- Oster ME, Shay DK, Su JR, et al.: Myocarditis cases reported after mRNA-based COVID-19 vaccination in the US from December 2020 to August 2021. JAMA. 2022, 327:331-40. 10.1001/jama.2021.24110
- Rees AR: Viruses, vaccines and cardiovascular effects. Br J Cardiol. 2022, 29:16. 10.5837/bjc.2022.016
- Almas T, Rehman S, Mansour E, et al.: Epidemiology, clinical ramifications, and cellular pathogenesis of COVID-19 mRNA-vaccination-induced adverse cardiovascular outcomes: a state-of-the-heart review. Biomed Pharmacother. 2022, 149:112843. 10.1016/j.biopha.2022.112843
- Gao J, Feng L, Li Y, et al.: A systematic review and meta-analysis of the association between SARS-CoV-2 vaccination and myocarditis or pericarditis. Am J Prev Med. 2023, 64:275-84. 10.1016/j.amepre.2022.09.002
- Yasmin F, Najeeb H, Naeem U, et al.: Adverse events following COVID-19 mRNA vaccines: a systematic review of cardiovascular complication, thrombosis, and thrombocytopenia. Immun Inflamm Dis. 2023, 11:e807. 10.1002/iid3.807
- Shiravi AA, Ardekani A, Sheikhbahaei E, Heshmat-Ghahdarijani K: Cardiovascular complications of SARS-CoV-2 vaccines: an overview. Cardiol Ther. 2022, 11:13-21. 10.1007/s40119-021-00248-0
- Jeet Kaur R, Dutta S, Charan J, et al.: Cardiovascular adverse events reported from COVID-19 vaccines: a study based on WHO database. Int J Gen Med. 2021, 14:3909-27. 10.2147/IJGM.S324349
- Did the Pfizer Trial Show the Vaccine Increases Heart Disease Deaths?. (2022). Accessed: October 16, 2023: https://chrismasterjohnphd.substack.com/p/did-the-pfizer-trial-show-the-vaccine.
- Brown RB: Outcome reporting bias in COVID-19 mRNA vaccine clinical trials. Medicina (Kaunas). 2021, 57:199. 10.3390/medicina57030199
- Olliaro P, Torreele E, Vaillant M: COVID-19 vaccine efficacy and effectiveness-the elephant (not) in the room. Lancet Microbe. 2021, 2:e279-80. 10.1016/S2666-5247(21)00069-0
- Ali T, Mujawar S, Sowmya AV, Saldanha D, Chaudhury S: Dangers of mRNA vaccines. Ind Psychiatry J. 2021, 30:S291-3. 10.4103/0972-6748.328833
- US Food and Drug Administration: Roster of the vaccines and related biological products advisory committee. (2020). Accessed: December 20, 2023: https://www.fda.gov/advisory-committees/vaccines-and-related-biological-products-advisory-committee/roster-vaccines-a….
- Communicating Risks and Benefits: An Evidence-Based User’s Guide. Fischhoff B, Brewer N, Downs J (ed): US Department of Health and Human Services, Silver Spring, MA; 2011. https://www.fda.gov/about-fda/reports/communicating-risks-and-benefits-evidence-based-users-guide.
- Adams K, Riddles JJ, Rowley EA, et al.: Number needed to vaccinate with a COVID-19 booster to prevent a COVID-19-associated hospitalization during SARS-CoV-2 Omicron BA.1 variant predominance, December 2021-February 2022, VISION Network: a retrospective cohort study. Lancet Reg Health Am. 2023, 23:100530. 10.1016/j.lana.2023.100530
- Gøtzsche PC, Demasi M: Serious harms of the COVID-19 vaccines: a systematic review [PREPRINT]. medRxiv. 2022, 10.1101/2022.12.06.22283145
- Gøtzsche PC: Deadly Medicines and Organized Crime: How Big Pharma has Corrupted Health Care. CRC Press, Boca Raton, FL; 2013.
- Gøtzsche PC: Vaccines: Truth, Lies, and Controversy . Skyhorse Publishing, New York; 2020.
- Gøtzsche PC: Made in China: the coronavirus that killed millions of people. Indian J Med Ethics. 2022, VII:254. 10.20529/IJME.2021.098
- Are Adverse Events in Covid-19 Vaccine Trials Under-Reported?. (2021). Accessed: October 16, 2023: https://maryannedemasi.com/publications/f/are-adverse-events-in-covid-19-vaccine-trials-under-reported.
- Hazell L, Shakir SA: Under-reporting of adverse drug reactions : a systematic review. Drug Saf. 2006, 29:385-96. 10.2165/00002018-200629050-00003
- Johnson RM, Doshi P, Healy D: Covid-19: should doctors recommend treatments and vaccines when full data are not publicly available?. BMJ. 2020, 370:m3260. 10.1136/bmj.m3260
- Summary of Clinical Safety. Pfizer Inc., New York, NY; 2021. https://phmpt.org/wp-content/uploads/2021/12/STN-125742_0_0-Section-2.7.4-summary-clin-safety.pdf.
- Murphy SL, Kochanek KD, Xu J, Arias E.: Mortality in the United States, 2020. NCHS Data Brief. 2021, No. 427:
- Schreckenberg R, Woitasky N, Itani N, Czech L, Ferdinandy P, Schulz R: Cardiac side effects of RNA-based SARS-CoV-2 vaccines: hidden cardiotoxic effects of mRNA-1273 and BNT162b2 on ventricular myocyte function and structure. Br J Pharmacol. 2024, 181:345-61. 10.1111/bph.16262
- Vaccines and Related Biological Products Advisory Committee, December 10, 2020. FDA Briefing Document: Pfizer-BioNTech COVID-19 Vaccine. US Food and Drug Administration, White Oak, MD; 2020. https://www.fda.gov/media/144245/download.
- Palmer M, Bhakdi S, Hooker B, et al.: Evidence of fraud in Pfizer’s clinical trials. mRNA Vaccine Toxicity. Doctors for COVID Ethics, Amsterdam, The Netherlands; 2023. 37-9.
- Assessment Report: Comirnaty. European Medicines Agency, Amsterdam, The Netherlands; 2020. https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf.
- Anomalous Patterns of Mortality and Morbidity in Pfizer’s Covid-19 Vaccine Trial. (2023). Accessed: October 20, 2023: https://wherearethenumbers.substack.com/p/anomalous-patterns-of-mortality-and.
- Thacker PD: Covid-19: researcher blows the whistle on data integrity issues in Pfizer’s vaccine trial. BMJ. 2021, 375:n2635. 10.1136/bmj.n2635
- Godlee F: A strong pandemic response relies on good data. BMJ. 2021, 375:n2668. 10.1136/bmj.n2668
- Cardozo T, Veazey R: Informed consent disclosure to vaccine trial subjects of risk of COVID-19 vaccines worsening clinical disease. Int J Clin Pract. 2021, 75:e13795. 10.1111/ijcp.13795
- Annas GJ: Beyond Nazi War Crimes Experiments: The Voluntary Consent Requirement of the Nuremberg Code at 70. Am J Public Health. 2018, 108:42-46. 10.2105/AJPH.2017.304103
- Healy D, Germán Roux A, Dressen B: The coverage of medical injuries in company trial informed consent forms. Int J Risk Saf Med. 2023, 34:121-8. 10.3233/JRS-220043
- COVID Vaccine Package Insert is Blank Because Up-to-Date Information is Online. (2021). Accessed: January 15, 2024: https://apnews.com/article/fact-checking-956865924140.
- Science brief: COVID-19 vaccines and vaccination. CDC COVID-19 Science Briefs [Internet]. National Center for Immunization and Respiratory Diseases (NCIRD), Division of Viral Diseases, Atlanta (GA); 2021.
- Madewell ZJ, Yang Y, Longini IM Jr, Halloran ME, Dean NE: Household transmission of SARS-CoV-2: a systematic review and meta-analysis. JAMA Netw Open. 2020, 3:e2031756. 10.1001/jamanetworkopen.2020.31756
- Mostaghimi D, Valdez CN, Larson HT, Kalinich CC, Iwasaki A: Prevention of host-to-host transmission by SARS-CoV-2 vaccines. Lancet Infect Dis. 2022, 22:e52-8. 10.1016/S1473-3099(21)00472-2
- Lipsitch M, Kahn R: Interpreting vaccine efficacy trial results for infection and transmission. Vaccine. 2021, 39:4082-8. 10.1016/j.vaccine.2021.06.011
- Maeda M, Murata F, Fukuda H: Effect of COVID-19 vaccination on household transmission of SARS-CoV-2 in the Omicron era: the vaccine effectiveness, networking, and universal safety (VENUS) study. Int J Infect Dis. 2023, 134:200-6. 10.1016/j.ijid.2023.06.017
- Allen H, Tessier E, Turner C, et al.: Comparative transmission of SARS-CoV-2 Omicron (B.1.1.529) and Delta (B.1.617.2) variants and the impact of vaccination: national cohort study, England. Epidemiol Infect. 2023, 151:e58. 10.1017/S0950268823000420
- Menegale F, Manica M, Zardini A, et al.: Evaluation of waning of SARS-CoV-2 vaccine-induced immunity: a systematic review and meta-analysis. JAMA Netw Open. 2023, 6:e2310650. 10.1001/jamanetworkopen.2023.10650
- Abou-Saleh H, Abo-Halawa BY, Younes S, et al.: Neutralizing antibodies against SARS-CoV-2 are higher but decline faster in mRNA vaccinees compared to individuals with natural infection. J Travel Med. 2022, 29:130. 10.1093/jtm/taac130
- Shrestha NK, Burke PC, Nowacki AS, Simon JF, Hagen A, Gordon SM: Effectiveness of the coronavirus disease 2019 bivalent vaccine. Open Forum Infect Dis. 2023, 10:ofad209. 10.1093/ofid/ofad209
- Shrestha NK, Burke PC, Nowacki AS, Gordon SM: Risk of coronavirus disease 2019 (COVID-19) among those up-to-date and not up-to-date on COVID-19 vaccination by US CDC criteria. PLoS One. 2023, 18:e0293449. 10.1371/journal.pone.0293449
- Vaccine-Induced Immune Response to Omicron Wanes Substantially Over Time. (2022). Accessed: October 16, 2023: https://www.nih.gov/news-events/news-releases/vaccine-induced-immune-response-omicron-wanes-substantially-over-time.
- Bar-On YM, Goldberg Y, Mandel M, et al.: Protection by a fourth dose of BNT162b2 against Omicron in Israel. N Engl J Med. 2022, 386:1712-20. 10.1056/NEJMoa2201570
- Ophir Y, Shira-Raz Y, Zakov S, et al.: The efficacy of COVID-19 vaccine boosters against severe illness and deaths scientific fact or wishful myth?. J Am Phys Surg. 2023, 28:20-7.
- Pilz S, Theiler-Schwetz V, Trummer C, Krause R, Ioannidis JP: SARS-CoV-2 reinfections: overview of efficacy and duration of natural and hybrid immunity. Environ Res. 2022, 209:112911. 10.1016/j.envres.2022.112911
- Spinardi JR, Srivastava A: Hybrid immunity to SARS-CoV-2 from infection and vaccination-evidence synthesis and implications for new COVID-19 vaccines. Biomed. 2023, 11:370. 10.3390/biomedicines11020370
- Bigay J, Le Grand R, Martinon F, Maisonnasse P: Vaccine-associated enhanced disease in humans and animal models: Lessons and challenges for vaccine development. Front Microbiol. 2022, 13:932408. 10.3389/fmicb.2022.932408
- Gartlan C, Tipton T, Salguero FJ, Sattentau Q, Gorringe A, Carroll MW: Vaccine-associated enhanced disease and pathogenic human coronaviruses. Front Immunol. 2022, 13:882972. 10.3389/fimmu.2022.882972
- Bossche GV: The Inescapable Immune Escape Pandemic. Pierucci Publishing, Aspen, CO; 2023.
- Rodríguez Y, Rojas M, Beltrán S, et al.: Autoimmune and autoinflammatory conditions after COVID-19 vaccination. New case reports and updated literature review. J Autoimmun. 2022, 132:102898. 10.1016/j.jaut.2022.102898
- Rojas M, Herrán M, Ramírez-Santana C, Leung PS, Anaya JM, Ridgway WM, Gershwin ME: Molecular mimicry and autoimmunity in the time of COVID-19. J Autoimmun. 2023, 139:103070. 10.1016/j.jaut.2023.103070
- Talotta R: Do COVID-19 RNA-based vaccines put at risk of immune-mediated diseases? In reply to «potential antigenic cross-reactivity between SARS-CoV-2 and human tissue with a possible link to an increase in autoimmune diseases». Clin Immunol. 2021, 224:108665. 10.1016/j.clim.2021.108665
- Akinosoglou K, Tzivaki I, Marangos M: Covid-19 vaccine and autoimmunity: awakening the sleeping dragon. Clin Immunol. 2021, 226:108721. 10.1016/j.clim.2021.108721
- Polykretis P, Donzelli A, Lindsay JC, et al.: Autoimmune inflammatory reactions triggered by the COVID-19 genetic vaccines in terminally differentiated tissues. Autoimmunity. 2023, 56:2259123. 10.1080/08916934.2023.2259123
- Appendix 2.2 Cumulative and Interval Summary Tabulation of Serious and Non-serious Adverse Reactions From Post-marketing Data Sources (BNT162B2). Pfizer Inc., New York, NY; 2022. https://www.globalresearch.ca/wp-content/uploads/2023/05/pfizer-report.pdf.
- Wang L, Davis PB, Kaelber DC, Volkow ND, Xu R: Comparison of mRNA-1273 and BNT162b2 vaccines on breakthrough SARS-CoV-2 infections, hospitalizations, and death during the delta-predominant period. JAMA. 2022, 327:678-80. 10.1001/jama.2022.0210
- Beatty AL, Peyser ND, Butcher XE, et al.: Analysis of COVID-19 vaccine type and adverse effects following vaccination. JAMA Netw Open. 2021, 4:e2140364. 10.1001/jamanetworkopen.2021.40364
- Kitagawa H, Kaiki Y, Sugiyama A, et al.: Adverse reactions to the BNT162b2 and mRNA-1273 mRNA COVID-19 vaccines in Japan. J Infect Chemother. 2022, 28:576-81. 10.1016/j.jiac.2021.12.034
- Valera-Rubio MM, Sierra-Torres MI, Castillejo García RR, Cordero-Ramos JJ, López-Márquez MR, Cruz-Salgado ÓO, Calleja-Hernández MÁM: Adverse events reported after administration of BNT162b2 and mRNA-1273 COVID-19 vaccines among hospital workers: a cross-sectional survey-based study in a Spanish hospital. Expert Rev Vaccines. 2022, 21:533-40. 10.1080/14760584.2022.2022478
- Chapin-Bardales J, Gee J, Myers T: Reactogenicity following receipt of mRNA-based COVID-19 vaccines. JAMA. 2021, 325:2201-2. 10.1001/jama.2021.5374
- Chapin-Bardales J, Myers T, Gee J, et al.: Reactogenicity within 2 weeks after mRNA COVID-19 vaccines: findings from the CDC v-safe surveillance system. Vaccine. 2021, 39:7066-73. 10.1016/j.vaccine.2021.10.019
- Nahab F, Bayakly R, Sexton ME, Lemuel-Clarke M, Henriquez L, Rangaraju S, Ido M: Factors associated with stroke after COVID-19 vaccination: a statewide analysis. Front Neurol. 2023, 14:1199745. 10.3389/fneur.2023.1199745
- Gazit S, Shlezinger R, Perez G, et al.: Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) naturally acquired immunity versus vaccine-induced immunity, reinfections versus breakthrough infections: a retrospective cohort study. Clin Infect Dis. 2022, 75:e545-51. 10.1093/cid/ciac262
- Wang Z, Muecksch F, Schaefer-Babajew D, et al.: Naturally enhanced neutralizing breadth against SARS-CoV-2 one year after infection. Nature. 2021, 595:426-31. 10.1038/s41586-021-03696-9
- Gallais F, Gantner P, Bruel T, et al.: Evolution of antibody responses up to 13 months after SARS-CoV-2 infection and risk of reinfection. EBioMedicine. 2021, 71:103561. 10.1016/j.ebiom.2021.103561
- Hall VJ, Foulkes S, Charlett A, et al.: SARS-CoV-2 infection rates of antibody-positive compared with antibody-negative health-care workers in England: a large, multicentre, prospective cohort study (SIREN). Lancet. 2021, 397:1459-69. 10.1016/S0140-6736(21)00675-9
- Harvey RA, Rassen JA, Kabelac CA, et al.: Association of SARS-CoV-2 seropositive antibody test with risk of future infection. JAMA Intern Med. 2021, 181:672-9. 10.1001/jamainternmed.2021.0366
- Turner JS, Kim W, Kalaidina E, et al.: SARS-CoV-2 infection induces long-lived bone marrow plasma cells in humans. Nature. 2021, 595:421-5. 10.1038/s41586-021-03647-4
- Wang Z, Yang X, Zhong J, et al.: Exposure to SARS-CoV-2 generates T-cell memory in the absence of a detectable viral infection. Nat Commun. 2021, 12:1724. 10.1038/s41467-021-22036-z
- Reynolds CJ, Pade C, Gibbons JM, et al.: Immune boosting by B.1.1.529 (Omicron) depends on previous SARS-CoV-2 exposure. Science. 2022, 377:eabq1841. 10.1126/science.abq1841
- Patalon T, Saciuk Y, Perez G, Peretz A, Ben-Tov A, Gazit S: Dynamics of naturally acquired immunity against severe acute respiratory syndrome coronavirus 2 in children and adolescents. J Pediatr. 2023, 257:113371. 10.1016/j.jpeds.2023.02.016
- Sahin U, Karikó K, Türeci Ö: mRNA-based therapeutics–developing a new class of drugs. Nat Rev Drug Discov. 2014, 13:759-80. 10.1038/nrd4278
- Majzoub RA, Alrofaie OH, Almotreb LK, Alateeq SK, Bin Obaid FR: Parental hesitancy and attitude concerning COVID-19 vaccine and its side effects in Saudi Arabia, Eastern region. Cureus. 2023, 15:e48776. 10.7759/cureus.48776
- Dudley MZ, Schwartz B, Brewer J, et al.: COVID-19 vaccination attitudes, values, intentions: US parents for their children, September 2021. Vaccine. 2023, 41:7395-408. 10.1016/j.vaccine.2023.11.002
- Abdulkader MA Sr, Merza MA: Immediate and long-term adverse events of COVID-19 vaccines: a one-year follow-up study from the Kurdistan Region of Iraq. Cureus. 2023, 15:e47670. 10.7759/cureus.47670
- Sultana A, Mim SR, Saha A, et al.: Assessing the self-reported after events following immunization of COVID-19 vaccines in Turkey and Bangladesh. Environ Sci Pollut Res Int. 2023, 30:47381-93. 10.1007/s11356-023-25527-2
- Priority List of Adverse Events of Special Interest: COVID-19. (2020). Accessed: October 16, 2023: https://brightoncollaboration.org/priority-list-of-adverse-events-of-special-interest-covid-19/.
- U.S. Department of Health & Human Services (DHHS): Vaccine Side Effects. (2022). Accessed: July 5, 2023: https://www.hhs.gov/immunization/basics/safety/side-effects/index.html.
- Skidmore M: Covid-19 illness and vaccination experiences in social circles affect covid-19 vaccination decisions. . Sci Publ Health Pol & Law . 2023, 4:208-26.
- Hulscher N, Alexander PE, Amerling R, et al.: A systematic review of autopsy findings in deaths after COVID-19 vaccinations. Zenodo. 2023, 10.5281/zenodo.8120770
- Hulscher N, Hodkinson R, Makis W, McCullough PA: Autopsy findings in cases of fatal COVID-19 vaccine-induced myocarditis. ESC Heart Failure. 2024, 1-14. 10.1002/ehf2.14680
- Schwab C, Domke LM, Hartmann L, et al.: Autopsy-based histopathological characterization of myocarditis after anti-SARS-CoV-2-vaccination. Clin Res Cardiol. 2023, 112:431-440. 10.1007/s00392-022-02129-5
- Pathology Conference: Vaccine-induced spike protein production in the brain, organs etc., now proven [Webpage in German]. (2022). Accessed: October 16, 2023: https://report24.news/pathologie-konferenz-impfinduzierte-spike-produktion-in-gehirn-u-a-organen-nun-erwiesen/.
- Reutlingen Autopsy/Histology Study: Side-effects from corona vaccinations [Webpage in German]. (2020). Accessed: October 16, 2023: https://corona-blog.net/2022/03/10/reutlinger-autopsie-histologie-studie-nebenwirkungen-und-todesfaelle-durch-die-cor….
- Seneff S, Kyriakopoulos AM, Nigh G, McCullough PA: A potential role of the spike protein in neurodegenerative diseases: a narrative review. Cureus. 2023, 15:e34872. 10.7759/cureus.34872
- Blaylock RL: COVID update: What is the truth?. Surg Neurol Int. 2022, 13:167. 10.25259/SNI_150_2022
- Tinari S: The EMA covid-19 data leak, and what it tells us about mRNA instability. BMJ. 2021, 372:n627. 10.1136/bmj.n627
- Assessment Report COVID-19 Vaccine Moderna. European Medicines Agency, Amsterdam, The Netherlands; 2021. https://www.ema.europa.eu/en/documents/assessment-report/spikevax-previously-covid-19-vaccine-moderna-epar-public-ass….
- Assessment Report: Comirnaty. European Medicines Agency, Amsterdam, The Netherlands; 2021. https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf.
- Milano G, Gal J, Creisson A, Chamorey E: Myocarditis and COVID-19 mRNA vaccines: a mechanistic hypothesis involving dsRNA. Future Virol. 2021, 17:10.2217/fvl-2021-0280
- Bruce Yu Y, Taraban MB, Briggs KT: All vials are not the same: potential role of vaccine quality in vaccine adverse reactions. Vaccine. 2021, 39:6565-9. 10.1016/j.vaccine.2021.09.065
- Speicher DJ, Rose J, Gutschi, Wiseman DM, McKernan K: DNA fragments detected in monovalent and bivalent Pfizer/BioNTech and Moderna modRNA COVID-19 vaccines from Ontario, Canada: exploratory dose response relationship with serious adverse events [PREPRINT]. OSFPreprints. 2023, 10.31219/osf.io/mjc97
- McKernan K, Helbert Y, Kane LT, McLaughlin S: Sequencing of bivalent Moderna and Pfizer mRNA vaccines reveals nanogram to microgram quantities of expression vector dsDNA per dose [PREPRINT]. OSFPreprints. 2023, 10.31219/osf.io/b9t7m
- Senate Hearing On Dangerous and Potentially Fatal Errors Within The Methods of Vaccine Distribution.. ( September 20, 2023.). Accessed: January 17, 2023: https://arvozylo.medium.com/senate-hearing-on-dangerous-and-potentially-fatal-errors-within-the-methods-of-vaccine-di….
- Health Canada Confirms Undisclosed Presence of DNA Sequence in Pfizer Shot. (2023). Accessed: December 20, 2023: https://www.theepochtimes.com/world/exclusive-health-canada-confirms-undisclosed-presence-of-dna-sequence-in-pfizer-s….
- Vilchez RA, Butel JS: Emergent human pathogen simian virus 40 and its role in cancer. Clin Microbiol Rev. 2004, 17:495-508. 10.1128/CMR.17.3.495-508.2004
- Rotondo JC, Mazzoni E, Bononi I, Tognon M, Martini F: Association between simian virus 40 and human tumors. Front Oncol. 2019, 9:670. 10.3389/fonc.2019.00670
- Vilchez RA, Kozinetz CA, Arrington AS, et al.: Simian virus 40 in human cancers. Am J Med. 2003, 114:675-84. 10.1016/s0002-9343(03)00087-1
- Qi F, Carbone M, Yang H, Gaudino G: Simian virus 40 transformation, malignant mesothelioma and brain tumors. Expert Rev Respir Med. 2011, 5:683-97. 10.1586/ers.11.51
- Li S, MacLaughlin FC, Fewell JG, et al.: Muscle-specific enhancement of gene expression by incorporation of SV40 enhancer in the expression plasmid. Gene Ther. 2001, 8:494-7. 10.1038/sj.gt.3301419
- Orient JM: Beyond negative evidence: Lessons from the disputes on DNA contamination of COVID-19 vaccines. J Am Phys Surg. 2023, 28:106-12.
- Florida Surgeon General Calls for Halt in Use of COVID mRNA Vaccines. (2024). Accessed: January 3, 2024: https://childrenshealthdefense.org/defender/florida-joseph-ladapo-halt-covid-mrna-vaccines/.
- Florida Surgeon General Calls for a Complete Halt on Pfizer and Moderna mRNA Vaccines. (2024). Accessed: January 4, 2024: https://petermcculloughmd.substack.com/p/breaking-florida-surgeon-general.
- FDA Fails to Address DNA Adulteration Concerns. (2023). Accessed: December 17, 2023: https://brownstone.org/articles/fda-fails-to-address-dna-adulteration-concerns/.
- WCH Expert Panel Finds Cancer-Promoting DNA Contamination in Covid-19 Vaccines. (2023). Accessed: December 20, 2023: https://worldcouncilforhealth.org/news/news-releases/dna-contamination-covid-19-vaccines/.
- Block J: Covid-19: researchers face wait for patient level data from Pfizer and Moderna vaccine trials. BMJ. 2022, 378:o1731. 10.1136/bmj.o1731
- European Medicines Agency: Comirnaty. (2020). Accessed: December 20, 2023: https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty.
- Nance KD, Meier JL: Modifications in an emergency: the role of N1-methylpseudouridine in COVID-19 vaccines. ACS Cent Sci. 2021, 7:748-56. 10.1021/acscentsci.1c00197
- Morais P, Adachi H, Yu YT: The critical contribution of pseudouridine to mRNA COVID-19 vaccines. Front Cell Dev Biol. 2021, 9:789427. 10.3389/fcell.2021.789427
- That Substack About N1-Methylpseudouridines and Frameshifting. (2023). Accessed: December 12, 2023: https://jessicar.substack.com/p/that-substack-about-n1-methylpseudouridines.
- Mulroney TE, Pöyry T, Yam-Puc JC, et al.: N(1)-methylpseudouridylation of mRNA causes +1 ribosomal frameshifting. Nature. 2024, 625:189-94. 10.1038/s41586-023-06800-3
- Vojdani A, Vojdani E, Kharrazian D: Reaction of human monoclonal antibodies to SARS-CoV-2 proteins with tissue antigens: Implications for autoimmune diseases. Front Immunol. 2020, 11:617089. 10.3389/fimmu.2020.617089
- Kanduc D, Shoenfeld Y: Molecular mimicry between SARS-CoV-2 spike glycoprotein and mammalian proteomes: implications for the vaccine. Immunol Res. 2020, 68:310-3. 10.1007/s12026-020-09152-6
- VAERS Reports Contradict Claim of No AEs in Frameshifting Context. (2023). Accessed: December 16, 2023: https://jessicar.substack.com/p/vaers-reports-contradict-claim-of.
- Wiseman DM, Gutschi LM, Speicher DJ, et al.: Ribosomal frameshifting and misreading of mRNA in COVID-19 vaccines produces “off-target” proteins and immune responses eliciting safety concerns: Comment on UK study by Mulroney et al. [PREPRINT]. OSFPreprints. 10.31219/osf.io/nt8jh
- Bellavite P, Ferraresi A, Isidoro C: Immune response and molecular mechanisms of cardiovascular adverse effects of spike proteins from SARS-CoV-2 and mRNA vaccines. Biomed. 2023, 11:451. 10.3390/biomedicines11020451
- Giannotta G, Murrone A, Giannotta N: COVID-19 mRNA vaccines: the molecular basis of some adverse events. Vaccines (Basel). 2023, 11:747. 10.3390/vaccines11040747
- Seneff S, Nigh G, Kyriakopoulos AM, McCullough PA: Response to Barriere et al. Food Chem Toxicol. 2023, 178:113898. 10.1016/j.fct.2023.113898
- Halma MTJ, Rose J, Lawrie T: The novelty of mRNA viral vaccines and potential harms: a scoping review. J. 2023, 6:220-35. 10.3390/j6020017
- Ostrowski SR, Søgaard OS, Tolstrup M, Stærke NB, Lundgren J, Østergaard L, Hvas AM: Inflammation and platelet activation after COVID-19 vaccines – possible mechanisms behind vaccine-induced immune thrombocytopenia and thrombosis. Front Immunol. 2021, 12:779453. 10.3389/fimmu.2021.779453
- Parry PI, Lefringhausen A, Turni C, Neil CJ, Cosford R, Hudson NJ, Gillespie J: ’Spikeopathy’: COVID-19 spike protein is pathogenic, from both virus and vaccine mRNA. Biomed. 2023, 11:2287. 10.3390/biomedicines11082287
- Kostoff RN, Kanduc D, Porter AL, et al.: Vaccine- and natural infection-induced mechanisms that could modulate vaccine safety. Toxicol Rep. 2020, 7:1448-58. 10.1016/j.toxrep.2020.10.016
- Devaux CA, Camoin-Jau L: Molecular mimicry of the viral spike in the SARS-CoV-2 vaccine possibly triggers transient dysregulation of ACE2, leading to vascular and coagulation dysfunction similar to SARS-CoV-2 infection. Viruses. 2023, 15:1045. 10.3390/v15051045
- Kanduc D: From anti-severe acute respiratory syndrome coronavirus 2 immune response to cancer onset via molecular mimicry and cross-reactivity. Glob Med Genet. 2021, 8:176-82. 10.1055/s-0041-1735590
- Lyons-Weiler J: Pathogenic priming likely contributes to serious and critical illness and mortality in COVID-19 via autoimmunity. J Transl Autoimmun. 2020, 3:100051. 10.1016/j.jtauto.2020.100051
- Syenina A, Gan ES, Toh JZ, et al.: Adverse effects following anti-COVID-19 vaccination with mRNA-based BNT162b2 are alleviated by altering the route of administration and correlate with baseline enrichment of T and NK cell genes. PLoS Biol. 2022, 20:e3001643. 10.1371/journal.pbio.3001643
- Hou X, Zaks T, Langer R, Dong Y: Lipid nanoparticles for mRNA delivery. Nat Rev Mater. 2021, 6:1078-94. 10.1038/s41578-021-00358-0
- Cui S, Wang Y, Gong Y, et al.: Correlation of the cytotoxic effects of cationic lipids with their headgroups. Toxicol Res (Camb). 2018, 7:473-9. 10.1039/c8tx00005k
- Ashman RB, Blanden RV, Ninham BW, Evans DF: Interaction of amphiphilic aggregates with cells of the immune system. Immunol Today. 1986, 7:278-83. 10.1016/0167-5699(86)90010-1
- Matzinger P: Tolerance, danger, and the extended family. Annu Rev Immunol. 1994, 12:991-1045. 10.1146/annurev.iy.12.040194.005015
- Sellaturay P, Nasser S, Ewan P: Polyethylene glycol-induced systemic allergic reactions (anaphylaxis). J Allergy Clin Immunol Pract. 2021, 9:670-5. 10.1016/j.jaip.2020.09.029
- Bigini P, Gobbi M, Bonati M, Clavenna A, Zucchetti M, Garattini S, Pasut G: The role and impact of polyethylene glycol on anaphylactic reactions to COVID-19 nano-vaccines. Nat Nanotechnol. 2021, 16:1169-71. 10.1038/s41565-021-01001-3
- Taieb A, Mounira EE: Pilot findings on SARS-CoV-2 vaccine-induced pituitary diseases: a mini review from diagnosis to pathophysiology. Vaccines (Basel). 2022, 10:2004. 10.3390/vaccines10122004
- Aliberti L, Gagliardi I, Rizzo R, et al.: Pituitary apoplexy and COVID-19 vaccination: a case report and literature review. Front Endocrinol (Lausanne). 2022, 13:1035482. 10.3389/fendo.2022.1035482
- Yan HY, Young YH: Vertigo/dizziness following COVID-19 vaccination. Am J Otolaryngol. 2023, 44:103723. 10.1016/j.amjoto.2022.103723
- Krauson AJ, Casimero FV, Siddiquee Z, Stone JR: Duration of SARS-CoV-2 mRNA vaccine persistence and factors associated with cardiac involvement in recently vaccinated patients. NPJ Vaccines. 2023, 8:141. 10.1038/s41541-023-00742-7
- Khan S, Shafiei MS, Longoria C, Schoggins JW, Savani RC, Zaki H: SARS-CoV-2 spike protein induces inflammation via TLR2-dependent activation of the NF-κB pathway. Elife. 2021, 10:68563. 10.7554/eLife.68563
- Meyer K, Patra T, Vijayamahantesh, Ray R: SARS-CoV-2 spike protein induces paracrine senescence and leukocyte adhesion in endothelial cells. J Virol. 2021, 95:e0079421. 10.1128/JVI.00794-21
- Nyström S, Hammarström P: Amyloidogenesis of SARS-CoV-2 spike protein. J Am Chem Soc. 2022, 144:8945-50. 10.1021/jacs.2c03925
- Cocco N, Leibundgut G, Pelliccia F, et al.: Arrhythmias after COVID-19 vaccination: have we left all stones unturned?. Int J Mol Sci. 2023, 24:10405. 10.3390/ijms241210405
- Kim H, Ahn HS, Hwang N, et al.: Epigenomic landscape exhibits interferon signaling suppression in the patient of myocarditis after BNT162b2 vaccination. Sci Rep. 2023, 13:8926. 10.1038/s41598-023-36070-y
- Bozkurt B: Shedding light on mechanisms of myocarditis with COVID-19 mRNA vaccines. Circulation. 2023, 147:877-80. 10.1161/CIRCULATIONAHA.123.063396
- Yonker LM, Swank Z, Bartsch YC, et al.: Circulating spike protein detected in post- COVID-19 mRNA vaccine myocarditis. Circulation. 2023, 147:867-76. 10.1161/CIRCULATIONAHA.122.061025
- Baumeier C, Aleshcheva G, Harms D, et al.: Intramyocardial inflammation after COVID-19 vaccination: an endomyocardial biopsy-proven case series. Int J Mol Sci. 2022, 23:6940. 10.3390/ijms23136940
- Cadegiani FA: Catecholamines are the key trigger of COVID-19 mRNA vaccine-induced myocarditis: a compelling hypothesis supported by epidemiological, anatomopathological, molecular, and physiological findings. Cureus. 2022, 14:e27883. 10.7759/cureus.27883
- Kim N, Jung Y, Nam M, et al.: Angiotensin II affects inflammation mechanisms via AMPK-related signalling pathways in HL-1 atrial myocytes. Sci Rep. 2017, 7:10328. 10.1038/s41598-017-09675-3
- McKinney EF, Lee JC, Jayne DR, Lyons PA, Smith KG: T-cell exhaustion, co-stimulation and clinical outcome in autoimmunity and infection. Nature. 2015, 523:612-6. 10.1038/nature14468
- Liu J, Wang J, Xu J, et al.: Comprehensive investigations revealed consistent pathophysiological alterations after vaccination with COVID-19 vaccines. Cell Discov. 2021, 7:99. 10.1038/s41421-021-00329-3
- Collier JL, Weiss SA, Pauken KE, Sen DR, Sharpe AH: Not-so-opposite ends of the spectrum: CD8(+) T cell dysfunction across chronic infection, cancer and autoimmunity. Nat Immunol. 2021, 22:809-19. 10.1038/s41590-021-00949-7
- Irrgang P, Gerling J, Kocher K, et al.: Class switch toward noninflammatory, spike-specific IgG4 antibodies after repeated SARS-CoV-2 mRNA vaccination. Sci Immunol. 2023, 8:eade2798. 10.1126/sciimmunol.ade2798
- Uversky VN, Redwan EM, Makis W, Rubio-Casillas A: IgG4 antibodies induced by repeated vaccination may generate immune tolerance to the SARS-CoV-2 spike protein. Vaccines (Basel). 2023, 11:99. 10.3390/vaccines11050991
- Chevaisrakul P, Lumjiaktase P, Kietdumrongwong P, Chuatrisorn I, Chatsangjaroen P, Phanuphak N: Hybrid and herd immunity 6 months after SARS-CoV-2 exposure among individuals from a community treatment program. Sci Rep. 2023, 13:763. 10.1038/s41598-023-28101-5
- Loacker L, Kimpel J, Bánki Z, Schmidt CQ, Griesmacher A, Anliker M: Increased PD-L1 surface expression on peripheral blood granulocytes and monocytes after vaccination with SARS-CoV2 mRNA or vector vaccine. Clin Chem Lab Med. 2023, 61:e17-9.
- Jiang X, Wang J, Deng X, et al.: Role of the tumor microenvironment in PD-L1/PD-1-mediated tumor immune escape. Mol Cancer. 2019, 18:10. 10.1186/s12943-018-0928-4
- Ai L, Xu A, Xu J: Roles of PD-1/PD-L1 pathway: signaling, cancer, and beyond. Adv Exp Med Biol. 2020, 1248:33-59. 10.1007/978-981-15-3266-5_3
- Goldman S, Bron D, Tousseyn T, et al.: Rapid progression of angioimmunoblastic T cell lymphoma following BNT162b2 mRNA vaccine booster shot: a case report. Front Med (Lausanne). 2021, 8:798095. 10.3389/fmed.2021.798095
- Sekizawa A, Hashimoto K, Kobayashi S, et al.: Rapid progression of marginal zone B-cell lymphoma after COVID-19 vaccination (BNT162b2): a case report. Front Med (Lausanne). 2022, 9:963393. 10.3389/fmed.2022.963393
- Tachita T, Takahata T, Yamashita S, et al.: Newly diagnosed extranodal NK/T-cell lymphoma, nasal type, at the injected left arm after BNT162b2 mRNA COVID-19 vaccination. Int J Hematol. 2023, 118:503-7. 10.1007/s12185-023-03607-w
- Zamfir MA, Moraru L, Dobrea C, et al.: Hematologic malignancies diagnosed in the context of the mRNA COVID-19 vaccination campaign: a report of two cases. Medicina (Kaunas). 2022, 58:874. 10.3390/medicina58070874
- Angues VR, Bustos PY: SARS-CoV-2 vaccination and the multi-hit hypothesis of oncogenesis. Cureus. 2023, 15:e50703. 10.7759/cureus.50703
- Echaide M, Labiano I, Delgado M, et al.: Immune profiling uncovers memory T-cell responses with a Th17 signature in cancer patients with previous SARS-CoV-2 infection followed by mRNA vaccination. Cancers (Basel). 2022, 14:4464. 10.3390/cancers14184464
- Gandolfo C, Anichini G, Mugnaini M, et al.: Overview of anti-SARS-CoV-2 immune response six months after BNT162b2 mRNA vaccine. Vaccines (Basel). 2022, 10:171. 10.3390/vaccines10020171
- Echaide M, Chocarro de Erauso L, Bocanegra A, Blanco E, Kochan G, Escors D: mRNA vaccines against SARS-CoV- 2: advantages and caveats. Int J Mol Sci. 2023, 24:5944. 10.3390/ijms24065944
- Russell MW, Mestecky J: Mucosal immunity: the missing link in comprehending SARS-CoV-2 infection and transmission. Front Immunol. 2022, 13:957107. 10.3389/fimmu.2022.957107
- Lavelle EC, Ward RW: Mucosal vaccines – fortifying the frontiers. Nat Rev Immunol. 2022, 22:236-50. 10.1038/s41577-021-00583-2
- Primorac D, Vrdoljak K, Brlek P, et al.: Adaptive immune responses and immunity to SARS-CoV-2. Front Immunol. 2022, 13:848582. 10.3389/fimmu.2022.848582
- Gould VM, Francis JN, Anderson KJ, Georges B, Cope AV, Tregoning JS: Nasal IgA provides protection against human influenza challenge in volunteers with low serum influenza antibody titre. Front Microbiol. 2017, 8:900. 10.3389/fmicb.2017.00900
- Mettelman RC, Allen EK, Thomas PG: Mucosal immune responses to infection and vaccination in the respiratory tract. Immunity. 2022, 55:749-80. 10.1016/j.immuni.2022.04.013
- Alu A, Chen L, Lei H, Wei Y, Tian X, Wei X: Intranasal COVID-19 vaccines: from bench to bed. EBioMedicine. 2022, 76:103841. 10.1016/j.ebiom.2022.103841
- Feng A, Obolski U, Stone L, He D: Modelling COVID-19 vaccine breakthrough infections in highly vaccinated Israel-the effects of waning immunity and third vaccination dose. PLOS Glob Public Health. 2022, 2:e0001211. 10.1371/journal.pgph.0001211
- Lyke KE, Atmar RL, Islas CD, et al.: Rapid decline in vaccine-boosted neutralizing antibodies against SARS-CoV-2 Omicron variant. Cell Rep Med. 2022, 3:100679. 10.1016/j.xcrm.2022.100679
- Tamandjou C, Auvigne V, Schaeffer J, Vaux S, Parent du Châtelet I: Effectiveness of second booster compared to first booster and protection conferred by previous SARS-CoV-2 infection against symptomatic Omicron BA.2 and BA.4/5 in France. Vaccine. 2023, 41:2754-60. 10.1016/j.vaccine.2023.03.031
- McCarthy MW: Original antigen sin and COVID-19: implications for seasonal vaccination. Expert Opin Biol Ther. 2022, 22:1353-8. 10.1080/14712598.2022.2137402
- Noori M, Nejadghaderi SA, Rezaei N: «Original antigenic sin»: a potential threat beyond the development of booster vaccination against novel SARS-CoV-2 variants. Infect Control Hosp Epidemiol. 2022, 43:1091-2. 10.1017/ice.2021.199
- Lv H, Wu NC, Tsang OT, et al.: Cross-reactive antibody response between SARS-CoV-2 and SARS-CoV infections. Cell Rep. 2020, 31:107725. 10.1016/j.celrep.2020.107725
- Shrock E, Fujimura E, Kula T, et al.: Viral epitope profiling of COVID-19 patients reveals cross-reactivity and correlates of severity. Science. 2020, 370:4250. 10.1126/science.abd4250
- Röltgen K, Nielsen SC, Silva O, et al.: Immune imprinting, breadth of variant recognition, and germinal center response in human SARS-CoV-2 infection and vaccination. Cell. 2022, 185:1025-1040.e14. 10.1016/j.cell.2022.01.018
- Samanovic MI, Cornelius AR, Gray-Gaillard SL, et al.: Robust immune responses after one dose of BNT162b2 mRNA vaccine dose in SARS-CoV-2 experienced individuals [PREPRINT]. medRxiv. 2021, 10.1101/2021.02.07.21251311
- Offit PA: Bivalent Covid-19 vaccines – a cautionary tale. N Engl J Med. 2023, 388:481-3. 10.1056/NEJMp2215780
- Reina J: Possible effect of the «original antigenic sin» in vaccination against new variants of SARS-CoV-2. Rev Clin Esp (Barc). 2022, 222:91-2. 10.1016/j.rceng.2021.05.005
- Gao FX, Wu RX, Shen MY, et al.: Extended SARS-CoV-2 RBD booster vaccination induces humoral and cellular immune tolerance in mice. iScience. 2022, 25:105479. 10.1016/j.isci.2022.105479
- Shahhosseini N, Babuadze GG, Wong G, Kobinger GP: Mutation signatures and in silico docking of novel SARS-CoV-2 variants of concern. Microorganisms. 2021, 9:926. 10.3390/microorganisms9050926
- Beeraka NM, Sukocheva OA, Lukina E, Liu J, Fan R: Development of antibody resistance in emerging mutant strains of SARS CoV-2: impediment for COVID-19 vaccines. Rev Med Virol. 2022, 32:e2346. 10.1002/rmv.2346
- Dumonteil E, Herrera C: Polymorphism and selection pressure of SARS-CoV-2 vaccine and diagnostic antigens: implications for immune evasion and serologic diagnostic performance. Pathogens. 2020, 9:584. 10.3390/pathogens9070584
- López-Cortés GI, Palacios-Pérez M, Veledíaz HF, Hernández-Aguilar M, López-Hernández GR, Zamudio GS, José MV: The spike protein of SARS-CoV-2 is adapting because of selective pressures. Vaccines (Basel). 2022, 10:864. 10.3390/vaccines10060864
- Chakraborty C, Sharma AR, Bhattacharya M, Lee SS: A detailed overview of immune escape, antibody escape, partial vaccine escape of SARS-CoV-2 and their emerging variants with escape mutations. Front Immunol. 2022, 13:801522. 10.3389/fimmu.2022.801522
- Seneff S, Nigh G: Worse than the disease? Reviewing some possible unintended consequences of the mRNA vaccines against COVID-19. Int J Vaccine Theory Pract Res. 2021, 2:38-79. 10.56098/ijvtpr.v2i1.23
- Azim Majumder MA, Razzaque MS: Repeated vaccination and ‘vaccine exhaustion’: relevance to the COVID-19 crisis. Expert Rev Vaccines. 2022, 21:1011-4. 10.1080/14760584.2022.2071705
- Dhama K, Nainu F, Frediansyah A, et al.: Global emerging Omicron variant of SARS-CoV-2: impacts, challenges and strategies. J Infect Public Health. 2023, 16:4-14. 10.1016/j.jiph.2022.11.024
- Krause PR, Fleming TR, Longini IM, et al.: Placebo-controlled trials of Covid-19 vaccines – why we still need them. N Engl J Med. 2021, 384:e2. 10.1056/NEJMp2033538
- Historical Vaccine Safety Concerns. (2020). Accessed: October 16, 2023: https://www.cdc.gov/vaccinesafety/concerns/concerns-history.html.
- Rotavirus Vaccine (RotaShield®) and Intussusception. (1999). Accessed: October 16, 2023: https://www.cdc.gov/vaccines/vpd-vac/rotavirus/vac-rotashield-historical.htm.
- Pfizer: Periodic Safety Update Report #3 for Active Substance: COVID-19 mRNA Vaccine, BNT162b2. BioNTech Manufacturing GmbH, Mainz, Germany; 2022. https://tkp.at/wp-content/uploads/2023/03/3.PSUR-1.pdf.
- Horowitz: Confidential Pfizer document shows the company observed 1.6 million adverse events covering nearly every organ system. (2023). Accessed: October 16, 2023: https://www.conservativereview.com/horowitz-confidential-pfizer-document-shows-the-company-observed-1-6-million-adver….
- Aarstad J, Kvitastein OA: Is there a link between the 2021 COVID-19 vaccination uptake in Europe and 2022 excess all-cause mortality?. Asian Pac J Health Sci. 2022, 2023:25-31. 10.21276/apjhs.2023.10.1.6
- Rancourt DG, Baudin M, Hickey J, Mercier J: COVID-19 Vaccine-Associated Mortality in the Southern Hemisphere. Correlation Research in the Public Interest, Ontario, Canada; 2023.
- Rancourt DG, Baudin M, Hickey J, Mercier J: Age-Stratified COVID-19 Vaccine-Dose Fatality Rate for Israel and Australia. Correlation Research in the Public Interest, Ontario, Canada;
- Pfizer-BioNTech Submits New COVID Vaccine Booster Targeting BA.5 to the FDA for Authorization. (2022). Accessed: October 16, 2023: https://www.usatoday.com/story/news/health/2022/08/22/pfizer-covid-booster-omicron-submitted-fda-emergency-authorizat….
- Bardosh K, Krug A, Jamrozik E, et al.: COVID-19 vaccine boosters for young adults: a risk benefit assessment and ethical analysis of mandate policies at universities. J Med Ethics. 2022, 10.1136/jme-2022-108449
- Palmer M, Bhakdi S, Wodarg W: On the Use of the Pfizer and the Moderna COVID-19 mRNA Vaccines in Children and Adolescents. Doctors for COVID Ethics, Amsterdam, The Netherlands; 2022.
- Mansanguan S, Charunwatthana P, Piyaphanee W, Dechkhajorn W, Poolcharoen A, Mansanguan C: Cardiovascular manifestation of the BNT162b2 mRNA COVID-19 vaccine in adolescents. Trop Med Infect Dis. 2022, 7:196. 10.3390/tropicalmed7080196
- Buergin N, Lopez-Ayala P, Hirsiger JR, et al.: Sex-specific differences in myocardial injury incidence after COVID-19 mRNA-1273 booster vaccination. Eur J Heart Fail. 2023, 25:1871-81. 10.1002/ejhf.2978
- Singer ME, Taub IB, Kaelber DC: Risk of myocarditis from COVID-19 infection in people under age 20: a population-based analysis [PREPRINT]. medRxiv. 2022, 10.1101/2021.07.23.21260998
- Amir M, Latha S, Sharma R, Kumar A: Association of cardiovascular events with COVID-19 vaccines using vaccine adverse event reporting system (VAERS): a retrospective study. Curr Drug Saf. 2023, 10.2174/0115748863276904231108095255
- Hurley P, Krohn M, LaSala T, et al.: Group Life COVID-19 Mortality Survey Report. Society of Actuaries Research Institute, Schaumburg, Illinois; 2023. https://www.soa.org/4ac0fd/globalassets/assets/files/resources/experience-studies/2023/group-life-covid-mort-06-23.pdf.
- Quarterly Excess Death Rate Analysis. (2022). Accessed: December 13, 2023: https://phinancetechnologies.com/HumanityProjects/Quarterly%20Excess%20Death%20Rate%20Analysis%20-%20US.htm.
- Irrefutable Evidence Vaccine Mandates Killed & Disabled Countless Americans. (2022). Accessed: July 7, 2023: https://twitter.com/NFSC_HAGnews/status/1640624477527769088.
- Polykretis P, McCullough PA: Rational harm‐benefit assessments by age group are required for continued COVID‐19 vaccination. Scand J Immunol. 2022, e13242. 10.1111/sji.13242
- Ittiwut C, Mahasirimongkol S, Srisont S, et al.: Genetic basis of sudden death after COVID-19 vaccination in Thailand. Heart Rhythm. 2022, 19:1874-9. 10.1016/j.hrthm.2022.07.019
- Lai CC, Chen IT, Chao CM, Lee PI, Ko WC, Hsueh PR: COVID-19 vaccines: concerns beyond protective efficacy and safety. Expert Rev Vaccines. 2021, 20:1013-25. 10.1080/14760584.2021.1949293
- Lee S, Lee CH, Seo MS, Yoo JI: Integrative analyses of genes about venous thromboembolism: An umbrella review of systematic reviews and meta-analyses. Medicine (Baltimore). 2022, 101:e31162. 10.1097/MD.0000000000031162
- Why is Life Expectancy in the US Lower Than in Other Rich Countries?. (2020). Accessed: December 13, 2023: https://ourworldindata.org/us-life-expectancy-low.
- Rancourt DG, Baudin M, Mercier J: COVID-Period mass vaccination campaign and public health disaster in the USA from age/state-resolved all-cause mortality by time, age-resolved vaccine delivery by time, and socio-geo-economic data [PREPRINT]. ResearchGate. 2022,
- Sennfält S, Norrving B, Petersson J, Ullberg T: Long-term survival and function after stroke: a longitudinal observational study from the Swedish stroke register. Stroke. 2019, 50:53-61. 10.1161/STROKEAHA.118.022913
- Yu CK, Tsao S, Ng CW, et al.: Cardiovascular assessment up to one year after COVID-19 vaccine-associated myocarditis. Circulation. 2023, 148:436-9. 10.1161/CIRCULATIONAHA.123.064772
- Barmada A, Klein J, Ramaswamy A, et al.: Cytokinopathy with aberrant cytotoxic lymphocytes and profibrotic myeloid response in SARS-CoV-2 mRNA vaccine-associated myocarditis. Sci Immunol. 2023, 8:eadh3455. 10.1126/sciimmunol.adh3455
- Brociek E, Tymińska A, Giordani AS, Caforio AL, Wojnicz R, Grabowski M, Ozierański K: Myocarditis: etiology, pathogenesis, and their implications in clinical practice. Biology (Basel). 2023, 12:874. 10.3390/biology12060874
- Davis HE, McCorkell L, Vogel JM, Topol EJ: Long COVID: major findings, mechanisms and recommendations. Nat Rev Microbiol. 2023, 21:133-46. 10.1038/s41579-022-00846-2
- Yong SJ, Liu S: Proposed subtypes of post-COVID-19 syndrome (or long-COVID) and their respective potential therapies. Rev Med Virol. 2022, 32:e2315. 10.1002/rmv.2315
- Raveendran AV, Jayadevan R, Sashidharan S: Long COVID: an overview. Diabetes Metab Syndr. 2021, 15:869-75. 10.1016/j.dsx.2021.04.007
- Arjun MC, Singh AK, Pal D, et al.: Characteristics and predictors of long COVID among diagnosed cases of COVID-19. PLoS One. 2022, 17:e0278825. 10.1371/journal.pone.0278825
- Hulscher N, Procter BC, Wynn C, McCullough PA: Clinical approach to post-acute sequelae after COVID-19 infection and vaccination. Cureus. 2023, 15:e49204. 10.7759/cureus.49204
- Vogel G, Couzin-Frankel J: Rare link between coronavirus vaccines and Long Covid-like illness starts to gain acceptance. Science. 2023, 381:6653. 10.1126/science.adj5565
- Brogna C, Cristoni S, Marino G, et al.: Detection of recombinant Spike protein in the blood of individuals vaccinated against SARS-CoV-2: possible molecular mechanisms. Proteomics Clin Appl. 2023, 17:e2300048. 10.1002/prca.202300048
- Craddock V, Mahajan A, Spikes L, et al.: Persistent circulation of soluble and extracellular vesicle-linked Spike protein in individuals with postacute sequelae of COVID-19. J Med Virol. 2023, 95:e28568. 10.1002/jmv.28568
- Dhuli K, Medori MC, Micheletti C, et al.: Presence of viral spike protein and vaccinal spike protein in the blood serum of patients with long-COVID syndrome. Eur Rev Med Pharmacol Sci. 2023, 27:13-9. 10.26355/eurrev_202312_34685
- Diexer S, Klee B, Gottschick C, et al.: Association between virus variants, vaccination, previous infections, and post-COVID-19 risk. Int J Infect Dis. 2023, 136:14-21. 10.1016/j.ijid.2023.08.019
- Scholkmann F, May CA: COVID-19, post-acute COVID-19 syndrome (PACS, «long COVID») and post-COVID-19 vaccination syndrome (PCVS, «post-COVIDvac-syndrome»): similarities and differences. Pathol Res Pract. 2023, 246:154497. 10.1016/j.prp.2023.154497
- Rodziewicz TL, Houseman B, Hipskind JE: Medical error reduction and prevention. StatPearls [Internet]. StatPearls Publishing, Treasure Island (FL); 2023.
- Oyebode F: Clinical errors and medical negligence. Med Princ Pract. 2013, 22:323-33. 10.1159/000346296
- Kohn LT, Corrigan JM, Donaldson MS: To Err Is Human: Building a Safer Health System. The National Academies Press, Washington, DC; 2000. 10.17226/9728
- How Many Deaths Were Caused by the Covid Vaccines?. (2023). Accessed: 2024: https://wherearethenumbers.substack.com/p/how-many-deaths-were-caused-by-the.
- Lazarus R, Baos S, Cappel-Porter H, et al.: Safety and immunogenicity of concomitant administration of COVID-19 vaccines (ChAdOx1 or BNT162b2) with seasonal influenza vaccines in adults in the UK (ComFluCOV): a multicentre, randomised, controlled, phase 4 trial. Lancet. 2021, 398:2277-87. 10.1016/S0140-6736(21)02329-1
- Ioannidis JP: Infection fatality rate of COVID-19 inferred from seroprevalence data. Bull World Health Organ. 2021, 99:19-33F. 10.2471/BLT.20.265892