Pfizer/BioNTech’s COVID-19 modRNA Vaccines: Dangerous Genetic Mechanism of Action Released before Sufficient Preclinical Testing – Philip R. Oldfield; L. Maria Gutschi, B.Sc.Phm, Pharm.D.; Peter A. McCullough, MD; David J. Speicher, Ph.D. https://jpands.org/vol29no4/oldfield.pdf

Introducción
Científicos y médicos independientes, junto con la organización Public Health and Medical Professionals for Transparency, presentaron una solicitud en virtud de la Ley de Libertad de Información (FOIA, por sus siglas en inglés) para que la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) revisara los datos y los informes con el fin de obtener la licencia para la inyecciones de ARNm modificado (modRNA) contra la COVID-19 de Pfizer/BioNTech (BNT162b2). Esto dio lugar a una orden judicial para que se publicara una gran cantidad de documentos que Pfizer/BioNTech presentó a la FDA para su aprobación regulatoria, que se publicaría en ocho meses en lugar de 75 años.1,2 La presentación regulatoria de Pfizer/BioNTech debe revisarse de manera independiente para determinar si las inyecciones de ARN modificado contra la COVID-19 se establecieron como productos seguros y efectivos, como los medios de comunicación tradicionales y las autoridades gubernamentales le hacen creer al público. Este estudio proporciona una breve descripción general de la seguridad y eficacia de las inyecciones de ARN modificado contra la COVID-19 de Pfizer/BioNTech.
Directrices reglamentarias para terapias basadas en ARN
El reciente auge de las terapias con ARNm ha provocado un colapso del marco regulatorio, en el que incluso las definiciones son vagas. Por ejemplo, las inyecciones de ARNm contra la COVID-19 no están clasificadas como productos de terapia génica, mientras que una inyección de ARNm contra una enfermedad no infecciosa como el cáncer no está clasificada como una inyección de ARNm, sino como un producto de terapia génica.3 Por lo tanto, las inyecciones de ácido nucleico contra enfermedades infecciosas fueron específicamente excluidas de las directrices regulatorias para productos de terapia genética.4 Esto ha provocado que se utilicen las directrices de la OMS de 2005 para la evaluación no clínica de las inyecciones de ARNm modificado contra la COVID-19.5 Es un requisito reglamentario que los fabricantes de un producto de terapia genética determinen la estructura, concentración y biodistribución de la proteína que ha sido codificada para su producción in vivo.6 Sin embargo, ese no fue el caso de la BNT162b2 de Pfizer/BioNTech, ya que fue clasificada erróneamente como una vacuna tradicional.
¿Cuánto antígeno de proteína pico produce la BNT162b2? ¿La cantidad varía entre individuos? ¿Cuál es el mecanismo completo de funcionamiento de estas inyecciones de ARNm en el cuerpo humano? Es necesario delinear tanto el proceso de inmunización como la patogenia de los síndromes de lesión por inyecciones. La proteína pico es tóxica y puede tener graves consecuencias inmunológicas.7 Sin embargo, es necesario comprender por completo la farmacocinética y la farmacodinamia del ARNm y de la proteína de la espícula para analizar los efectos no deseados. Por ejemplo, en el caso de BNT162b2, la proteína de la espícula se produce en células humanas transfectadas por el ARNm encapsulado en nanopartículas lipídicas (LNP). A continuación, el ARNm da instrucciones a los ribosomas sobre cómo crear la proteína de la espícula o spike. Esta proteína de la espícula se une posteriormente a la membrana celular y se libera en el torrente sanguíneo.8 La inyección BNT162b2 de Pfizer/BioNTech fue clasificada erróneamente como una vacuna tradicional y, por lo tanto, estas evaluaciones nunca se realizaron ni se presentaron como parte de la presentación reglamentaria.
Para determinar cuáles deberían haber sido los requisitos regulatorios de seguridad y eficacia para estas inyecciones de ARNm, necesitamos entender las diferencias fundamentales entre las vacunas tradicionales, es decir, las vacunas inactivadas y/o atenuadas que se han utilizado durante más de 100 años, y las nuevas inyecciones de ARNm modificado contra la COVID-19 que utilizan tecnología de transferencia genética que han recibido uso de emergencia y posterior autorización por parte de la FDA y otras agencias reguladoras nacionales.
Inyecciones contra la COVID-19 de Pfizer/BioNTech
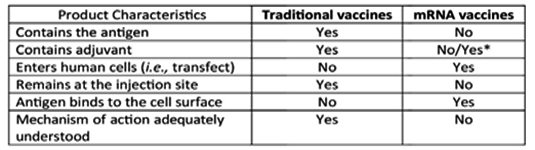
Las vacunas tradicionales contienen un antígeno diana en concentraciones conocidas del patógeno (que puede ser vivo atenuado, inactivado o una subunidad del patógeno) junto con un adyuvante. Juntos, el antígeno y el adyuvante producen una respuesta inmunitaria. Este no es el caso de las inyecciones de ARN modificado contra la COVID-19 (por ejemplo, Pfizer/BioNTech y Moderna) y las vacunas de vector de adenovirus (por ejemplo, AstraZeneca). Estas “vacunas” más nuevas son similares a un “profármaco”, ya que utilizan las propias células del cuerpo para producir la proteína pico o spike viral in vivo en niveles que varían mucho.9
Los profármacos no tienen actividad intrínseca para provocar una respuesta farmacológica (en este caso, la formación de anticuerpos) por sí solos, pero dan instrucciones a los ribosomas sobre cómo producir el “fármaco activo” (es decir, la proteína de la espícula). Las inyecciones de ARNm modificado de Pfizer/BioNTech tienen una fase farmacológica pronunciada a la que luego le sigue una fase inmunológica para producir la respuesta inmunitaria. Esta diferencia se ha ignorado al evaluar la seguridad y la farmacocinética de la inyección de ARNm modificado BNT162b2 contra la COVID-19 de Pfizer/BioNTech y sus componentes. Las personas inyectadas pueden producir cantidades variables de proteína de la espícula o spike durante períodos de tiempo variables en función de su genética, edad, estado hormonal y nutricional, condición atlética y lote de vacuna que reciben.10 Nunca se han realizado estudios para investigar estos factores en las fases preclínicas y clínicas de desarrollo. Por lo tanto, la inyección BNT162b2 no es como ninguna otra vacuna que se haya utilizado con éxito. La respuesta inmunitaria innata se dirige inicialmente contra la proteína de la espícula o spike, que está unida a las propias células del vacunado en lugar de al patógeno invasor. Las diferencias fundamentales se resumen en la Tabla 1.
Tabla 1. Diferencias fundamentales entre las vacunas tradicionales y las inyecciones de ARN modificado
*Las nanopartículas lipídicas tienen propiedades adyuvantes intrínsecas, al igual que las impurezas como la endotoxina o el ARNbc.
En ninguno de los estudios de Pfizer/BioNTech se determinó la caracterización y la estructura de la proteína de la espícula resultante o su estado trimerizado en la conformación de prefusión. La distribución de la proteína de la espícula codificada, la secuencia de la proteína en sí y la seguridad de BNT162b2 se basaron exclusivamente en suposiciones de las revisiones regulatorias tradicionales de las vacunas.
Una revisión de los datos de presentación de la inyección de ARN modificado contra la COVID-19 de Pfizer/BioNTech
Estudios no clínicos de seguridad y toxicología
Al no realizar estudios farmacocinéticos y farmacodinámicos de la proteína pico codificada producida a partir del ARNm, que ya se sabía que era tóxica a través de la infección natural por SARS-CoV-2,11,12 La presentación reglamentaria está incompleta. Módulo 2.4. La descripción general no clínica del BNT162b2 de Pfizer/BioNTech8, pág. 17 establece:
No se han realizado estudios farmacocinéticos con BNT162b2 y, por lo general, no se consideran necesarios para respaldar el desarrollo y la autorización de productos de vacunas para enfermedades infecciosas (OMS, 2005; OMS, 2014).5,13
Por lo tanto, los estudios de seguridad no clínicos se diseñaron para proporcionar datos que no eran suficientes para un nuevo tipo de “vacuna”. Los documentos de orientación de la Organización Mundial de la Salud (OMS) solo eran aplicables a las vacunas tradicionales y, como resultado, no se evaluaron las características farmacológicas y farmacodinámicas ni los riesgos de seguridad exclusivos de los medicamentos a base de ácidos nucleicos.4 En resumen, la cantidad permitida de ADN por dosis según las directrices del organismo regulador de la OMS es de 10 ng.14 Estas pautas se aplican a fragmentos de ADN desnudos de menos de 200 pb y no al ADN que se transfecta dentro de LNP. Las pautas tampoco tienen en cuenta la administración de dosis múltiples de la misma vacuna o plataforma, el riesgo de secuencias reguladoras, la integración de fragmentos de ADN pequeños (de 7 pb a 200 pb) o la entrada/integración nuclear.
El ARNm de la inyección se modifica ampliamente para mejorar su estabilidad y eficiencia en la producción de proteína pico,15 así como hacer que el modRNA sea “inmunológicamente silencioso”.16 El modRNA utilizado en los LNP no es un ARNm de origen natural, sino un modRNA diseñado biológicamente en el que todas las uridinas han sido reemplazadas por N1-metilpseudouridina sintética.17 Además, el ARNm también está optimizado en cuanto a codones y contiene secuencias humanas en el 5-UTR y el 3-UTR, así como una cola de poli(A) segmentada bioingenierizada.
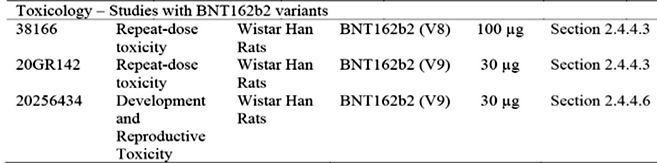
El problema de modificar el ARNm reemplazando todas las uridinas con N1-metilpseudouridina es que produce una “secuencia resbaladiza” (UUU o ΨΨΨ) que causa problemas para la unión del ARNt al ARNm durante la traducción del ARN a la producción de aminoácidos en el ribosoma. Esta secuencia resbaladiza hace que los ribosomas se “salten” durante la traducción (es decir, cambio de marco ribosómico) y produce una amplia gama de proteínas de pico aberrantes y degeneradas. Esto es un problema de seguridad ya que la producción de proteínas de pico de varios tamaños puede causar respuestas inmunes variables, de bajo rendimiento y/o alteradas, así como el potencial de enfermedad similar a la causada por priones, especialmente si las proteínas de pico no están unidas a una membrana celular.18 El código “propenso a errores” también constituye un problema de seguridad con un potencial significativo de ser dañino y provocar respuestas autoinmunes y otros efectos toxicológicos desconocidos.19Los estudios de toxicología de Pfizer/BioNTech se enumeran en la Tabla 2.
Tabla 2. Estudios toxicológicos extraídos del Módulo 2.4 de BNT162b2 de Pfizer/BioNTech. Descripción general no clínica.8,
Los estudios toxicológicos de Pfizer/BioNTech se realizaron con ratas Wistar Han™. Este enfoque es inusual por dos razones. En primer lugar, el procedimiento estándar para los estudios toxicológicos es utilizar dos especies (una de roedores y otra de no roedores); en este caso, la segunda especie habría sido el primate macaco. En segundo lugar, aunque no es tan obvio, la selección de las especies utilizadas para estos estudios no se correlaciona con la fisiología humana. Las ratas en estado salvaje están asociadas con al menos 55 patógenos diferentes que pueden transmitirse a los humanos; el SARS-CoV-2 no es uno de ellos. Por lo tanto, al igual que los ratones con los que están estrechamente relacionados genéticamente, su receptor ACE2 no se une a la proteína de pico del SARS-CoV-2.20 Si bien se esperaría que las ratas produzcan anticuerpos neutralizantes contra la proteína de la espícula codificada, cualquier posible efecto de toxicidad observado probablemente se deba principalmente a las LNP únicamente, no a la proteína de la espícula no unida. En concreto, no se esperaría que presentaran efectos adversos asociados con la proteína de la espícula, ya que no se une a su diana ACE2. La especie de roedor más relevante habría sido el hámster dorado chino.21,22 Estudios realizados tras el brote de SARS-CoV-1 de 2003-2004 determinaron que la unión de la proteína de pico viral al receptor ACE2 es tóxica para los humanos.11,12 Sin embargo, como los estudios realizados sobre la proteína de pico del SARS-CoV-2 utilizaron el modelo animal incorrecto, no se pudo determinar la toxicidad debido a los efectos fuera del objetivo de las proteínas de pico.
Estudios de biodistribución
El Módulo 2.5 Descripción clínica general de BNT162b2 de Pfizer/BioNTech, sección 2.5.2.2, Estudios biofarmacéuticos,23, pág. 27 afirma:
Las evaluaciones de biodisponibilidad y bioequivalencia no son relevantes para la antigenicidad de la vacuna y no se han medido. El principal efecto farmacodinámico de una vacuna, a diferencia de un fármaco, es provocar una respuesta inmunitaria a los antígenos incluidos en la vacuna. La activación inducida por la vacuna de las células presentadoras de antígenos tiene lugar en el lugar de la inyección (es decir, el músculo), a la que sigue rápidamente la migración de las células presentadoras de antígenos a través de los vasos linfáticos hacia el ganglio linfático de drenaje, donde los antígenos de la vacuna activan células B y T específicas. No se requiere un nivel específico de antígeno de la vacuna en sangre para provocar la respuesta inmunitaria.
Dado que el antígeno (proteína pico codificada) no está incluido en la inyección de ARNm, las afirmaciones realizadas en esta descripción clínica son engañosas. Pfizer/BioNTech no tenía idea de cuánta proteína pico se genera in vivo ni dónde se distribuye posteriormente dentro del cuerpo humano. Además, Pfizer/BioNTech asumió que la vacuna de ARNm reside en el lugar de la inyección, concluyendo que no es necesario medir la proteína pico en la sangre. Esta conclusión es incorrecta según los datos del estudio de biodistribución del propio Pfizer/BioNTech que aparecieron después de la autorización de uso de emergencia de la FDA, en el que se demostró que las LNP se distribuían a una variedad de tejidos probablemente mediada por la entrada de las LNP en el torrente sanguíneo.8, pág. 17
Aunque no se realizaron estudios farmacocinéticos o de biodistribución tradicionales con BNT162b2 específicamente, ni con la formulación final de modRNA/LNP utilizada clínicamente, Pfizer/BioNTech realizó un estudio no clínico en el que se evaluó la biodistribución utilizando luciferasa como proteína marcadora sustituta, ya que se asumió que era poco probable que cambiar la secuencia codificante del ARNm afectara su biodistribución o sus propiedades fisicoquímicas. Sin embargo, las diferencias entre el ARN portador de la luciferasa y los nucleósidos de BNT162b2 (es decir, el modRNA) podrían afectar potencialmente la estabilidad o la persistencia de la señal medida, ya que la proteína de la espícula tiene una vida media más larga que la luciferasa.24 Además, no se especificó la duración de los estudios de biodistribución de las inyecciones.5 Utilizando ARN que codifica la luciferasa formulada como la “provacuna” BNT162b2, con una composición lipídica idéntica, el Módulo 2.4. Descripción general no clínica, Sección 2.4.3.4., Distribución, BNT162b2 de Pfizer/BioNTech8, pág. 17 afirma:
En un estudio in vivo (R-20-0072; Resumen tabulado 2.6.5.5A), se evaluó la biodistribución utilizando luciferasa como una proteína marcadora sustituta, con ARN que codifica la luciferasa formulada como BNT162b2, con la misma composición lipídica. El modRNA que codifica la luciferasa formulado con LNP se administró a ratones BALB/c mediante inyección IM de 1 μg en cada pata trasera derecha e izquierda (para un total de 2 μg). Mediante bioluminiscencia in vivo después de la inyección del sustrato de luciferina, se detectó la expresión de la proteína luciferasa en diferentes puntos temporales en el sitio de la inyección y, en menor medida y de forma más transitoria, en el hígado (Figura 2.4.3-2). La distribución al hígado probablemente esté mediada por los LNP que entran al torrente sanguíneo. La expresión de luciferasa en los sitios de inyección descendió a niveles de fondo después de 9 días….
Se espera que la biodistribución del antígeno codificado por el componente de ARN de BNT162b2 dependa de la distribución de LNP y los resultados presentados deberían ser representativos de la plataforma de ARN de la inyección, ya que el modARN que codifica la luciferasa formulado por LNP tenía la misma composición lipídica.
Cabe señalar que en la descripción general no clínica se afirma que: “La distribución al hígado probablemente esté mediada por las LNP que ingresan al torrente sanguíneo”. Por lo tanto, tanto Pfizer/BioNTech como la FDA sabían de antemano que era incorrecto suponer que la generación in vivo de la proteína de la espícula estaría restringida al músculo deltoides. Esto se confirmó en un estudio posterior de distribución tisular en ratas Wistar Han™ utilizando un modRNA que codifica luciferasa formulado con LNP con exactamente la misma composición lipídica que BNT162b2 (Estudio 185350; Resumen tabulado 2.6.5.5B).25,26 El colesterol en el LNP fue radiomarcado y la señal se midió mediante autorradiografía cuantitativa de cuerpo entero (QWBA), considerada el estándar de la industria para la terapéutica del ARN.3
Con base en los resultados de biodistribución anteriores, se puede concluir que, si se administrara BNT162b2 en lugar del sustituto, la producción in vivo de proteína de la espiga también probablemente ocurriría en el hígado, las glándulas suprarrenales, el bazo, los ovarios y en otros lugares. Aunque no se examinó la distribución de la proteína de la espiga en sí, se espera que sea extensa ya que la proteína de la espiga tiene fácil acceso al torrente sanguíneo. Las LNP tienen selectividad para ciertos tipos de tejido y transporte dentro de la célula, lo que requiere medir las acciones de las LNP, el ARNm y la proteína de la espiga por separado. Por lo tanto, los estudios de biodistribución deben medir la distribución de cada uno de estos componentes por separado y simultáneamente, ya que no siempre existe una correlación entre dónde se encuentran las LNP en el cuerpo y dónde y cuánta proteína de la espiga se produce.3 Estos estudios no se realizaron.
Dado que las LNP tienen actividades similares a las de los adyuvantes,27 Se indicó una evaluación inmunológica y de seguridad exhaustiva y un seguimiento potencialmente más prolongado para detectar eventos adversos en comparación con lo que se requería según las pautas de vacunación de la OMS de 2005. Además, solo alrededor del 1-2% de las LNP resultan en una transfección exitosa que conduce a la producción de proteína de pico, y la disposición de las LNP restantes no se conoce por completo.28 Debido a que el paso limitante de la velocidad de producción de proteínas es la liberación de los endosomas después de la transfección, se ha propuesto la toxicidad de las LNP almacenadas en los endosomas.29 No se han realizado evaluaciones de estos riesgos de los LNP.
Otros estudios toxicológicos
Documento de descripción general no clínica de Pfizer/BioNTech, sección 2.4.4.4., Genotoxicidad,8, pág. 29 afirma:
No se planean estudios de genotoxicidad para BNT162b2 ya que los componentes de la inyección son lípidos y ARN y no se espera que tengan potencial genotóxico.
Y nuevamente, en la sección 2.4.4.5. Carcinogenicidad, el documento afirma:
No se han realizado estudios de carcinogenicidad con BNT162b2 ya que los componentes de la inyección son lípidos y ARN y no se espera que tengan efectos cancerígenos o potencial tumorígeno. En general, no se considera necesario realizar pruebas de carcinogenicidad para respaldar el desarrollo y la autorización de productos vacunales para enfermedades infecciosas.
Aunque no se espera que BNT162b2 tenga potencial genotóxico o cancerígeno, la proteína pico codificada que se produce sí lo tiene.30 Por lo tanto, estos estudios deberían haberse realizado, pero no se hicieron. O sea, la Sección 2.4.4.6. Toxicidad reproductiva y del desarrollo muestra que estos estudios se realizaron utilizando ratas Wistar Han™, una especie de roedor que es totalmente inadecuada para estudios toxicológicos. Se debería haber elegido una especie más relevante para los estudios de toxicidad en las crías en desarrollo. Además, la distribución de la proteína de la espícula en los tejidos tanto de la madre como de las crías habría proporcionado información muy necesaria sobre si BNT162b2 es adecuado para administrar a mujeres embarazadas y madres que están amamantando. Además, no se estudiaron ratas macho y se desconocen los datos sobre la fertilidad masculina. Además, recientemente se ha documentado que el ARNm puede predisponer al cáncer a individuos por lo demás sanos.31
Estudios clínicos
Módulo 2.5 BNT162b2 de Pfizer/BioNTech, sección Descripción general clínica 2.5.3, Descripción general de la farmacología clínica,23, pág. 27 afirma: “Normalmente no se requieren estudios farmacocinéticos para las vacunas. No es posible medir la concentración plasmática de la vacuna a lo largo del tiempo”.
Dado que la inyección BNT162b2 no es una vacuna tradicional, la farmacocinética de la proteína de pico codificada (es decir, el antígeno viral) debería haberse determinado como parte de ensayos clínicos de fase I de dosis ascendente. Esto nunca se estudió. Un perfil farmacocinético completo mostraría la variabilidad en los niveles de proteína de pico producidos entre individuos. Lamentablemente, la variabilidad sigue siendo desconocida. Además, los efectos adversos podrían haberse cotejado con las concentraciones de proteína de pico en la sangre. En una reunión celebrada el 15 de junio de 2022, el Dr. Portnoy, miembro del Comité Asesor de Vacunas y Productos Biológicos Relacionados (VRBAC) de la FDA, preguntó al Dr. W. Gruber de Pfizer qué células producen proteína de pico, cuánta producen y durante cuánto tiempo. El Dr. Gruber descartó esta pregunta por considerarla académica.32 Comprender estas preguntas básicas es esencial para entender la seguridad de las inyecciones de ARNm. Hasta la fecha, estas preguntas aún no han recibido respuesta. De hecho, un estudio realizado por investigadores de Stanford demostró la persistencia tanto del ARNm como de la proteína de pico durante hasta 60 días.33
Perfil de seguridad
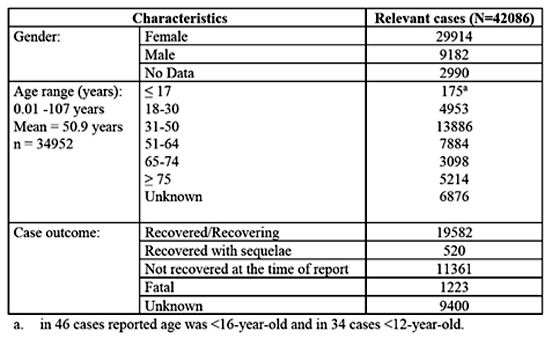
La sección 5.3.6 del módulo de Pfizer/BioNTech “Análisis acumulativo de informes de eventos adversos posteriores a la autorización”34 La Tabla 1 en la página 7 de su informe (incluida aquí como Tabla 3 a continuación), muestra 1.223 muertes. durante un período de 3 meses (del 1 de diciembre de 2020 al 28 de febrero de 2021).
Tabla 3. Descripción general: características seleccionadas de todos los casos recibidos durante el intervalo de notificación
Extraído de: https://phmpt.org/wp-content/uploads/2022/04/reissue_5.3.6-postmarketing-experience.pdf
Tal tasa de mortalidad tan alta después de una intervención médica habría dado lugar a que cualquier otro medicamento se retirara del mercado de inmediato. Por lo tanto, cabe preguntarse: ¿por qué se permitió que las inyecciones de ARNm siguieran utilizándose?
Los resultados de los casos de 9.400 personas se clasifican como “desconocidos”. ¿Cuántas de ellas murieron? Además, de la Tabla 3, había 6.876 personas cuya edad no se pudo determinar. De las 11.361 personas que no se habían recuperado en el momento de este informe inicial, ¿cuántas de ellas murieron posteriormente? ¿Se debió simplemente a una documentación deficiente o hay otra explicación? De cualquier manera, tales fallas en la documentación de un estudio regulado deberían haberse investigado más a fondo y los hallazgos deberían haberse documentado.
Implicaciones de la aprobación de la inyección de ARNm de Pfizer/BioNTech contra la COVID-19 basada en datos defectuosos e incompletos
Seguridad
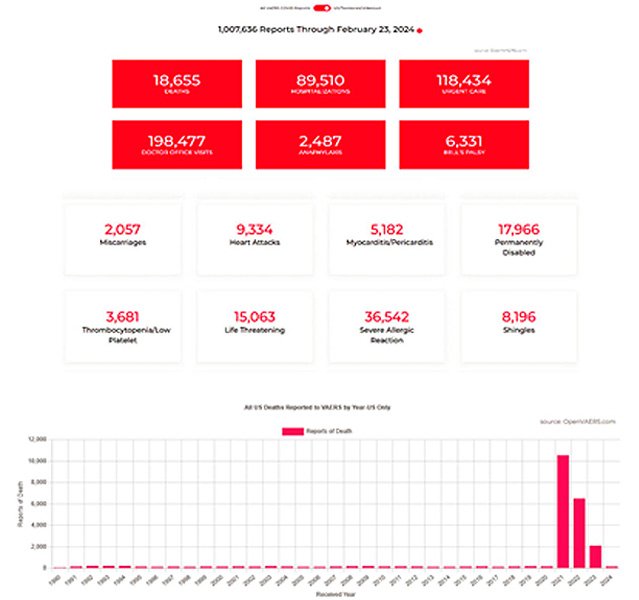
El VAERS (Sistema de notificación de efectos adversos de las vacunas) es una base de datos que mantiene la FDA y los CDC con informes de lesiones posteriores a la vacunación, diseñada para detectar posibles problemas de seguridad con una vacuna. OpenVAERS es una superposición disponible al público que permite explorar y buscar informes del VAERS sin necesidad de realizar una búsqueda avanzada.35 Es bastante laborioso y presentar un informe al VAERS lleva mucho tiempo, pero un profesional médico o un miembro del público puede presentar un informe con información detallada sobre la lesión. Los médicos y otros profesionales médicos suelen presentar informes cuando sospechan que la vacuna ha causado el evento adverso. Presentar una reclamación falsa conlleva el riesgo de recibir fuertes multas federales o prisión. El sistema de presentación de informes en sí es transparente y muy detallado y, como resultado, muchos profesionales no presentan informes, incluso en el caso de eventos adversos graves, debido al tiempo que requiere, el hecho de que se puede desalentar la presentación de informes u otros factores sistémicos.36 Esta falta de informes ha dado lugar a que VAERS subestime el número real de eventos adversos,37 como es habitual en los sistemas de farmacovigilancia pasiva.38 Desde el lanzamiento de las inyecciones de ARN modificado contra la COVID-19, se ha producido un gran aumento en el número de eventos adversos graves, incluidas muertes (Figura 1). Existe un marcado contraste entre la respuesta a la vacuna contra el rotavirus (Rotashield®), en la que 15 casos de invaginación intestinal llevaron a la rápida retirada de esta vacuna del mercado,39 y la de Pfizer/BioNTech BNT162b2. Debido al enorme aumento de eventos adversos graves y muertes, uno debe preguntarse: ¿Qué se necesita antes de que se tomen medidas correctivas?
Para responder a esa pregunta, si este nivel de daño hubiera ocurrido en la industria de la aviación, todos los aviones de esa marca y modelo quedarían en tierra hasta que se localizara y reparara la falla.40Sin embargo, en el caso de las inyecciones BNT162b2 no se tomó ninguna medida similar.
Figura 1. Resúmenes de Red Box de la base de datos VAERS, que muestran los eventos adversos de la vacuna contra la COVID-19 notificados hasta el 23 de febrero de 2024 (solo en EE. UU./países nacionales), de openVAERS.com
A parte de Salud de Florida,41 los funcionarios gubernamentales siguen promoviendo agresivamente las inyecciones de ARN modificado contra la COVID-19 entre la población como “seguras y efectivas”, a pesar de que “la ciencia” muestra todo lo contrario.
En febrero de 2021, tanto Pfizer/BioNTech como la FDA ya eran conscientes de que el producto entrañaba riesgos importantes. En el VAERS se estaban documentando efectos adversos relacionados con la vacuna. Sin embargo, las autoridades gubernamentales siguen promocionando las inyecciones de ARN modificado contra la COVID-19 como muy eficaces, y están promoviendo la vacunación con las últimas dosis de refuerzo para el mayor número posible de personas. Mientras tanto, estas autoridades aceptan una cifra de muertes superior a la que se toleraría con otra vacuna o medicamento. Esta tasa de mortalidad se acepta como un “daño colateral” en beneficio de un bien mayor. Sin embargo, ¿es acertada la suposición de que las inyecciones de ARN modificado contra la COVID-19 son muy eficaces? Hay dos puntos a tener en cuenta.
- ¿Existe una prueba definitiva de que las inyecciones de ARNm modificado contra la COVID-19 detuvieron la propagación de la infección y salvaron vidas, es decir, los beneficios potenciales superan los riesgos conocidos?
- ¿Había medicamentos alternativos que fueran seguros y efectivos y estuvieran fácilmente disponibles para el tratamiento de pacientes infectados con COVID-19?
Eficacia
Los ensayos iniciales se interrumpieron todos prematuramente y tuvieron graves fallos al ofrecerle la inyección al grupo de control después de sólo unos meses.42 Los investigadores criticaron la revelación de los datos a los pacientes que recibieron placebo para recibir la inyección debido a la pérdida de datos confiables futuros, especialmente en los ancianos. Esta revelación “establecerá un estándar de facto para todos los ensayos de vacunas futuros”.43 Por lo tanto, en ausencia de ensayos clínicos aleatorizados con la potencia adecuada, es imposible demostrar de manera definitiva que las inyecciones de ARNm modificado contra la COVID-19 sean eficaces para reducir el punto final binario de la enfermedad leve por COVID-19. No se ha realizado ningún ensayo prospectivo, doble ciego, aleatorizado y controlado con placebo sobre la vacunación contra la COVID-19 que haya demostrado reducciones en la hospitalización y la muerte. Asimismo, ningún estudio válido no aleatorizado que controle la terapia temprana con múltiples fármacos, la inmunidad natural y las cepas progresivamente más leves del SARS-CoV-2 demostró que la vacunación estuviera asociada con reducciones en los puntos finales duros. Además, ¿cómo se puede demostrar la eficacia, ya que ahora se sabe que estas inyecciones no previenen la transmisión o la aparición de la enfermedad?44 Finalmente, los estudios disponibles mostraron que cualquier efecto protector teórico de la vacunación duró menos de seis meses.45
En lugar de datos reales, se han utilizado modelos para predecir lo que habría sucedido si la pandemia de COVID-19 hubiera ocurrido en ausencia de vacunas. Uno de esos estudios46 predijo que las inyecciones de ARN modificado contra la COVID-19 y las medidas de salud pública fueron responsables de salvar hasta 800.000 vidas en Canadá. Este modelo utilizó datos recopilados entre el 7 de febrero de 2020 y el 31 de marzo de 2022. La población canadiense durante ese tiempo era de aproximadamente 38 millones47 y se sugirió que la tasa de mortalidad promedio de la cepa de Wuhan era del 2,3%.48 Solo asumiendo que las variantes posteriores menos letales/más contagiosas tuvieron la misma tasa de mortalidad que la cepa original de Wuhan, que no existía inmunidad adquirida naturalmente y que todos se infectaron, obtenemos una cifra cercana a la de la publicación del modelo previsto, es decir, 38.000.000 (población canadiense) X 2,3% (tasa de mortalidad) = 874.000 vidas salvadas.
Al 22 de mayo de 2020, antes del lanzamiento de la inyección de ARNm modificado contra la COVID-19, el número de muertes en Canadá era de 2.305 “con” COVID (es decir, la COVID podría no haber sido la causa de la muerte).49 Para la misma fecha, el número de casos notificados era de 80.142,50 lo que arroja una tasa de mortalidad por infección calculada del 2,9%. Por lo tanto, se consideró razonable una tasa de mortalidad del 2,3% para la cepa de Wuhan y se utilizó en el cálculo.48
Por lo tanto, decir que la publicación de este modelo es tendenciosa sería quedarse corto. Las hipótesis utilizadas eran obviamente poco realistas.
Además, las variantes dominantes posteriores durante ese período, que terminaron con Ómicron, tuvieron mayor infectividad, pero mucha menos letalidad. En otro estudio, los investigadores estudiaron la relación entre el porcentaje de población completamente vacunada y los nuevos casos de COVID-19 en 68 países y en 2.947 condados de los EE. UU. No se encontró correlación entre la tasa de vacunación y los nuevos casos de COVID-19.51 Hasta que se realice un ensayo clínico aleatorizado adecuado, las conclusiones basadas en modelos predictivos no son más que conjeturas. Por lo tanto, tanto con los modelos predictivos como con los análisis de población, se debe concluir que los posibles beneficios de las inyecciones BNT162b2 están asociados con considerables riesgos conocidos y desconocidos.35
Tratamientos alternativos seguros y eficaces para la COVID-19
El 11 de diciembre de 2020, la FDA emitió una autorización de uso de emergencia (EUA) para que la inyección COVID-19 de Pfizer-BioNTech se distribuya en los EE. UU.52 “Para que la FDA emita una EUA, no debe existir una alternativa adecuada, aprobada y disponible al producto candidato para diagnosticar, prevenir o tratar la enfermedad o afección”.53 Sin embargo, al comienzo de la pandemia de COVID-19, hubo evidencia abrumadora que indicaba que la ivermectina (IVM),54-60 y la hidroxicloroquina (HCQ)61 Los protocolos multimedicamentosos basados en la inyección contra la COVID-19 fueron agentes activos cuando se utilizaron en forma temprana contra la COVID-19. Sin embargo, la literatura médica y gubernamental demonizó el tratamiento farmacológico no aprobado de los pacientes con COVID-19 a favor de las inyecciones de ARN modificado contra la COVID-19.
Se realizaron varios ensayos controlados aleatorios (ECA) que estaban mal diseñados y ejecutados, y, sin embargo, estos resultados fueron ampliamente citados por los medios de comunicación y las recomendaciones de políticas gubernamentales como prueba de que la IVM era ineficaz contra la COVID-19. En particular, el ensayo TOGETHER62 fue un ensayo clínico aleatorizado de alto perfil que concluyó que la IVM no era eficaz para tratar a pacientes con COVID-19. Este ensayo clínico aleatorizado tuvo varias deficiencias críticas que invalidaron efectivamente el estudio.63 Por el contrario, un estudio de observación clínica en un centro de cuidados de larga duración en Francia64El estudio de observación demostró definitivamente que la IVM utilizada para tratar a los pacientes era segura y eficaz contra la COVID-19. La integridad de los datos se puede verificar fácilmente y nunca se cuestionó. Si las inyecciones contra la COVID-19 en lugar de la IVM hubieran dado resultados tan claros, el estudio observacional habría tenido cobertura mediática mundial. En cambio, lo que sucedió en el centro de cuidados de larga estancia en Francia permanece oculto a simple vista. Como prueba de que la IVM ha salvado al menos una vida, existe un estudio de caso convincente en el que un paciente estuvo a punto de morir.65
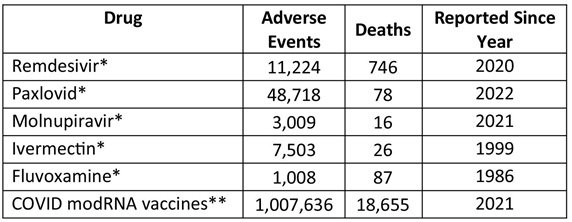
IVM ha estado en el mercado durante más de 40 años con más de 4 mil millones de tratamientos administrados y se ha demostrado que es segura (ver Tabla 4).66 Sin embargo, las autoridades gubernamentales incluso prohibieron los tratamientos que utilizan medicamentos reutilizados, como la IVM, para el tratamiento de la COVID-19, y en su lugar se promovieron tratamientos más tóxicos y no probados, como el remdesivir y las inyecciones de ARN modificado contra la COVID-19 empleadas en virtud de la EUA. Hubo una notable excepción, en la que las autoridades gubernamentales realmente escucharon a los profesionales de la salud que están en primera línea. Los médicos de Zimbabue apelaron formalmente al gobierno para utilizar el IVM para tratar a los pacientes con COVID-19, afirmando que el medicamento ha demostrado ser «un cambio radical» sobre el terreno.67 En un aviso a la Autoridad de Control de Medicamentos de Zimbabwe (MCAZ), el Dr. Mudyirandima, Secretario del Ministerio de Salud, declaró:68
“En estos tiempos difíciles del tratamiento de la COVID-19, debemos tener cuidado de proteger a los pacientes y de no negarles regímenes de tratamiento eficaces. Es en este sentido que se le otorga la autoridad para proceder en virtud de la Sección 75 de la Ley de Control de Medicamentos y Sustancias Aliadas para permitir la importación y el uso de estos medicamentos bajo la supervisión y la orientación que usted ha indicado.
La ivermectina se puede evaluar tanto para el tratamiento como para la profilaxis. Posteriormente, la MCAZ emitió una circular que permite el uso de IVM para la prevención y/o tratamiento del COVID-19”.69
Tabla 4. Historial de seguridad de los medicamentos utilizados para tratar la COVID-19
- De www.Vigiaccess.org, consultado en marzo de 2024 (en todo el mundo)
- De VAERS, 23 de febrero de 2024 (solo EE. UU., territorios y zonas desconocidas)
La situación actual
El SARS-CoV-2 y la COVID-19 seguirán con nosotros durante muchos años y es probable que el virus aparezca estacionalmente. La letalidad de la COVID-19 ha disminuido considerablemente desde que la variante ómicron reemplazó a la variante Delta. Sin embargo, se sigue animando a las personas a que se mantengan al día con las dosis de refuerzo de la inyección de ARNm contra la COVID-19. Otro problema es que el “COVID prolongado” y las “lesiones por vacunas” tienen apariencias clínicas muy similares, y los efectos adversos de las inyecciones de ARNm contra la COVID-19 siguen acumulándose. Los efectos adversos a corto plazo asociados con la proteína de pico incluyen, entre otros: miocarditis y otras afecciones inflamatorias,70-74 enfermedad autoinmune,75 coágulos de sangre y trombosis,76-78 enfermedad neurológica,79,80 insuficiencia multiorgánica y casos de COVID prolongado relacionados con la inyección.81,82
Si bien la proteína de pico en sí y las LNP son tóxicas, no son el único problema de la inyección de ARNm modificado contra la COVID-19 de Pfizer/BioNTech. Esta inyección también contiene grandes cantidades de ADN plasmídico residual y fragmentado del proceso de fabricación de cebo.83-85 Si bien los organismos reguladores permiten hasta 10 ng/dosis de ADN residual,14,86,87 estas pautas son para fragmentos de ADN desnudos ≤200 pb y no para ADN plasmídico protegido dentro de nanopartículas lipídicas (LNP). Los datos han demostrado que las LNP son capaces de aumentar significativamente la entrada de ARN o ADN a las células.88 Las directrices tampoco tienen en cuenta la administración de dosis múltiples de la misma inyección o plataforma, el riesgo de secuencias reguladoras, la posible integración de fragmentos pequeños de ADN (de 7 pb a 200 pb) o la entrada/integración nuclear. En un estudio canadiense, Speicher et al. descubrieron que, si bien la cantidad de ADN plasmídico residual en las inyecciones de Pfizer determinada por qPCR era inferior a 10 ng/dosis, el ADN total cuando se analizó por fluorometría era de 1.896 a 3.720 ng/dosis.83 Un estudio alemán publicado mostró que el ADN total después de la lisis de las LNP con Triton-X-100 fue de 3.600 a 5.340 ng/dosis.89
Desde el lanzamiento de la inyección contra la COVID-19 en 2021, ha habido un gran aumento en la morbilidad y la mortalidad por neoplasias malignas.90,91 Existen varios mecanismos que pueden explicar la asociación observada entre la vacuna proactiva y el riesgo de oncogénesis,30 incluido el promotor-potenciador-ori de SV40 que se encuentra en las inyecciones de ARN modificado contra la COVID-19 de Pfizer/BioNTech. Esta secuencia fue identificada por primera vez por McKernan et al. en abril de 2023, después de secuenciar el ADN residual tanto en la inyección pro de Pfizer/BioNTech como en la de Moderna en el producto farmacéutico final que se encuentra en los viales.84 Sorprendentemente, el análisis identificó las secuencias promotoras/potenciadoras/ori de SV40, a veces como una secuencia intacta de 317 pares de bases. No se identificaron secuencias de SV40 en la inyección provacuna de Moderna. También se identificaron otras secuencias, incluida una señal poli (A) de SV40, un promotor AmpR, una señal poli (A) de HSV-TK y un marco de lectura abierto (ORF) inverso que abarca la secuencia completa de la proteína de pico.
Las inyecciones de ARNm modificado contra la COVID-19 de Pfizer-BioNTech utilizaron un plásmido de terapia génica,92 que contenía un casete promotor-potenciador-ori de SV4083 que no fue revelado a los reguladores,93,94 contrariamente a las directrices reglamentarias.95, pág. 95-96
El hecho de que el elemento regulador potenciador SV40 promueva la localización nuclear y la integración genómica del huésped cuando se insertan fragmentos que contienen el potenciador SV40 en el citoplasma no es nuevo. Un estudio de 1999 realizado por David Dean et al. demostró que tan solo entre 3 y 10 copias de fragmentos de ADN con un potenciador SV40 de 72 pb inyectados en el citoplasma en células que no se dividen aumenta en gran medida su capacidad de ser transportados al núcleo.96 (Así es como se insertan en las células los fragmentos de ADN dentro de los LNP en las inyecciones de ARNm modificado contra la COVID). Esto no es una mera especulación. Un trabajo preliminar realizado en Alemania ha encontrado evidencia de la integración genómica de todo el marco de lectura abierto del ADN de la espícula de la vacuna contra la COVID-19. Después de que células de cáncer de ovario humano (OVCAR-3) se expusieran en un cultivo celular durante la noche a la vacuna de ARNm modificado de Pfizer, se descubrió que todo el ADN de la espícula del SARS-CoV-2 tal como se secuenció en la vacuna de Pfizer se había integrado en el genoma en los cromosomas 9 y 12.97 Por lo tanto, la integración en el genoma humano es posible y es muy posible que se produzca en las células primarias de una persona vacunada. Además, el promotor SV40 puede unirse al gen supresor de tumores p53 (es decir, el guardián del genoma) y potencialmente inactivar el p53, lo que proporciona otro mecanismo para impulsar la oncogénesis.96,98,99
Algunas publicaciones científicas ahora vinculan el cáncer y otras enfermedades únicamente con la infección por COVID-19.100,101 En estas publicaciones, los autores no habían considerado la posibilidad de que las vacunas también pudieran ser responsables de estas patologías, ya que la presencia de la proteína espiga es común a ambos. Debido a los datos incompletos de los estudios aleatorizados y a la dependencia de los datos de estudios observacionales que carecen de buenos comparadores, puede ser difícil diferenciar entre los efectos adversos de las inyecciones de ARN modificado de COVID-19 y las complicaciones y comorbilidades de una enfermedad cuya historia natural aún no se comprende por completo. Sin embargo, dado que es posible que la proteína espiga o spike producida tanto por el virus como por la inyección sea responsable de estas patologías, es prudente aceptar que tanto el SARS-CoV-2 como las proteínas espiga generadas a partir de las inyecciones de ARN modificado de COVID-19 son potencialmente responsables de estos aumentos en el cáncer.102
Para determinar en qué medida las inyecciones de ARNm modificado pueden contribuir al riesgo de cáncer, los estudios epidemiológicos deben incluir una historia clínica completa, considerando no solo la infección, sino también el estado de la inyección de ARNm modificado y el número de dosis de refuerzo administradas. Además, ciertas variantes del SARS-CoV-2 parecen haber causado una enfermedad grave en la población más joven.103-105 La tolerancia inmunológica a la infección por SARS-CoV-2 ocurre cuando un individuo ha estado expuesto a la proteína espiga durante un período prolongado después de varias inyecciones de refuerzo de la inyección modRNA contra la COVID-19.106 Las consecuencias de esto son infecciones repetidas y más graves por SARS-CoV-2. Además, debido a que el ARNm modificado empleado en estas inyecciones está modificado para mejorar la estabilidad del ARNm,107 esto permite que la proteína de pico se genere durante un período de tiempo prolongado,108 con graves consecuencias, especialmente si la persona tiene el sistema inmunitario comprometido o es inmunotolerante.
La proteína pico generada por la inyección que circula podría causar una variedad de lesiones relacionadas con la inyección. Estas lesiones bien documentadas35,37 son consistentes con el modo de acción de la proteína pico como se mencionó anteriormente. Una revisión reciente describe las preocupaciones únicas con las inyecciones de ARNm, incluidos los efectos tanto de estimulación como de inhibición del sistema inmunitario.109
Discusión
Los estudios proporcionados por Pfizer/BioNTech a la FDA y otras autoridades reguladoras eran fundamentalmente defectuosos e insuficientes para demostrar la seguridad y eficacia. Pfizer/BioNTech no logró determinar las concentraciones y la estructura de la proteína de pico codificada en sus estudios no clínicos y clínicos. Dichos estudios son fundamentales para determinar la farmacología, farmacodinámica y farmacocinética de un «profármaco» como el representado por las inyecciones Pfizer/BioNTech. Pfizer/BioNTech realizó un estudio de biodistribución utilizando un ARNm sustituto que codifica la luciferasa en lugar de la proteína de pico. El estudio demostró que las LNP se distribuyeron a una variedad de tejidos diferentes, incluidos el hígado, el bazo, las glándulas suprarrenales, los órganos reproductivos y el cerebro. Se sabía que la suposición de que la inyección de ARNm residiría en el lugar de la inyección, es decir, el músculo deltoides, era falsa. Los propios datos de Pfizer/BioNTech mostraron que la proteína de pico también se expresaría en estos tejidos distales. Estos datos ayudan a explicar el alcance y la variedad de efectos adversos graves de la inyección de ARNm observados en humanos.7,35,110
Pfizer/BioNTech tampoco realizó estudios clínicos de fase 1 con dosis ascendentes adecuados, que habrían proporcionado información importante sobre la cantidad de proteína de pico codificada producida y su distribución entre individuos. No se ha estudiado el efecto acumulativo de la administración continua de dosis más allá de la serie primaria de hasta 12 inyecciones para los inmunodeprimidos. Dado que se sabía que la proteína de pico era tóxica, utilizando los propios datos de Pfizer/BioNTech, la afirmación de que la inyección de ARNm modificado es segura es dudosa. Además, no se determinaron las características de seguridad, genotoxicidad, carcinogenicidad o excreción a corto plazo de la inyección de ARNm modificado, ya que las directrices regulatorias de la inyección no lo exigían, y aún no se han determinado los efectos adversos a largo plazo, como el cáncer, las enfermedades neurológicas o autoinmunes.
Por último, Pfizer/BioNTech no pudo establecer adecuadamente la seguridad a corto o largo plazo de las inyecciones de ARN modificado. El proceso de revisión continua utilizado por las autoridades regulatorias de todo el mundo, incluidas la FDA, la Agencia Médica Europea y Health Canada, reveló cuestiones preocupantes, que fueron ignoradas o rebajadas en las evaluaciones publicadas de las inyecciones contra COVID-19, lo que plantea dudas sobre la efectividad, la veracidad y la confiabilidad de nuestras agencias regulatorias.111
Conclusión
En el caso de cualquier otro medicamento, la solicitud de autorización de comercialización se habría considerado incompleta y, muy probablemente, rechazada. Por lo tanto, se debería, como mínimo, establecer una moratoria sobre el uso de las inyecciones y las dosis de refuerzo de Pfizer/BioNTech contra COVID-19, pero lo ideal sería que se las retirara del mercado y se detuviera su uso en humanos. La responsabilidad de determinar si una intervención médica es segura debería recaer en la industria farmacéutica, no en científicos independientes. Según los datos de Pfizer/BioNTech, no se ha demostrado la seguridad de su inyección de ARN modificado contra COVID-19.
Philip R. Oldfield, doctor en filosofía, Recientemente jubilada como consultora científica y regulatoria, Dragon, Quebec, Canadá. L. Maria Gutschi, B.Sc.Phm, Pharm.D., es consultora farmacéutica, Ottawa, Ontario, Canadá. Peter A. McCullough, MD, MPH, es internista, cardiólogo, epidemiólogo y director científico de The Wellness Company y presidente de la Fundación McCullough, EE. UU. David J. Speicher, Ph.D., es investigador asociado sénior en el Departamento de Patobiología, Universidad de Guelph, Guelph, Ontario, Canadá. Contacto: phillyraccoon@gmail.com .
Colabore por favor con nosotros para que podamos incluir mas información y llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
Via PAYPAL: Euros o dólares click aqui
ARGENTINA 10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Solicite nuestro CBU contactenos
REFERENCIAS
1. Orden de Pittman MT. Profesionales de la salud pública y médicos por la transparencia contra la FDA; 6 de enero de 2022. Disponible en: https://phmpt.org/wp-content/uploads/2022/01/ORDER_2022_01_06.pdf. Consultado el 12 de abril de 2024.
2. Deese K. Judge descarta el plazo de 75 años de la FDA para publicar los datos de seguridad de la vacuna Pfizer, lo que le da a la agencia ocho meses. Washington Examiner, 7 de enero de 2022. Disponible en: https://www.washingtonexaminer.com/news/2381224/judge-scraps-75-year-fda-timeline-to-release-pfizer-vaccine-safety-data-giving-agency-eight-months/. Consultado el 12 de abril de 2024.
3. Vervaeke P, Borgos SE, Sanders NN, Combes F. Directrices regulatorias y herramientas preclínicas para estudiar la biodistribución de terapias de ARN. Adv Drug Deliv Rev 2022;184:114236. doi: 10.1016/j.addr.2022.114236.
4. Banoun H. ARNm: ¿Vacuna o terapia génica? Cuestiones de seguridad regulatorias. Int J Ciencia molecular2023;24(13):10514. doi: 10.3390/ijms241310514.
5. OMS. Directrices de la OMS para la evaluación no clínica de las vacunas. Anexo 1; 2005. Disponible en: https://www.who.int/publications/m/item/nonclinical-evaluation-of-vaccines-annex-1-trs-no-927. Consultado el 5 de marzo de 2022.
6. FDA. Guía para la industria: evaluación preclínica de medicamentos celulares en investigación y productos de terapia génica; noviembre de 2013. Disponible en: https://www.fda.gov/media/87564/download. Consultado el 7 de noviembre de 2021.
7. Parry PI, Lefringhausen A, Turni C, et al. ‘Spikeopathy’: la proteína de pico de COVID-19 es patógena, tanto a partir del ARNm del virus como de la vacuna. Biomedicines 2023;11(8):2287. doi: 10.3390/biomedicines11082287.
8. Pfizer/BioNTech. BNT162b2 Módulo 2.4. Descripción general no clínica; 8 de febrero de 2021. Disponible en: https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M2_24_nonclinical-overview.pdf. Consultado el 2 de marzo de 2022.
9. Cosentino M, Marino F. Entendiendo la farmacología de las vacunas de ARNm contra la COVID-19: ¿jugando a los dados con la proteína de espiga? Int J Mol Sci 2022;23(18):10881. doi: 10.3390/ijms231810881.
10. Manniche V, Schmeling M, Gilthorpe JD, Hansen PR. Informes de eventos adversos sospechosos dependientes del lote de la vacuna de ARNm BNT162b2 contra la COVID-19: comparación de resultados de Dinamarca y Suecia. Medicina (Mex) 2024;60(8):1343. doi:10.3390/medicina60081343.
11. Para K, Lo AW. Exploración de la patogenia del síndrome respiratorio agudo severo (SARS): la distribución tisular del coronavirus (SARS-CoV) y su supuesto receptor, la angiotensina-enzima convertidora de angiotensina 2 (ACE2). J Pathol 2004;203(3):740-743. doi: 10.1002/path.1597.
12. Imai Y, Kuba K, Ohto-Nakanishi T, Penninger JM. Enzima convertidora de angiotensina 2 (ACE2) en la patogénesis de enfermedades. Circ J 2010;74(3):405-410. doi: 10.1253/circj.CJ-10-0045.
13. OMS. Directrices para la evaluación no clínica de adyuvantes de vacunas y vacunas con adyuvante. Anexo 2; 2014. Disponible en: https://cdn.who.int/media/docs/default-source/biologicals/vaccine-standardization/trs_987_annex2.pdf?sfvrsn=ea91caca_3&download=true . Consultado el 5 de marzo de 2022.
14. Shin J, Wood D, Robertson J, Minor P, Peden K. Consulta informal de la OMS sobre la aplicación de métodos moleculares para asegurar la calidad, seguridad y eficacia de las vacunas, Ginebra, Suiza, 7 y 8 de abril de 2005. Biologicals 2007;35(1):63-71. doi: 10.1016/j.biologicals.2005.12.005.
15. Kim SC, Sekhon SS, Shin WR, et al. Modificaciones de los elementos estructurales de las vacunas de ARNm para mejorar la estabilidad del ARNm y la eficiencia de la traducción. Mol Cell Toxicol 2022;18(1):1-8. doi: 10.1007/s13273-021-00171-4.
16. Nelson J, Sorensen EW, Mintri S, et al. Impacto de la química del ARNm y el proceso de fabricación en la activación inmunitaria innata. Sci Adv 2020;6(26):eaaz6893. doi: 10.1126/sciadv.aaz6893.
17. Mulroney TE, Pöyry T, Yam-Puc JC, et al. La N1-metilpseudouridilación del ARNm provoca un desplazamiento del marco de lectura ribosomal +1. Nature 2024;625(7993):189-194. doi: 10.1038/s41586-023-06800-3.
18. Demongeot J, Fougère C. Vacunas de ARNm contra la COVID-19: hechos e hipótesis sobre la fragmentación y la encapsulación. Vaccines 2022;11(1):40. doi: 10.3390/ vaccines11010040.
19. Universidad de Cambridge. Los investigadores rediseñan futuras terapias de ARNm para prevenir respuestas inmunitarias potencialmente dañinas. Research News; 6 de diciembre de 2023. Disponible en: https://www.cam.ac.uk/research/news/researchers-redesign-future-mrna-therapeutics-to-prevent-potentially-harmful-immune-responses. Consultado el 26 de julio de 2024.
20. Lubbe L, Cozier GE, Oosthuizen D, Acharya KR, Sturrock ED. ACE2 y ACE: información basada en la estructura sobre el mecanismo, la regulación y el reconocimiento de receptores por el SARS-CoV. Clin Sci 2020;134(21):2851-2871. doi: 10.1042/CS20200899.
21. Sia SF, Yan LM, Chin AWH, et al. Patogenia y transmisión del SARS-CoV-2 en hámsteres dorados. Naturaleza 2020;583(7818):834-838. doi: 10.1038/s41586-020-2342-5.
22. Satyanarayana M. Relevo COVID. Ciencia Am 2022;327(5):22. doi: 10.1038/científicoamericano1122-22.
23. Pfizer/BioNTech. Módulo 2.5 de BNT162b2. Descripción clínica; 30 de abril de 2021. Disponible en: https://phmpt.org/wp-content/uploads/2021/12/STN-125742_0_0-Section-2.5-Clinical-Overview.pdf. Consultado el 4 de marzo de 2022.
24. Pateev I, Seregina K, Ivanov R, Reshetnikov V. Biodistribución de vacunas de ARN y de sus productos: evidencia de estudios en humanos y animales. Biomedicines 2023;12(1):59. doi: 10.3390/biomedicines12010059.
25. Pfizer/BioNTech. Estudio de distribución tisular de una formulación de ARNm de nanopartículas lipídicas marcadas con [3H] que contiene ALC-0315 y ALC-0159 tras la administración intramuscular en ratas Wistar Han: estudio de instalaciones de prueba 185350; 9 de noviembre de 2020. Disponible en: https://phmpt.org/wp-content/ uploads/2022/03/125742_S1_M4_4223_185350.pdf. Consultado el 2 de marzo de 2022.
26. Pfizer/BioNTech. BNT162b2 Módulo 2.6.5. Resumen tabulado de farmacocinética; 21 de enero de 2021. Disponible en: https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M2_26_pharmkin-tabulated-summary.pdf. Consultado el 2 de marzo de 2022.
27. Albertsen CH, Kulkarni JA, Witzigmann D, et al. El papel de los componentes lipídicos en nanopartículas lipídicas para vacunas y terapia génica. Adv Drug Deliv Rev 2022;188:114416. doi: 10.1016/j.addr.2022.114416.
28. Bitounis D, Jacquinet E, Rogers MA, Amiji MM. Estrategias para reducir los riesgos de toxicidad de fármacos y vacunas de ARNm. Nat Rev Drug Discov 2024;23(4):281-300. doi: 10.1038/s41573-023-00859-3.
29. Paramasivam P, Franke C, Stöter M, et al. Escape endosómico del ARNm entregado desde los túbulos de reciclaje endosómicos visualizado a escala nanométrica. J Cell Biol 2022;221(2):e202110137. doi: 10.1083/jcb.202110137.
30. Angues RV, Bustos YP. Vacunación contra el SARS-CoV-2 y la hipótesis de oncogénesis de múltiples impactos. Cureus; 17 de diciembre de 2023. doi: 10.7759/cureus.50703.
31. Rubio-Casillas A, Cowley D, Raszek M, Uversky VN, Redwan EM. Reseña: N1-Metil-pseudouridina (m1Ψ): ¿Amiga o enemiga del cáncer? Int J Biol Macromol 2024;267:131427. doi: 10.1016/j.ijbiomac.2024.131427.
32. FDA. Comité Asesor sobre Vacunas y Productos Biológicos Relacionados; 2022. Disponible en: https://www.youtube.com/watch?v=Ixm4UmldTGQ&t=11575s. (3h:13m:00s – 3h:15m:46s). Consultado el 10 de junio de 2024.
33. Röltgen K, Nielsen SCA, Silva O, et al. Impronta inmunitaria, amplitud del reconocimiento de variantes y respuesta del centro germinal en la infección y vacunación humana por SARS-CoV-2. Cell 2022;185(6):1025-1040.e14. doi: 10.1016/j.cell.2022.01.018.
34. Pfizer/BioNTech. BNT162b2 Módulo 5.3.6 Análisis acumulativo de los informes de eventos adversos posteriores a la autorización; 30 de abril de 2021. Disponible en: https://phmpt.org/wp-content/uploads/2022/04/reissue_5.3.6-postmarketing-experience.pdf. Consultado el 30 de septiembre de 2022.
35. OpenVAERS. Red Box Summaries; 28 de marzo de 2024. Disponible en: https://www.openvaers.com/covid-data. Consultado el 28 de marzo de 2024.
36. Block J. ¿Está roto el sistema de notificación de efectos adversos de las vacunas en Estados Unidos? BMJ 2023;383:2582. doi: 10.1136/bmj.p2582.
37. OpenVAERS. Qué es lo que no se informa y por qué es importante; 28 de marzo de 2024. Disponible en: https://www.openvaers.com/faq/what-is-underreporting-and-why-it-matters. Consultado el 28 de marzo de 2024.
38. García-Abeijon P, Costa C, Taracido M, et al. Factores asociados con la subnotificación de reacciones adversas a medicamentos por parte de profesionales sanitarios: actualización de una revisión sistemática. Drug Saf 2023;46(7):625-636. doi: 10.1007/s40264-023-01302-7.
39. Delage G. Retirada de la vacuna contra el rotavirus en los Estados Unidos: el papel de la vigilancia posterior a la comercialización. Can J Infect Dis 2000;11(1):10-12. doi: 10.1155/2000/414396.
40. Lu D, McCann A, Wu J, Lai R. De 8.600 vuelos a cero: la puesta a tierra de los Boeing737 Max 8. NY Times, 13 de marzo de 2019. Disponible en: https://www.nytimes.com/interactive/2019/03/11/world/boeing-737-max-which-airlines.html. Consultado el 10 de abril de 2024.
41. Departamento de Salud de Florida. Orientación actualizada para las dosis de refuerzo contra el COVID-19 para la temporada de otoño e invierno 2024-2025; 13 de septiembre de 2024. Disponible en: https://www.floridahealth.gov/newsroom/2024/09/20210912-Guía actualizada COVID-19.html. Consultado el 16 de septiembre de 2024.
42. Thomas SJ, Moreira ED, Kitchin N, et al. Seguridad y eficacia de la vacuna de ARNm BNT162b2 contra la COVID-19 durante 6 meses. N Engl J Med 2021;385(19):1761-1773. doi: 10.1056/NEJMoa2110345.
43. Lenzer J. Covid-19: ¿Los ensayos de vacunas deberían ser abiertos? BMJ 2020;371:m4956.
44. Franco-Paredes C. Transmisibilidad del SARS-CoV-2 entre personas completamente vacunadas. Lancet Infect Dis 2022;22(1):16. doi: 10.1016/S1473-3099(21)00768-4.
45. Cohn BA, Cirillo PM, Murphy CC, Krigbaum NY, Wallace AW. Protección y muertes de la vacuna SARS-CoV-2 entre veteranos estadounidenses durante 2021. Science 2022;375(6578):331-336. doi: 10.1126/science.abm0620.
46. Ogden N, Turgeon P, Fazil A, et al. Contrafactuales de los efectos de la vacunación y las medidas de salud pública en los casos de COVID-19 en Canadá: ¿Qué podría haber sucedido? Can Commun Dis Rep 2022;48(7/8):292-302. doi: 10.14745/ccdr. v48i78a01.
47. Worldometer. Población canadiense 2024. Disponible en: https://www.worldometers.info/world-population/canada-population/. Consultado el 28 de marzo de 2024.
48. El equipo de epidemiología de respuesta a emergencias por neumonía por el nuevo coronavirus. Características epidemiológicas de un brote de enfermedades por el nuevo coronavirus 2019 (COVID-19) en China, 2020. China CDC Wkly 2020;2(8):113-122.
49. Ioannidis JPA, Axfors C, Contopoulos-Ioannidis DG. Riesgo de mortalidad por COVID-19 a nivel poblacional para personas no mayores en general y para personas no mayores sin enfermedades subyacentes en epicentros de la pandemia. Environ Res 2020;188:109890. doi: 10.1016/j.envres.2020.109890.
50. Worldometer. Estadísticas sobre el COVID-coronavirus en Canadá; 13 de abril de 2024. Disponible en: https://www.worldometers.info/coronavirus/country/canada/. Consultado el 13 de abril de 2024.
51. Subramanian SV, Kumar A. Los aumentos de COVID-19 no están relacionados con los niveles de vacunación en 68 países y 2947 condados de los Estados Unidos. Eur J Epidemiol 2021;36(12):1237-1240. doi: 10.1007/s10654-021-00808-7.
52. FDA. La FDA toma medidas clave en la lucha contra el COVID-19 al emitir una autorización de uso de emergencia para la primera vacuna contra el COVID-19. Comunicado de prensa; 11 de diciembre de 2020. Disponible en: https://www.fda.gov/news-events/press-announcements/fda-takes-key-action-fight-against-covid-19-issuing-emergency-use-authorization-first-covid-19. Consultado el 10 de septiembre de 2024.
53. FDA. Autorización de uso de emergencia de productos médicos y autoridades relacionadas: guía para la industria y otras partes interesadas; enero de 2017. Disponible en: https://www.fda.gov/media/97321/download. Consultado el 10 de septiembre de 2024.
54. Ahmed S, Karim MM, Ross AG, et al. Un tratamiento de cinco días con ivermectina para la COVID-19 puede reducir la duración de la enfermedad. Int J Infect Dis 2021;103:214-216. doi: 10.1016/j.ijid.2020.11.191.
55. Mahmud R, Rahman MM, Alam I, et al. Ivermectina en combinación con doxiciclina para el tratamiento de los síntomas de la COVID-19: un ensayo aleatorizado. J Int Med Res 2021;49(5):030006052110135. doi: 10.1177/03000605211013550.
56. Kerr L, Baldi F, Lobo R, et al. El uso regular de ivermectina como profilaxis para COVID-19 condujo a una reducción del 92% en la tasa de mortalidad por COVID-19 de manera dosis-respuesta: resultados de un estudio observacional prospectivo de una población estrictamente controlada de 88.012 sujetos. Cureus 2022;14(8):e28624. doi: 10.7759/cureus.28624.
57. Shakhsi Niaee M, Namdar P, Allami A, et al. Ivermectina como tratamiento complementario para pacientes adultos hospitalizados con COVID-19: un ensayo clínico multicéntrico aleatorizado. Asian Pac J Trop Med 2021;14(6):266. doi: 10.4103/1995-7645.318304.
58. Okumuş N, Demirtürk N, Çetinkaya RA, et al. Evaluación de la eficacia y seguridad de añadir ivermectina al tratamiento en pacientes graves con COVID-19. BMC Infect Dis 2021;21(1):411. doi: 10.1186/s12879-021-06104-9.
59. Shahbaznejad L, Davoudi A, Eslami G, et al. Efectos de la ivermectina en pacientes con COVID-19: un ensayo clínico multicéntrico, doble ciego, aleatorizado y controlado. Clin Ther 2021;43(6):1007-1019. doi: 10.1016/j.clinthera.2021.04.007.
60. Investigación sobre el tratamiento de la COVID-19. Ivermectina para la COVID-19: análisis en tiempo real todos los 261 estudios; agosto de 2024. Disponible en: https://c19ivm.org/. Consultado el 28 de julio de 2024.
61. Investigación sobre el tratamiento de la COVID-19. HCQ para la COVID-19: análisis en tiempo real de los 597Estudios; agosto de 2024. Disponible en: https://c19hcq.org/. Consultado el 28 de julio de 2024.
62. Reis G, Silva EASM, Silva DCM, et al. Efecto del tratamiento temprano con ivermectina en pacientes con Covid-19. N Engl J Med 2022;386(18):1721-1731. doi: 10.1056/NEJMoa2115869.
63. Investigación sobre el tratamiento de la COVID-19. Efecto del tratamiento temprano con ivermectina en pacientes con COVID-19; noviembre de 2022. Disponible en: https://c19ivm.org/togetherivm.html. Consultado el 2 de abril de 2024.
64. Bernigaud C, Guillemot D, Ahmed-Belkacem A, et al. Ivermectina oral para un brote de sarna en un perro de largo-Centro de atención a término: valor potencial en la prevención de COVID-19 y mortalidad asociada. Br J Dermatol 2021;184(6):1207-1209. doi: 10.1111/bjd.19821.
65. Stone JC, Ndarukwa P, Scheim DE, et al. Cambios en la SpO2 en aire ambiente para 34 pacientes graves con COVID-19 después del tratamiento combinado a base de ivermectina: normalización del 62 % en 24 horas. Biologics 2022;2:196-210. doi: 10.3390/biologics2030015.
66. Guzzo CA, Furtek CI, Porras AG, et al. Seguridad, tolerabilidad y farmacocinética de dosis altas crecientes de ivermectina en sujetos adultos sanos. J Clinical Pharmacol 2002;42:1122-1133. doi: 10.1177/009127002401382731.
67. Los médicos zimbabuenses presionan para que se use ivermectina en el tratamiento de la COVID-19. Times Live; 27 de enero de 2022. Disponible en: https://www.timeslive.co.za/news/africa/2021-01-27-zim-doctors-push-for-ivermectin-in-covid-19-treatment/. Consultado el 9 de noviembre de 2022.
68. NewsdzeZimbabue. El gobierno aprueba el uso de ivermectina. NoticiasdzeZimbabue; 28 de enero de 2021. Disponible en: http://www.newsdzezimbabwe.co.uk/2021/01/govt-approves-ivermectin-use.html. Consultado el 18 de noviembre de 2022.
69. MCAZ. El uso de formulaciones orales de ivermectina para la prevención y/o el tratamiento de la COVID-19. Circular 16 de 2021; 19 de julio de 2021. Disponible en: https://www.mcaz.co.zw/wp-content/uploads/2022/02/Circular-16-of-2021-Use-of-Ivermectin-human-oral-formulations-for-prevention-and-or-treatment-of-COVID-19.pdf. Consultado el 9 de noviembre de 2022.
70. Mörz M. Informe de un caso: encefalitis necrosante multifocal y miocarditis después de la vacunación con ARNm BNT162b2 contra la COVID-19. Vaccines 2022;10(10):1651. doi: 10.3390/vaccines10101651.
71. Choi S, Lee S, Seo JW, et al. Muerte súbita inducida por miocarditis después de la vacunación contra la COVID-19 con ARNm BNT162b2 en Corea: informe de caso centrado en los hallazgos histopatológicos. J Korean Med Sci 2021;36(40):e286. doi: 10.3346/jkms.2021.36.e286.
72. Murata K, Nakao N, Ishiuchi N, et al. Cuatro casos de tormenta de citocinas después de la vacunación contra la COVID-19: informe de caso. Front Immunol 2022;13:967226. doi: 10.3389/ fimmu.2022.967226.
73. Nushida H, Ito A, Kurata H, et al. Un caso de inflamación multiorgánica mortal tras la vacunación contra la COVID-19. Leg Med 2023;63:102244. doi: 10.1016/j. legalmed.2023.102244.
74. Yonker LM, Swank Z, Bartsch YC, et al. Proteína de pico circulante detectada en la miocarditis posterior a la vacuna de ARNm contra la COVID-19. Circulation 2023;147(11):867-876. doi: 10.1161/CIRCULATIONAHA.122.061025.
75. Chaufan C, Manwell L, Heredia C, McDonald J. Vacunas contra la COVID-19 y trastornos autoinmunes: un protocolo de revisión exploratoria. AIMS Medical Science 2023;10(4):318-328. doi: 10.3934/medsci.2023025.
76. Zhang S, Liu Y, Wang X, et al. El SARS-CoV-2 se une a la ECA2 plaquetaria para aumentar la trombosis en la COVID-19. J Hematol Oncol 2020;13(1):120. doi: 10.1186/s13045-020-00954-7.
77. Bilotta C, Perrone G, Adelfio V, et al. Trombosis relacionada con la vacuna contra la COVID-19: una revisión sistemática y un análisis exploratorio. Front Immunol 2021;12:729251. doi: 10.3389/fimmu.2021.729251.
78. Bekal S, Husari G, Okura M, Huang CA, Bukari MS. Desarrollo de trombosis después de la administración de la vacuna de ARNm COVID-19: una serie de casos. Cureus 2023;15(7):e41371. doi: 10.7759/cureus.41371.
79. Oldfield PR, Hibberd J, Bridle BW. ¿Cómo afecta el síndrome respiratorio agudo severo-coronavirus-2 al cerebro y sus implicaciones para las vacunas que se utilizan actualmente? Vaccines 2021;10(1):1. doi: 10.3390/vaccines10010001.
80. Seneff S, Kyriakopoulos AM, Nigh G, McCullough PA. Un papel potencial de la proteína Spike en enfermedades neurodegenerativas: una revisión narrativa. Cureus 2023;15(2):e34872. doi: 10.7759/cureus.34872.
81. Couzin-Frankel J, Vogel G. Las vacunas pueden causar síntomas raros y prolongados similares a los de la COVID-19. Science 2022;375(6579):364-366. doi: 10.1126/science.ada0536.
82. Tindle R. COVID prolongado: los afectados pueden sentirse alentados. Aust J Gen Pract 2024;53(4):238-240. doi: 10.31128/AJGP-07-23-6896.
83. Speicher DJ, Rose J, Gutschi LM, Wiseman DM, McKernan K. Fragmentos de ADN detectados en las vacunas monovalentes y bivalentes de Pfizer/BioNTech y Moderna de ARNm modificado contra la COVID-19 de Ontario, Canadá: relación exploratoria dosis-respuesta con eventos adversos graves. Preimpresión de ResearchGate; 19 de octubre de 2023. doi: 10.31219/osf.io/mjc97.
84. McKernan K, Helbert Y, Kane LT, McLaughlin S. La secuenciación de las vacunas de ARNm bivalentes de Moderna y Pfizer revela cantidades de nanogramos a microgramos de dsADN del vector de expresión por dosis. Preimpresión de ResearchGate; 10 de abril de 2023. doi: 10.31219/osf.io/b9t7m.
85. Senado de Carolina del Sur. Audiencia del Senado de Carolina del Sur: Dr. Phillip Buckhaults, profesor de la USC; 2023. Disponible en: https://rumble.com/v3kcmr4-dr.-phillip-buckhaults-testimony-on-dna-contamination-in-pfizers-mrna-vacci.html. Consultado el 18 de septiembre de 2024.
86. FDA. Guía para la industria: Información sobre química, fabricación y control (CMC) para solicitudes de nuevos fármacos en investigación (IND) de terapia génica humana; enero de 2020. Disponible en: https://www.fda.gov/media/113760/ download. Consultado el 10 de septiembre de 2024.
87. TGA. Guía 18: Impurezas en sustancias y productos farmacéuticos; agosto
2013. Disponible en: https://www.tga.gov.au/sites/default/files/pm-argpm-guidance-18.pdf. Consultado el 10 de septiembre de 2024.
88. Turnbull IC, Eltoukhy AA, Fish KM, et al. La administración al miocardio de nanopartículas lipídicas que transportan modRNA induce una expresión rápida y transitoria. Mol Ther 2016;24(1):66-75. doi: 10.1038/mt.2015.193.
89. König B, Kirchner JO. Consideraciones metodológicas sobre la cuantificación de impurezas de ADN en la vacuna de ARNm contra la COVID-19 Comirnaty®. Methods Protoc 2024;7(3):41. doi: 10.3390/mps7030041.
90. Alegria, Nunes Y. Tendencias en las tasas de mortalidad por neoplasias en los EE. UU. para todas las edades y análisis detallado para 75-84. Preimpresión de ResearchGate; abril de 2024. doi: 10.13140/RG.2.2.16221.01760.
91. Alegria C, Nunes Y. Reino Unido: tendencias de muerte y discapacidad por neoplasias malignas, edades de 15 a 44 años. Preimpresión de ResearchGate; febrero de 2024. doi: 10.13140/RG.2.2.34374.45123.
92. Thorn CR, Sharma D, Combs R, et al. El viaje de una vida: desarrollo de la vacuna de Pfizer contra la COVID-19. Curr Opin Biotechnol 2022;78:102803. doi: 10.1016/j.copbio.2022.102803.
93. Horwood M. Exclusiva: Health Canada confirma la presencia no revelada de ADN secuencia de ADN en la vacuna Pfizer. Epoch Times, 1 de noviembre de 2023. Disponible en: https://www.theepochtimes.com/world/exclusive-health-canada-confirms-undisclosed-presence-of-dna-sequence-in-pfizer-shot-5513277. Consultado el 17 de septiembre de 2024.
94. Phillips J. La FDA responde a los informes de contaminación del ADN en las vacunas contra la COVID. Epoch Times, 31 de octubre de 2023. Disponible en: https://www.theepochtimes.com/article/fda-responds-to-reports-of-dna-contamination-in-covid-vaccines-5496717. Consultado el 17 de septiembre de 2024.
95. OMS. Anexo 3 Evaluación de la calidad, seguridad y eficacia de las vacunas de ARN mensajero para la prevención de enfermedades infecciosas: consideraciones reglamentarias. Anexo 3; 2022. Disponible en: https://cdn.who.int/media/docs/default-source/ biologicals/vaccine-standardization/annex-3—mrna-vaccines_who_ trs_1039_web-2.pdf?sfvrsn=6e31a112_1&download=true. Consultado el 17 de septiembre de 2024.
96. Dean DA, Dean BS, Muller S, Smith LC. Requisitos de secuencia para la importación nuclear de plásmidos. Exp Cell Res 1999;253(2):713-722. doi: 10.1006/excr.1999.4716.
97. Anandamida. Replicación del ADN plasmídico en líneas celulares vacunadas con BNT162b2: entrevista de FLCCC y más. Nepetalactone Newsletter; 5 de marzo de 2024. Disponible en: https://anandamide.substack.com/p/plasmid-dna-replication-in-bnt162b2. Consultado el 16 de septiembre de 2024.
98. Drayman N, Ben-nun-Shaul O, Butin-Israeli V, et al. La elevación de p53 en células humanas detiene la infección por SV40 al inhibir la expresión de T-ag. Oncotarget 2016;7(33):52643-52660. doi: 10.18632/oncotarget.10769.
99. Zhang S, El-Deiry WS. El ADN de la proteína pico del SARS-CoV-2 transfectado para la expresión en células de mamíferos inhibe la activación de las proteínas p53 p21(WAF1), TRAIL Death Receptor DR5 y MDM2 en células cancerosas y aumenta la viabilidad de las células cancerosas después de la exposición a la quimioterapia. Oncotarget 2024;15(1):275-284. doi: 10.18632/ oncotarget.28582.
100. Jahankhani K, Ahangari F, Adcock IM, Mortaz E. Posible capacidad cancerígena del COVID-19: ¿es el SARS-CoV-2 un agente oncogénico? Biochimie 2023;213:130-138. doi: 10.1016/j.biochi.2023.05.014.
101. Lam ICH, Zhang R, Man KKC, et al. Persistencia del riesgo y efecto de la vacunación contra la COVID-19 en las consecuencias para la salud a largo plazo después de la infección por SARS-CoV-2. Nat Commun 2024;15(1):1716. doi: 10.1038/s41467-024-45953-1.
102. Hulscher N, Procter BC, Wynn C, McCullough PA. Enfoque clínico de las secuelas post-agudas tras la infección por COVID-19 y la vacunación. Cureus 2023;15(11):e49204. doi: 10.7759/cureus.49204.
103. Behnood S, Newlands F, O’Mahoney L, et al. Los síntomas persistentes se asocian con efectos a largo plazo de la COVID-19 entre niños y jóvenes: resultados de una revisión sistemática y metanálisis de estudios controlados. PLoS One 2023;18(12):e0293600. doi: 10.1371/journal. pone.0293600.
104. Herrera E, Pérez-Sánchez MDC, San Miguel-Abella R, et al. Deterioro cognitivo en adultos jóvenes con síndrome post COVID-19. Representante científico 2023;13(1):6378. doi: 10.1038/s41598-023-32939-0.
105. Jiang L, Li X, Nie J, Tang K, Bhutta ZA. Una revisión sistemática de las características clínicas persistentes después del SARS-CoV-2 en la población pediátrica. Pediatría 2023;152(2):e2022060351. doi: 10.1542/peds.2022-060351.
106. Uversky V, Redwan E, Makis W, Rubio-Casillas A. Los anticuerpos IgG4 inducidos por la vacunación repetida pueden generar tolerancia inmunitaria a la proteína de pico del SARS-CoV-2. Vaccines 2023;11(5):991. doi: 10.3390/vaccines11050991.
107. Morais P, Adachi H, Yu YT. La contribución crítica de la pseudouridina a las vacunas de ARNm contra la COVID-19. Front Cell Dev Biol 2021;9:789427. doi: 10.3389/fcell.2021.789427.
108. Castruita JAS, Schneider UV, Mollerup S, et al. SRAS-CoV-2 secuencias de ARNm de la vacuna de espiga circulan en la sangre hasta 28 días después de la COVID-19 vacunación. APMIS 2023;131(3):128-132. doi: 10.1111/apm.13294.
109. Igyártó BZ, Qin Z. Las vacunas de ARNm-LNP: ¿las buenas, las malas y las feas? Front Immunol 2024;15:1336906. doi: 10.3389/fimmu.2024.1336906.
110. McKernan K, Kyriakopoulos AM, McCullough PA. Diferencias en el ARNm derivado de la replicación de la vacuna y del SARS-CoV-2: implicaciones para la biología celular y la enfermedad futura. Semantic Scholar; 25 de noviembre de 2021. doi: 10.31219/osf.io/bcsa6.
111. Tinari S. La filtración de datos de la EMA sobre la COVID-19 y lo que nos dice sobre la inestabilidad del ARNm. BMJ 2021;372:n627. doi: 10.1136/bmj.n627.