Pre-exposure to mRNA-LNP inhibits adaptive immune responses and alters innate immune fitness in an inheritable fashion – doi: https://doi.org/10.1101/2022.03.16.484616 – https://www.biorxiv.org/content/10.1101/2022.03.16.484616v2.full
Un estudio preliminar reciente ha arrojado luz sobre por qué se han observado eventos adversos después de una vacunación con ARN mensajero ( ARNm ) de COVID-19, además de la toxicidad ya conocida de la proteina pico o Spike. Las nanopartículas de lípidos, que se dice que no son tóxicas y son seguras, en realidad son altamente inflamatorias. Los cambios en el sistema inmunitario, que sorprende a los autores es que descubrieron que pueden ser generacionales (transmitidos a la descendencia)
El estudio , dirigido por investigadores de la Universidad Thomas Jefferson, encontró que las nanopartículas lipídicas (LNP) utilizadas para transportar ARNm en las inyecciones contra el COVID-19 podrían “inhibir” y “alterar” las respuestas inmunitarias en ratones.
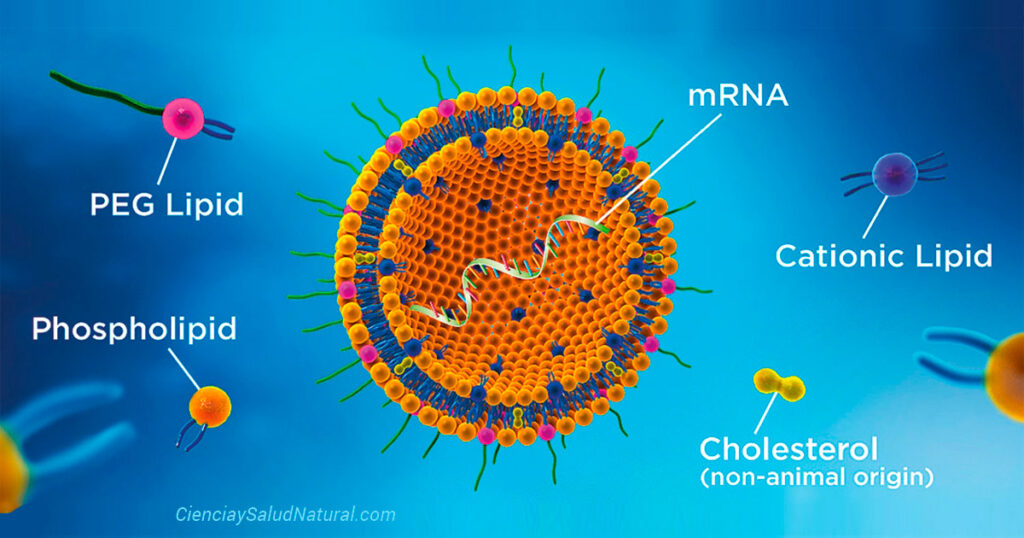
Los LNP son capas de lípidos que envuelven el ARNm para evitar la degradación y detección por parte del sistema inmunitario de nuestro cuerpo.
Tanto las inyecciones de ARNm COVID-19 de Pfizer como Moderna utilizan LNP para administrar secuencias de proteínas pico o Spike de ARNm en células humanas. Una vez que las células humanas recibieron las secuencias de ARNm, las células fabricarán proteínas pico o Spike, lo que desencadenaría una respuesta inmune.
Originalmente, se pretendía que los LNP entregaran discretamente secuencias de ARNm en las células para producir proteínas de pico y, al hacerlo, formar inmunidad contra el virus COVID-19.
Sin embargo, muchos estudios en ratones han encontrado desde entonces que las nanopartículas de lípidos, que se dice que no son tóxicas y son seguras, en realidad son altamente inflamatorias. Los cambios en el sistema inmunitario, que sorprende a los autores es que descubrieron que pueden ser generacionales (transmitidos a la descendencia)
Estas nanopartículas son muy duraderas y pueden durar de 20 a 30 días en el cuerpo. Mientras persistan en el cuerpo, es probable que continúen activando el sistema inmunitario, lo que provocará un agotamiento inmunitario y una falta de respuesta.
El estudio de Thomas Jefferson también compartió hallazgos similares. Los investigadores inyectaron ratones con los mismos LNP utilizados en las vacunas de Pfizer, y algunos ratones recibieron incluso una dosis doble.
La inflamación y las respuestas inmunitarias en ratones no son signos seguros de que suceda lo mismo en humanos. No obstante, los ratones se han utilizado durante mucho tiempo para probar la seguridad y la eficacia de los medicamentos para uso humano; los signos de problemas inmunológicos son una indicación de posibles riesgos para la salud en humanos.

Los autores encontraron que los ratones que recibieron dos dosis tuvieron una respuesta inmune reducida en su segunda inyección en comparación con los ratones que solo recibieron una dosis.
“La plataforma de inyecciones mRNA-LNP ( nanopartículas ) induce cambios inmunológicos inesperados a largo plazo que afectan tanto las respuestas inmunitarias adaptativas como la protección heteróloga contra las infecciones”, escribieron los autores.
La exposición previa a nanopartículas de ARNm reduce el número de células innatas
Los ratones a los que se les inyectaron dos dosis de mRNA LNP tenían un número reducido de células inmunitarias innatas, las células inmunitarias de primera respuesta.
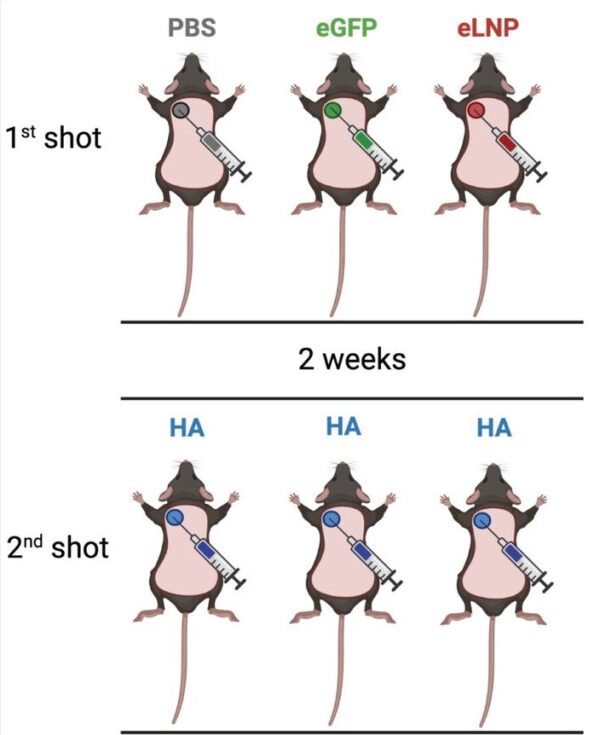
Los autores probaron los efectos de las nanopartículas de ARNm dividiendo a los ratones en tres grupos. Los tres grupos recibieron dos inyecciones, aunque con diferente contenido.
Cada grupo recibió diferentes vacunas para la primera vacunación, pero recibió la misma inyección para la segunda inyección.
Para la primera inyección, el primer grupo recibió PBS (agua salada), el segundo grupo recibió inyecciones de LNP con secuencias de ARNm para una proteína de medusa (eGFP), el tercer grupo recibió LNP vacíos.
Dos semanas después, a los tres grupos se les administró la misma inyección de LNP que contenía secuencias de ARNm para una proteína de influenza (HA). La segunda inyección permitió que sus células produjeran proteínas HA, lo que desencadenó una respuesta inmunitaria. Se pretendía que esta respuesta inmune hiciera a los ratones inmunes contra el virus de la influenza.
Los investigadores encontraron que después de la segunda inyección, todos los ratones habían desarrollado una defensa inmunológica contra el virus de la influenza, particularmente aquellos que recibieron dos dosis de LNP.
Sin embargo, este mismo grupo de ratones también eran más susceptibles a las infecciones por hongos, en concreto Candida albicans , lo que indica una alteración en la respuesta inmunitaria innata.
Estos ratones tenían una menor cantidad de neutrófilos, que son las células inmunitarias de primera respuesta más comunes.
El trabajo de los neutrófilos es patrullar el cuerpo y atacar indiscriminadamente cuando encuentran algo extraño.
Dado que una infección fúngica descontrolada, en particular C. albicans , suele ser un signo de una respuesta inmunitaria innata o de respuesta inicial debilitada, los autores sospecharon que la reducción del número de neutrófilos pudo haber contribuido al brote fúngico.
Los LNP causan inflamación y ciertas vías inflamatorias reducen la producción de células sanguíneas. Los autores especularon que las dos dosis de LNP que recibieron algunos ratones pueden haber causado una mayor inflamación que condujo a una disminución en la producción de células sanguíneas y bajos recuentos de neutrófilos.
Aunque aún falta verificar si los efectos en los ratones se aplicarían a los humanos, ha habido informes en personas vacunadas sobre la aparición repentina de anemia aplásica grave, una afección en la que el cuerpo ya no puede producir suficientes glóbulos rojos, particularmente sangre roja. células.
También ha habido algunos informes de personas vacunadas con COVID-19 que desarrollaron enfermedades fúngicas raras y otras con empeoramiento de enfermedades fúngicas preexistentes.
Aunque una enfermedad fúngica grave no significa automáticamente un sistema inmunitario débil, las infecciones fúngicas graves “son más comunes entre las personas con sistemas inmunitarios débiles”, escriben los Centros para el Control y la Prevención de Enfermedades (CDC) de EE . UU .
Números de antígenos reducidos en ratones con alta exposición a nanopartículas
Dentro del sistema inmunitario, existen los primeros respondedores (células inmunitarias innatas) y los segundos respondedores (células inmunitarias adaptativas).
Los primeros en responder montan un ataque inmediato al encontrar algo extraño. Sin embargo, sus ataques son inespecíficos y, a menudo, no pueden eliminar completamente las infecciones.
Por lo tanto, las células inmunitarias adaptativas, también conocidas como células T y B, sirven como segundos respondedores.
Se activan alrededor de una semana después de la infección y eliminan las infecciones mediante ataques potentes y específicos.
Para activar las células inmunes adaptativas, las células T y B deben recibir información sobre el patógeno. En el caso de Sars-Cov-2, puede ser una sección de la proteína de pico.
Las APC (células presentadoras de antígenos), un tipo de célula de primera respuesta, traen fragmentos del virus, bacterias o partículas infecciosas a las células T o B adaptativas. Esto activará la célula T o B, desencadenando una respuesta inmunitaria adaptativa.
La siguiente imagen muestra una célula dendrítica (APC), activando una célula T al presentarle un antígeno, una sustancia tóxica o extraña.
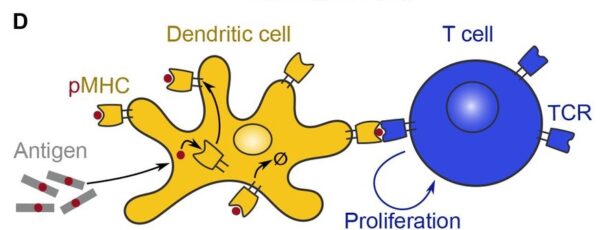
Sin embargo, los autores encontraron que los ratones que recibieron dos dosis de mRNA LNP tenían una presentación de antígenos reducida en comparación con los ratones que solo recibieron una dosis de LNP.
Esto implica que se hicieron menos células inmunitarias adaptativas para activarse contra las proteínas de la gripe.
Las nanopartículas de ARNm reducen las respuestas de las células T y B
Los autores encontraron que los ratones que recibieron dos inyecciones de LNP tenían respuestas de células T y B más bajas que los ratones que solo recibieron una dosis.
Como línea final de la respuesta inmunitaria, las células T y B son críticas en la capacidad de nuestro sistema inmunitario para eliminar infecciones.
Sin embargo, en ratones que recibieron dos dosis de LNP, se activaron menos células T y B.
Los grupos de dosis doble también tenían concentraciones más bajas de anticuerpos (las células B producen anticuerpos) contra la proteína de la influenza.
La respuesta inmunitaria adaptativa reducida fue sistémica y persistió en todos los órganos y regiones. Sin embargo, esta reducción fue aún mayor en el lugar de la inyección, especialmente si los ratones recibieron inyecciones en el mismo lugar para ambas inyecciones, según los autores.
Por otro lado, el grupo que solo recibió una inyección de LNP tuvo respuestas de células T y B más altas con más anticuerpos producidos.
Los autores encontraron que la exposición a LNP redujo las células progenitoras T. Dado que las células T progenitoras maduran en células T activadas, menos progenitores significan una reducción en el número y la respuesta de las células T.
Los autores encontraron que si las células progenitoras T se eliminaban antes de la vacunación y luego se volvían a colocar después de la vacunación, el número de células T activas no se reduciría. Esto sugiere que la LNP reduce directamente el número de células progenitoras T y, al hacerlo, reduce la respuesta de las células T.
“La exposición previa a mRNA-LNP inhibe las respuestas de las células T”, escribieron los autores.
Esta inmunidad reducida no debería ser permanente, especularon los autores.
Señalaron que las respuestas de las células B se recuperaban en su mayoría si se introducía un intervalo de 8 semanas entre la primera y la segunda dosis.
Sin embargo, los autores no verificaron el período de tiempo necesario para una recuperación completa, ni verificaron si la respuesta de las células B alguna vez se recuperó en los ratones.
Sin embargo, inyectar a los ratones adyuvantes como sales de aluminio o AddaVax eliminó los efectos supresores que las inyecciones de LNP tenían en las células inmunitarias de los ratones.
Implicación del estudio y preguntas apremiantes
Los hallazgos del estudio con ratones sugieren que las funciones de las células T y B se reducen temporalmente en los ratones y plantea la pregunta de si ocurre lo mismo en los humanos.
La respuesta inmunitaria adaptativa es fundamental para eliminar infecciones y prevenir enfermedades crónicas como el cáncer. El estudio sugiere que después de dos vacunas con los LNP de ARNm, hay algunas semanas de vulnerabilidad en los ratones, lo que los pone en mayor riesgo de infecciones y cáncer.
También se observan informes similares en humanos, aunque todavía no se ha realizado ningún estudio que establezca un vínculo concluyente.
Sin embargo, un aumento en la tasa de enfermedad que se informa al Sistema de Informe de Eventos Adversos a las Vacunas (VAERS, por sus siglas en inglés) después de la vacunación contra el COVID-19 sugiere una inmunidad reducida en las personas después de la vacunación.
Ha habido muchos informes de cánceres emergentes después de las vacunas COVID-19.
En la base de datos de VAERS , se informaron 284 casos de cáncer de mama después de la vacunación contra el COVID-19, mientras que solo se han informado 350 casos en toda la historia de VAERS.
Se informaron 269 casos de leucemia después de la vacunación contra el COVID-19 en comparación con 432 casos en toda la historia de VAERS.
Además, también ha habido informes preocupantes de herpes zóster de nueva aparición y recurrente después de las vacunas contra el COVID-19. Los datos de VAERS muestran que se informaron 7559 casos de culebrilla después de la vacunación contra el COVID-19.
A lo largo de toda la historia de VAERS, se informaron 28.180 casos de culebrilla después de cualquier vacunación, lo que significa que alrededor de una cuarta parte de los casos de culebrilla ocurrieron después de la vacunación contra el COVID-19.
El CDC ha indicado que un nuevo diagnóstico o la recurrencia de la culebrilla ocurre principalmente en personas con sistemas inmunitarios comprometidos y es un signo de inmunidad debilitada.
Los crecientes datos de los efectos adversos para la salud informados en humanos después de la vacunación contra el COVID-19 justifican una mayor investigación.
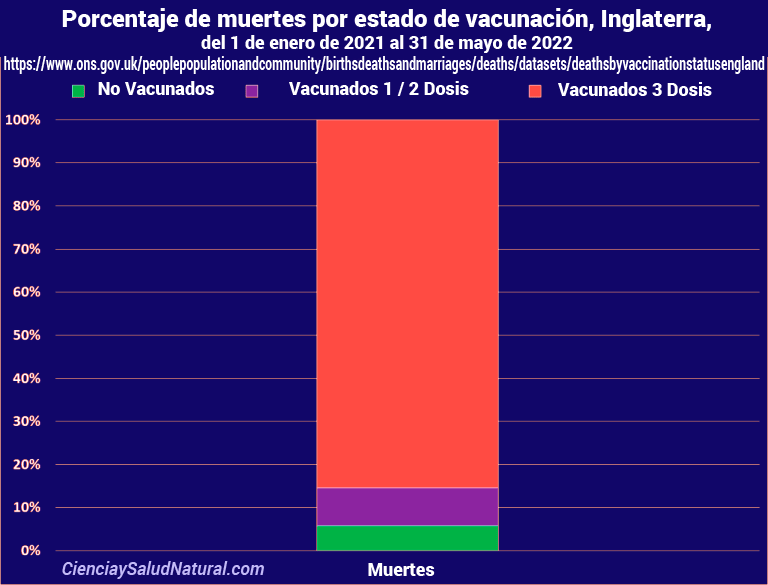
- Al 15 de mayo de 2021 ya habían 15.696 muertes y 1.379.654 reacciones adversas luego de la inyecciones KO BIT reportados entre Europa, EE.UU. y el Reino Unido.
- Para el 1 agosto de 2022 ya hay 76.789 muertes y 6.089.773 efectos adversos reportados entre EE. UU. y Europa luego de la inyección K0 B1T , ¡y aún siguen inyectando!
“Teniendo en cuenta la amplia exposición de una gran proporción de poblaciones humanas a las inyecciones basadas en esta nueva tecnología (ARNm), se justifican más estudios para comprender completamente sus efectos inmunológicos y fisiológicos generales. Determinar el impacto a corto y largo plazo de esta plataforma en la salud humana ayudaría a optimizarla para disminuir sus efectos potencialmente dañinos”, concluyeron los autores.
Las cifras oficiales publicadas por el gobierno del Reino Unido revelan que 9 de cada 10 muertes por covid-19 en Inglaterra durante el año pasado ha sido la población triple vacunada o totalmente vacunada , como asi también el 91 % de todas las muertes por covid-19 desde principios de 2022 y el 94 % de todas las muertes por Covid-19 desde principios de abril de 2022.