Luego de ser aplicada esta vacuna contra el coronavirus masivamente, en el primer año o dos puede parecer que no existe un problema de seguridad real, y con el tiempo, un mayor porcentaje de la población mundial será vacunado debido a esta supuesta «seguridad» . Durante este período intermedio, el virus está ocupado mutando. Finalmente, los anticuerpos que los individuos vacunados tienen en su torrente sanguíneo ahora se pueden volver no neutralizantes porque no se pueden unir al virus con la misma afinidad debido al cambio estructural resultante de la mutación. La disminución de las concentraciones del anticuerpo a lo largo del tiempo también contribuiría a este cambio hacia la no neutralización. Cuando estas personas previamente vacunadas están infectadas con esta cepa diferente de SARS-CoV-2, podrían experimentar una reacción mucho más severa al virus.
Independientemente de la convicción de alguien sobre las vacunas, la Mejora dependiente de anticuerpos (ADE), debe ser reconocido. Este artículo, explica cómo funciona ADE y los peligros futuros que puede traer. En este momento, se estima que la tasa de mortalidad del virus es aproximadamente del 0.26%, y este número parece estar disminuyendo a medida que el virus se está atenuando naturalmente en la población. Sería una gran equivocación vacunar a toda la población contra un virus con una tasa de mortalidad tan baja, especialmente teniendo en cuenta el considerable riesgo presentado por ADE. A pesar de esto los laboratorios fabricantes estarán exentos de reclamos de responsabilidad por la vacuna contra el coronavirus en la mayoría de los países
Los medicamentos basados en anticuerpos y las vacunas contra el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2) se están acelerando mediante el desarrollo clínico y preclínico. Los datos del estudio del SARS-CoV y otros virus respiratorios sugieren que los anticuerpos anti-SARS-CoV-2 podrían exacerbar el COVID-19 a través de la mejora dependiente de anticuerpos (ADE). Estudios previos de vacunas contra el virus sincitial respiratorio y el virus del dengue revelaron riesgos de seguridad clínica humana relacionados con el ADE, lo que resultó en ensayos de vacunas fallidos. Aquí, describimos los mecanismos clave de ADE y discutimos las estrategias de mitigación para las vacunas y terapias del SARS-CoV-2 en desarrollo. También describimos los datos publicados recientemente para evaluar los riesgos y oportunidades de la protección basada en anticuerpos contra el SARS-CoV-2.
Anticuerpo Neutralizante
Para que una vacuna funcione, nuestro sistema inmunitario necesita ser estimulado para producir un anticuerpo neutralizante. Un anticuerpo neutralizante es aquel que puede reconocer y unirse a alguna región (‘epítopo’) del virus, y que posteriormente da como resultado que el virus no entre o no se replique en las células.
Anticuerpo no Neutralizante
Un anticuerpo no neutralizante es aquel que puede unirse al virus, pero por alguna razón, el anticuerpo no logra neutralizar al virus. Esto puede ocurrir, por ejemplo, si el anticuerpo no se une lo suficientemente fuerte al virus, o si el porcentaje de la superficie del virus cubierto por el anticuerpo es demasiado bajo, o la concentración del anticuerpo no es lo suficientemente alta. Básicamente, existe algún tipo de unión genérica del anticuerpo al virus, pero no logra neutralizar el virus.
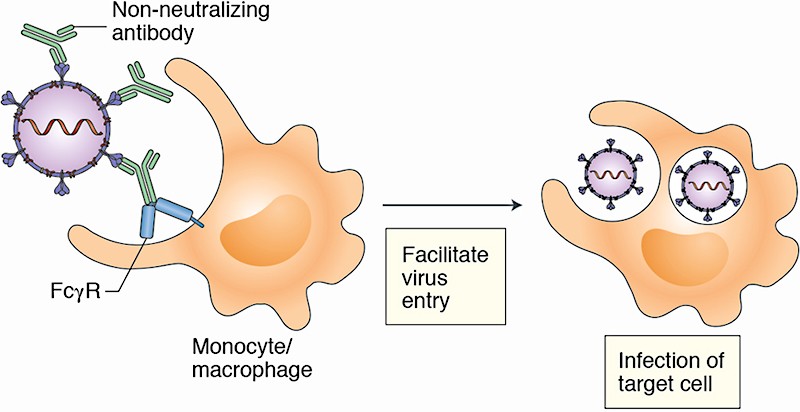
Mejora dependiente de anticuerpos (ADE)
En algunos virus, si una persona alberga un anticuerpo no neutralizante contra el virus, una infección posterior por el virus puede provocar que esa persona provoque una reacción más severa al virus debido a la presencia del anticuerpo no neutralizante. Esto sucede solo en algunos virus. Esto se llama Mejora dependiente de anticuerpos (ADE) y es un problema común con el virus del dengue, el virus del Ébola, el VIH, el VSR y la familia de los coronavirus. De hecho, este problema de ADE es una razón importante por la cual fallaron muchos ensayos de vacunas previas para otros coronavirus. Se observaron importantes problemas de seguridad en modelos animales. Si ADE ocurre en un individuo, su respuesta al virus puede ser peor que su respuesta si nunca antes hubieran desarrollado un anticuerpo.
Un anticuerpo puede convertirse en un anticuerpo no neutralizante simplemente porque no se une a la porción correcta del virus para neutralizarlo o porque el anticuerpo se une demasiado débilmente al virus. Esto también puede ocurrir si la concentración de un anticuerpo neutralizante disminuye con el tiempo y ahora ya no tiene la concentración suficiente para causar la neutralización del virus. Además, un anticuerpo neutralizante puede pasar posteriormente a ser un anticuerpo no neutralizante cuando se encuentra con una cepa diferente del virus.
Se desconoce el mecanismo exacto de la Mejora dependiente de anticuerpos, ADE en el SARS, pero la teoría principal se describe de la siguiente manera:
En ciertos virus, la unión de un anticuerpo no neutralizante al virus puede dirigir al virus a ingresar e infectar sus células inmunes. Esto ocurre a través de un receptor llamado FcγRII. FcγRII se expresa en el exterior de muchos tejidos de nuestro cuerpo, y en particular, en macrófagos derivados de monocitos, que son un tipo de glóbulo blanco. En otras palabras, la presencia del anticuerpo no neutralizante ahora dirige al virus a infectar las células de su sistema inmune, y estos virus pueden replicarse en estas células y causar estragos en su respuesta inmune. Un extremo del anticuerpo se adhiere al virus y el otro extremo del anticuerpo se adhiere a una célula inmune. Esencialmente, El anticuerpo no neutralizante permite al virus engancharse para infectar las células inmunes. Puedes ver esto en la imagen de arriba.
Esto puede causar una respuesta hiperinflamatoria, una tormenta de citoquinas y una desregulación general del sistema inmunitario que permite que el virus cause más daño a nuestros pulmones y otros órganos de nuestro cuerpo. Además, los nuevos tipos de células en todo nuestro cuerpo ahora son susceptibles a la infección viral debido a la vía de entrada viral adicional facilitada por el receptor FcγRII, que se expresa en muchos tipos de células diferentes.
Lo que esto significa que esta vacuna, puede hacer que su sistema inmunitario produzca un anticuerpo y luego, cuando su cuerpo es realmente desafiado con el patógeno real o variante, la infección es mucho peor que si no hubiera sido vacunado.
Es muy probable que los factores genéticos, así como el estado de salud del individuo, puedan desempeñar un papel en la modulación de esta respuesta. Dicho esto, hay muchos estudios (en la sección de referencia a continuación) que demuestran que ADE es un problema persistente con los coronavirus en general, y en particular, con los virus relacionados con el SARS. Se sabe menos, por supuesto, con respecto al SARS-CoV-2, pero las similitudes genéticas y estructurales entre el SARS-CoV-2 y los otros coronavirus sugieren que este riesgo es real.
ADE ha demostrado ser un desafío serio con las vacunas de coronavirus, y esta es la razón principal por la que muchos han fallado en los primeros ensayos in vitro o en animales. Por ejemplo, los macacos rhesus que fueron vacunados con la proteína Spike del virus del SARS-CoV demostraron daño pulmonar agudo severo cuando fueron desafiados con el SARS-CoV, mientras que los monos que no fueron vacunados no lo hicieron. De manera similar, los ratones que fueron inmunizados con una de cuatro vacunas diferentes de SARS-CoV mostraron cambios histopatológicos en los pulmones con infiltración de eosinófilos después de ser expuestos al virus del SARS-CoV. Esto no ocurrió en los controles que no habían sido vacunados. Un problema similar ocurrió en el desarrollo de una vacuna para FIPV, que es un coronavirus felino.
Para que una vacuna funcione, los desarrolladores de vacunas necesitarán encontrar una manera de sortear el problema de ADE. Esto requerirá una solución muy novedosa, y puede no ser alcanzable, o al menos, predecible. Además, la vacuna no debe inducir ADE en cepas posteriores de SARS-CoV-2 que emergen con el tiempo, ni a otros coronavirus endémicos que circulan cada año y causan el resfriado común.
Un desencadenante importante de ADE es la mutación viral.
Los cambios en la secuencia de aminoácidos de la proteína Spike (que es la proteína del virus que facilita la entrada a nuestras células a través del receptor ACE2) pueden causar una deriva antigénica. Lo que esto significa es que un anticuerpo que una vez fue neutralizante puede convertirse en un anticuerpo no neutralizante porque el antígeno ha cambiado ligeramente. Por lo tanto, las mutaciones en la proteína Espiga (Spike) que ocurren naturalmente con los coronavirus podrían presumiblemente provocar ADE. Dado que estas cepas futuras no son predecibles, es imposible predecir si ADE se convertirá en un problema en una fecha futura.
Este problema de imprevisibilidad inherente se destaca en el siguiente escenario: una vacuna de coronavirus puede no ser peligrosa inicialmente. Si la prueba inicial parece positiva, los esfuerzos de vacunación masiva probablemente se administrarían a una gran parte de la población. En el primer año o dos, puede parecer que no existe un problema de seguridad real, y con el tiempo, un mayor porcentaje de la población mundial será vacunado debido a esta «seguridad» percibida. Durante este período intermedio, el virus está ocupado mutando. Finalmente, los anticuerpos que los individuos vacunados tienen flotando en su torrente sanguíneo ahora se vuelven no neutralizantes porque no se pueden unir al virus con la misma afinidad debido al cambio estructural resultante de la mutación. La disminución de las concentraciones del anticuerpo a lo largo del tiempo también contribuiría a este cambio hacia la no neutralización. Cuando estas personas previamente vacunadas están infectadas con esta cepa diferente de SARS-CoV-2, podrían experimentar una reacción mucho más severa al virus.
Irónicamente, en este escenario, esta vacuna hizo que el virus fuera más patógeno en lugar de menos patógeno. Esto no es algo que los productores de vacunas puedan predecir o probar con un nivel de confianza real desde el principio, y solo se hará evidente en un momento posterior.
De acuerdo a Nature Biotechnology publicada el 5 de junio, 2020:
» Es importante hablar de eso [ADE] «, dice Gregory Glenn, presidente de Novavax, que lanzó su prueba de vacuna COVID-19 en mayo. Pero “no podemos ser demasiado cautelosos. La gente se está muriendo. Así que tenemos que ser agresivos aquí «.
Gregory Glenn, presidente de Novavax, Nature Biotechnology publicada el 5 de junio, 2020
Y del mismo artículo:
«ADE» es una preocupación genuina «, dice el virólogo Kevin Gilligan, consultor senior de Biologics Consulting, que aconseja estudios de seguridad exhaustivos. «Porque si se dispara la pistola y se distribuye ampliamente una vacuna que potencia la enfermedad, eso sería peor que no aplicar ninguna vacuna».
Virólogo Kevin Gilligan, consultor senior de Biologics Consulting, Nature Biotechnology publicada el 5 de junio, 2020
La industria de las vacunas es consciente de este problema. El grado en que lo están tomando en serio, es otra cuestión.
Si bien muchos desarrolladores de vacunas son conscientes del problema, algunos de ellos están abordando el problema con más actitud de Laissez-faire, minimizando el problema. Ven este problema como «teórico» con la idea de que los ensayos con animales deberían descartar el potencial de ADE en humanos.
Por otro lado no es ético realizar estudios de «desafío» en humanos. En otras palabras, un ensayo clínico para una vacuna no incluye administrar la vacuna a una persona y luego exponer a esta persona al virus después de la vacunación para controlar su reacción. En los ensayos clínicos, a los humanos solo se les administra la vacuna, no se los «reta» con el virus salvaje después. En estudios con animales, realizan una prueba de desafío para observar cómo responden los animales a la infección con el virus real después de ser vacunados.
Como se señaló anteriormente, el desarrollo de diferentes cepas virales en los años posteriores podría presentar un problema importante que no se nota durante las pruebas de seguridad iniciales en humanos o animales.
¿Qué pasa con las personas no vacunadas que están naturalmente infectadas con el virus y desarrollan anticuerpos? ¿Podrían estas personas experimentar ADE a una cepa futura de SARS-CoV-2?
Otros factores competitivos y no competitivos en nuestro sistema inmunitario
La respuesta ADE es en realidad mucho más complicada existen otros factores competitivos y no competitivos en nuestro sistema inmunitario que contribuyen a la respuesta ADE, muchos de los cuales no se comprenden completamente. Parte de esa ecuación es una variedad de diferentes tipos de células T que modulan esta respuesta, y estas células T responden a otras porciones (epítopos) del virus. En una vacuna, nuestro cuerpo normalmente se presenta con una pequeña parte del virus (como la proteína Spike) o un virus modificado (atenuado o muerto) que es más benigno. Una vacuna no expone la totalidad de nuestro sistema inmunitario al virus real.
Estos tipos de vacunas solo provocarán anticuerpos que reconocen la porción del virus que está presente en la vacuna. Las otras porciones del virus no están representadas en el conjunto de anticuerpos. En este escenario, es mucho más probable que los anticuerpos inducidos por la vacuna puedan convertirse en anticuerpos no neutralizantes, porque el virus completo no está cubierto de anticuerpos, solo la porción que se utilizó para desarrollar la vacuna.
Infección Real vs Vacuna
En una infección real, nuestro sistema inmunitario está expuesto a todos los rincones del virus completo y, como tal, nuestro sistema inmunitario desarrolla una panacea de anticuerpos que reconocen diferentes porciones del virus y, por lo tanto, cubren más virus y se neutralizan. Además, nuestro sistema inmunitario desarrolla respuestas de células T a cientos de epítopos peptídicos diferentes a través del virus; mientras que en la vacuna la gran cantidad de estas respuestas de células T están ausentes. Los investigadores ya son conscientes de que la respuesta de las células T desempeña un papel cooperativo en el desarrollo o la ausencia de la respuesta ADE.
En base a estas diferencias y la respuesta inmunológica sesgada que es inherente a las vacunas, creo que el riesgo de ADE es un orden de magnitud mayor en un sistema inmunitario preparado para vacuna que en un sistema inmunitario preparado para virus. Esto sin duda se hará más evidente a medida que COVID-19 progrese a lo largo de los años, pero la carga de la prueba recae sobre los hombros de la industria de las vacunas para demostrar que ADE no será una amenaza en el corto o largo plazo. Una vez que se administra una vacuna y las personas desarrollan anticuerpos contra alguna tergiversación del virus, no se puede revertir. Nuevamente, este es un problema que podría manifestarse en una fecha posterior.
Otra posibilidad es una reacción de inflamación alérgica
El problema de ADE, no es la única vía o mecanismo que podría presentar un problema para las personas infectadas después de la vacunación. Otra vía se rige por la inmunopatología Th2, en la que una respuesta defectuosa de células T inicia una reacción de inflamación alérgica. Una segunda vía se basa en el desarrollo de anticuerpos defectuosos que forman complejos inmunes, que luego activan el sistema del complemento y, en consecuencia, dañan las vías respiratorias. Estas vías también son riesgos potenciales para el SARS-CoV-2.
En este momento, se estima que la tasa de mortalidad del virus es aproximadamente del 0.26%, y este número parece estar disminuyendo a medida que el virus se está atenuando naturalmente en la población. Sería una gran equivocación vacunar a toda la población contra un virus con una tasa de mortalidad tan baja, especialmente teniendo en cuenta el considerable riesgo presentado por ADE. El riesgo de desarrollar ADE en un individuo vacunado será mucho mayor que 0.26% y, por lo tanto, la vacuna puede empeorar el problema, no mejorarlo. Sería el mayor error del siglo ver aumentar la tasa de mortalidad de este virus en los años venideros debido a esfuerzos descuidados y apresurados para desarrollar una vacuna con un umbral tan bajo de pruebas de seguridad y la posibilidad de que ADE esté al acecho en las sombras.
Con suerte, ahora se sabe un poco más sobre el tema de la mejora dependiente de anticuerpos y los peligros reales e impredecibles de una vacuna contra el coronavirus. Al final, nuestra salud debería ser nuestra decisión, no la de un burócrata que no sabe lo básico sobre biología molecular presionado por los intereses de los laboratorios.
Vacuna de la gripe relacionada al Coronavirus , Dra. Maria José Martínez Albarracín – Médicos por la Verdad
Pathogenic priming
Pathogenic priming likely contributes to serious and critical illness and mortality in COVID-19 via autoimmunity https://www.sciencedirect.com/science/article/pii/S2589909020300186?dgcid=api_sd_search-api-endpoint https://doi.org/10.1016/j.jtauto.2020.100051 – https://dryburgh.com/james-lyons-weiler-coronavirus-vaccine-safety-warning/
Simplificado se dice cebado patógeno cuando el sistema inmunológico reacciona al coronavirus y cuando descompone al virus en pequeños componentes, detecta las diferentes proteínas del corona virus y luego desarrolla una reacción inmune a esos componentes, pero alguno de estos componentes del coronavirus son muy similares a nuestra propia proteína humana y entonces el sistema inmunológico comienza a reaccionar en contra nuestra propia proteína humana, a esto se le llama cebado patógeno (pathogenic priming) o magnificación o mejora dependiente de anticuerpos ADE, le dicen mejora pero lo que mejora es la potencia del virus para enfermarnos, el sistema inmunológico ataca nuestro propio tejido, y se vuelve demasiado reactivo.
Respuesta del pecado antigénico original a virus de ARN e inmunidad antiviral
Original Antigenic Sin Response to RNA Viruses and Antiviral Immunity doi: 10.4110/in.2016.16.5.26 1 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5086450/
La inmunidad cruzada (o reactividad cruzada) se define como la capacidad de nuestro sistema inmunitario para actuar con anticuerpos previamente generados contra un virus, frente a otro virus altamente similar. Se ha demostrado que una infección previa con la cepa del virus de la gripe H1N1 confiere cierta inmunidad cruzada frente a otra cepa similar, la H5N1. Esto también ocurre en la familia de los coronavirus: la respuesta frente al SARS-CoV-1 puede generar anticuerpos con reactividad cruzada frente al coronavirus que causa resfriado común (HCov-OC43) y viceversa.
La memoria inmune orientada a luchar contra un patógeno previamente reconocido, tiende a recordar una forma original del patógeno cuando una forma variante invade posteriormente. Esto se ha denominado «pecado antigénico original». Este efecto inmunológico adverso puede alterar la eficacia de la vacuna y en ocasiones, provocar una mayor patogenicidad o respuestas inflamatorias adicionales, según el tipo de patógeno y las circunstancias de la infección. Aquí nuestro objetivo es brindar una comprensión conceptual simplificada de la infección por virus y el pecado antigénico original comparando y contrastando los dos ejemplos de infecciones recurrentes, como los virus de la influenza y el dengue en humanos.
La (Original Antigenic Sin) OAS fue descrita por primera vez por Davenport et al. para explicar las respuestas de anticuerpos que se generaron después de la infección por el virus de la influenza en personas de diferentes grupos de edad ( 1 ). Luego se sugirió que los mecanismos de formación de anticuerpos parecen estar dirigidos por infecciones infantiles iniciales, de modo que la exposición a cepas relacionadas antigénicamente más adelante en la vida da como resultado un refuerzo progresivo del anticuerpo primario. Según esta sugerencia, la OAS podría ‘congelar’ o neutralizar el repertorio inmunológico contra un patógeno ( 2 ).
El mecanismo de congelación del repertorio de la OAS se entiende como parte de las respuestas de memoria inmunitaria codificadas de forma rígida contra un posible patógeno recurrente ( 3 ). Investigaciones recientes han demostrado que, aunque parece ser dependiente de patógenos, esta respuesta de memoria también se encuentra durante las respuestas inmunitarias innatas y no se limita a la inmunidad adaptativa ( 4 ). Este mecanismo protegería al huésped del patógeno como un equipo de defensa bien entrenado. La inmunidad contra el sarampión, las paperas y la viruela, entre otros, es un buen ejemplo de respuestas de memoria que brindan protección de por vida después de una sola infección natural ( 4 , 5). Desafortunadamente, la mayoría de los patógenos se adaptan a este programa inmunológico cambiando constantemente sus moléculas de superficie. La razón por la que se estigmatiza a la OAS como ‘pecado’ es su interferencia con la respuesta inmune ingenua contra variantes del patógeno ( 6 ). En esta revisión, presentamos el concepto de OEA como un tipo de ‘congelación del repertorio inmune’, cuyo resultado puede tener impactos tanto positivos como negativos en las respuestas inmunes contra patógenos y en el curso de enfermedades causadas por tales agentes.
CONCLUSIÓN
OAS puede aprovecharse para defenderse de un patógeno, o un patógeno puede aprovechar OAS para ingresar a la célula huésped a través del mecanismo de ADE. La OAS también puede dar lugar a respuestas inflamatorias exageradas cuando existe una disparidad entre la tasa de proliferación del patógeno y el potencial protector contra el patógeno, que podría ser proporcionado por las células B de memoria de reacción cruzada. Las respuestas de las células B de memoria de reacción cruzada normalmente protectoras de OAS que se convierten en modos ‘autodestructivos’ de formación de complejos inmunes con un patógeno, durante la ‘batalla’ contra un patógeno de rápida replicación parecen ser las víctimas inevitables de la ‘guerra’ entre el sistema inmunológico humano y los patógenos. Desde un punto de vista evolutivo, la diversidad de MHC en humanos podría representar una movilización contra tal evento; pero desde el punto de vista individual, los adultos jóvenes que tienen un repertorio de la OAS contra los virus de la influenza, potencialmente a través de muchas infecciones naturales e incluso sin vacunación, podrían convertirse en víctimas. El complejo principal de histocompatibilidad (MHC) es una serie de genes que codifican proteínas de la superficie celular que controlan la respuesta inmune adaptativa.
Las interacciones célula-célula de la respuesta inmune adaptativa son de importancia crítica en la protección contra patógenos. Estas interacciones están orquestadas por la sinapsis inmunológica cuyos componentes principales son el receptor de antígeno de células T (TCR) y la molécula del complejo principal de histocompatibilidad (MHC). ver referencias en el link al estudio mencionado arriba de este tema.
Roxana Bruno PhD. Inmunología, Inmunidad Colectiva
Dr. Eduardo Yahbes – Cuarentena
Dra Maria Jose Martinez, Test PCR ineficientes
80% de participantes con efectos adversos a vacuna contra coronavirus
Referencias
Garber K. Coronavirus vaccine developers wary of errant antibodies. Nature Biotechnology. 2020 Jun 5.
Wan, Yushun, et al. “Molecular mechanism for antibody-dependent enhancement of coronavirus entry.” Journal of virology 94.5 (2020)
Yang, Zhi-yong, et al. “Evasion of antibody neutralization in emerging severe acute respiratory syndrome coronaviruses.” Proceedings of the National Academy of Sciences 102.3 (2005): 797-801.
Ulrich, Henning, Micheli M. Pillat, and Attila Tárnok. “Dengue Fever, COVID‐19 (SARS‐CoV‐2), and Antibody‐Dependent Enhancement (ADE): A Perspective.” Cytometry Part A (2020).
Wang, Sheng-Fan, et al. “Antibody-dependent SARS coronavirus infection is mediated by antibodies against spike proteins.” Biochemical and biophysical research communications 451.2 (2014): 208-214.
Tseng C Te, Sbrana E, Iwata-Yoshikawa N, Newman PC, Garron T, Atmar RL, et al. Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLoS ONE. (2012) 7:35421. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0035421
Tetro, Jason A. “Is COVID-19 receiving ADE from other coronaviruses?.” Microbes and infection 22.2 (2020): 72-73
Hohdatsu, Tsutomu, et al. “Antibody-dependent enhancement of feline infectious peritonitis virus infection in feline alveolar macrophages and human monocyte cell line U937 by serum of cats experimentally or naturally infected with feline coronavirus.” Journal of veterinary medical science 60.1 (1998): 49-55.
Leung, Hiu-lan, Nancy. Mechanism of antibody-dependent enhancement in severe acute respiratory syndrome coronavirus infection (Thesis). The University of Hong Kong Libraries.
Yip, M. S., et al. “Antibody-dependent enhancement of SARS coronavirus infection and its role in the pathogenesis of SARS.” Hong Kong Med J 22.3 Suppl 4 (2016): 25-31.
Yip, Ming Shum, et al. “Antibody-dependent infection of human macrophages by severe acute respiratory syndrome coronavirus.” Virology journal 11.1 (2014): 1-11.
Corapi, WAYNE V., C. W. Olsen, and FREDRIC W. Scott. “Monoclonal antibody analysis of neutralization and antibody-dependent enhancement of feline infectious peritonitis virus.” Journal of virology 66.11 (1992): 6695-6705.
Takano, Tomomi, et al. “Antibody-dependent enhancement of serotype II feline enteric coronavirus infection in primary feline monocytes.” Archives of virology 162.11 (2017): 3339-3345.
Yip, Ming S., et al. “Investigation of Antibody-Dependent Enhancement (ADE) of SARS coronavirus infection and its role in pathogenesis of SARS.” BMC Proceedings. Vol. 5. No. S1. BioMed Central, 2011.
Fierz, Walter, and Brigitte Walz. “Antibody dependent enhancement due to original antigenic sin and the development of SARS.” Frontiers in immunology 11 (2020).
Ricke, Darrell, and Robert W. Malone. “Medical countermeasures analysis of 2019-nCoV and vaccine risks for antibody-dependent enhancement (ADE).” Available at SSRN 3546070 (2020).
Jaume, Martial, et al. “Anti-severe acute respiratory syndrome coronavirus spike antibodies trigger infection of human immune cells via a pH-and cysteine protease-independent FcγR pathway.” Journal of virology 85.20 (2011): 10582-10597.
Peron, Jean Pierre Schatzmann, and Helder Nakaya. “Susceptibility of the Elderly to SARS-CoV-2 Infection: ACE-2 Overexpression, Shedding, and Antibody-dependent Enhancement (ADE).” Clinics 75 (2020).
Yong, Chean Yeah, et al. “Recent advances in the vaccine development against Middle East respiratory syndrome-coronavirus.” Frontiers in microbiology 10 (2019): 1781.
Wang, Qidi, et al. “Immunodominant SARS coronavirus epitopes in humans elicited both enhancing and neutralizing effects on infection in non-human primates.” ACS infectious diseases 2.5 (2016): 361-376.
Olsen, CHRISTOPHER W., et al. “Monoclonal antibodies to the spike protein of feline infectious peritonitis virus mediate antibody-dependent enhancement of infection of feline macrophages.” Journal of virology 66.2 (1992): 956-965.
Hotez, Peter J., Maria Elena Bottazzi, and David B. Corry. “The potential role of TH17 immune responses in coronavirus immunopathology and vaccine-induced immune enhancement.” (2020).
Morens DM. Antibody-dependent enhancement of infection and the pathogenesis of viral disease. Clin Infect Dis. (1994) 19:500–12
Liu L, Wei Q, Lin Q, Fang J, Wang H, Kwok H, Tang H, Nishiura K, Peng J, Tan Z, et al. Anti‐spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS‐CoV infection. JCI Insight.2019;4(4):e123158.
de Alwis R, Chen S, Gan ES, Ooi EE. Impact of immune enhancement on Covid‐19 polyclonal hyperimmune globulin therapy and vaccine development. EBioMedicine2020;55:102768.
Kissler, S. M., Tedijanto, C., Goldstein, E., Grad, Y. H. & Lipsitch, M. Projecting the transmission dynamics of SARS-CoV-2 through the postpandemic period. Science (80-. ). eabb5793 (2020) doi:10.1126/science.abb5793.
Kucharski AJ, Edmunds WJ. Cross-immunity and age patterns of influenza A(H5N1) infection.EpidemiolInfect. 2015;143(6):1119‐1124. doi:10.1017/S0950268814001976
Vatti A, Monsalve DM, Pacheco Y, Chang C, Anaya JM, Gershwin ME. Original antigenic sin: A comprehensive review. J Autoimmun. 2017;83:12‐21. doi:10.1016/j.jaut.2017.04.008