https://www.mdpi.com/1648-9144/57/3/199/htm https://doi.org/10.3390/medicina57030199
La eficacia de la vacuna de BNT162b2 de Pfizer contra la infección disminuyó progresivamente del 92% al 47% dentro de los 4 a 6 meses , y desde el 7° mes en adelante no se pudo detectar efectividad . https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3949410
Justo antes de que la FDA emitiera su Autorización de uso de emergencia (EUA) inicial para la inyección COVID de Pfizer, Doshi advirtió al público que los resultados de eficacia de Pfizer y Moderna parecían espectaculares sólo porque las empresas los derivaban de datos de riesgo relativo.
El público no comprenden bien las medidas de reducción del riesgo relativo y de reducción del riesgo absoluto en la evaluación de los datos de los ensayos clínicos. La ausencia de una reducción del riesgo absoluto informada en los ensayos clínicos de la inyección COVID-19 puede generar un sesgo en la notificación de resultados que afecte la interpretación de la eficacia de la inyección.
En primer lugar, se informa de una reducción del riesgo relativo, no de una reducción del riesgo absoluto, que parece ser inferior al 1%. En segundo lugar, estos resultados se refieren al criterio de valoración principal de los ensayos de covid-19 de prácticamente cualquier gravedad y, lo que es más importante, no a la capacidad de la vacuna para salvar vidas , ni a la capacidad de prevenir infecciones, ni a la eficacia en subgrupos importantes (por ejemplo, ancianos frágiles). Éstos aún siguen siendo desconocidos.
En tercer lugar, estos resultados reflejan un momento relativamente corto después de la vacunación, y no sabemos nada sobre el rendimiento de la vacuna a los 3, 6 o 12 meses, por lo que no podemos comparar estas cifras de eficacia con otras vacunas como las vacunas contra la influenza (que se evalúan a lo largo de una temporada). En cuarto lugar, los niños, los adolescentes y las personas inmunocomprometidas fueron excluidos en gran medida de los ensayos, por lo que todavía carecemos de datos sobre estas importantes poblaciones.
El riesgo absoluto , explicado simplemente, es “la probabilidad de que ocurra un resultado”. El riesgo relativo «compara el riesgo de un evento de salud… entre un grupo con el riesgo entre otro grupo
El riesgo relativo mide la probabilidad de muerte, lesión o enfermedad en quienes se exponen a algo peligroso comparados con los que no se exponen, y por ello expresa una comparación. La reducción del riesgo relativo (RRR) solo tiene en cuenta a las personas que sufrirían un problema de salud si no reciben tratamiento. El riesgo relativo puede disminuir o aumentar según las circunstancias. Por ejemplo, el riesgo relativo de muerte por K0 B1T es mucho mayor si tenemos comorbilidades.
El riesgo absoluto mide la probabilidad personal de muerte, lesión o enfermedad en quienes se exponen a algo peligroso/beneficioso y considera a todos los participantes del estudio. El riesgo absoluto también puede disminuir o aumentar según las circunstancias, pero se refiere al individuo, sin hacer comparaciones.
Sobre los ensayos de Pfizer y Moderna
Charla Dr. en Farmacia Juan Erviti efectividad vacunas covid 19 – capítulo 1 https://odysee.com/@ELPIDA:c/charla-Juan-Erviti-efectividad-vacunas_3:b
Juan Erviti: Reflexiones sobre las «vacunas» covid19 tres años después. Juan Erviti es doctor en Farmacia y director del Centro Cochrane de Navarra. Es el investigado español que más ha publicado en revistas internacionales sobre efectividad y efectos adversos de «vacunas» covid19. Desde septiembre de 2021 nos ofrecido seis conferencias de actualización en esta temática. https://odysee.com/@Facilita.eU:d/Erviti-Mayo-24:d
Pfizer dijo a la FDA que ocho (de aproximadamente 22.000) voluntarios en su grupo de su inyección desarrollaron un caso de COVID-19 confirmado por PCR , frente a 162 de 22.000 voluntarios en el grupo de placebo. Moderna informó una propagación similar: 5 de 15.000 en el grupo de la vacuna frente a 90 de 15.000 en el grupo del placebo.
Si hacemos cuentas, las cifras de los ensayos clínicos de Pfizer mostraron : “La reducción del riesgo en términos absolutos [fue] sólo del 0,7%, de un riesgo ya muy bajo del 0,74% [en el grupo de placebo] a un riesgo mínimo del 0,04% [ en el grupo de la vacuna]”. (Dividir 0,7 (la diferencia entre los dos grupos) por 0,74 es el cálculo matemático que produjo el tan promocionado número de “95% de efectividad”).
Aunque los ocho casos de COVID versus 162 confirmados por PCR en el ensayo de Pfizer pueden parecer una gran diferencia para el lector casual, Peter Doshi posteriormente alertó al público sobre el hecho de que Pfizer sesgó su análisis al excluir a más de 3.400 personas con casos no confirmados por PCR. Síntomas confirmados de COVID: los individuos se dividieron casi por igual entre los grupos de vacuna y placebo.
Como escribió Doshi en The BMJ: “Con 20 veces más casos sospechosos que confirmados, esta categoría de enfermedad no puede ignorarse simplemente porque no hubo un resultado positivo en la prueba de PCR. De hecho, esto hace que sea aún más urgente entenderlo”. Doshi señaló que si se tienen en cuenta tanto los casos sospechosos como los confirmados, la cifra de riesgo relativo del 95% se reduciría al 19%.
RFK Jr. da un vuelco a la narrativa ‘segura y eficaz’ con datos del propio ensayo clínico de Pfizer https://rumble.com/v10fkxv-rfk-jr.-upends-the-safe-and-effective-narrative-with-data-from-pfizers-own-.html
Solo publicitar el riesgo relativo da al público una falsa percepción de la eficacia de la vacuna
El presente artículo utiliza herramientas epidemiológicas clínicas para evaluar críticamente los informes de eficacia en los ensayos clínicos de la vacuna de ARNm Pfzier / BioNTech y Moderna COVID-19.
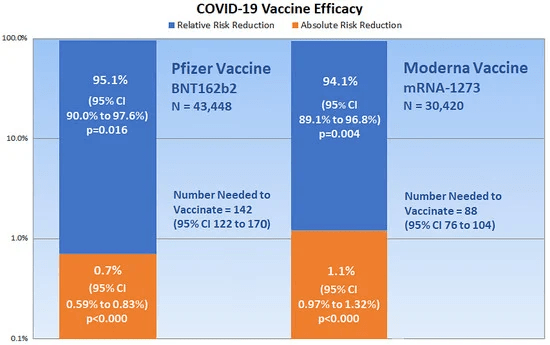
Según los datos informados por el fabricante de la vacuna BNT162b2 de Pfzier / BioNTech, esta evaluación crítica muestra: reducción del riesgo relativo, 95,1% y reducción del riesgo absoluto, 0,7%.
Para la vacuna Moderna mRNA-1273, la evaluación muestra: reducción del riesgo relativo, 94,1%; a 96,8%; reducción absoluta del riesgo, 1,1%a 1,32%.
Las medidas de reducción del riesgo absoluto no informadas de 0,7% y 1,1% para las vacunas Pfzier / BioNTech y Moderna, respectivamente, son mucho más bajas que las medidas de reducción del riesgo relativo informadas. Informar las medidas absolutas de reducción del riesgo es esencial para evitar una mala interpretación de los resultados en la evaluación de la eficacia de la vacuna COVID-19.
1. Solo la transparencia y entendimiento de estos datos permitirán una toma de decisiones informada.
Pfizer / BioNTech y Moderna informaron la reducción del riesgo relativo de sus inyecciones, pero los fabricantes no informaron una reducción del riesgo absoluto correspondiente, que “parece ser menos del 1%” [ 9 ].
La reducción del riesgo absoluto (ARR) y la reducción del riesgo relativo (RRR) son medidas de eficacia del tratamiento informadas en ensayos clínicos aleatorizados. Debido a que la ARR y la RRR pueden ser dramáticamente diferentes en el mismo ensayo, es necesario incluir ambas medidas al informar los resultados de eficacia para evitar sesgos en el informe de resultados.
Una evaluación crítica de los datos de ensayos clínicos disponibles públicamente verifica que los porcentajes de reducción del riesgo absoluto para la vacuna Pfizer / BioNTech BNT162b2 [ 7 ] y la vacuna Moderna mRNA-1273 [ 8 ] son, respectivamente, 0,7% y 1,1%; a 1,32%.
Los mismos datos disponibles públicamente, sin medidas absolutas de reducción del riesgo, fueron revisados y aprobados por la lista de miembros que forman parte del Comité Asesor de Vacunas y Productos Biológicos Relacionados (VRBPAC) de la Administración de Drogas y Alimentos de los EE. UU. (FDA) para la autorización de uso de emergencia (EUA) de las vacunas de ARNm [ 10 ].
Irónicamente, la omisión de medidas absolutas de reducción del riesgo en los datos revisados por el VRBPAC pasa por alto las directrices de la FDA para comunicar al público los riesgos y beneficios basados en la evidencia [ 11 ]. El consejo de la FDA para los proveedores de información incluye:
“Proporcione riesgos absolutos, no solo riesgos relativos. Los pacientes se ven indebidamente influenciados cuando la información de riesgo se presenta utilizando un enfoque de riesgo relativo; esto puede resultar en decisiones subóptimas. Por lo tanto, se debe utilizar un formato de riesgo absoluto «.
El New England Journal of Medicine también publicó datos de ensayos clínicos sobre la seguridad y eficacia de la vacuna BNT162b2 [ 12 ] y la vacuna mRNA-1273 [ 13 ], pero sin mencionar las medidas absolutas de reducción del riesgo. El presente artículo utiliza herramientas epidemiológicas para evaluar críticamente las medidas de reducción del riesgo absoluto y relativo para la eficacia de la vacuna en los ensayos clínicos de fase III de las inyecciones de ARNm de COVID-19.
2. Evaluación crítica de la eficacia de la vacuna
La aplicación de métodos epidemiológicos y biométricos al diagnóstico y tratamiento clínicos se conoce como epidemiología clínica [ 14 ]. Las herramientas epidemiológicas clínicas se pueden aplicar en la medicina basada en la evidencia (MBE) para evaluar críticamente la validez de la evidencia de la investigación, el tamaño del efecto y la utilidad en la práctica clínica [ 15 ].
Los efectos del tratamiento clínico en grupos de participantes se miden comparando las probabilidades de un evento, conocidas como tasas de eventos [ 16 ]. La Figura 1, abajo, muestra un ejemplo de un ensayo clínico de una inyección para una enfermedad infecciosa.
Los grupos de vacuna y placebo en la Figura 1 cada uno tiene 100 individuos asignados al azar sin antecedentes de infección, y un evento se define como la incidencia de infección entre todos los individuos durante el curso del ensayo.
El porcentaje de eventos en el grupo de la vacuna es la tasa de eventos experimentales (EER) o el riesgo de infección en el grupo de la vacuna (1/100 = 1%), y el porcentaje de eventos en el grupo de placebo es la tasa de eventos de control (CER ) o el riesgo de infección en el grupo placebo (2/100 = 2%).
La reducción absoluta del riesgo (ARR) es la diferencia de riesgo de enfermedad entre los grupos de placebo y vacuna, es decir, el CER menos el EER (2% – 1% = 1%). La ARR también se conoce como incidencia prevenible de enfermedades por vacunación (VDPI) [ 17].
La reducción del riesgo relativo (RRR) o la eficacia de la vacuna (VE) es el riesgo reducido de la vacunación, el ARR o el VDPI, en relación o dividido por el riesgo en individuos no vacunados, el CER (1% / 2% = 50%) [ 18 ] .
Figura 1. Ejemplo de ensayo clínico de una vacuna para una enfermedad infecciosa.
Figura 2. El gráfico muestra los resultados de la evaluación crítica de la eficacia de la vacuna de ARNm COVID-19.
Conclusiones
Una evaluación crítica de los datos de los ensayos clínicos de fase III para la inyección de Pfizer / BioNTech BNT162b2 y la inyección de Moderna mRNA-1273 muestra que las medidas de reducción del riesgo absoluto son mucho más bajas que las medidas de reducción del riesgo relativo informadas. Sin embargo, los fabricantes no informaron sobre las medidas absolutas de reducción del riesgo en documentos publicados.
Además, el Comité Asesor de la FDA de EE. UU. (VRBPAC) no siguió las pautas publicadas por la FDA para comunicar los riesgos y beneficios al público, y el comité no informó las medidas absolutas de reducción del riesgo al autorizar las inyecciones BNT162b2 y mRNA-1273 para uso de emergencia. Tales ejemplos de sesgo de notificación de resultados engañan y distorsionan la interpretación pública de la eficacia de la vacuna de ARNm de COVID-19 y violan las obligaciones éticas y legales del consentimiento informado.
Hágase miembro, con su colaboración reinvertiremos los ingresos de estas suscripciones en un volumen cada vez mayor de informes y análisis expertos de alta calidad, independientes e imparciales. Les estamos agradecidos si consideran colaborar y/o recomendarnos.
Bill Gates poseía una gran participación en el fabricante de remdesivir, Gilead. [124] Los propios estudios de la OMS mostraron claramente, como incluso la OMS reconoció, que el remdesivir no era útil contra el COVID. [125] Peor aún, la extrema toxicidad del fármaco (los efectos secundarios del remdesivir imitan los síntomas de la última etapa del COVID [126 , 127] ) en realidad puede empeorar la gravedad de la enfermedad. [128] Para superar estos obstáculos, el Dr. Fauci financió y manipuló una serie de estudios defectuosos para sugerir, engañosamente, que remdesivir podría reducir levemente la cantidad de días que un paciente permanecería en el hospital. [129] Los estudios mucho más amplios de la OMS demostraron que no hubo reducción en la duración de la estancia hospitalaria. Sin embargo, utilizando su “investigación” descaradamente orquestada, el Dr. Fauci forzó la aprobación de remdesivir a través de la FDA como “estándar de atención” para COVID. Al mismo tiempo, el Dr. Fauci y Bill Gates estaban financiando y promoviendo estudios para desacreditar la cloroquina y la hidroxicloroquina y sabotear la ivermectina, dos remedios efectivos contra el COVID que representaban una amenaza existencial para el remdesivir y toda la empresa de vacunas contra el COVID de Fauci/Gates.
Extractado de el libro de Robert Kennedy Jr. sobre Fauci, ver mas en : https://cienciaysaludnatural.com/la-historia-criminal-del-dr-anthony-fauci-documentada-en-un-libro-de-robert-kennedy-jr/
- Gilead Sciences, Inc., U.S. Securities and Exchange Commission, Form 10-K (Dec. 31, 2005), sec.gov/Archives/edgar/data/882095/000119312506045128/d10k.htm
- World Health Organization, “WHO recommends against the use of remdesivir in COVID-19 patients” (Nov 20, 2020), who.int/news-room/feature-stories/detail/who-recommends-against-the-use-of-remdesivir-in-covid-19-patients
- Drugs.com, Remdesivir Side Effects (Feb 13, 2021), drugs.com/sfx/remdesivir-side-effects.html
- Centers for Disease Control and Prevention, Symptoms of COVID-19 (Feb. 22, 2021), cdc.gov/coronavirus/2019-ncov/symptoms-testing/symptoms.html
- Jason D. Goldman et al., “Remdesivir for 5 or 10 Days in Patients with Severe Covid-19,” New England Journal of Medicine (May 27, 2020), nejm.org/doi/full/10.1056/NEJMoa2015301
- John H. Beigel et al., “Remdesivir for the Treatment of Covid-19—Final Report,” New England Journal of Medicine (Oct. 8, 2020), nejm.org/doi/10.1056/NEJMoa2007764
Referencias
- Kwon, D. The Promise of mRNA Vaccines. Available online: https://www.the-scientist.com/news-opinion/the-promise-of-mrna-vaccines-68202 (accessed on 23 December 2020).
- Genome. Messenger RNA (mRNA). Available online: https://www.genome.gov/genetics-glossary/messenger-rna (accessed on 23 December 2020).
- Garde, D. The Story of mRNA: How a Once-Dismissed Idea Became a Leading Technology in the Covid Vaccine Race. Available online: https://www.statnews.com/2020/11/10/the-story-of-mrna-how-a-once-dismissed-idea-became-a-leading-technology-in-the-covid-vaccine-race/ (accessed on 5 January 2021).
- Centers for Disease Control and Prevention. Understanding mRNA COVID-19 Vaccines. Available online: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/different-vaccines/mrna.html (accessed on 22 December 2020).
- Wadhwa, A.; Aljabbari, A.; Lokras, A.; Foged, C.; Thakur, A. Opportunities and Challenges in the Delivery of mRNA-based Vaccines. Pharmaceutics 2020, 12, 102. [Google Scholar] [CrossRef] [PubMed]
- Reichmuth, A.M.; Oberli, M.A.; Jaklenec, A.; Langer, R.; Blankschtein, D. mRNA vaccine delivery using lipid nanoparticles. Ther. Deliv. 2016, 7, 319–334. [Google Scholar] [CrossRef] [PubMed]
- Food and Drug Administration. Pfizer-BioNTech COVID-19 Vaccine VRBPAC Briefing Document. Available online: https://www.fda.gov/media/144246/download (accessed on 23 December 2020).
- Food and Drug Administration. FDA Briefing Document: Moderna COVID-19 Vaccine. Available online: https://www.fda.gov/media/144434/download (accessed on 23 December 2020).
- Doshi, P. Peter Doshi: Pfizer and Moderna’s ”95% effective” Vaccines—Let’s Be Cautious and First See the Full Data. Available online: https://blogs.bmj.com/bmj/2020/11/26/peter-doshi-pfizer-and-modernas-95-effective-vaccines-lets-be-cautious-and-first-see-the-full-data/ (accessed on 23 December 2020).
- Food and Drug Administration. Roster of the Vaccines and Related Biological Products Advisory Committee. Available online: https://www.fda.gov/advisory-committees/vaccines-and-related-biological-products-advisory-committee/roster-vaccines-and-related-biological-products-advisory-committee (accessed on 23 December 2020).
- Fischhoff, B.; Brewer, N.; Downs, J. Communicating Risks and Benefits: An Evidence-Based User’s Guide; Food and Drug Administration (FDA), US Department of Health and Human Services: Silver Spring, MA, USA, 2011.
- Polack, F.P.; Thomas, S.J.; Kitchin, N.; Absalon, J.; Gurtman, A.; Lockhart, S.; Perez, J.L.; Pérez Marc, G.; Moreira, E.D.; Zerbini, C. Safety and efficacy of the BNT162b2 mRNA covid-19 vaccine. N. Engl. J. Med. 2020, 383. [Google Scholar] [CrossRef] [PubMed]
- Baden, L.R.; El Sahly, H.M.; Essink, B.; Kotloff, K.; Frey, S.; Novak, R.; Diemert, D.; Spector, S.A.; Rouphael, N.; Creech, C.B.; et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N. Engl. J. Med. 2020, 384. [Google Scholar] [CrossRef]
- Sackett, D.L. Clinical epidemiology. Am. J. Epidemiol. 1969, 89, 125–128. [Google Scholar] [CrossRef] [PubMed]
- Sackett, D.; Straus, S.; Scott Richardson, W.; Rosenberg, W.; Haynes, R. Evidence-Based Medicine: How to Practice and Teach EBM, 2nd ed.; Churchill Livingstone: Edinburgh, UK; London, UK, 2000. [Google Scholar]
- Cook, R.J.; Sackett, D.L. The number needed to treat: A clinically useful measure of treatment effect. BMJ 1995, 310, 452–454. [Google Scholar] [CrossRef] [PubMed]
- Dasgupta, S. A Review of Vaccine Efficacy Measures. Vaccin Res. Open J. 2019, 1, 61–64. [Google Scholar]
- Irwig, L.; Irwig, J.; Revena, L.; Sweet, M. Relative risk, relative and absolute risk reduction, number needed to treat and confidence intervals. In Smart Health Choices: Making Sense of Health Advice; Hammersmith Press: London, UK, 2008; Chapter 18. [Google Scholar]
- Kremer, L.; Moyer, V. Tips and tricks for understanding and using SR results—No 1: Relative risk, risk difference, and number needed to treat. Evidence-Based Child Health Cochrane Rev. J. 2009, 4, 1146–1148. [Google Scholar] [CrossRef]
- Sullivan, L. Confidence Intervals for the Risk Ratio (Relative Risk). Available online: https://sphweb.bumc.bu.edu/otlt/mph-modules/bs/bs704_confidence_intervals/bs704_confidence_intervals8.html#:~:text=Therefore%2C%20computing%20the%20confidence%20interval,confidence%20interval%20for%20the%20RR (accessed on 26 December 2020).
- Morris, J.A.; Gardner, M.J. Calculating Confidence Intervals For Relative Risks (Odds Ratios) And Standardised Ratios And Rates. BMJ 1988, 296, 1313–1316. [Google Scholar] [CrossRef] [PubMed]
- Schechtman, E. Odds ratio, relative risk, absolute risk reduction, and the number needed to treat—Which of these should we use? Value Health 2002, 5, 431–436. [Google Scholar] [CrossRef] [PubMed]
- Altman, D.G.; Bland, J.M. How to obtain the P value from a confidence interval. BMJ 2011, 343, d2304. [Google Scholar] [CrossRef] [PubMed]
- Azzopardi, D. Group Comparison Calculator. Available online: https://www.neoweb.org.uk/Additions/compare.htm (accessed on 6 January 2021).
- Heidel, E. Epidemiology. Available online: https://www.scalestatistics.com/epidemiology.html (accessed on 6 January 2021).
- Voysey, M.; Clemens, S.A.C.; Madhi, S.A.; Weckx, L.Y.; Folegatti, P.M.; Aley, P.K.; Angus, B.; Baillie, V.L.; Barnabas, S.L.; Bhorat, Q.E. Safety and Efficacy of the ChAdOx1 nCoV-19 Vaccine (AZD1222) against SARS-CoV-2: An Interim Analysis of Four Randomised Controlled Trials in Brazil, South Africa, and the UK. Lancet 2021, 397, 99–111. [Google Scholar] [CrossRef]
- Sadoff, J.; Le Gars, M.; Shukarev, G.; Heerwegh, D.; Truyers, C.; de Groot, A.M.; Stoop, J.; Tete, S.; Van Damme, W.; Leroux-Roels, I. Interim Results of a Phase 1–2a Trial of Ad26. COV2. S Covid-19 Vaccine. N. Engl. J. Med. 2021. [Google Scholar] [CrossRef] [PubMed]
- Elliott, M.H.; Skydel, J.J.; Dhruva, S.S.; Ross, J.S.; Wallach, J.D. Characteristics and Reporting of Number Needed to Treat, Number Needed to Harm, and Absolute Risk Reduction in Controlled Clinical Trials, 2001–2019. JAMA Intern. Med. 2020, 181. [Google Scholar]
- Kahwati, L.; Carmody, D.; Berkman, N.; Sullivan, H.W.; Aikin, K.J.; DeFrank, J. Prescribers’ Knowledge and Skills for Interpreting Research Results: A Systematic Review. J. Contin. Educ. Health Prof. 2017, 37, 129–136. [Google Scholar] [CrossRef]
- Thomas, E.T.; Heneghan, C. Outcome Reporting Bias. Available online: https://catalogofbias.org/biases/outcome-reporting-bias/ (accessed on 23 November 2020).
- Shah, P.; Thornton, I.; Turrin, D.; Hipskind, J.E. Informed Consent. Available online: https://www.ncbi.nlm.nih.gov/books/NBK430827/#:~:text=Informed%20consent%20is%20the%20process,undergo%20the%20procedure%20or%20intervention (accessed on 8 February 2021).
- Demicheli, V.; Jefferson, T.; Ferroni, E.; Rivetti, A.; Di Pietrantonj, C. Vaccines for preventing influenza in healthy adults. In Cochrane Database Of Systematic Reviews; Cochrane Library: Hoboken, NJ, USA, 2018. Available online: https://pubmed.ncbi.nlm.nih.gov/29388196 (accessed on 7 January 2021).
- Centers for Disease Control and Prevention. Vaccine Effectiveness: How Well Do the Flu Vaccines Work? Available online: https://www.cdc.gov/flu/vaccines-work/vaccineeffect.htm (accessed on 26 November 2020).
- Remschmidt, C.; Wichmann, O.; Harder, T. Frequency and impact of confounding by indication and healthy vaccinee bias in observational studies assessing influenza vaccine effectiveness: A systematic review. BMC Infect. Dis. 2015, 15, 429. [Google Scholar] [CrossRef] [PubMed]
Más casos en : https://www.actasanitaria.com/riesgo-relativo-y-riesgo-absoluto/