Current Safety Concerns with Human Papillomavirus Vaccine: A Cluster Analysis of Reports in VigiBase
Rebecca E. Chandler, Kristina Juhlin, Jonas Fransson, Ola Caster, I. Ralph Edwards G. Niklas Norén – 2016
doi: 10.1007 / s40264-016-0456-3
Resumen
Han surgido una serie de señales de seguridad (síndrome de dolor regional complejo (SDRC), síndrome de taquicardia ortostática postural (POTS) y síndrome de fatiga crónica (SFC)) con las vacunas contra el virus del papiloma humano (VPH), que comparten un patrón similar de sintomatología. Evaluaciones previas de señales y estudios epidemiológicos se han basado en gran medida en metodologías tradicionales y las señales se han considerado individualmente.
Objetivo
El objetivo de este estudio fue explorar los patrones de informes globales para la vacuna contra el VPH para subgrupos de informes con perfiles de eventos adversos (EA) similares.
Métodos
Se identificaron todos los informes de seguridad de casos individuales (informes) para las vacunas contra el VPH en VigiBase ® hasta el 1 de enero de 2015. Se utilizó un algoritmo de análisis estadístico de conglomerados para identificar agrupaciones naturales basadas en perfiles de AE en un análisis exploratorio basado en datos. La evaluación clínica de los grupos se realizó para identificar grupos relevantes para las preocupaciones actuales de seguridad.
Resultados
En general, se identificaron 54 grupos que contenían al menos cinco informes. Los cuatro grupos más grandes incluyeron el 71% de los informes de VPH analizados y los EA descritos incluidos en la etiqueta del producto. Se identificaron cuatro grupos más pequeños para incluir informes de casos relevantes para problemas de seguridad en curso (un total de 694 casos). En los cuatro grupos, los términos de EA más comúnmente reportados fueron dolor de cabeza y mareos y fatiga o síncope; tres de estos cuatro términos de EA se informaron en> 50% de los informes incluidos en los grupos. Estos grupos tenían una mayor proporción de casos graves en comparación con los informes generales de VPH (44-89% en los grupos en comparación con 24%). Además, solo una minoría de los informes incluidos en estos grupos incluyeron términos de diagnóstico de EA para explicar estos síntomas. Usando proporciones de informes proporcionales, Se encontró que la combinación de dolor de cabeza y mareos con fatiga o síncope se informó con mayor frecuencia en los informes de vacuna contra el VPH en comparación con los informes de vacuna contra el VPH para mujeres de 9 a 25 años. Esta desproporcionalidad se mantuvo cuando los resultados se estratificaron por edad y cuando se excluyeron aquellos países que informaron las señales de CRPS (Japón) y POTS (Dinamarca).
Conclusiones
El análisis de conglomerados revela informes adicionales de EA tras la vacunación contra el VPH que son de naturaleza grave y describen síntomas que se superponen a los informados en casos de las señales de seguridad recientes (POTS, CRPS y CFS), pero que no informan diagnósticos explícitos. Si bien la asociación causal entre la vacuna contra el VPH y estos EA sigue siendo incierta, los análisis más extensos de los informes espontáneos pueden identificar mejor las series de casos relevantes para una evaluación exhaustiva de la señal.
Síndrome de fatiga crónica, Síndrome de dolor complejo regional, Síndrome de taquicardia ortostática postural.
Material electrónico complementario
La versión en línea de este artículo (doi: 10.1007 / s40264-016-0456-3 )
1 Introducción
Las vacunas contra el virus del papiloma humano (VPH) se introdujeron inicialmente en el uso público hace 10 años, primero con la aprobación europea de 2006 de la vacuna cuadrivalente, Gardasil, y luego con la aprobación de 2007 de la vacuna bivalente, Cervarix. Desde entonces, se estima que 80 millones de niñas y mujeres en todo el mundo han recibido la vacuna contra el VPH [ 1 ].
La introducción de la vacuna contra el VPH en los programas nacionales de vacunación ha variado entre países, y Australia se convirtió en el primer país en introducir un programa nacional de vacunación contra el VPH financiado por el gobierno en 2007 [ 2 ]. Dentro de la UE, Alemania recomendó la vacunación ya en 2007, el Reino Unido implementó la vacuna contra el VPH en el programa nacional de vacunación en 2008, mientras que los diversos países nórdicos incorporaron la vacunación entre 2009 y 2012 [ 3 ]. Aunque está disponible para la compra privada en los EE. UU. Desde 2007, no fue sino hasta 2010 que las vacunas contra el VPH debían estar cubiertas por las pólizas de seguro [ 4] Japón introdujo la vacuna en abril de 2010 y tuvo una absorción de hasta el 90% en aquellas regiones del país en las que la vacuna estaba disponible por subsidio del gobierno. En agosto de 2014, 58 países habían introducido la vacuna contra el VPH en su programa nacional de inmunización para niñas y también para niños en algunos países [ 5 ].
En 2013, surgieron una serie de señales de seguridad para las vacunas contra el VPH: síndrome de dolor regional complejo (SDRC) en Japón, síndrome de taquicardia ortostática postural (POTS) en Dinamarca y fatiga duradera en los Países Bajos [ 6 , 7 , 8.] Cada uno de estos diagnósticos generalmente es poco conocido y en gran medida poco reconocido, particularmente en la población pediátrica, como se revela en la relativa escasez de datos publicados sobre su fisiopatología y epidemiología. La Agencia Europea de Medicamentos (EMA) informó una revisión de las preocupaciones de seguridad de POTS y CRPS en noviembre de 2015. La evaluación incluyó principalmente una revisión de los datos presentados por los titulares de autorizaciones de comercialización (TAC) y la consulta con un grupo de asesoramiento científico sobre vacunas. Aunque la EMA reconoció la dificultad inherente en una evaluación de estas señales («Los síntomas de CRPS y POTS pueden superponerse con otras condiciones, dificultando el diagnóstico tanto en la población general como en las personas vacunadas»),9 ] A pesar de estas garantías regulatorias, las preocupaciones públicas con respecto a la seguridad de las vacunas contra el VPH siguen siendo reveladas en la reciente disminución significativa en la absorción de vacunas en Dinamarca [10 ] y en las acciones de los grupos de defensa de pacientes que colaboran a nivel mundial [11 ].
El objetivo de este trabajo fue explorar VigiBase, la base de datos internacional de la Organización Mundial de la Salud (OMS) de sospechas de reacciones adversas a medicamentos, para casos relevantes adicionales en la revisión de la señal de seguridad grave para las vacunas contra el VPH que ha sido difícil de caracterizar completamente por la señal tradicional Metodología de detección. Presumimos que diferentes reporteros podrían usar diferentes términos de AE para describir condiciones similares, y sin embargo, podría haber una superposición suficiente entre los informes que describen condiciones relacionadas para identificar subgrupos de informes de vacunas contra el VPH con perfiles de AE similares. Para lograr estos objetivos, se utilizó un enfoque novedoso basado en datos para la exploración de señales: análisis de conglomerados de eventos adversos (EA).
2 métodos
La fuente de datos para esta investigación fue VigiBase, la base de datos internacional de la OMS de sospechas de reacciones adversas a medicamentos. VigiBase es un sistema de farmacovigilancia computarizado en el que la información se registra de forma estructurada y jerárquica. Se reciben informes de los centros nacionales de farmacovigilancia en los 124 países que participan en el Programa de la OMS para el Monitoreo Internacional de Medicamentos (PIDM). Los informes presentados a los centros nacionales provienen de fuentes reguladas y voluntarias. El Centro de Monitoreo de Uppsala (UMC) recibe detalles limitados sobre cada sospecha de reacción adversa [ 12 ].
Todos los informes de seguridad de casos individuales (informes) para las vacunas contra el VPH recibidas en VigiBase hasta el 1 de enero de 2015 se identificaron para su uso en esta investigación. Todos los análisis se llevaron a cabo en los datos AE en el Diccionario Médico para las actividades de regulación (MedDRA ® ) Término preferido (PT) terminología -level.
La designación de seriedad se incluye en los informes y la determina el reportero o en los informes locales, en los centros nacionales de farmacovigilancia. La estandarización de la seriedad comúnmente utilizada es la que proporcionan las Directrices de la Conferencia Internacional de Armonización (ICH) [ 13 ].
2.1 Análisis de conglomerados de eventos adversos
El análisis de conglomerados busca identificar subgrupos naturales en los datos con un parecido más cercano entre los ítems dentro de un subgrupo que entre los ítems en diferentes subgrupos. Representa una forma de aprendizaje no supervisado, donde el algoritmo no cuenta con ejemplos conocidos de una serie de clases preespecificadas u otra información sobre la naturaleza de las clases. En cambio, las clases y sus perfiles se derivan de los datos sin orientación adicional. Restringiendo nuestro conjunto de datos a los informes de casos de VPH que contienen al menos dos términos de EA, aplicamos el análisis de conglomerados de clase latente [ 14], que se basa en un modelo de mezcla probabilística en el que se supone que cada informe se generó en un proceso aleatorio, extraído de uno de un conjunto de clases latentes distintas, cada una con su frecuencia relativa general y un conjunto de probabilidades para los términos de EA informados . Para empezar, los informes se asignan aleatoriamente a una clase latente. Una llamada iteración de expectativa-maximización (EM) [ 15] luego se emplea mediante el cual la frecuencia relativa y las probabilidades de AE de cada clase se vuelven a estimar alternativamente en función de sus informes asignados, y los informes se vuelven a asignar a las clases latentes en función de las frecuencias relativas actualizadas y los perfiles de AE de estas clases. Con el fin de aumentar la estabilidad de nuestra solución general, aplicamos el denominado agrupamiento de consenso. La iteración EM se repitió así 100 veces con puntos de partida aleatorios, y los grupos finales se derivaron como grupos de informes que se habían asignado a la misma clase latente que otro informe en el mismo grupo, en al menos 90 de las 100 soluciones originales para la clase latente análisis de conglomerados.
2.2 Revisión clínica de grupos
Todos los grupos resultantes fueron revisados independientemente por dos médicos diferentes (RC e IRE) para determinar el escenario clínico descrito por cada grupo. Los grupos con síntomas relevantes para las preocupaciones de seguridad actuales se seleccionaron para la revisión clínica a nivel de caso.
Los casos dentro de los grupos identificados fueron revisados por coherencia clínica, con un enfoque en la gravedad, que incluyó la revisión de los criterios de gravedad, así como la evaluación clínica de la información narrativa del caso, cuando esté disponible, para obtener detalles sobre los procedimientos o resultados de diagnóstico y el impacto en la calidad de vida ( como dejar las actividades, faltar a la escuela).
Se consideró que un caso era relevante para las preocupaciones actuales de seguridad si los EA informados, la seriedad y / o la narración del caso juntos justificaban la inclusión de POTS, CRPS o síndrome de fatiga crónica (SFC) en un diagnóstico clínico diferencial. Ni los casos que informan diagnósticos alternativos como términos de EA o que incluyen información narrativa (factores de riesgo, resultados de diagnóstico) sugestivos de la posibilidad de otros diagnósticos ni casos que describen síntomas que se resolvieron o continuaron durante un período corto después de la vacunación (hasta 1 semana) fueron considerados relevantes.
2.3 Proporciones de informes proporcionales
Tras la identificación de la combinación de los términos de EA dolor de cabeza y mareos con síncope o fatiga a partir de los resultados del análisis de conglomerados, se realizó una investigación para explorar si hubo informes desproporcionados de esta combinación de términos de AE en los informes de vacunas contra el VPH en comparación con Vacunas contra el VPH en el mismo sexo y franja de edad (mujeres de 9 a 25 años). Para hacer coincidir el período de tiempo en el que las vacunas contra el VPH han estado disponibles, limitamos el grupo de comparación (informes de vacunas que no son contra el VPH) a los que se recibieron desde 2005 en adelante. Dado que el rango de edad descrito en la indicación para las vacunas contra el VPH es algo amplio, también se realizaron análisis estratificados para los grupos de edad 9-12 años, 13-16 años, 17-20 años y 21-25 años, como un análisis de sensibilidad . Además, dado que las señales de CRPS y POTS surgieron de Japón y Dinamarca, respectivamente, Las proporciones ajustadas de informes proporcionales (PRR) se calcularon después de la exclusión de los informes de estos dos países. Se realizó un análisis adicional para determinar si había una desproporcionalidad en la «seriedad» de los informes que describen esta combinación de términos en los informes de vacunas contra el VPH en comparación con las vacunas sin VPH. Se calcularon los PRR [16 ]
3 resultados
El 1 de enero de 2015, hubo un total de 10,3 millones de informes en VigiBase, y se ingresaron 39.953 informes de vacunas contra el VPH en el algoritmo de agrupamiento. Los informes se clasificaron en un total de 4116 grupos con 54 de los grupos que contienen cinco o más informes. Los 54 grupos están incluidos en la tabla electrónica suplementaria 1.Los cuatro grupos más grandes incluyeron el 71% (28,502) de los informes analizados de la vacuna contra el VPH y los EA descritos que están bien caracterizados y están incluidos en la etiqueta del producto, como eventos locales y sistémicos y reacciones vasovagales. Estos grupos se caracterizaron además por el hecho de que, en promedio, los informes incluyeron solo unos pocos términos de EA (tres a cuatro PT) y generalmente se clasificaron como no graves (Fig. 1 ). La revisión clínica de los grupos más pequeños reveló que describían series de casos relacionadas con varios escenarios clínicos, como la displasia cervical (grupo 7), la mononucleosis (grupo 21) y el lupus eritematoso sistémico (grupo 39) [tabla 1 complementaria electrónica].
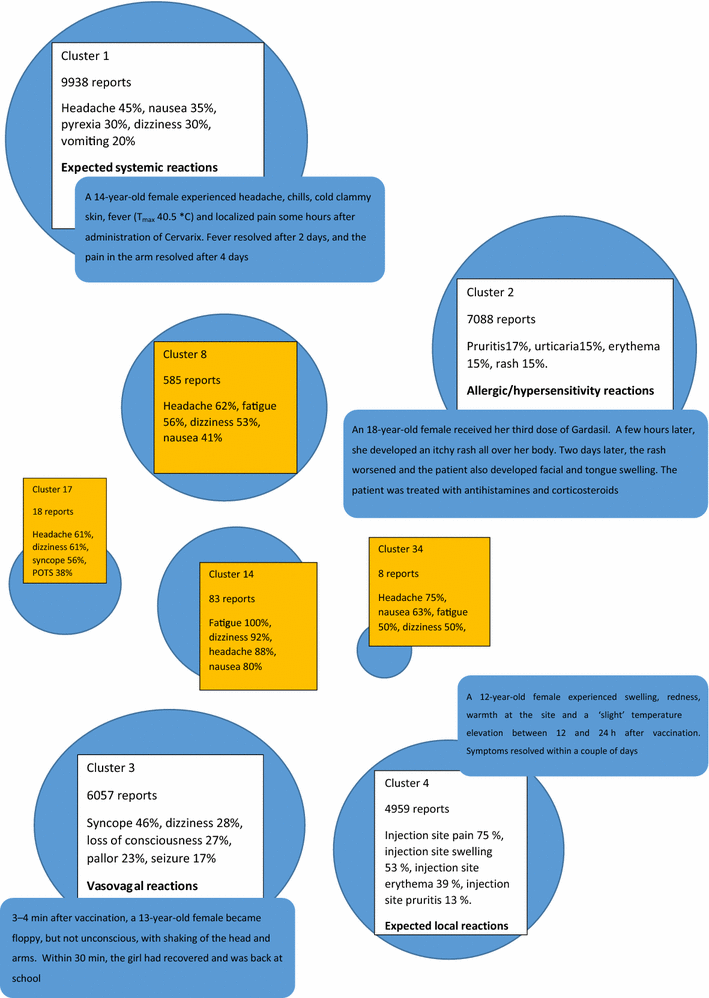
Se identificaron cuatro grupos más pequeños que incluían informes de casos relevantes para problemas de seguridad en curso. En los cuatro grupos, los términos de EA más comúnmente reportados fueron dolor de cabeza y mareos y fatiga o síncope; tres de estos cuatro términos de EA se informaron en> 50% de los informes incluidos en los grupos. Estos grupos tenían una mayor proporción de casos graves en comparación con los informes generales de VPH (44-89% en los grupos en comparación con 24%). El criterio más común para una designación ‘grave’ fue ‘hospitalización causada / prolongada’ (32%, 139/432 informes graves), ‘incapacitante / incapacitante’ (27%, 111/432), o una combinación de estos dos (14 %, 62/432).Tres de estos grupos contenían proporciones significativas del número total de informes generales de VPH contenidos dentro de Vigibase que informa los términos de EA de POTS (58%, 61/106), CRPS (20%, 15/76) y CFS (37%, 32 / 87); sin embargo, los informes de casos que incluyen uno de estos diagnósticos representaron solo una pequeña proporción del total de casos incluidos en los grupos (15% de 694 informes) (Tabla 1 )].tabla 1
Grupos identificados como clínicamente relevantes para la evaluación de la preocupación de seguridad, que se ha identificado de diversas maneras como CRPS, POTS y CFS
| Grupo 8 | Grupo 14 | Grupo 17 | Grupo 34 | |
|---|---|---|---|---|
| Número total de informes en el clúster. | 585 | 83 | 18 años | 8 |
| Principales eventos adversos informados [MedDRA] (%) | Dolor de cabeza (62)Fatiga (56)Mareos (53)Náuseas (41)Artralgia (31) | Fatiga (100)Mareos (92)Dolor de cabeza (88)Náuseas (80)Artralgia (71) | Dolor de cabeza (61)Mareos (61)Síncope (56)Ollas (39)EEG normal (33) | Dolor de cabeza (75)Náuseas (63)Fatiga (50)Mareos (50)Artralgia (38) |
| Otros eventos adversos de interés (%) | Síncope (22)Dolor abdominal superior (16)Debilidad muscular (15)Perturbación en la atención (14)Palpitaciones (13)Dolor (21) | Síncope (25)Dolor abdominal (37)Debilidad muscular (48)Perturbación en la atención (66)Palpitaciones (39)Dolor (46) | Fatiga (33)Dolor abdominal (11)Debilidad muscular (11)Pérdida de conciencia (28)Palpitaciones (22)Dolor (6) | Síncope (13)Dolor abdominal (13)Dolor abdominal superior (13)Debilidad muscular (13)Perturbación en la atención (38)Palpitaciones (38)Dolor (13) |
| Origen de los informes (%) | Estados Unidos (75)Dinamarca (9)Japón (6)Alemania (4)Reino Unido (3) | Estados Unidos (40)Dinamarca (39)Japón (5)Reino Unido (5)Alemania (5) | Estados Unidos (89)Alemania (6)España (6) | Estados Unidos (50)Dinamarca (25)Alemania (13)Japón (13) |
| Número medio de términos de MedDRA informados por informe de caso | 14,6 | 41,7 | 12,9 | 8.5 |
| Informes que contienen ciertos términos relacionados con el diagnóstico (%) | Macetas (6)CFS (4)PVFS (2)CRPS (2)FM (2) | Macetas (23)CFS (11)PVFS (7)CRPS (4)FM (5) | Ollas (39) | 0 0 |
| Porcentaje de informes ‘serios’ | 58% (343 informes) | 89% (74 informes) | 44% (8 informes) | 88% (7 informes) |
| Informes que contienen términos relacionados con las pruebas de diagnóstico (%) | CT (16)Resonancia magnética (22)ECG (14)EEG (7.9) | CT (11)Resonancia magnética (11)ECG (3.6)EEG (2.4) | CT (33)Resonancia magnética (39)ECG (44)EEG (50) | 0 0 |
| Porcentaje de informes que contienen el código MedDRA ‘Actividades de la vida diaria con discapacidad’ | 20% (117/585) | 19% (16/83) | 5.5% (1/18) | 1/8 (caso grave) |
| Porcentaje de informes que contienen el código MedDRA ‘Calidad de vida disminuida’ | 1,4% (8/585) | 4,8% (4/83) | 0 0 | 1/8 (caso no grave) |
| Porcentaje de informes serios con designación de ‘deshabilitar / incapacitar’ | 47% (162/343) | 57% (42/74) | 0 0 | 1/7 |
| Porcentaje de casos que se determinó que son clínicamente relevantes para los problemas de seguridad actuales | 75% (438/585) | 95% (79/83) | 72% (13/18) | 100% (8/8) |
Síndrome de dolor regional complejo CRPS , síndrome de taquicardia postural ortostática POTS , síndrome de fatiga crónica CFS , Diccionario Médico MedDRA para Actividades Regulatorias, CT cualquier término MedDRA que contenga ‘tomografía computarizada’, MRI cualquier término MedDRA que contenga ‘resonancia magnética nuclear’, ECG cualquier término MedDRA que contiene ‘electrocardiograma’, EEG , cualquier término de MedDRA que contenga ‘electroencefalograma’, síndrome de fatiga viral PVFS , fibromialgia FM
La revisión a nivel individual de los casos dentro de los grupos reveló una mayor coherencia clínica entre los grupos reflejada en los diversos patrones de EA menos frecuentes, incluidos los términos de los síntomas (como náuseas, debilidad muscular, trastornos en la atención) y los términos del procedimiento de diagnóstico (como el electrocardiograma , cabeza de imagen por resonancia magnética), así como el impacto en la vida del reportero, según lo identificado por la gravedad, los EA informados (como actividades de la vida cotidiana deteriorada, calidad de vida disminuida, postrado en cama, usuario de silla de ruedas) e información narrativa del caso. Los ejemplos de casos que demuestran un impacto en la vida del reportero de cada uno de los grupos incluyen: “Yo [madre] estoy muy frustrada y ella también. Esto ha afectado a toda nuestra familia. Me siento impotente y no sé cómo ayudarla ”(grupo 8, caso codificado como ‘no serio’); “Era inteligente en la escuela y en casa, le gustaba ir a nadar, andar en bicicleta, bailar, etc. Después de las vacunas con Gardasil, dejó de ser activa, la vida cambió a lo peor «(grupo 14, caso codificado como» incapacitante / incapacitante «grave, que incluía tanto los términos de MedDRA como» disminución de la calidad de vida «y» actividades de la vida diaria deteriorada «) ; “Perdí mucha escuela debido a que NO tenía energía y me sentía mal. A veces duerme de 12 a 20 horas al día. Muy saludable antes del disparo. Está cansada de estar enferma ”(grupo 17, caso codificado como ‘no grave’); «Es demasiado tarde para mi hijo, cuya vida ha sido irrevocablemente alterada / su vida nunca ha sido la misma» (grupo 34, caso codificado como ‘no grave’, incluido el término MedDRA ‘calidad de vida disminuida’). Después de las vacunas con Gardasil, dejó de ser activa, la vida cambió a lo peor «(grupo 14, caso codificado como» incapacitante / incapacitante «grave, que incluía tanto los términos de MedDRA como» disminución de la calidad de vida «y» actividades de la vida diaria deteriorada «) ; “Perdí mucha escuela debido a que NO tenía energía y me sentía mal. A veces duerme de 12 a 20 horas al día. Muy saludable antes del disparo. Está cansada de estar enferma ”(grupo 17, caso codificado como ‘no grave’); «Es demasiado tarde para mi hijo, cuya vida ha sido irrevocablemente alterada / su vida nunca ha sido la misma» (grupo 34, caso codificado como ‘no grave’, incluido el término MedDRA ‘calidad de vida disminuida’). Después de las vacunas con Gardasil, dejó de ser activa, la vida cambió a lo peor «(grupo 14, caso codificado como» incapacitante / incapacitante «grave, que incluía tanto los términos de MedDRA como» disminución de la calidad de vida «y» actividades de la vida diaria deteriorada «) ; “Perdí mucha escuela debido a que NO tenía energía y me sentía mal. A veces duerme de 12 a 20 horas al día. Muy saludable antes del disparo. Está cansada de estar enferma ”(grupo 17, caso codificado como ‘no grave’); «Es demasiado tarde para mi hijo, cuya vida ha sido irrevocablemente alterada / su vida nunca ha sido la misma» (grupo 34, caso codificado como ‘no grave’, incluido el término MedDRA ‘calidad de vida disminuida’). incluyó tanto los términos de MedDRA ‘calidad de vida disminuida’ como ‘actividades de la vida diaria deteriorada’); “Perdí mucha escuela debido a que NO tenía energía y me sentía mal. A veces duerme de 12 a 20 horas al día. Muy saludable antes del disparo. Está cansada de estar enferma ”(grupo 17, caso codificado como ‘no grave’); «Es demasiado tarde para mi hijo, cuya vida ha sido irrevocablemente alterada / su vida nunca ha sido la misma» (grupo 34, caso codificado como ‘no grave’, incluido el término MedDRA ‘calidad de vida disminuida’). incluyó tanto los términos de MedDRA ‘calidad de vida disminuida’ como ‘actividades de la vida diaria deteriorada’); “Perdí mucha escuela debido a que NO tenía energía y me sentía mal. A veces duerme de 12 a 20 horas al día. Muy saludable antes del disparo. Está cansada de estar enferma ”(grupo 17, caso codificado como ‘no grave’); «Es demasiado tarde para mi hijo, cuya vida ha sido irrevocablemente alterada / su vida nunca ha sido la misma» (grupo 34, caso codificado como ‘no grave’, incluido el término MedDRA ‘calidad de vida disminuida’).
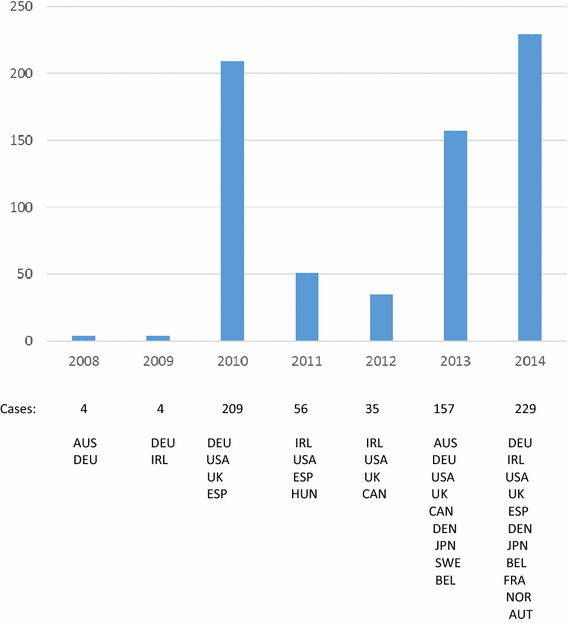
Con base en estas revisiones clínicas a nivel individual, la mayoría del total de 694 casos (77.5%) incluidos en estos cuatro grupos se consideraron relevantes para las preocupaciones de seguridad en curso.Un cronograma de los años de recepción de los casos contenidos dentro de los grupos en VigiBase revela que los casos se han recibido a lo largo de la vida posterior a la comercialización de las vacunas contra el VPH. Los países informantes representados en estos grupos son los siguientes: Estados Unidos con 491 casos, Dinamarca con 88 casos, Japón con 39 casos, Alemania con 28 casos, Reino Unido con 23 casos, Irlanda con 6 casos, España con 5 casos, Francia con 3 casos, Canadá y Australia y Bélgica y Noruega con 2 casos, y Austria, Suecia y Hungría con 1 caso cada uno. Los países con introducción más temprana de la vacuna contra el VPH en el uso de rutina informaron los primeros casos (Australia, Alemania, Estados Unidos y el Reino Unido) con una contribución cada vez mayor de aquellos países con una introducción posterior (Irlanda, Japón, Dinamarca) (Fig. 2 ) .
Los PRR se calcularon utilizando 45.780 informes de vacuna contra el VPH y 32.839 informes de vacuna no contra el VPH de mujeres entre las edades de 9 y 25 años. Hubo 596 (1.3%) informes de vacuna contra el VPH que contenían la combinación de AE de interés (dolor de cabeza y mareos con síncope o fatiga) en comparación con 175 informes (0.53%) para otras vacunas. El PRR fue 2,44 (intervalo de confianza [IC] del 95%: 2,07 a 2,89). El análisis estratificado por edad reveló que la PRR para esta combinación de AA permaneció estadísticamente significativamente mayor para las vacunas contra el VPH en comparación con otras vacunas en todos los grupos de edad, con el valor más pequeño siendo 2.09 (IC 95% 1.55-2.81). Además, el PRR para esta combinación de términos se mantuvo significativo cuando se excluyeron los informes de Japón y Dinamarca (2,28; IC del 95%: 1,92 a 2,70) [tabla electrónica complementaria 2].
Al restringir los análisis solo a aquellos informes con información disponible sobre ‘gravedad’, la tasa de informes de informes graves con esta combinación de AE para las vacunas contra el VPH fue del 53,3% y del 43,9% para otras vacunas. Por lo tanto, se calcula que el PRR es 1.21 (1.00–1.47). Tanto en los análisis estratificados por edad como en el análisis que excluye los informes de Japón y Dinamarca, el PRR para los informes serios con esta combinación de AA fueron todos> 1, sin embargo, estos resultados ya no fueron estadísticamente significativos (tabla complementaria electrónica 3).
4 Discusión
Nuestro análisis de informes globales de EA sospechosos después de la vacunación contra el VPH ha revelado una gran cantidad de informes con un patrón de EA, que incluyen dolor de cabeza, mareos, fatiga y síncope, que se distinguen de los EA más comunes por su naturaleza grave (que causan / prolongan la hospitalización y / o incapacitante / incapacitante), lo que resulta en un impacto en la calidad de vida del paciente. En este grupo se incluyen informes que han sido etiquetados como POTS, CFS y CRPS, pero la mayoría de los informes carecen de diagnósticos explícitos. Además, nuestros análisis sugieren que la combinación de dolor de cabeza y mareos con fatiga o síncope se informa significativamente más a menudo en los informes de la vacuna contra el VPH en comparación con los informes de la vacuna contra el VPH para las mujeres de 9 a 25 años;
Dadas las preocupaciones con respecto a la influencia en los informes secundarios a los medios, restringimos nuestros análisis a los informes que se habían recopilado hasta el 1 de enero de 2015 para reducir cualquier influencia en los informes secundarios a la acción reguladora ampliamente publicitada de la EMA tomada en julio de 2015 y el ampliamente visto programa de televisión ‘De vacunarede piger’, que se emitió por primera vez en Dinamarca en marzo de 2015 y posteriormente se colocó en YouTube con subtítulos en inglés. Además, hemos demostrado que los casos dentro de los grupos se han distribuido a lo largo de toda la vida posterior a la comercialización de las vacunas contra el VPH, con los primeros casos informados de aquellos países que fueron los primeros en recomendar y / o implementar la vacuna contra el VPH en el uso de rutina. Además, en nuestros análisis de PRR, Hemos encontrado un mayor informe de esta combinación de eventos de EA en las vacunas contra el VPH en comparación con otras vacunas, incluso cuando se excluyen los informes de Japón y Dinamarca. Finalmente, la proporción de casos graves entre los informes con la combinación de AE fue al menos tan alta (pero no significativamente mayor) para las vacunas contra el VPH como para las vacunas sin VPH, lo que podría no haber sido así si la atención en los medios hubiera llevado a un aumento informes, principalmente de eventos menos severos.
La mayor limitación de este estudio es la falta de información sobre muchos de los informes en VigiBase. La falta de datos significa que puede ser difícil hacer un juicio clínico sobre la relevancia de los casos y, por lo tanto, existe la posibilidad de una falta de coherencia entre los diferentes evaluadores. En consecuencia, puede haber un número menor o mayor de casos relevantes dentro de los grupos que contribuirían a la señal final. Dada la alta proporción de casos considerados relevantes de nuestra revisión (77.5%), es poco probable que alguna variación en el juicio clínico entre los evaluadores cambie la conclusión general de nuestro análisis.
Los casos dentro de los grupos son notablemente similares a los descritos en una serie de señales de seguridad para las vacunas contra el VPH. En los Países Bajos, el Centro de Farmacovigilancia Lareb ha publicado el documento «Eventos adversos de larga duración después de la inmunización con Cervarix ® » [ 8] Dado un gran número de informes de EA de larga duración (> 2 meses) después de la vacunación, se realizó una encuesta para mejorar el nivel de documentación clínica de estos informes. En general, 230 informes se consideraron relevantes. Se encontraron varias combinaciones de eventos adversos frecuentes, siendo la más común la fatiga, el dolor de cabeza y las molestias musculoesqueléticas. Además, la encuesta de seguimiento reveló que estos síntomas duraderos e inexplicables han tenido un impacto considerable tanto en la vida de las niñas como en la de sus familiares. En Japón, Kinoshita et al. informaron una cohorte de 40 sujetos en quienes describieron dolores de cabeza, fatiga general, frialdad en las piernas, dolor en las extremidades y debilidad. Dieciocho niñas cumplieron los criterios para un diagnóstico de SDRC y, utilizando la prueba de Schellong, cuatro fueron identificadas como POTS.6 ] En Dinamarca, Brinth et al. informaron una cohorte de 35 sujetos en quienes describieron náuseas, dolor de cabeza crónico, fatiga, palpitaciones, función cognitiva reducida, cambios en la piel, temblor intermitente / espasmos mioclónicos, dolor neuropático, trastornos del sueño y debilidad muscular. Todos los sujetos fueron diagnosticados con intolerancia ortostática [7 ]. En los Estados Unidos, Blitshteyn informó una serie de casos cuyos síntomas incluyeron mareos, fatiga, náuseas, pérdida de peso e intolerancia al ejercicio [17 ], mientras que en México, Martínez-Lavín describió a dos pacientes con síntomas de tipo fibromialgia, que incluyen dolor intenso, insomnio, profundo fatiga y parestesia [18] Una señal de trastornos de la motilidad gastrointestinal de la UMC describió una serie de casos de 26 sujetos, en los cuales 15 informaron fatiga concomitante, 13 informaron dolor de cabeza o migraña, y 9 informaron mareos [ 19 ]. La publicación más reciente es un informe de Italia que describe una serie de casos de 18 niñas (de 12 a 24 años) que fueron derivadas a una ‘Red Médica de Segunda Opinión’ para la evaluación de ‘neuropatía con disfunción autónoma’ después de la vacunación contra el VPH; todas las niñas se quejaron de síntomas somatomorfos de larga duración e invalidantes (que incluyen astenia, dolor de cabeza, disfunciones cognitivas, mialgia, taquicardia sinusal y erupciones cutáneas) [ 20] Se reconoce que estas publicaciones representan series de casos y, por lo tanto, tienen las limitaciones que tradicionalmente se asocian con este tipo de informes. Sin embargo, la recopilación de una serie de series de casos que muestran patrones similares de AA de ubicaciones distribuidas geográficamente potencialmente aumenta la fuerza general de la señal.
El procedimiento de referencia de EMA se centró en los dos síndromes específicos de POTS y CRPS; Las revisiones de la base de datos de seguridad y los análisis observados versus esperados realizados en informes espontáneos por los TAC consideraron cada uno de estos dos síndromes por separado. Además, aunque se solicitó que el TAC use ‘estrategias de búsqueda comunes’ para identificar informes de casos potencialmente no diagnosticados con combinaciones de signos y síntomas comunes en CRPS o POTS, los detalles de estas estrategias de búsqueda no se han proporcionado en el informe de evaluación disponible públicamente. Sin embargo, el número total de casos adicionales identificados por estas consultas, incluso antes de su evaluación de acuerdo con los criterios de diagnóstico de CRPS y POTS, fueron menores que los casos identificados por el informe explícito de los términos POTS y CRPS [ 9] En contraste, nuestro análisis identificó un mayor número de casos potencialmente no diagnosticados que el número total de casos que habían sido etiquetados con uno de estos diagnósticos.
Ha habido una serie de investigaciones epidemiológicas con respecto a las preocupaciones de seguridad de la vacuna contra el VPH que se han basado principalmente en la notificación de un diagnóstico específico o un concepto de síntoma único, ya sea como un código de facturación de diagnóstico o términos de EA únicos o sinónimos para definir la serie de casos relevante . Un estudio epidemiológico en los Países Bajos fue diseñado para investigar el potencial de un mayor riesgo de dolores de cabeza por migraña después de la vacuna contra el VPH [ 21 ]. Como parte de un plan de farmacovigilancia proactivo, la Autoridad Reguladora de Medicamentos y Salud (MHRA, por sus siglas en inglés) realizó un estudio epidemiológico utilizando una metodología de series de casos autocontroladas en la que identificaron casos que informan términos que contienen « fatiga crónica », como fatiga crónica, síndrome de fatiga crónica. , fatiga post-viral y fibromialgia [ 22] Aunque es loable que considerara una variedad de términos relacionados con la fatiga, el estudio no tuvo en cuenta los síntomas de una naturaleza más variada. Del mismo modo, si bien los resultados de los estudios de seguridad posteriores a la autorización más grandes han sido tranquilizadores en general, debe recordarse que tales estudios han utilizado patologías médicas predefinidas y bien definidas como puntos finales [ 23 , 24 , 25 , 26 ]. El uso de estudios epidemiológicos que requieren definiciones de casos específicos son útiles para cuantificar los riesgos de problemas de seguridad después de que una señal ha sido identificada y bien caracterizada a partir de los informes de EA.
Dada la falta de consenso sobre el diagnóstico específico que describen estos informes espontáneos, puede ser necesario centrarse en la sintomatología y la gravedad en combinación con una investigación de la patología subyacente para dilucidar completamente esta señal de seguridad. La evidencia de una fisiopatología común en niñas con esta sintomatología está, de hecho, emergiendo actualmente, con un enfoque en autoanticuerpos contra receptores acoplados a proteínas G en el sistema nervioso, como los receptores β2-adrenérgicos y muscarínicos-2 que se han aislado de uno sujeto en los Estados Unidos [ 27] y en una gran proporción de una muestra de pacientes en Dinamarca (Mehlsen J, comunicación personal). Estos resultados podrían explicar la variedad de etiquetas que se han utilizado para explicar esta sintomatología, ya que los autoanticuerpos contra estos receptores se han relacionado previamente con CRPS, POTS y CFS [ 28 , 29 , 30 , 31 ].
Una asociación causal con la vacuna contra el VPH sigue siendo incierta; sin embargo, creemos que se requiere una investigación más exhaustiva de esta señal para garantizar la confianza pública continua tanto en los programas de vacunación como en las autoridades reguladoras.
5 conclusiones
El análisis de conglomerados revela informes adicionales de EA después de la vacunación contra el VPH, que son de naturaleza grave y con superposición de signos y síntomas a las recientes señales de seguridad para POTS, CRPS y CFS, pero sin diagnósticos explícitos. Además, se sugiere la notificación desproporcionada de este patrón de sintomatología en los informes posteriores a la vacunación contra el VPH en comparación con otras vacunas en mujeres de 9 a 25 años de edad. Esta desproporcionalidad se mantuvo incluso cuando aquellos países que informaron las señales de CRPS (Japón) y POTS (Dinamarca) fueron excluidos.
Una asociación causal entre estos AA y la vacuna contra el VPH sigue siendo incierta; Sin embargo, dada la gravedad médica de este problema de seguridad, creemos que un estudio más definitivo de los hallazgos presentados aquí es esencial para garantizar la confianza continua en la vacuna contra el VPH.
Nuestro estudio ilustra cómo los análisis más extensos de informes espontáneos pueden identificar mejor las series de casos relevantes para una evaluación exhaustiva de la señal.
Referencias
- 1.HPV vaccines: EMA confirms evidence does not support that they cause CRPS or POTS. EMA/749763/2015. 2015. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/Referrals_document/HPV_vaccines_20/Opinion_provided_by_Committee_for_Medicinal_Products_for_Human_Use/WC500196773.pdf.
- 2.Tabrizi S, Brotherton J, Kaldor J, Skinner SR, Cummins E, Lui E, et al. Fall in human papillomavirus prevalence following a national vaccination program. J Infect Dis. 2012;206(11):1645–51.CrossRefPubMedGoogle Scholar
- 3.European Centre for Disease Prevention and Control. ECDC guidance. Introduction of HPV vaccines in European Union countries: an update. 2012. Available at: http://ecdc.europa.eu/en/publications/Publications/20120905_GUI_HPV_vaccine_update.pdf.
- 4.ACA Preventative Services Benefits for Women and Pregnant Women. Immunization for women. Retrieved 10 Dec 2015.Google Scholar
- 5.Human papillomavirus vaccines: WHO position paper, October 2014. Wkly Epidemiol Rec. 2014;89(43):465–491. http://www.ncbi.nlm.nih.gov/pubmed/25346960.
- 6.Kinoshita T, Abe R-T, Hineno A, Tsunekawa K, Nakane S, Ikeda S. Peripheral sympathetic nerve dysfunction in adolescent Japanese girls following immunization with the human papillomavirus vaccine. Intern Med. 2014;53:2185–200.CrossRefPubMedGoogle Scholar
- 7.Brinth LS, Pors K, Theibel AC, Mehlsen J. Orthostatic intolerance and postural tachycardia syndrome as suspected adverse effects of vaccination against human papilloma virus. Vaccine. 2015;33(22):2602–5.CrossRefPubMedGoogle Scholar
- 8.Lareb. Long-lasting adverse events following immunization with Cervarix®. 2015. Available at: http://databankws.lareb.nl/Downloads/Lareb_rapport_HPV_dec15_03.pdf.
- 9.European Medicines Agency assessment report. Review under Article 20 of Regulation (EC) No 726/200411. 2015. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/Referrals_document/HPV_vaccines_20/Opinion_provided_by_Committee_for_Medicinal_Products_for_Human_Use/WC500197129.pdf.
- 10.Statens Serum Institut. Available at: http://www.ssi.dk/Smitteberedskab/Sygdomsovervaagning/VaccinationSurveillance.aspx?vaccination=5&xaxis=Cohort&sex=0&landsdel=100&show=Graph&datatype=Vaccination&extendedfilters=True#HeaderText. Accessed 3 May 2016.
- 11.Sanevax. Open letter to EMA re: HPV vaccine safety. 2016. Available at: http://sanevax.org/open-letter-ema-hpv-vaccine-safety/.
- 12.Lindquist M. Vigibase, the WHO Global ICSR Database System: basic facts. Drug Inf J. 2008;42:409–19.Google Scholar
- 13.ICH Harmonised Tripartite Guideline. Maintenance of the ICH guideline on clinical safety data management: data elements for transmission of individual case safety reports E2B (R2). Available at: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E2B/Step4/E2B_R2__Guideline.pdf.
- 14.Vermunt JK, Magidson J. Latent class cluster analysis. In: Hagenaars J, McCutcheon A, editors. Applied latent class analysis. Cambridge: Cambridge University Press; 2002. p. 89–106.CrossRefGoogle Scholar
- 15.Dempster AP, Laird NM, Rubin DB. Maximum likelihood from incomplete data via the EM algorithm. J R Stat Soc Series B Stat Methodol. 1977;39(1):1–38.Google Scholar
- 16.Evans SJW, Waller PC, Davis S. Use of proportional reporting ratios (PRRs) for signal generation from spontaneous adverse drug reaction reports. Pharmacoepidemiol Drug Saf. 2001;10(6):483–6.CrossRefPubMedGoogle Scholar
- 17.Blitshteyn S. Postural tachycardia syndrome following human papilloma vaccination. Eur J Neurol. 2014;21(1):135–9.CrossRefPubMedGoogle Scholar
- 18.Martínez-Lavín M. Fibromyalgia-like illness in 2 girls after human papillomavirus vaccination. J Clin Rheumatol. 2014;20(7):392–3.PubMedGoogle Scholar
- 19.Chandler R, Hult S, Caduff-Janosa P. Human papilloma virus vaccines and gastrointestinal motility disorders. Drug Saf. 2015;38(10):976.Google Scholar
- 20.Palmieri B, Poddighe D, Vadalà M, Laurino C, Carnovale C, Clementi E. Severe somatoform and dysautonomic syndromes after HPV vaccination: case series and review of literature. Immunol Res. 2016. doi: 10.1007/s12026-016-8820-z.
- 21.Van’t Klooster, de Ridder MAJ, Kemmerem JM, van der Lei J, Dekker F, Sturkenboom M, et al. Examining a possible association between human papilloma virus (HPV) vaccination and migraine: results of a cohort study in the Netherlands. Eur J Pediatr. 2015;174:641–649.Google Scholar
- 22.Donegan K, Beau-Lejdstrom R, King B, Seabroke S, Thomson A, Bryan P. Bivalent human papillomavirus vaccine and the risk of fatigue syndromes in girls in the UK. Vaccine. 2013;31(43):4961–7.CrossRefPubMedGoogle Scholar
- 23.Arnheim-Dahlstrom L, Pasternak B, Svanstrom H, Sparen P, Hviid A. Autoimmune, neurological, and venous thromboembolic adverse events after immunisation of adolescent girls with quadrivalent human papillomavirus vaccine in Denmark and Sweden: cohort study. BMJ. 2013;347:f5906.CrossRefPubMedPubMedCentralGoogle Scholar
- 24.Klein NP, Hansen J, Chao C, Velicer C, Emery M, Slezak J, et al. Safety of quadrivalent human papillomavirus vaccine administered routinely to females. Arch Pediatr Adolesc Med. 2012;166(12):1140–8.CrossRefPubMedGoogle Scholar
- 25.Grönlund O, Herweijer E, Sundström K, Arnheim-Dahlström L. Incidence of new-onset autoimmune disease in girls and women with pre-existing autoimmune disease after quadrivalent human papillomavirus vaccination: a cohort study. J Intern Med. 2016. doi: 10.1111/joim.12535.
- 26.Willame C, Rosillon D, Zima J, Angelo MG, Stuurman AL, Vroling H, et al. Risk of new onset autoimmune disease in 9- to 25-year-old women exposed to human papillomavirus-16/18 AS04-adjuvanted vaccine in the United Kingdom. Hum Vaccin Immunother. 2016. doi: 10.1080/21645515.2016.1199308.
- 27.Hendrickson JE. Human papilloma virus vaccination and dysautonomnia: considerations for autoantibody testing and HLA typing [letter]. Vaccine. 2016;34(38):4468.CrossRefPubMedGoogle Scholar
- 28.Kohr D, Singh P, Tschernatsch M, Kaps M, Pouokam E, Diener M, et al. Autoimmunity against the β2 adrenergic receptor and muscarinic-2 receptor in complex regional pain syndrome. Pain. 2011;152(12):2690–700.CrossRefPubMedGoogle Scholar
- 29.Li H, Yu X, Liles C, Khan M, Vanderlinde-Wood M, Galloway A, et al. Autoimmune basis for postural tachycardia syndrome. J Am Heart Assoc. 2014;3(1):e000755.CrossRefPubMedPubMedCentralGoogle Scholar
- 30.Dubey D, Hopkins S, Vernino S. M1 and M2 muscarinic receptor antibodies among patients with Postural Orthostatic Tachycardia Syndrome: potential disease biomarker [abstract]. Available at: http://www.dysautonomiainternational.org/pdf/Vernino_Muscarinic_Abstract.pdf.
- 31.Loebel M, Grabowski P, Heidecke H, Bauer S, Hanitsch LG, Wittke K, et al. Antibodies to β adrenergic and muscarinic cholinergic receptors in patients with chronic fatigue syndrome. Brain Behav Immun. 2016;52:32–9.CrossRefPubMedGoogle Scholar