Regular Use of Ivermectin as Prophylaxis for COVID-19 Led Up to a 92% Reduction in COVID-19 Mortality Rate in a Dose-Response Manner: Results of a Prospective Observational Study of a Strictly Controlled Population of 88,012 Subjects doi:10.7759/cureus.28624 https://www.cureus.com/articles/111851-regular-use-of-ivermectin-as-prophylaxis-for-covid-19-led-up-to-a-92-reduction-in-covid-19-mortality-rate-in-a-dose-response-manner-results-of-a-prospective-observational-study-of-a-strictly-controlled-population-of-88012-subjects

La ivermectina se ha propuesto como posible profilaxis y terapia para la enfermedad por coronavirus 2019 (COVID-19) debido a sus acciones antivirales [1-4] , metabólicas [5-10] y antiinflamatorias [11-19] previamente informadas con gran plausibilidad [20,21] y resultados positivos in vitro, in vivo y epidemiológicos [22-24] en estudios preliminares.
Entre julio y diciembre de 2020, un programa para toda la ciudad de Itajaí, en el estado de Santa Catarina, en el sur de Brasil, ofreció un programa voluntario y prescrito por un médico de ivermectina como profilaxis para la COVID-19. Esto se basó en el perfil de seguridad extenso y bien establecido y la ausencia conocida de riesgos con el uso prolongado de ivermectina, y la falta de opciones alternativas terapéuticas y preventivas en 2020.
Los datos recopilados sistemáticamente dentro de este programa demostraron que la ivermectina utilizada como profilaxis para la COVID-19 mejoró los resultados relacionados con la COVID-19. El uso de ivermectina condujo a una reducción del 44% en la tasa de infección, una reducción del 56% en la tasa de hospitalización y una reducción del 68% en la tasa de mortalidad mediante el uso del emparejamiento por puntuación de propensión (PSM) para equilibrar los grupos de estudio [25] .
Estas conclusiones se basaron en una evaluación análoga del análisis por intención de tratar (ITT) de ensayos clínicos aleatorios (ECA). Todos los participantes del programa fueron incluidos para el análisis, independientemente de la regularidad o la cantidad total de ivermectina tomada. Entre los participantes del uso de ivermectina (regular e irregular) como profilaxis para el programa COVID-19, se desconocía si el uso regular de ivermectina conduciría a una reducción más sustancial en la tasa de infección por COVID-19 y los resultados relacionados que el uso irregular.
En este estudio, se realizó una evaluación con participantes que usaron ivermectina de forma profiláctica para COVID-19, para determinar si el uso regular en comparación con el uso irregular impactó el grado de reducción de las tasas de infección, hospitalización y mortalidad por COVID-19. Los usuarios habituales e irregulares de ivermectina también se compararon con los no usuarios para evaluar la evidencia de un patrón de eficacia dosis-respuesta.
La ivermectina utilizada como profilaxis para la enfermedad por coronavirus 2019 (COVID-19), independientemente de la regularidad, en un programa estrictamente controlado en toda la ciudad del sur de Brasil (Itajaí, Brasil), se asoció con reducciones en la infección por COVID-19 y en las hospitalizaciones. y tasas de mortalidad. En este estudio, nuestro objetivo fue determinar si el uso regular de ivermectina impactaba el nivel de protección contra COVID-19 y los resultados relacionados, reforzando la eficacia de la ivermectina mediante la demostración de un efecto dosis-respuesta.
Métodos
Este análisis exploratorio de un estudio observacional prospectivo involucró un programa que utilizó ivermectina en una dosis de 0,2 mg/kg/día durante dos días consecutivos, cada 15 días, durante 150 días. Las definiciones de regularidad fueron las siguientes: los usuarios habituales tenían 180 mg o más de ivermectina y los usuarios irregulares tenían hasta 60 mg, en total, durante todo el programa.
Se realizaron comparaciones entre no usuarios (sujetos que no usaban ivermectina) y usuarios habituales e irregulares después de ajustes multivariados. Se utilizó la base de datos completa de la ciudad para calcular y comparar la infección por COVID-19 y el riesgo de morir por COVID-19. Se utilizó la base de datos COVID-19 y se empleó el emparejamiento por puntuación de propensión (propensity score matching, PSM) para las tasas de hospitalización y mortalidad.
Resultados
Entre 223.128 sujetos de la ciudad de Itajaí, 159.560 tenían 18 años o más y no estaban infectados por COVID-19 hasta el 7 de julio de 2020, de los cuales 45.716 (28,7%) no utilizaban y 113.844 (71,3%) utilizaban ivermectina.
Entre los usuarios de ivermectina, 33.971 (29,8%) consumían de forma irregular (hasta 60 mg) y 8.325 (7,3%) consumían de forma regular (más de 180 mg). Los 71.548 participantes restantes no fueron incluidos en el análisis.
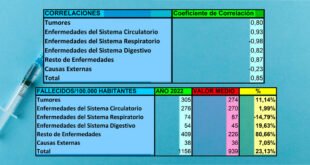
La tasa de infección por COVID-19 fue un 49 % menor para los usuarios habituales (3,40 %) que para los no usuarios (6,64 %) (tasa de riesgo (RR): 0,51; IC del 95 %: 0,45-0,58; p < 0,0001), y un 25 % menor que los usuarios irregulares (4,54%) (RR: 0,75; IC 95%: 0,66-0,85; p < 0,0001).
La tasa de infección fue un 32% menor para los usuarios irregulares que para los no usuarios (RR: 0,68; IC del 95%: 0,64-0,73; p < 0,0001). Entre los participantes de COVID-19, los consumidores habituales eran mayores y tenían una mayor prevalencia de diabetes tipo 2 e hipertensión que los consumidores irregulares y los no consumidores.
Después de la puntuación de propensión PSM, el análisis emparejado contenía 283 sujetos en cada grupo de no usuarios y usuarios habituales, entre usuarios habituales y usuarios irregulares, y 1.542 sujetos entre no usuarios y usuarios irregulares.
La tasa de hospitalización se redujo en un 100% en los usuarios habituales en comparación tanto con los usuarios irregulares como en los no usuarios (p < 0,0001), y en un 29% entre los usuarios irregulares en comparación con los no usuarios (RR: 0,781; IC 95%: 0,49-1,05 ; p = 0,099).
La tasa de mortalidad fue un 92% menor en los consumidores habituales que en los no consumidores (RR: 0,08; IC 95%: 0,02-0,35; p = 0,0008) y un 84% menor que en los usuarios irregulares (RR: 0,16; IC 95%: 0,04-0,71; p = 0,016), mientras que los usuarios irregulares tuvieron una reducción de la tasa de mortalidad un 37% menor que los no usuarios (RR: 0,67; IC 95%: 0,40-0,99; p = 0,049).
El riesgo de morir por COVID-19 fue un 86% menor entre los usuarios habituales que los no usuarios (RR: 0,14; IC 95%: 0,03-0,57; p = 0,006), y un 72% menor que los usuarios irregulares (RR: 0,28; 95% IC: 0,07-1,18; p = 0,083), mientras que los usuarios irregulares tuvieron una reducción del 51% respecto a los no usuarios (RR: 0,49; IC 95%: 0,32-0,76; p = 0,001).
Conclusión
La no utilización de ivermectina se asoció con un aumento de 12,5 veces en la tasa de mortalidad y un riesgo siete veces mayor de morir por COVID-19 en comparación con el uso regular de ivermectina. Esta eficacia dosis-respuesta refuerza los efectos profilácticos de la ivermectina contra la COVID-19.
Ver más: https://cienciaysaludnatural.com/category/ivermectina/
Colabore por favor con nosotros para que podamos incluir mas información y llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
Via PAYPAL: Euros o dólares click aqui
ARGENTINA 10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Solicite nuestro CBU contactenos
Referencias
- Mastrangelo E, Pezzullo M, De Burghgraeve T, et al.: Ivermectin is a potent inhibitor of flavivirus replication specifically targeting NS3 helicase activity: new prospects for an old drug. J Antimicrob Chemother. 2012, 67:1884-94. 10.1093/jac/dks147
- Wagstaff KM, Sivakumaran H, Heaton SM, Harrich D, Jans DA: Ivermectin is a specific inhibitor of importin α/β-mediated nuclear import able to inhibit replication of HIV-1 and dengue virus. Biochem J. 2012, 443:851-6. 10.1042/BJ20120150
- Crump A: Ivermectin: enigmatic multifaceted ‘wonder’ drug continues to surprise and exceed expectations. J Antibiot (Tokyo). 2017, 70:495-505. 10.1038/ja.2017.11
- Heidary F, Gharebaghi R: Ivermectin: a systematic review from antiviral effects to COVID-19 complementary regimen. J Antibiot (Tokyo). 2020, 73:593-602. 10.1038/s41429-020-0336-z
- Li N, Zhao L, Zhan X: Quantitative proteomics reveals a broad-spectrum antiviral property of ivermectin, benefiting for COVID-19 treatment. J Cell Physiol. 2021, 236:2959-75. 10.1002/jcp.30055
- Jin L, Feng X, Rong H, et al.: The antiparasitic drug ivermectin is a novel FXR ligand that regulates metabolism. Nat Commun. 2013, 4:1937. 10.1038/ncomms2924
- Yang JS, Qi W, Farias-Pereira R, Choi S, Clark JM, Kim D, Park Y: Permethrin and ivermectin modulate lipid metabolism in steatosis-induced HepG2 hepatocyte. Food Chem Toxicol. 2019, 125:595-604. 10.1016/j.fct.2019.02.005
- Cairns DM, Giordano JE, Conte S, Levin M, Kaplan DL: Ivermectin promotes peripheral nerve regeneration during wound healing. ACS Omega. 2018, 3:12392-402. 10.1021/acsomega.8b01451
- Zheng YY, Ma YT, Zhang JY, Xie X: COVID-19 and the cardiovascular system. Nat Rev Cardiol. 2020, 17:259-60. 10.1038/s41569-020-0360-5
- Nagai H, Satomi T, Abiru A, et al.: Antihypertrophic effects of small molecules that maintain mitochondrial ATP levels under hypoxia. EBioMedicine. 2017, 24:147-58. 10.1016/j.ebiom.2017.09.022
- Park A, Iwasaki A: Type I and type III interferons – induction, signaling, evasion, and application to combat COVID-19. Cell Host Microbe. 2020, 27:870-8. 10.1016/j.chom.2020.05.008
- Zhang X, Song Y, Ci X, et al.: Ivermectin inhibits LPS-induced production of inflammatory cytokines and improves LPS-induced survival in mice. Inflamm Res. 2008, 57:524-9. 10.1007/s00011-008-8007-8
- Zaidi AK, Dehgani-Mobaraki P: The mechanisms of action of ivermectin against SARS-CoV-2-an extensive review. J Antibiot (Tokyo). 2022, 75:60-71. 10.1038/s41429-021-00491-6
- Matsuyama T, Kubli SP, Yoshinaga SK, Pfeffer K, Mak TW: An aberrant STAT pathway is central to COVID-19. Cell Death Differ. 2020, 27:3209-25. 10.1038/s41418-020-00633-7
- Dou Q, Chen HN, Wang K, et al.: Ivermectin induces cytostatic autophagy by blocking the PAK1/Akt axis in breast cancer. Cancer Res. 2016, 76:4457-69. 10.1158/0008-5472.CAN-15-2887
- Layhadi JA, Turner J, Crossman D, Fountain SJ: ATP evokes Ca2+ responses and CXCL5 secretion via P2X4 receptor activation in human monocyte-derived macrophages. J Immunol. 2018, 200:1159-68. 10.4049/jimmunol.1700965
- Juarez M, Schcolnik-Cabrera A, Dueñas-Gonzalez A: The multitargeted drug ivermectin: from an antiparasitic agent to a repositioned cancer drug. Am J Cancer Res. 2018, 8:317-31.
- Andersson U, Ottestad W, Tracey KJ: Extracellular HMGB1: a therapeutic target in severe pulmonary inflammation including COVID-19?. Mol Med. 2020, 26:42. 10.1186/s10020-020-00172-4
- Yan S, Ci X, Chen N, et al.: Anti-inflammatory effects of ivermectin in mouse model of allergic asthma. Inflamm Res. 2011, 60:589-96. 10.1007/s00011-011-0307-8
- Kaur H, Shekhar N, Sharma S, Sarma P, Prakash A, Medhi B: Ivermectin as a potential drug for treatment of COVID-19: an in-sync review with clinical and computational attributes. Pharmacol Rep. 2021, 73:736-49. 10.1007/s43440-020-00195-y
- Zaidi AK, Dehgani-Mobaraki P: The mechanisms of action of ivermectin against SARS-CoV-2: an evidence-based clinical review article. J Antibiot (Tokyo). 2022, 75:122. 10.1038/s41429-021-00430-5
- Kalfas S, Visvanathan K, Chan K Drago J: The therapeutic potential of ivermectin for COVID-19: a systematic review of mechanisms and evidence. [PREPRINT]. medRxiv. 2020, 10.1101/2020.11.30.20236570
- Behera P, Patro BK, Singh AK, et al.: Role of ivermectin in the prevention of SARS-CoV-2 infection among healthcare workers in India: a matched case-control study. PLoS One. 2021, 16:e0247163. 10.1371/journal.pone.0247163
- Hellwig MD, Maia A: A COVID-19 prophylaxis? Lower incidence associated with prophylactic administration of ivermectin. Int J Antimicrob Agents. 2021, 57:106248. 10.1016/j.ijantimicag.2020.106248
- Kerr L, Cadegiani FA, Baldi F, et al.: Ivermectin prophylaxis used for COVID-19: a citywide, prospective, observational study of 223,128 subjects using propensity score matching. Cureus. 2022, 14:e21272. 10.7759/cureus.21272
- Coronavirus epidemiological data – State of Santa Catarina. (2022). Accessed: July 8, 2022: https://itajai.sc.gov.br/noticias/59/boletins-coronavirus.
- Boing AF, Lunardon C: Trend in the mortality and incidence from AIDS in Itajaí (Santa Catarina) between 1990 and 2005. (Article in Portuguese). Arch Catarin Med. 2009, 38:59-65.
- HIV/AIDS and port workers: a resource pack for unions. (2013). Accessed: January 22, 2021: https://www.itfglobal.org/sites/default/files/resources-files/HIV_AIDS_portworkers.pdf.
- Zhang J: Hospital avoidance and unintended deaths during the COVID-19 pandemic. Am J Health Econ. 2021, 7:405-26. 10.1086/715158
- Eichler HG, Pignatti F, Schwarzer-Daum B, et al.: Randomized controlled trials versus real world evidence: neither magic nor myth. Clin Pharmacol Ther. 2021, 109:1212-8. 10.1002/cpt.2083
- Wang SV, Schneeweiss S, Gagne JJ, Evers T, Gerlinger C, Desai R, Najafzadeh M: Using real-world data to extrapolate evidence from randomized controlled trials. Clin Pharmacol Ther. 2019, 105:1156-63. 10.1002/cpt.1210
- Franklin JM, Schneeweiss S: When and how can real world data analyses substitute for randomized controlled trials?. Clin Pharmacol Ther. 2017, 102:924-33. 10.1002/cpt.857