Por Roxana Bruno, Bioquímica. PhD en Inmunología.
Asombrosa similitud entre las sincitinas humanas y la proteina espiga del sars-cov-2. Porqué las inyecciones contra covid-19 podrían afectar la fertilidad.
English Version 
Resumen
Las inyecciones contra COVID-19 introducen la proteína de la espiga (S o “Spike”) del virus SARS-CoV-2 como supuesto antígeno para desencadenar la respuesta inmunitaria, la cual comparte alta similitud genética y proteica con dos proteínas humanas, Sincitina-1 y Sincitina-2.
Roxana Bruno Ph.D en Inmunología, Bioquímica, Efectos graves de la inyección K0 B1T en los órganos reproductores
https://www.bitchute.com/video/yvTjAtob4EzL/
Las sincitinas humanas
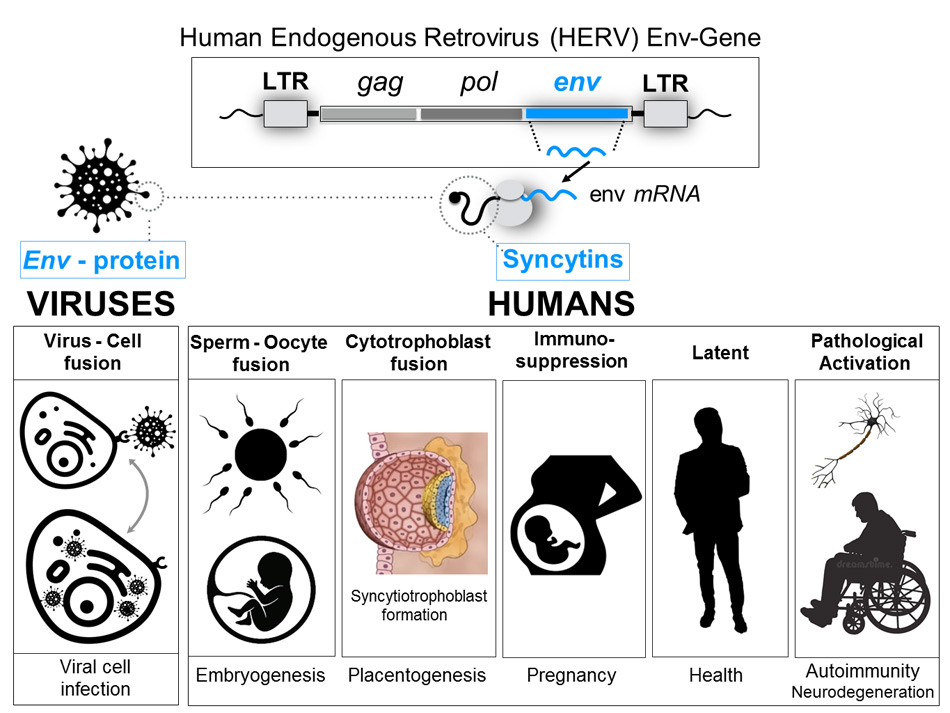
Las sincitinas humanas son el producto de expresión de los genes de la envoltura (Env) de retrovirus endógenos humanos (HERV): son proteínas que median la fusión entre las células y tienen propiedades inmunosupresoras.
Las sincitinas se expresan de manera fisiológica durante el embarazo: intervienen en el desarrollo de la placenta, la diferenciación del trofoblasto, el implante del embrión en el útero materno y la inmunosupresión del sistema inmunitario de la madre para impedir el rechazo alogénico del embrión.
Por el parecido entre las sincitinas y la proteína espiga del SARS-CoV-2, los anticuerpos inducidos con cualquiera de las inyecciones contra COVID-19 podrían desencadenar una reacción cruzada contra las sincitinas, provocando efectos secundarios alérgicos, citotóxicos y/o autoinmunes que afecten la salud y la reproducción humana.
Las inyecciones de ARNm tienen la capacidad potencial de modificar el ADN humano
Las inyecciones de ARNm tienen la capacidad potencial de modificar el ADN humano por el mecanismo de silenciamiento de genes mediado por los ARN de interferencia. Mediante el uso de oligonucleótidos antisentido inhibidores, se pudo silenciar el gen sincitina. Cuando el ARNm del gen o la cantidad de proteína sincitina disminuyen, se producen defectos graves en la placenta, mala diferenciación del trofoblasto humano y disfunción vascular placentaria, lo que conduce a la pérdida de la gestación.
Ética de los Fabricantes de estas inyecciones
Las empresas que desarrollan las inyecciones contra COVID-19 no están actuando de manera ética ni responsable, porque no realizan los estudios de seguridad en los modelos animales adecuados, no están respetando los tiempos necesarios para detectar efectos adversos a mediano y largo plazo y además, no van a proporcionar la información acerca de la verdadera composición, la que consideran “confidencial”.
Los voluntarios no están siendo debidamente informados de todos los riesgos que conlleva la vacunación. Al adelantar y acortar las fases experimentales las empresas están trasladando el riesgo de los animales a los seres humanos, usando a las personas como modelos de desafío animal.
Las consecuencias de inocular genes extraños con las inyecciones contra COVID-19 pueden resultar catastróficas para el destino de la humanidad, si se tiene en cuenta papel de las proteínas de envoltura HERV (sincitinas) en la fisiología humana y sus posibles efectos patogénicos en varios tipos de cánceres y de trastornos autoinmunes.
La asombrosa similitud entre proteínas retrovirales humanas endógenas y la proteína Espiga del SARS-COV-2.
Diversas voces cualificadas de investigadores científicos y médicos, están advirtiendo a la comunidad internacional del peligro que entrañan las inyecciones contra COVID-19 y están solicitando a las autoridades que se detengan de inmediato los ensayos clínicos de fase III de las inyecciones que contienen ARNm de la proteína de la espiga (S o “Spike”) del virus SARS-CoV-2 1, 2 .
Una de las razones de este pedido urgente se basa en que la proteína S, contra la cual los fabricantes de inyecciones compiten para desarrollar en una vacuna, guarda una gran similitud genética y proteica (es decir, es altamente homóloga en la secuencia de los nucléotidos y de los aminoácidos) con dos proteínas humanas codificadas por genes localizados en los cromosomas 7 y 6, las llamadas Sincitina-1 y Sincitina- 2, respectivamente. (Figura 1)
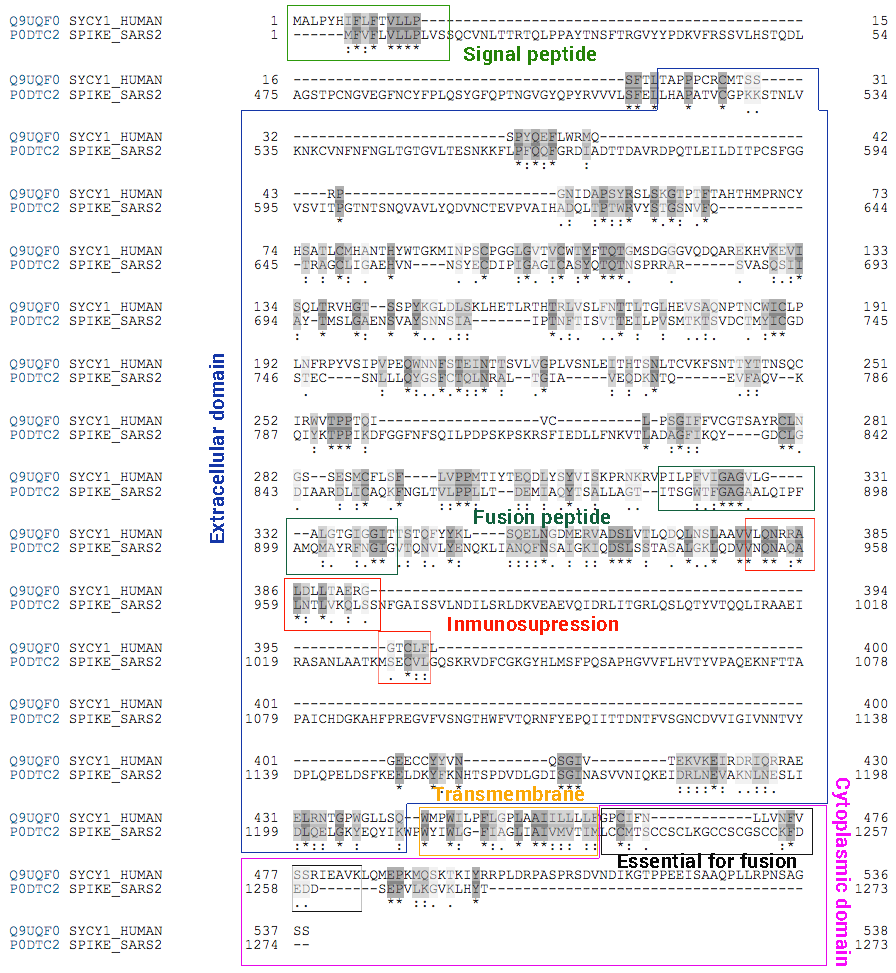
La Sincitina- 1 es la proteína de la envoltura del retrovirus W humano endógeno (HERV-W), cuya función es necesaria durante el embarazo para permitir el desarrollo de la placenta y la diferenciación del trofoblasto 3, debido a que interviene en la fusión de las células placentarias y permite el implante del embrión en el útero materno 4.
La Sincitina- 2 es la proteína de la envoltura de otro miembro de la familia HERV (HERV-FRD) y también está altamente expresada en la placenta humana 5. Aunque ambas sincitinas 1 y 2 son proteínas que median la fusión célula-célula de los citotrofoblastos para permitir la formación de la capa multinucleada del sincitiotrofoblasto durante el desarrollo placentario, la Sincitina- 2 (pero no la Sincitina – 1) posee además, una actividad inmunosupresora con la que consigue hacer invisible al feto ante el sistema inmune de la madre, con lo cual se impide el rechazo alogénico, por ser el embrión un ser humano único e irrepetible y genéticamente distinto a la madre 6.
La similitud que existe entre la estructura de las sincitinas y la proteína S del virus SARS-Cov-2 es realmente asombrosa. La proteína de la sincitinas maduras (proteína de la envoltura, Env, de los retrovirus endógenos humanos, HERV) consiste en un trímero de heterodímeros de dos subunidades, S1 y S2, unidos por un enlace disulfuro lábil entre las dos cadenas, que se escinde por Furina luego de que se produce la unión de S1 al receptor 7, 8, 9.
La estructura de las sincitinas es la misma que se describió para la proteína S de SARS-CoV-2. La subunidad S1 de la espiga se une al receptor y a continuación, la separación entre ambas – el corte realizado por la enzima Furina de las subunidades S1 y S2- permite la entrada del virus a las células10.
Curiosamente, el virus SARS-CoV-2 también presenta secuencias idénticas a las sincitinas que le confieren actividad inmunosupresora 11, con la que el virus consigue hacerse “invisible” al sistema inmune de la persona infectada.
¿Porqué las inyecciones contra COVID-19 podrían afectar la fertilidad humana?
En primer lugar, las inyecciones experimentales contra COVID-19 podrían afectar la fertilidad humana debido a la elevada similitud entre las sincitinas y la proteína de la espiga de SARS-CoV-2 11.
Aún no sabemos si los anticuerpos que se generen por acción de la vacunación contra COVID-19 podrían llegar a reaccionar de manera cruzada con las sincitinas. Si los anticuerpos contra SARS-COV-2 reconocen a las sincitinas humanas, estas proteínas se verían bloqueadas y serían neutralizadas por los anticuerpos, con lo cual estarían inhabilitadas para realizar su función de fusionar los citotrofoblastos fetales, que juegan un papel clave tanto en el proceso de implantación del embrión como en el desarrollo placentario. El resultado sería el aborto espontáneo del embrión en las mujeres vacunadas, al quedar impedido el proceso de diferenciación y de anidación en el útero materno, por una acción de inhibición directa de las sincitinas por los anticuerpos inducidos por medio de la inmunización artificial con cualquiera de las inyecciones experimentales contra COVID-19.
De hecho, esta afirmación está apoyada en la observación de que la expresión de sincitina recombinante en una amplia variedad de tipos de células induce la formación de sincitios gigantes y la fusión de una línea celular trofoblástica humana que expresa sincitina endógena se puede inhibir mediante un antisuero anti-sincitina. Un anticuerpo policlonal de conejo producido contra una mezcla de péptidos Env-W fue capaz de inhibir in vitro la fusión celular mediada por las sincitinas humanas 12.
Con idéntica lógica podríamos esperar que los anticuerpos dirigidos contra la espiga también podrían reconocer de forma cruzada y neutralizar a la Sincitina- 2, con lo cual su actividad inmunosupresora podría verse afectada, dejando al embrión expuesto al reconocimiento del sistema inmunitario de la madre, pudiendo conducir al rechazo inmune materno del feto 13.
Se ha demostrado que las proteínas de la envoltura de los HERV (HERV-Env), por un lado, desencadenan tanto la inmunidad innata como la adaptativa, provocando reacciones inflamatorias, citotóxicas y apoptóticas. Por otro lado, tienen capacidad para prevenir la activación de la respuesta inmunitaria, presentando propiedades inmunosupresoras y actuando como inmunorreguladoras 14. (Figura 2)
Cuando existe una similitud tan elevada con motivos de péptidos retrovirales endógenos, el sistema inmunitario humano puede detectarlo como un antígeno distinto y puede desencadenar una respuesta alérgica, como las que ocurren cuando los haptenos (por ejemplo, la penicilina) se unen a las proteínas del huésped 11.
Con la vacunación contra COVID-19, también se podrían inducir respuestas de anticuerpos de tipo IgE y una hipersensibilidad de tipo retardada por parte de las células T, tal como se observó en ratones, que tras la exposición a una vacuna contra el SARS, les provocó una respuesta alérgica 15, 16.
Por lo tanto, ya sabemos que debido al parecido de la proteína de la espiga del virus SARS-CoV-2 con las dos proteínas humanas, Sincitina- 1 y Sincitina- 2, es poco probable que se obtenga una vacuna contra COVID-19 segura, sin observar efectos secundarios alérgicos, citotóxicos y/o autoinmunes y sin que estos efectos afecten tarde o temprano el delicado mecanismo de la reproducción humana.
En segundo lugar, las inyecciones experimentales contra COVID-19 podrían afectar la fertilidad humana porque los niveles de la expresión del ácido ribonucleico mensajero (ARNm) de las sincitinas aumentan progresivamente desde el comienzo de la concepción, durante el primer trimestre y hasta el término del embarazo 17.
Tanto la fusión como la diferenciación de las células del trofoblasto se asocian con un aumento concomitante en la expresión del ARNm del gen sincitina (HERV-W env) y de la proteína Sincitina. En términos sencillos, si la cantidad de proteína o del ARNm del gen Sincitina disminuyen, se observan defectos en la formación de la placenta, mala diferenciación del trofoblasto y disfunción vascular en la placenta.
Se ha comprobado que la proteína y los niveles de transcripción del gen sincitina están significativamente disminuidos en las placentas de mujeres con hipertensión inducida por el embarazo, incluidas las pacientes con preeclampsia e hipertensión gestacional 18.
Clínicamente, se encontró expresión disminuida y localización anormal de Sincitina-1 y Sincitina- 2 en la preeclampsia, un trastorno del embarazo que se caracteriza por defectos en la formación de la placenta, mala diferenciación del trofoblasto y disfunción vascular en la placenta. Esto significa que la expresión alterada del gen de la sincitina y la ubicación celular alterada de su producto proteico pueden contribuir a la etiología de la preeclampsia 19. En otras palabras, una expresión placentaria reducida de sincitina puede contribuir a procesos de fusión celular alterados durante la placentogénesis y a una función placentaria alterada en los trastornos hipertensivos del embarazo 20.
Por otra parte, la determinación
de la Sincitina-1 en el esperma humano y su receptor
ASCT-2 en el ovocito humano sugiere muy probablemente un papel de la Sincitina- 1
en la fusión del esperma y el ovocito durante la fertilización 21. El
receptor ASCT-2, pero no Sincitina-1, se expresa en ovocitos y el nivel de ARNm
aumenta con el aumento de la madurez de los ovocitos. Sin embargo, aún no está claro
cómo llevan a cabo la fusión de gametos las sincitinas y sus receptores.
Inyecciones contra COVID-19: Un experimento de transgénesis humana a gran escala.
Las inyecciones de ARNm contra COVID-19 de las empresas Moderna, Pfizer/BioNtech, y CureVac contienen ARN mensajeros de la proteína espiga, que se administran recubiertos con nanopartículas lipídicas con polietilenglicol con el fin de evadir los mecanismos del cuerpo y permitirles ingresar en las células.
Esta plataforma de terapia con ARNs modificados es totalmente nueva, es una forma experimental de inoculación de genes extraños en el cuerpo humano que no puede llamarse “vacunación” ya que no se trata de administrar patógenos atenuados o inactivados como simples antígenos que estimulen la inmunidad. Se trata de la inoculación en el cuerpo humano variantes de genes sintéticos inyectables, para que penetren en las células humanas y las haga producir la proteína espiga (S) del virus, lo cual representa un verdadero experimento de transgénesis, nunca antes realizado en la historia de la humanidad con el fin de conferir inmunidad contra enfermedades infecto-contagiosas de transmisión humana.
Las empresas de biotecnología se esfuerzan en repetir el hecho de que las inyecciones ARNm no tienen la capacidad de ingresar al núcleo para modificar el ADN. Explican que el ARNm de la vacuna tan sólo va a codificar la glicoproteína espiga (S) y se va limitar a transcribirla en el citoplasma celular. Llama la atención que expertos y asesores de las organizaciones nacionales e internacionales responsables de la salud, se abstengan de mencionar el mecanismo de regulación epigenética que tiene el ARNm. La capacidad de regular directamente la expresión de los genes es un mecanismo ampliamente reconocido por la biología molecular: el silenciamiento génico mediado por ácidos ribonucleicos, los llamados ARN inhibitorios (ARNi) 22.
La Asamblea Nobel del Karolinska Institutet de Estocolmo, Suecia, otorgó el Premio Nobel de Fisiología o Medicina de 2006 conjuntamente a los investigadores Andrew Fire (Stanford University School of Medicine, Stanford, California, USA) y Craig Mello (University of Massachusetts Medical School, Worchester, Massachusetts, USA) por su descubrimiento de la interferencia de ARN. Estos científicos demostraron el silenciamiento de genes por medio del uso de ARNi de doble cadena 23.
Mediante el mecanismo de silenciamiento génico mediado por los ARNi, las inyecciones de ARNm tienen la capacidad potencial de modificar el ADN humano, induciendo o silenciando distintos genes de nuestro genoma. La interferencia de ARN es un mecanismo fundamental para controlar el flujo de información genética en las células.
En el caso específico de las sincitinas, mediante el uso de inhibidores del ARN (siRNA y shRNA) es decir, mediante el uso de oligonucleótidos antisentido específicos del gen sincitina, ya se demostró que se puede silenciar el gen y que la inhibición de la expresión de la proteína Env-W conduce a una disminución de la fusión y de la diferenciación del trofoblasto humano 3.
Mediante experimentos in vivo en animales, se llevaron a cabo pruebas de pérdida de función en el útero de ovejas, mediante la inyección de oligonucleótidos antisentido en el día 8 del embarazo. Las inyecciones de estos oligonucleótidos bloquearon la producción de proteína de la envoltura del gen ERV en el trofoectodermo de las ovejas.
El tratamiento génico específico para silenciar la expresión del gen envoltura del ERV en las ovejas, inhibió la diferenciación de las células binucleadas gigantes del trofoblasto y condujo a la pérdida de la gestación el día 20, en todas las ovejas que recibieron oligonucleótidos antisentido 24.
Cabe señalar que los retrovirus endógenos (ERV) son abundantes en los genomas de los vertebrados y desempeñan un papel fundamental en la reproducción de los mamíferos, en particular en la morfogénesis placentaria y en la implantación, razón por la cual, se podría esperar un resultado similar de inhibición génica específica de las sincitinas 1 y 2 en seres humanos y en primates 25 y posiblemente de los dos genes env relacionados, la sincitina A y sincitina B, en ratones 26.
Los oligonucleótidos antisentido se diseñan para modular la transferencia de información del gen a la proteína, interfiriendo con la función del ARNm o del pre-ARNm. Para lograr una modulación eficaz de la expresión génica mediante oligonucleótidos antisentido, se utilizan modificaciones de oligonucleótidos que no promuevan la degradación por ARNasa H del ARN diana. Por ejemplo, se diseñan para inhibir específicamente la expresión de ARNm del gen de la envoltura de los HERV, de manera que inhiben el empalme y / o la traducción del ARNm mediante un mecanismo de bloqueo estérico, que es independiente de la ARNasa H. Además de los efectos de estos oligonucleótidos inhibidores a corto plazo, la regulación génica a largo plazo se puede lograr mediante ARN antisentido expresados intracelularmente administrados por vectores virales 27.
Conociendo la alta homología que existe entre sincitina y la proteína de la espiga del virus SARS-CoV-2, y sabiendo que las secuencias de oligonucleótidos que silencian el gen humano sincitina tienen 100% de homología con las secuencias del gen de la espiga introducido en las vacunas, nadie puede garantizar que las inyecciones de ARNm contenidos en las inyecciones no acabarán afectando la expresión de los genes endógenos humanos Sincitina- 1 y Sincitina- 2.
Estos aspectos de seguridad y efectos adversos de las inyecciones contra COVID-19 en la fertilidad humana no están siendo evaluados en los ensayos pre-clínicos en animales, ni en los ensayos clínicos de fase I, II y III que ya se están llevando adelante con voluntarios y que no son debidamente informados de todos los riesgos que conlleva la vacunación 28.
Es importante destacar que hay autores que señalan que los genes sincitina están presentes en los seres humanos y en primates del Viejo Mundo y difieren de los genes env que están presentes en roedores 17, 25. En este sentido, los ensayos pre-clínicos de una de las inyecciones candidatas de ARNm se realizaron sólo en ratones y hámsters y fueron publicados online a fines de octubre de 2020 sin revisión por pares 29, después de haber iniciado los ensayos clínicos de fase 1 y 2 con voluntarios.
Por otra parte, las cláusulas de confidencialidad que han sido concedidas por los gobiernos a las empresas que desarrollan estas inyecciones no nos permitirán saber si las construcciones que componen las inyecciones vectorizadas codifican un gen de la espiga del SARS-CoV-2 y/o un ARNi de simple o de doble cadena con resistencia a las nucleasas. Por lo tanto tampoco podemos saber con certeza si las inyecciones que introducen ARN modificados tienen función de ARNi y si pueden dirigirse contra sitios específicos a lo largo de la transcripción de ARN de un gen, en este caso, las sincitinas humanas, por la alta similitud que comparten en la secuencia.
Por todo lo expuesto, el resultado de la inoculación de estas inyecciones experimentales puede terminar conduciendo a producir anticuerpos “con un 95% de efectividad” pero no se puede descartar que, como efecto secundario, puedan bloquear la traducción de un ARN mensajero que codifica una proteína humana normal. Sabemos de antemano que los oligonucleótidos antisentido resistentes a la ARNasa H proporcionan una resistencia completa a las nucleasas, exhiben una buena capacidad de focalización, alta eficacia en la célula y presentan especificidad de secuencia 30.
Con las herramientas de biología molecular disponibles en la actualidad, las empresas de biotecnología pueden introducir modificaciones desestabilizadoras en los ARNm, pueden mejorar la eficacia de los ARN inhibidores y con ello pueden activar un mecanismo alternativo a través del cual se elimina la hebra sentido, otorgando una potente actividad silenciadora a los ARNi. Si estos ARN modificados se administran con las inyecciones contra COVID-19, se estará sometiendo a la población mundial a un método nuevo y soslayado de terapia génica experimental a gran escala, con el fin de desestabilizar la expresión de genes humanos mediante la inyección de secuencias extrañas, con posible resistencia a las nucleasas y con capacidad demostrada de ejercer control epigénico.
Las empresas que desarrollan estas inyecciones no están actuando de manera ética ni responsable
Las empresas que desarrollan estas inyecciones no están actuando de manera ética ni responsable, porque no llevan adelante los estudios de seguridad en los modelos animales adecuados, ni están respetando los tiempos necesarios para observar efectos adversos severos a mediano y largo plazo, ni van a proporcionar la información necesaria que consideran “confidencial”. Evitando e improvisando las fases de experimentación pre-clínicas y avanzando directamente con las fases clínicas experimentación I, II y III, las empresas están trasladando el riesgo de los animales a los seres humanos, usando a las personas como modelos de desafío animal.
En síntesis, nos vemos obligados a denunciar que si los gobiernos quieren implementar una vacunación experimental masiva y obligatoria en la población con inyecciones que no han cumplido las fases experimentales y que son aprobadas con protocolos “de emergencia”, están siendo cómplices de posibles delitos de contra la humanidad, debido a que estas plataformas terapéuticas “novedosas” encierran riesgos implícitos y ocultos en sus diseños los mecanismos más ampliamente aceptados de silenciamiento de genes inducidos mediante ARN inhibidores, cuyos efectos son de pleno conocimiento para la comunidad científica internacional y sin embargo están siendo minimizados por las farmacéuticas, cuando deberían ser evaluados antes de la autorización comercial de estas inyecciones.
Las consecuencias de inocular estos genes extraños en la población con las inyecciones contra COVID-19 pueden resultar catastróficas para el destino de la humanidad, si se tiene en cuenta papel de las proteínas de envoltura HERV (sincitinas) en la fisiología humana y sus posibles efectos patogénicos en varios tipos de cánceres y de trastornos autoinmunes como la Esclerosis Múltiple 31, 32, la Esclerosis Lateral Amiotrófica 33, 34, 35 y la Diabetes tipo 1 36.
Declaración de conflictos de interés
La autora y el editor no tienen conflictos de intereses para declarar.
Referencias:
1- Wodarg W. https://www.wodarg.com/impfen/
2- Wodarg W and Yeadon M. Petition to European Medicines Agency Committee for human medicinal products (CHMP) COVID-19 EMA pandemic Task Force (COVID-ETF) Domenico Scarlattilaan 61083 HS Amsterdam The Netherlands. December 1, 2020. https://2020news.de/wp-content/uploads/2020/12/Wodarg_Yeadon_EMA_Petition_Pfizer_Trial_FINAL_01DEC2020_EN_unsigned_with_Exhibits.pdf
3- Frendo JL, Olivier D, Cheynet V, Blond JL, Bouton O, Vidaud M, Rabreau M, Evain-Brion D, Mallet F. Direct involvement of HERV-W Env glycoprotein in human trophoblast cell fusion and differentiation. Mol Cell Biol 2003; 23:3566–3574. PMID: 12724415 PMCID: PMC164757 DOI: 10.1128/mcb.23.10.3566-3574.2003 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC164757/pdf/1493.pdf
4- Mi, S., Lee, X., Li, Xp. et al. Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis . Nature 403, 785–789 (2000). PMID: 10693809 DOI: 10.1038/35001608. https://www.nature.com/articles/35001608
5- Blaise S, de Parseval N, Bénit L, Heidmann T. Genomewide screening for fusogenic human endogenous retrovirus envelopes identifies syncytin 2, a gene conserved on primate evolution. Proc Natl Acad Sci U S A. 2003 Oct 28;100(22):13013-8. doi: 10.1073/pnas.2132646100. Epub 2003 Oct 13. PMID: 14557543; PMCID: PMC240736. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC240736/pdf/10013013.pdf
6- Mangeney M, Renard M, Schlecht-Louf G, Bouallaga I, Heidmann O, Letzelter C, Richaud A, Ducos B, Heidmann T. Placental syncytins: genetic disjunction between the fusogenic and immunosuppressive activity of retroviral envelope proteins. Proc Natl Acad Sci U S A 2007; 104:20534–20539. PMID: 18077339 PMCID: PMC2154466 DOI: 10.1073/pnas.0707873105. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2154466/pdf/zpq20534.pdf
7- Harris JR. Placental endogenous retrovirus (ERV): structural, functional, and evolutionary significance. Bioessays. 1998; 20: 307-316 PMID: 9619102 DOI: 10.1002/(SICI)1521-1878(199804)20:4<307::AID-BIES7>3.0.CO;2-M https://pubmed.ncbi.nlm.nih.gov/9619102/
8- Gong R, Peng X, Kang S, Feng H, Huang J, Zhang W, Lin D, Tien P, Xiao G. Structural characterization of the fusion core in syncytin, envelope protein of human endogenous retrovirus family W. Biochem Biophys Res Commun. 2005 Jun 17;331(4):1193-200. doi: 10.1016/j.bbrc.2005.04.032. PMID: 15883002; PMCID: PMC7092852. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7092852/pdf/main.pdf
9- Cheynet V, Ruggieri A, Oriol G, Blond JL, Boson B, Vachot L, Verrier B, Cosset FL, Mallet F. Synthesis, assembly, and processing of the Env ERVWE1/syncytin human endogenous retroviral envelope. J Virol. 2005 May;79(9):5585-93. doi: 10.1128/JVI.79.9.5585-5593.2005. PMID: 15827173; PMCID: PMC1082723. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1082723/pdf/1588-04.pdf
10- Walls AC, Park YJ, Tortorici MA, Wall A, McGuire AT and Veesler D. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell Volume 181, Issue 2, 16 April 2020, Pages 281-292. https://doi.org/10.1016/j.cell.2020.02.058
11- Gallaher B. Response to nCoV2019 Against Backdrop of Endogenous Retroviruses. https://virological.org/t/response-to-ncov2019-against-backdrop-of-endogenous-retroviruses/396
12- Mi S Xinhua L Xiang-Ping L Geertrudia MV Finnerty H Racie L et al. Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis. Nature. 2000; 403: 785-789 PMID: 10693809 DOI: 10.1038/35001608 https://www.nature.com/articles/35001608
13- Chie-Pein Chen, Liang-Fu Chen, Su-Ray Yang, Chia-Yu Chen, Chun-Chuan Ko, Geen-Dong Chang, Hungwen Chen, Functional Characterization of the Human Placental Fusogenic Membrane Protein Syncytin 2, Biology of Reproduction, Volume 79, Issue 5, 1 November 2008, Pages 815–823, https://doi.org/10.1095/biolreprod.108.069765
14- Grandi N, Tramontano E. HERV Envelope Proteins: Physiological Role and Pathogenic Potential in Cancer and Autoimmunity. Front Microbiol. 2018 Mar 14;9:462. doi: 10.3389/fmicb.2018.00462. PMID: 29593697; PMCID: PMC5861771. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5861771/pdf/fmicb-09-00462.pdf
15- Tseng CT, Sbrana E, Iwata-Yoshikawa N, Newman PC, Garron T, Atmar RL, Peters CJ, Couch RB. Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLoS One. 2012;7(4):e35421. doi: 10.1371/journal.pone.0035421. PMID: 22536382; PMCID: PMC3335060. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3335060/pdf/pone.0035421.pdf
16- Bolles M, Deming D, Long K, Agnihothram S, Whitmore A, Ferris M, Funkhouser W, Gralinski L, Totura A, Heise M, Baric RS. A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge. J Virol. 2011 Dec;85(23):12201-15. doi: 10.1128/JVI.06048-11. PMID: 21937658; PMCID: PMC3209347. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3209347/pdf/zjv12201.pdf
17- Keith JC Jr, Pijnenborg R, Van Assche FA. Placental syncytin expression in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 2002 Oct;187(4):1122-3; author reply 1123-4. doi: 10.1067/mob.2002.128512. PMID: 12389018. https://www.ajog.org/article/S0002-9378(02)70072-0/fulltext
18- Knerr I, Beinder E, Rascher W. Syncytin, a novel human endogenous retroviral gene in human placenta: evidence for its dysregulation in preeclampsia and HELLP syndrome. Am J Obstet Gynecol 2002; 186:210–213. PMID: 11854637 DOI: 10.1067/mob.2002.119636 https://www.ajog.org/article/S0002-9378(02)11228-2/fulltext
19- Lee X, Keith JC Jr, Stumm N, Moutsatsos I, McCoy JM, Crum CP, Genest D, Chin D, Ehrenfels C, Pijnenborg R, van Assche FA, Mi S. Downregulation of placental syncytin expression and abnormal protein localization in pre-eclampsia. Placenta 2001; 22:808-812. PMID: 11718567 DOI: 10.1053/plac.2001.0722 https://linkinghub.elsevier.com/retrieve/pii/S0143-4004(01)90722-2
20- Chen CP, Wang KG, Chen CY, Yu C, Chuang HC, Chen H. Altered placental syncytin and its receptor ASCT2 expression in placental development and pre-eclampsia. BJOG 2006; 113:152–158. PMID: 16411991 DOI: 10.1111/j.1471-0528.2005.00843.x. https://obgyn.onlinelibrary.wiley.com/doi/full/10.1111/j.1471-0528.2005.00843.x
21- Bjerregaard, B., Lemmen, J.G., Petersen, M.R. et al. Syncytin-1 and its receptor is present in human gametes. J Assist Reprod Genet 31, 533–539 (2014). https://doi.org/10.1007/s10815-014-0224-1
22- Cavagnari BM. Regulación de la expresión génica: cómo operan los mecanismos epigenéticos. Regulation of gene expression: how do epigenetic mechanisms work. Arch Argent Pediatr 2012;110(2):132-136. Departamento de Pediatría. Hospital Alemán.Ciudad Autónoma de Buenos Aires :https://www.sap.org.ar/docs/publicaciones/archivosarg/2012/v110n2a08.pdf
23- The Nobel Prize in Physiology or Medicine 2006. NobelPrize.org. https://www.nobelprize.org/prizes/medicine/2006/7474-the-nobel-prize-in-physiology-or-medicine-2006-2006-4/
24- Dunlap KA, Palmarini M, Varela M, Burghardt RC, Hayashi K, Farmer JL, and Spencer TE. Endogenous retroviruses regulate periimplantation placental growth and differentiation PNAS September 26, 2006 103 (39) 14390-14395; https://doi.org/10.1073/pnas.0603836103https://www.pnas.org/content/pnas/103/39/14390.full.pdf
25- Voisset C, Blancher A, Perron H, Mandrand B, Mallet F, Paranhos-Baccala G. Phylogeny of a novel family of human endogenous retrovirus sequences, HERV-W, in humans and other primates. AIDS Res Hum Retroviruses. 1999; 15: 1529-1533(15-19) PMID: 10580403 DOI: 10.1089/088922299309810 https://pubmed.ncbi.nlm.nih.gov/10580403/
26- Henke C, Ruebner M, Faschingbauer F, et al. Regulation of murine placentogenesis by the retroviral genes Syncytin-A, Syncytin-B and Peg10. Differentiation; Research in Biological Diversity. 2013 Apr-Jun;85(4-5):150-160. DOI: 10.1016/j.diff.2013.02.002. https://europepmc.org/article/med/23807393
27- Short-term and long-term modulation of gene expression by antisense therapeutics Peter Sazani, Marla M Vacek and Ryszard Kole. Current Opinion in Biotechnology Volume 13, Issue 5, 1 October 2002, Pages 468-472.https://doi.org/10.1016/S0958-1669(02)00366-X https://pubmed.ncbi.nlm.nih.gov/12459339/
28- Cardozo T and Veazey R . Informed consent disclosure to vaccine trial subjects of risk of COVID‐19 vaccines worsening clinical disease. International Journal of Clinical Practice, October 28, 2020 DOI: 10.111/ijcp.13795 https://doi.org/10.1111/ijcp.13795 https://onlinelibrary.wiley.com/doi/10.1111/ijcp.13795
29- Susanne Rauch, Nicole Roth, Kim Schwendt, et al. mRNA based SARS-CoV-2 vaccine candidate CVnCoV induces high levels of virus neutralizing antibodies and mediates protection in rodents. doi: https://doi.org/10.1101/2020.10.23.351775 https://www.biorxiv.org/content/10.1101/2020.10.23.351775v1.full.pdf
30- Summerton J. Morpholino antisense oligomers: the case for an RNase H-independent structural type. Biochim Biophys Acta. 1999 Dec 10;1489(1):141-58. doi: 10.1016/s0167-4781(99)00150-5. PMID: 10807004. https://pubmed.ncbi.nlm.nih.gov/10807004/
31- Dolei A. The aliens inside us: HERV-W endogenous retroviruses and multiple sclerosis. Mult Scler. 2018 Jan;24(1):42-47. doi: 10.1177/1352458517737370. PMID: 29307292. https://pubmed.ncbi.nlm.nih.gov/29307292/
32- Antony JM, Deslauriers AM, Bhat RK, Ellestad KK, Power C. Human endogenous retroviruses and multiple sclerosis: innocent bystanders or disease determinants? Biochim Biophys Acta. 2011 Feb;1812(2):162-76. doi: 10.1016/j.bbadis.2010.07.016. Epub 2010 Aug 6. PMID: 20696240; PMCID: PMC7172332. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7172332/pdf/main.pdf
33- Arru G, Mameli G, Deiana GA, Rassu AL, Piredda R, Sechi E, Caggiu E, Bo M, Nako E, Urso D, Mariotto S, Ferrari S, Zanusso G, Monaco S, Sechi G, Sechi LA. Humoral immunity response to human endogenous retroviruses K/W differentiates between amyotrophic lateral sclerosis and other neurological diseases. Eur J Neurol. 2018 Aug;25(8):1076-e84. doi: 10.1111/ene.13648. Epub 2018 May 14. PMID: 29603839. https://pubmed.ncbi.nlm.nih.gov/29603839/
34- Alfahad T, Nath A. Retroviruses and amyotrophic lateral sclerosis. Antiviral Res. 2013 Aug;99(2):180-7. doi: 10.1016/j.antiviral.2013.05.006. Epub 2013 May 23. PMID: 23707220; PMCID: PMC3723705. https://pubmed.ncbi.nlm.nih.gov/23707220/
35- Küry P, Nath A, Créange A, Dolei A, Marche P, Gold J, Giovannoni G, Hartung HP, Perron H. Human Endogenous Retroviruses in Neurological Diseases. Trends Mol Med. 2018 Apr;24(4):379-394. doi: 10.1016/j.molmed.2018.02.007. Epub 2018 Mar 15. PMID: 29551251; PMCID: PMC7185488. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7185488/pdf/main.pdf
36- Levet S, Charvet B, Bertin A, Deschaumes A, Perron H, Hober D. Human Endogenous Retroviruses and Type 1 Diabetes. Curr Diab Rep. 2019 Nov 21;19(12):141. doi: 10.1007/s11892-019-1256-9. PMID: 31754894; PMCID: PMC6872510. https://pubmed.ncbi.nlm.nih.gov/31754894/
Tambien ver Biólogos por la verdad: http://www.biologosporlaverdad.es/spikeysincitinas.pdf