The Increasing Prevalence in Intersex Variation from Toxicological Dysregulation in Fetal Reproductive Tissue Differentiation and Development by Endocrine-Disrupting Chemicals https://doi.org/10.4137/EHI.S3982 https://journals.sagepub.com/doi/full/10.4137/EHI.S39825
Los disruptores endocrinos, EDC pueden interferir con las complejas vías bioquímicas del cerebro y el desarrollo de las características sexuales secundarias, afectando el comportamiento normal o el desarrollo de género en consonancia con el sexo del niño sin desregulación en la diferenciación de tejidos. Esto puede afectar la química del cerebro y la forma en que una persona se asocia con su sexo fisiológico o personifica su género en el comportamiento. 63 , 64 Esta interferencia puede resultar en una disforia de género (anteriormente denominada trastorno de identidad de género), o personas cuya identidad de género difiere de su sexo biológico al momento del nacimiento, lo que puede explicar el deseo de reasignación de género quirúrgica en algunas personas. El elemento crítico de la disforia de género es la presencia de angustia clínicamente significativa asociada con la condición. 65 Un feto o bebé expuesto a desencadenantes ambientales como los EDC durante períodos críticos del desarrollo puede no manifestar una enfermedad o disfunción biológica hasta más tarde en la vida.
Un número cada vez mayor de niños nace con variación intersexual (IV; genitales ambiguos/hermafrodita, pseudohermafroditismo, etc.). La evidencia muestra que las sustancias químicas disruptoras endocrinas (EDC, por sus siglas en inglés) en el medio ambiente pueden causar una variación reproductiva a través de la desregulación de la diferenciación, el crecimiento y la maduración del tejido reproductivo normal si el feto está expuesto a sustancias químicas disruptoras endocrinas, EDC durante los períodos críticos de desarrollo en el útero.
Los estudios en animales respaldan que los embriones de peces y reptiles exhibieron genitales ambiguos/hermafrodita, pseudohermafroditismo, etc., IV e inversión sexual cuando se expusieron a EDC.
Estudios ocupacionales verificaron mayor prevalencia de hijos con IV en trabajadores expuestos químicamente (hombres y mujeres). Los productos químicos asociados con la capacidad de alteración endocrina en humanos incluyen:
- pesticidas organoclorados,
- bifenilos policlorados,
- bisfenol A,
- ftalatos,
- dioxinas y furanos.
Las personas intersexuales pueden tener trastornos físicos concurrentes que requieran una intervención médica de por vida y experimentar disforia de género.
Existe una necesidad urgente de determinar qué sustancias químicas presentan el mayor riesgo de IV y los mecanismos por los cuales estas sustancias químicas son capaces de interferir con el desarrollo fisiológico normal de los niños.
El Dr. Eduardo Yahbes presenta este articulo. Nota del Editor : Hay un cúmulo de sustancias químicas que causan confusión de género en los niños, pero en vez de atender las causas Carla Vizzotti y el ministerio de las Mujeres, Géneros y Diversidad de Argentina, compra de 180 mil píldoras con hormonas para trans, no- binarios y otras diversidades que les causan más problemas neurológicos y de salud graves. https://www.bitchute.com/video/HygcIe1zv5hM/
Definición de la variación intersexual
La variación intersexual (IV) es una anomalía morfológica y fisiológica en la que un individuo nace con “condiciones congénitas en las que el desarrollo del sexo cromosómico, gonadal o anatómico es atípico”. 1 En esencia, los órganos reproductivos difieren de los típicamente asociados como masculinos o femeninos. 2 , 3
La evidencia respalda la premisa de que en las etapas críticas del desarrollo fetal, la exposición a sustancias químicas exógenas conocidas como sustancias químicas disruptoras endocrinas (EDC, por sus siglas en inglés) puede alterar la diferenciación y el desarrollo de los órganos reproductivos en el útero, lo que lleva a una condición IV. 4 – 10
Este estudio analiza más de cerca los complejos mecanismos fisiológicos de la diferenciación sexual fetal y el desarrollo en el útero y proporciona una mejor comprensión de la vulnerabilidad del feto a la desregulación toxicológica de los EDC.
Históricamente, la incidencia y la prevalencia en la IV han sido difíciles de cuantificar, ya que se han realizado pocos estudios que clasifiquen las numerosas presentaciones físicas de la IV o que cuantifiquen las condiciones específicas de la IV al nacer. Algunas condiciones de IV son defectos de nacimiento reportables documentados en los Registros Estatales de Defectos de Nacimiento. Otras variaciones de la norma física no se definen como defectos de nacimiento y, por lo tanto, no se han documentado como tales.
Los datos actuales indican que se está observando una tendencia creciente en IV a nivel mundial. Un estudio inicial de Lilford y Dear 11 sugirió que uno de cada 2000 recién nacidos tenía algún tipo de ambigüedad genital externa, pero el estudio no estaba bien respaldado por datos médicos o científicos, según se pudo determinar.
Este documento contiene la suficiente evidencia cientifica (más de 150 referencias) para que las madres puedan presentar a sus médicos y abogados y lograr exenciones para prevenir ser dañadas con vacunas o inyecciones génicas, que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. descargar libro, click aqui
Una revisión más reciente de la Organización Mundial de la Salud (OMS, 2016) encontró que la frecuencia de las variaciones del desarrollo sexual era muy variable y oscilaba entre 1:600 (síndrome de Klinefelter) y 1:5000 (hiperplasia suprarrenal congénita [CAH]). 12
En 2004, Ahmed et al. informaron una tendencia creciente. 13 , que examina anomalías genitales en nacimientos únicos (excluyendo nacimientos múltiples) en Escocia. La prevalencia de hipospadias y otras anomalías genitales aumentó durante un período de 8 años de 4,0 por 1000 nacimientos (1988) a 5,9 por 1000 nacimientos (1996). Gaspar et al 14 también sustentó una tendencia creciente en el número de niños que nacen con IV.
Ningún estudio examinó la incidencia de IV como comorbilidad en recién nacidos o lactantes fallecidos. Si esta tendencia creciente en IV es un artefacto de reconocimiento y documentación; inclusión ampliada de variaciones morfológicas en los genitales; tratamiento médico mejorado en los recién nacidos, lo que lleva a una tasa de mortalidad reducida; es difícil de determinar con pocos estudios y datos en los que confiar.
Desregulación toxicológica en la diferenciación genital fetal
La desregulación toxicológica puede interferir con la diferenciación del tejido fetal y afectar negativamente el desarrollo normal de las características morfológicas masculinas y femeninas mientras están en el útero. La diferenciación de los genitales externos masculinos o femeninos en el feto comienza durante la séptima semana de gestación. Antes de este momento, los conductos genitales internos derivados del mesonefros están presentes, pero el feto no es reconocible externamente como masculino o femenino.
La masculinización es iniciada por los andrógenos testiculares (derivados del término griego «andro» que significa masculino) en el feto, definiendo los genitales externos andróginos en una forma o sexo reconocible entre las 8 y 12 semanas de gestación.
La dihidrotestosterona, un metabolito de la testosterona, activa los genes que hacen que se desarrollen el aparato reproductor masculino y los genitales externos. 15 La producción o acción anormal de hormonas puede interrumpir este proceso, lo que resulta en una masculinización incompleta. 16
En ausencia de la influencia hormonal de la dihidrotestosterona, un feto se desarrollará esencialmente en una mujer. Por lo tanto, la diferenciación de los genitales externos depende fuertemente de las hormonas.
Durante este momento crítico en la diferenciación sexual, el feto es el más susceptible a las sustancias químicas del medio ambiente con la capacidad de alterar el sensible sistema endocrino.
La exposición del feto a los EDC durante esta etapa crítica puede afectar la diferenciación de tejidos, el crecimiento y la maduración fisiológica y también puede afectar el desarrollo posterior de las características sexuales secundarias. 17 – 19
La seguridad de las vacunas contra la hepatitis B que se administran a los recién nacidos no se ha probado en un solo ensayo clínico controlado aleatorio con placebo inerte como se manifiesta en los propios prospectos y tiene sobredosis de aluminio neurotóxico. Este compendio de estudios de expertos, contiene la suficiente evidencia para que los padres puedan presentar a sus médicos y abogados y prevenir que su hijos sean intoxicados con vacunas que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. Descargar libro click aqui
La diferenciación incompleta o parcial de los genitales puede resultar en el desarrollo de los órganos reproductores masculinos y femeninos, lo que dificulta identificar claramente a un bebé como hombre o mujer físicamente en el momento del nacimiento.
Múltiples factores genéticos y no genéticos son capaces de alterar los procesos dimórficos de la determinación del sexo, donde las gónadas en desarrollo se convierten en testículos u ovarios, y la subsiguiente diferenciación sexual, donde se forman los conductos internos y los genitales externos. 20
Estas variaciones de nacimientos no deseados han sido identificadas por diferentes términos a lo largo del tiempo (genitales ambiguos, hermafrodita, pseudohermafrodita, etc.) con la terminología actualmente adoptada IV.
Un feto expuesto a sustancias químicas que alteran el género puede nacer con un espectro de variaciones morfológicas.
Los genitales ambiguos (genitales atípicos) que resultan en IV pueden presentarse como criptorquidia (ausencia de uno o ambos testículos), hipospadias perineal (la abertura de la uretra no está en la cabeza del pene), epispadias (abertura de la uretra en el dorso del pene) y clitoromegalia (agrandamiento anormal del clítoris). 21 – 23
IV también puede ir acompañada de otros trastornos médicos o cromosómicos, incluidos el síndrome de Turner, el síndrome de Klinefelter y la hiperplasia suprarrenal congénita, CAH.
El síndrome de Turner, trastorno que afecta solamente a las personas de sexo femenino, se produce cuando falta un cromosoma X (cromosoma sexual) de forma total o parcial. El síndrome de Turner puede causar una variedad de problemas médicos y de desarrollo, como baja estatura, la falta de desarrollo de los ovarios y defectos cardíacos. El síndrome de Klinefelter es una afección genética que se produce cuando un niño nace con una copia adicional del cromosoma X. El síndrome de Klinefelter es una afección genética que afecta a los hombres y que a menudo no se diagnostica hasta la edad adulta. La hiperplasia suprarrenal congénita, o CAH por sus siglas en inglés, se refiere a un grupo de trastornos genéticos que afectan las glándulas suprarrenales. Estas glándulas se encuentran sobre los riñones y liberan hormonas que el cuerpo necesita para funcionar.
La exposición a los EDC se ha asociado con una mayor incidencia de CAH, que puede poner en peligro la vida, según la gravedad. Aproximadamente el 95% de los casos de CAH son causados por una deficiencia de 21-hidroxilasa (21-OHD), una mutación en el gen que codifica la enzima 21-OH.
Una deficiencia de 21-OH puede resultar en una interferencia en la eficiencia de la síntesis de cortisol y aldosterona, lo que resulta en una mayor producción de andrógenos y una pubertad temprana. 24 – 28
La gravedad de la CAH depende de la magnitud de la alteración enzimática y la interferencia resultante en la síntesis de estas hormonas. Una forma más leve de CAH (CAH no clásica) no pone en peligro la vida, y los síntomas aparecen al final de la infancia o al principio de la edad adulta.
Los signos de infertilidad, baja estatura y pubertad temprana pueden ser indicadores de una alteración de la función suprarrenal. Las personas con CAH producen más andrógenos, lo que resulta en un desarrollo temprano y excesivo de características masculinas tanto en hombres como en mujeres.
La producción excesiva de andrógenos puede interferir con el desarrollo normal de las características sexuales secundarias en las mujeres durante la pubertad y la asociación apropiada de identidad de género más adelante en la vida. 29 , 30
Aunque no todos los CAH resultan en intersexualidad, CAH es la causa más común de IV en las mujeres.31 Los estudios respaldan que incluso la exposición a dosis bajas de EDC tiene la capacidad de afectar los mecanismos sensibles en los procesos fisiológicos y bioquímicos, en lugar de solo la exposición a dosis altas. 32 – 35
Un estudio de Ostby et al. 36 examinaron la exposición de bajo nivel al fungicida dicarboximida (vinclozolina) con efecto antiandrogénico en ratas encapuchadas Long-Evans preñadas. La descendencia masculina desarrolló numerosas anomalías reproductivas, incluida la reducción de la distancia anogenital y la disminución del tamaño y el peso de la próstata ventral. 36 Este hallazgo respalda el potencial de un efecto antiandrogénico bimodal en ciertos EDC.
Este documento contiene la suficiente evidencia científica (más de 50) para que las madres puedan presentar a sus médicos y abogados y prevenir sus hijas e hijos sean dañados con vacunas que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. No espere hasta último momento para estar protegida… descargar desde: https://cienciaysaludnatural.com/recursos

Los EDC también pueden sentar las bases para futuras enfermedades (cáncer testicular), 37 , 38 y anomalías reproductivas (hipospadias, distancia anogenital reducida, mala calidad del semen). 39 , 40
Las condiciones de IV pueden presentarse con una mayor tasa de defectos cardíacos. Durante el mismo tiempo de desarrollo genital en el feto, el corazón continúa su diferenciación y desarrollo. A principios de la séptima semana, el foramen secundum en el septum primum (precursor del tabique interauricular del corazón embriológico) se cierra y comienza a dividirse en las cavidades cardíacas derecha e izquierda.
Los troncos aórtico y pulmonar se separan durante la octava y novena semana del desarrollo fetal y el nódulo sinoauricular (nódulo SA o marcapasos del corazón) se vuelve identificable a medida que continúa la morfogénesis de la válvula y el tabique. 41 – 46
El período embrionario (semanas 4 a 8) es una ventana crítica de la organogénesis en la que el embrión se encuentra en su máxima vulnerabilidad a la interrupción de la diferenciación.
La exposición a los EDC durante este tiempo puede provocar anomalías congénitas importantes, incluida la malformación cardíaca, un indicador potencial de CAH e IV. 47 – 50
Las deformaciones craneofaciales y de las extremidades también están asociadas con esta ventana crítica en el desarrollo genital fetal. 51 – 53 Los niños con anomalías genitales tienen un mayor riesgo de muerte prematura debido a diversas malformaciones congénitas, en particular las que afectan el sistema cardiovascular. 54 , 55
El síndrome de Turner
El síndrome de Turner es una de las anomalías cromosómicas más comunes en humanos y está altamente correlacionada con anomalías cardiovasculares. 56 Un estudio de Davenport 57 encontró que el 75% de los fetos con síndrome de Turner tenían una cardiopatía congénita. La cardiopatía congénita también se registró en el 25% -45% de las mujeres con síndrome de Turner. La válvula aórtica bicúspide (16%) y la coartación de la aorta (11%) se identificaron como la variación cardiaca más comúnmente expresada. 57
Además de las enfermedades cardiovasculares, las personas con síndrome de Turner pueden manifestar un amplio espectro de comorbilidades que incluyen retraso en el crecimiento, pérdida de la audición, problemas de aprendizaje, malformaciones renales e infertilidad. 58 – 60
Las anomalías genitales también se han asociado con dismorfias faciales, anomalías musculoesqueléticas e insuficiencia renal y respiratoria. 61 También se han documentado comorbilidades psicológicas asociadas a anomalías genitales.
Un estudio de mujeres taiwanesas nacidas con CAH mostró que una proporción significativa de pacientes había sido diagnosticada con un trastorno psiquiátrico. 62 Las malformaciones congénitas del corazón suelen ser el principal factor de mortalidad infantil y, por lo tanto, se informan como la principal causa de muerte. En la actualidad, no se requiere informar las afecciones IV como comorbilidad (excluidos los trastornos cromosómicos) en los EE. UU. y, por lo tanto, se presta a la notificación insuficiente, lo que complica aún más el establecimiento de una tasa precisa de incidencia o prevalencia.
DMSO, Dimetíl Sulfóxido, usos: Accidentes cerebrovasculares, hemorragias cerebrales, lesiones cerebrales y de la columna, parálisis, ataques cardíacos, demencia, amiloidosis, más, descargar desde https://red.cienciaysaludnatural.com/
EDC y efecto sobre la química cerebral
La reciente transición de género de alto perfil del campeón olímpico de decatlón masculino de los Estados Unidos de 1976 Bruce Jenner a la mujer Caitlyn Jenner ha provocado una discusión considerable sobre lo que realmente define el género o la identidad de género de uno.
Los EDC pueden interferir con las complejas vías bioquímicas del cerebro y el desarrollo de las características sexuales secundarias, afectando el comportamiento normal o el desarrollo de género en consonancia con el sexo del niño sin desregulación en la diferenciación de tejidos. Esto puede afectar la química del cerebro y la forma en que una persona se asocia con su sexo fisiológico o personifica su género en el comportamiento. 63 , 64
Esta interferencia puede resultar en una disforia de género (anteriormente denominada trastorno de identidad de género), o personas cuya identidad de género difiere de su sexo biológico al momento del nacimiento, lo que puede explicar el deseo de reasignación de género quirúrgica en algunas personas. La Asociación Estadounidense de Psiquiatría aclara que “la inconformidad de género no es en sí misma un trastorno mental. El elemento crítico de la disforia de género es la presencia de angustia clínicamente significativa asociada con la condición. 65
Posiblemente, el aspecto o expresión más verdadero de la sexualidad de uno se puede definir mejor mediante la integración de la asignación del sistema reproductivo de un individuo, o sexo , y la expresión de su sexo a través del comportamiento sexual/social o identidad de género. La interacción sexo/género es, por lo tanto, una danza compleja entre factores cromosómicos, factores genéticos, química cerebral y la expresión de esos factores en la exhibición de comportamiento (comportamiento sexual, preferencia romántica o íntima; Fig. 1 ) .

EDC y IV en estudios con animales
Décadas de investigación en animales expuestos a EDC brindan una base sólida para comprender el potencial de los EDC para interferir en el desarrollo de los órganos reproductivos humanos. Las primeras investigaciones de Guillette et al. 66 examinó el desarrollo gonadal anormal en la población juvenil de caimanes del lago Apopka, Florida.
Los resultados identificaron proporciones elevadas de estrógeno/testosterona en caimanes machos y hembras expuestos a sustancias químicas xenobióticas estrogénicas (dicofol, DDT y metabolitos de DDT), provenientes de escorrentía agrícola y un derrame de una planta de fabricación de pesticidas con embriones que mostraban inversión sexual (macho a hembra).
Los caimanes juveniles machos expuestos tenían concentraciones plasmáticas de testosterona más bajas en comparación con los caimanes juveniles no expuestos, mientras que las caimanes juveniles hembras expuestas tenían folículos poliovulares elevados y ovocitos polinucleares, lo que interfirió en el crecimiento y desarrollo normal de los ovocitos centrales y periféricos. La conclusión del estudio determinó que la alteración en el desarrollo sexual (falos de tamaño anormal)66
La investigación realizada por Colborn y Clement 67 informó un crecimiento deficiente, emaciación y tasas más bajas de actividad neonatal en animales expuestos a niveles elevados de xenobióticos estrogénicos.
Semenza et al. 68 apoyó el hallazgo de una alta mortalidad en embriones y neonatos en caimanes juveniles expuestos a EDC con una disminución dramática en la población general de caimanes durante un período de siete años.
Parásitos, tratamientos naturales, hierbas y alimentos que pueden librarnos de varios tipos de parásitos: Cáscara de nuez negra, Ajenjo, Clavo de olor y otras, desontoxicación durante y post-tratamiento, como restaurar el microbioma. Más de 200 referencias científicas. Descargar aqui
Investigaciones más recientes que involucran especies de peces expuestas a EDC respaldan los estudios históricos en reptiles. La intersexualidad en los peces se ha asociado durante mucho tiempo con la exposición a efluentes de aguas residuales tratadas de industrias como las papeleras, que contienen productos químicos con capacidad estrogénica. 69
Un estudio de Jobling et al. 70 encontraron un alto grado de intersexualidad entre las poblaciones de cucarachas silvestres expuestas a efluentes de aguas residuales tratadas que contenían una mezcla de EDC.
Los peces también tenían menor volumen de esperma y densidad de esperma. El pez mosquito hembra ( Gambusia holbrooki ) expuesto a los efluentes de una fábrica de papel mostró características sexuales secundarias masculinizadas y un comportamiento reproductivo alterado que respalda aún más el impacto de los EDC en la desalineación de género. 71
Un estudio de Aravindakshan et al. 72 de pececillos manchados en el río St. Lawrence mostraron evidencia de que los machos inmaduros y los machos expuestos a xenoestrógenos estaban relacionados con una función reproductiva masculina reducida (espermatogénesis retrasada) e intersexualidad. Ortiz-Zarragoitia et al. 73 mostró un aumento en la intersexualidad masculina en la especie lisa asociada con la exposición a compuestos xenoestrogénicos durante un momento crítico en la diferenciación sexual juvenil.
Se descubrió que la exposición a los EDC de las plantas de tratamiento de aguas residuales altera los tejidos reproductivos masculinos de algunas especies, lo que hace que presenten condiciones de feminización o intersexualidad. 74 – 78
Se ha demostrado que la atrazina, un pesticida común clasificado como EDC, afecta los sistemas reproductivos de las ranas y provoca anomalías gonadales (gónadas múltiples y condiciones hermafroditas), a través de procesos de alteración endocrina. 79
Atrazina, desmasculinización y feminización de las gónadas masculinas por atrazina. La atrazina es el herbicida contaminante más comúnmente detectado en aguas subterráneas, aguas superficiales y precipitaciones. La atrazina también es un disruptor endocrino que, entre otros efectos… Por Tyrone Hayes Ph.D https://www.bitchute.com/video/R4RQa4XzuR6k/
Un estudio de Rey et al. 80 encontraron que los caimanes recién nacidos expuestos en el óvulo a la atrazina alteraron la histoarquitectura de los testículos y la organización de los túbulos seminíferos. Otras condiciones ambientales pueden aumentar el efecto de la exposición química.
La determinación del sexo dependiente de la temperatura existe en muchas especies de reptiles. Una exposición simultánea a los EDC y un cambio en el rango de temperatura y/o la duración de la exposición pueden alterar la determinación del sexo masculino o femenino, aunque el tiempo en la diferenciación gonadal depende de la especie y es muy variable. 81 , 82
El potencial sinérgico de los EDC con la temperatura fue examinado en un estudio de Olmstead y LeBlanc. 83 Se descubrió que el piriproxifeno era más activo biológicamente y causaba ginandromorfismo bilateral (dimorfismo sexual) en algunos crustáceos a medida que aumentaban las temperaturas. 83
Pyriproxyfen es un insecticida y un análogo de la hormona juvenil, que controla los ciclos de desarrollo de los insectos, evitando que las larvas se desarrollen hasta la edad adulta y deshabilitando su reproducción. 84
Diferentes alternativas han demostrado una importante actividad antiinflamatoria y antioxidante, lo que contribuye a reducir la inflamación y el daño tisular. Estas ofrecen un método complementario o alternativo para un tratamiento eficaz y seguro. En esta revisión, se toman en cuenta la seguridad y la eficacia (incluidos los resultados en cuanto al dolor y la inflamación). Descargar click aqui
Las especies acuáticas se ven muy afectadas debido a su posición única en la cadena alimentaria y la exposición acuática. También se ha confirmado la alteración del equilibrio endocrino en aves depredadoras superiores (águilas pescadoras, halcones y águilas) y mamíferos, que se alimentan de especies acuáticas.
La exposición al DDT se ha asociado directamente con la disminución de la población de aves depredadoras debido a la interferencia con la hormona responsable de la producción de cáscara de huevo. 85 – 87
La investigación de principios de la década de 1960 en la cuenca de los Grandes Lagos informó fallas reproductivas entre los peces alimentados con visones criados en granjas con altas concentraciones de compuestos organoclorados.
Las muertes fetales y las anomalías se relacionaron con los bifenilos policlorados (PCB) similares a las dioxinas y las dibenzodioxinas policloradas/dibenzofuranos policlorados (PCDD/F). 88 – 90
Un estudio longitudinal de las poblaciones de nutrias suecas que abarcó 30 años (1968-1999) mostró una relación inversa en los niveles de PCB en el medio ambiente y el éxito de las crías. 91
Investigación sobre focas grises y anilladas ( Halicorerus grypus y Phoca hispida) durante el mismo período en el Mar Báltico encontró un aumento dramático en los abortos espontáneos y la esterilidad, lo que llevó a una disminución dramática en la población de focas.
Se descubrió que las focas tenían altas concentraciones de DDT y PCB absorbidas por la ingestión de pescado contaminado. También se identificaron malformaciones de las garras y la presencia de hiperplasia de la corteza suprarrenal en las focas afectadas. 92 – 94
Se ha demostrado que los EDC causan defectos genéticos y efectos hormonales en animales domésticos, incluso en concentraciones de bajo nivel.
Un estudio de Gajezcka 95examinó los efectos de dosis bajas de zearalenona, un potente metabolito estrogénico de micotoxinas, sobre los receptores de estrógeno en los ovarios de perras Beagle prepúberes. Se descubrió que la intoxicación por zearalenona durante una etapa crítica del desarrollo provocaba hiperestrogenismo en perras prepuberales. 95
Un estudio que evaluó la lixiviación de EDC de los juguetes para perros realizado por Wooten y Smith 96 examinó si un subconjunto de ftalatos y bisfenol A (BPA) podría filtrarse de los juguetes para perros y los dispositivos de entrenamiento (parachoques) a la saliva canina.
Este compendio de estudios de expertos, contiene la suficiente evidencia para que los padres puedan presentar a sus médicos y abogados y prevenir que su hijos sean intoxicados con vacunas o inyecciones génicas que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. Click aqui para descargar este compendio
Los EDC sintéticos que se encuentran comúnmente en el plástico revelaron actividad antiandrogénica de los lixiviados de parachoques, así como actividad estrogénica tanto de los lixiviados de parachoques como de juguetes, lo que confirma el potencial de alteración endocrina en perros de compañía. 96
Investigaciones recientes que examinaron el efecto de los EDC en el ganado lechero doméstico encontraron una interrupción de los procesos reproductivos consistente con lo que se ha exhibido en las poblaciones de animales salvajes.
En un estudio de Meijer et al. 97 , el agua potable contaminada con EDC por aguas residuales mostró una disminución en la producción de leche en general, pero un aumento en la edad del primer parto. Las ovejas expuestas a pastos fertilizados con lodos de aguas residuales que contenían múltiples compuestos EDC mostraron un desarrollo testicular fetal reducido, peso testicular y perfiles hormonales alterados. 98
Las cabras expuestas a los EDC durante la gestación (PCB 125 y PCB 153) tuvieron resultados similares a los del ganado lechero doméstico, que mostraron una lactancia reducida y un inicio tardío de la pubertad. Los animales expuestos a PCB 153 mostraron un ADN dañado significativamente mayor en el esperma y niveles alterados de hormona luteinizante (LH) y testosterona en plasma. 99 – 102
También se observó una reducción de la resistencia ósea en la vida silvestre y el ganado doméstico y se pensó que se debía al aumento del contenido mineral debido a la exposición a mezclas de contaminantes de bajo nivel. 103
Los experimentos de laboratorio con roedores validaron los hallazgos de los estudios anteriores. Un estudio que examinó si el 4-terc-octilfenol (OP), un disruptor endocrino, interfería con la ciclicidad del estro en ratas recién nacidas proporcionó pruebas sólidas de que actuaba como estrógeno tanto en ratas hembra adultas como en recién nacidas. 104
Un estudio realizado por Markey et al 105 sobre los efectos del BPA en las glándulas mamarias de ratón reveló una alteración en el eje hipotalámico-pituitario-ovárico y/o expresión errónea de genes de desarrollo en ratones, lo que confirma el potencial de alteración endocrina.
El propósito principal del ganado doméstico es la producción de alimentos para el consumo humano. Muchos EDC son lipofílicos con la capacidad de bioacumularse y biomagnificarse y, por lo tanto, se retienen en productos altamente grasos como los lácteos y la carne. Por lo tanto, la exposición humana a los EDC por el consumo de productos animales es plausible y probable, aunque el efecto puede variar ampliamente, según el comportamiento de consumo, la concentración química y el momento (etapas críticas de la vida) de la exposición.
Efecto de los EDC en el desarrollo reproductivo en humanos
Investigaciones adicionales han proporcionado apoyo probatorio para la asociación entre los EDC y los efectos adversos sobre el desarrollo reproductivo tanto en hombres como en mujeres. Los trastornos reproductivos femeninos, que incluyen tasas de concepción decrecientes y menopausia latente, se han asociado con sustancias químicas ambientales capaces de imitar o bloquear las hormonas naturales. 106 , 107
El efecto que los EDC pueden tener sobre el eje hipotálamo-pituitario-gonadal femenino y la regulación e iniciación de la cascada hormonal que ocurre durante la transición de la pubertad a la edad adulta es, en el mejor de los casos, complejo y dependiente del tiempo.
El hipotálamo contiene neuronas que expresan la hormona liberadora de gonadotropina, que sintetiza la gonadotropina (GnRH) y libera las hormonas reproductivas de la glándula pituitaria, activando las gónadas.
La investigación de Bellingham et al. 108 confirmaron la capacidad de los EDC para interrumpir los neuropéptidos sensibles al estrógeno sexualmente dimórficos que estimulan la secreción de LH y la hormona estimulante del folículo, lo que afecta la neuroquímica durante el desarrollo sexual temprano. 109
Un feto o bebé expuesto a desencadenantes ambientales como los EDC durante períodos críticos del desarrollo puede no manifestar una enfermedad o disfunción biológica hasta más tarde en la vida.
El efecto de estos productos químicos a menudo se observa por primera vez durante los primeros años reproductivos cuando surgen complicaciones de la fertilidad, y también se han identificado como un factor potencial en el desarrollo de cáncer más adelante en la vida. 110
Investigación de Svechnikov et al. 111 apoyó la teoría de que el rápido aumento de los trastornos reproductivos y las variaciones genitales en los seres humanos en las últimas décadas son probablemente la causa de factores ambientales o de estilo de vida en lugar de mutaciones causadas genéticamente.
Se ha descubierto que los EDC, incluidos los pesticidas organoclorados, los bifenilos policlorados, el BPA, los ftalatos, las dioxinas y los furanos, poseen fuertes propiedades estrogénicas y antiandrogénicas. Los estudios respaldan que estos mismos químicos están asociados con trastornos reproductivos en humanos, así como con trastornos en el desarrollo y la diferenciación sexual en especies de peces y caimanes.La interrupción del sistema endocrino por los EDC en el medio ambiente ha sido confirmada a través de estudios ocupacionales de trabajadores expuestos a sustancias químicas.
En un estudio de Ratcliffe et al. 112 , los trabajadores que fumigaron campos de papaya en Hawái con dibromuro de etileno (exposición durante ±5 años) mostraron una disminución estadísticamente significativa en el recuento de espermatozoides por eyaculación y una disminución de la viabilidad y motilidad de los espermatozoides.
En los trabajadores expuestos también se encontró un aumento en la proporción de espermatozoides morfológicamente anormales, incluidos aquellos con cabezas cónicas y colas anormales. 112
Un estudio de Gaspari et al. 113, al examinar la incidencia de malformaciones genitales en recién nacidos varones franceses, encontró una asociación directa entre la exposición de los padres a plaguicidas y el desarrollo genital externo masculino anormal, incluido un aumento de criptorquidia (1,25 %), hipospadias (0,97 %), micropene (0,35 %), y trastornos del desarrollo sexual (DSD) (0,14%).
Los efectos secundarios de la vacuna contra el Sarampión, Rubeola y Paperas, SRP (MMR en EE.UU.) incluyen convulsiones, que ocurren en aproximadamente 1 de cada 640 niños vacunados, aproximadamente 5 veces más frecuentemente que las convulsiones por infección de sarampión, sepa como eximir a sus hijos de esta vacuna. Este compendio de estudios de expertos, contiene la suficiente evidencia para que los padres puedan presentar a sus médicos y abogados y prevenir que su hijos sean intoxicados con vacunas que no tienen los suficientes estudios de seguridad como corresponde. Tambien sirve para educar a los médicos sin pensamiento crítico. Descargar libro click aqui
En uno de los peores accidentes químicos industriales de la historia, la ciudad de Seveso, Italia, estuvo expuesta a altos niveles de 2,3,7,8-tetraclorodibenzo- p -dioxina (TCDD) de una liberación accidental de fabricación durante la producción química. El estudio inicial de los niños expuestos en el momento de la liberación no fue concluyente en cuanto a los efectos inmediatos en la salud distintos del cloracné; sin embargo, se observó una mayor incidencia de abortos espontáneos entre mujeres expuestas. 114
Particularmente interesante es el cambio en la proporción de sexos que ahora se observa décadas después en los niños de la generación actual, que eran niños en el momento del accidente de Seveso.
Un estudio de Mocarelli et al. 115 , encontró que los hombres expuestos a TCDD tenían una mayor proporción de sexo femenino: masculino en la descendencia, que persistió años después de la exposición de los padres.
A nivel global, esto tiene profundas implicaciones. Con la vida media de las dioxinas en la atmósfera de 21 días, las dioxinas se convierten en un factor de impacto atmosférico local, regional y global. Debido a su característica persistencia y capacidad de bioacumulación en el suelo (vida media, 9-15 años), la exposición de los humanos a las dioxinas puede provenir del consumo de carne (res, cerdo, aves y pescado) y lácteos (leche y queso) productos, así como la exposición ambiental.116
Si bien muchos productos químicos se conocen como EDC, es posible que otros productos químicos no se identifiquen actualmente como EDC, pero pueden tener una capacidad similar para la interrupción celular.

- Degradación de la proteína pico o Spike.
- Enfoque de tratamiento por el Front Line COVID-19 Critical Care Alliance
- COVID-19 Efectos a largo plazo en pacientes tratados con dióxido de cloro
CLICK ACA PARA DESCARGAR
Se ha descubierto que el disulfuro de carbono (CS 2 ) afecta la función de la hidroxilación de la enzima C21 (21-OH). La interferencia en 21-OH puede causar una disminución de la producción de cortisol y aldosterona, y un aumento de la producción de andrógenos, lo que da como resultado una pubertad de inicio temprano. 117
El mecanismo de interferencia puede ser cambios histológicos en las células corticoides suprarrenales que afectan la actividad del retículo endoplásmico o mitocondrial, los orgánulos primarios para la producción de esteroides.
Dado que cada paso en la síntesis de hormonas esteroides es catalizado por una enzima específica, incluso un ligero cambio en la actividad enzimática puede resultar en diferentes tipos o proporciones de hormonas producidas. CS 2 también tiene la capacidad de inhibir la actividad de CYP2B1 (enzima activa en el hígado responsable del metabolismo de los xenobióticos), incluso en niveles bajos.
Esto aumenta el potencial de daño hepatocelular por peroxidación de lípidos por especies reactivas de oxígeno, lo que resulta en niveles elevados de alanina transaminasa (ALT) sérica. Un metabolito de CS 2, sulfuro de carbonilo (COS), produce monóxido de carbono (CO) y sulfuro de hidrógeno (H 2 S) durante la biotransformación. H 2 S puede inhibir la respiración celular creando estrés oxidativo y cambios en la membrana microsomal, lo que contribuye al daño hepático. 118 , 119
El tetracloruro de carbono (CCl 4 ), un solvente y propulsor, es más conocido por su capacidad hepatotóxica y nefrotóxica, pero también puede alterar las vías de producción de hormonas esteroides. La activación de CCL 4 causa daño celular a la corteza suprarrenal, lo que afecta la función del cortisol. Esto da como resultado el deterioro de la actividad adrenocorticoide al competir con los sitios receptores de hormonas esteroides, lo que reduce el número de sitios receptores disponibles para la unión de hormonas esteroides y la interferencia en la secreción. 120
En respuesta al creciente cuerpo de evidencia que respalda los efectos adversos de los EDC en la salud reproductiva, un grupo de países europeos y la Organización Mundial de la Salud (OMS) establecieron la Red de Salud Reproductiva Humana y Medio Ambiente General (HURGENT) en 2013. HURGENT es una red internacional sistema de vigilancia que fomenta la colaboración y el intercambio de información en salud reproductiva y factores de riesgo ambientales entre los países europeos. El establecimiento de una red para el intercambio de datos científicos entre naciones impulsará la investigación longitudinal en salud reproductiva transgeneracional y la influencia de los factores de riesgo ambientales en la reproducción, proporcionando la capacidad de evaluar tendencias a largo plazo en toda Europa. 121
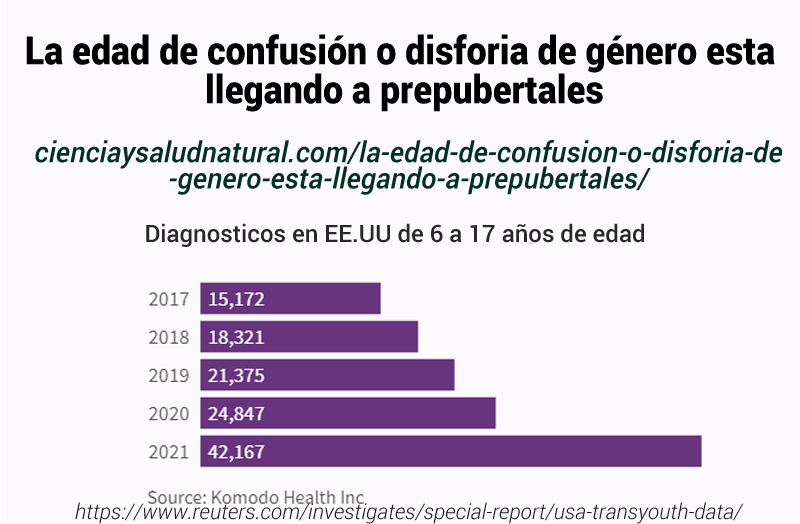
Muchos niños y niñas, al entrar en la pubertad, tienen ambigüedad de género. Los legisladores en realidad están aumentando las enfermedades psiquiátricas.Dr Peter MacCullough https://www.bitchute.com/video/KfSt5D3wxCB8/ En este video McCullough cita este estudio de https://pubmed.ncbi.nlm.nih.gov/29736809/ van der Miesen el al. «Prevalencia del deseo de ser del género opuesto en adolescentes y adultos con trastorno del espectro autista»
Conclusión
Con la creciente incidencia de variaciones de nacimientos intersexuales, existe la urgencia de comprender mejor cómo las sustancias químicas en el medio ambiente están afectando el desarrollo fetal. Identificar sustancias químicas específicas que representan el mayor riesgo durante esta ventana crítica en el desarrollo genital y cuantificar el nivel en el que son capaces de afirmar su influencia es un desafío continuo para los científicos.
Debemos tomar una decisión activa para proteger al feto de la exposición ambiental a los EDC y sus efectos adversos mientras brindamos apoyo a quienes viven con enfermedades intravenosas. A medida que aumenta la población de niños con IV y seguirá aumentando mientras produzcamos y usemos productos químicos con potencial EDC, también lo hará nuestra lucha por comprender, aceptar, proteger e integrar a las personas con IV en nuestra sociedad. Al igual que acomodar y aceptar a niños con otras necesidades especiales, es fundamental que los niños IV reciban el mismo trato, inclusión y protección.
Ver más sobre este tema:
- https://cienciaysaludnatural.com/herbicida-atrazina-hace-que-las-ranas-macho-pongan-huevos/
- https://cienciaysaludnatural.com/glifosato-autismo-y-disforia-de-genero/
- https://cienciaysaludnatural.com/bebes-afectados-por-las-mamaderas-de-plastico/
- https://cienciaysaludnatural.com/dna-de-abortos-humanos-en-vacunas-infantiles-autismo-y-disforia-de-genero/
- https://cienciaysaludnatural.com/quimicos-toxicos-en-la-leche-materna/

Descargar desde https://red.cienciaysaludnatural.com/
Colabore por favor con nosotros para que podamos incluir mas información y llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
Via PAYPAL: Euros o dólares click aqui
ARGENTINA 10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Solicite nuestro CBU contactenos
Colabore por favor con nosotros para que podamos incluir mas información y llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
Via PAYPAL: Euros o dólares click aqui
ARGENTINA 10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Solicite nuestro CBU contactenos
Referencias
1. Lee P.A., Houk C.P., Ahmed S.F., Hughes I.A., Houk A., Hughes I.A. Consensus statement on management of intersex disorders. Pediatrics. 2006; 118(2): e488–500.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
2. White P.C., Speiser P.W. Congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Endocr Rev. 2013; 21(3): 245–91.
GO TO REFERENCE Google Scholar
3. Intersex Society of North America (ISNA). What is Intersex? 2008. Available at: http://www.isna.org/faq/what_is_intersex. Accessed June 1, 2016.
GO TO REFERENCE Google Scholar
4. Crain D.A., Janssen S.J., Edwards T.M.et al. Female reproductive disorders: the roles of endocrine-disrupting compounds and development timing. Fertil Steril. 2008; 90(4): 911–40.
GO TO REFERENCE Crossref PubMed ISI
5. Fowler P.A., Bellingham M., Sinclair K.D.et al. Impact of endocrine-disrupting compounds (EDCs) on female reproductive health. Mol Cell Endocrinol. 2012; 355: 231–9.
Crossref PubMed ISI Google Scholar
6. Earl-Gray L., Wilson V.S., Stoker T.et al. Adverse effects of environmental antiandrogens and androgens on reproductive development in mammals. Int J Androl. 2006; 29(1): 96–104.
7. Zoeller R.T., Brown T.R., Doan L.L.et al. Endocrine-disrupting chemicals and public health protection: a statement of principles from The Endocrine Society. Endocrinology. 2012; 153(9): 4097–110.
Crossref PubMed ISI Google Scholar
8. Hamlin H.J., Guillette L.J. Jr. Birth defects in wildlife: the role of environmental contaminants as inducers of reproductive and developmental dysfunctions. Syst Biol Reprod Med. 2010; 56(2): 113–21.
9. Niemuth N.J., Klapper R.D. Emerging wastewater contaminant metformin causes intersex and reduced fecundity in fish. Chemosphere. 2015; 135: 38–45.
Crossref PubMed ISI Google Scholar
10. Accord Alliance (n.d.). Intersex. Available at http://www.accordalliance.org/glossary/intersex/. Accessed June 1, 2016.
GO TO REFERENCE Google Scholar
11. Lilford R.J., Dear P.R. The intersex baby. Br J Hosp Med (Lond). 1987; 37(1): 28–30.
GO TO REFERENCE ISI Google Scholar
12. World Health Organization (WHO). Gender and Genetics: Genetic Components of Sex and Gender. Available at: http://www.who.int/genomics/gender/en/index1.html. Accessed July 27, 2015.
GO TO REFERENCE Google Scholar
13. Ahmed S.F., Dobbie R., Finlayson A.R.et al. Prevalence of hypospadias and other genital anomalies among singleton births, 1988-1997, in Scotland. Arch Dis Child Fetal Neonatal Ed. 2004; 89: F149–51.
GO TO REFERENCE Crossref Google Scholar
14. Gaspari L., Paris F., Jandel C.et al. Prenatal environmental risk factors for genital malformations in a population of 1442 French male newborns: a nested case–control study. Hum Reprod. 2011; 26(11): 3155–62.
GO TO REFERENCE Crossref ISI Google Scholar
15. Svechnikov K., Stukenborg J.B., Savchuck I., Söder O. Similar causes of various reproductive disorders in early life. Asian J Androl. 2014; 16: 50–9.
GO TO REFERENCE Crossref ISI Google Scholar
16. Sharpe R. Hormones and testis development and the possible adverse effects of environmental chemicals. Toxicol Lett. 2001; 120: 221–32.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
17. Kavlock R.J., Daston G.P., DeRosa C.et al. Research needs for the assessment of health and environmental effects of endocrine disruptor: a report of the U.S. EPA-sponsored workshop. Environ Health Perspect. 1996; 104(Suppl 4): 715–40.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
18. Newbold R.R. Developmental exposure to endocrine-disrupting chemicals programs for reproductive tract alterations and obesity in later years. Am J Clin Nutr. 2011; 94(6 Supple): 1939S–42S.
19. Acerini C.L., Hughes I.A. Endocrine disrupting chemicals: a new and emerging public health problem? Arch Dis Child. 2006; 91: 633–8.
GO TO REFERENCE Crossref ISI Google Scholar
20. Laino L., Majore S., Preziosi N.et al. Disorders of sex development: a genetic study of patients in a multidisciplinary clinic. Endocr Connect. 2014; 3(4): 180–92.
GO TO REFERENCE Crossref ISI Google Scholar
21. World Health Organization (WHO). Gender and Genetics: Genetic Components of Sex and Gender. Available at: http://www.who.int/genomics/gender/en/index1.html. Accessed July 27, 2015.
GO TO REFERENCE Google Scholar
22. National Institute of Health (NIH). NIH FY 2016-2020 Strategic plan to advance research on the health and well-bring of sexual and gender minorities. Available at: http://edi.nih.gov/sites/default/files/EDI_Public_files/sgm-strate-gic-plan.pdf. Accessed October 11, 2015.
23. Hughes I.A. Disorders of sex development: a new definition and classification. Best Pract Res Clin Endocrinol Metab. 2008; 22(1): 119–34.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
24. Öcal B., Berberoğlu M., Siklar Z.et al. Clinical review of 95 patients with 46, XX disorders of sex development based on the New Chicago classification. J Pediatr Adolesc Gyneco. 2015; 28(1): 6–11.
GO TO REFERENCE Crossref ISI Google Scholar
25. Speiser P.W., Azziz R., Baskin L.S.et al. Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2010; 95(9): 4133–60.
Crossref PubMed ISI Google Scholar
26. Frisén L., Nordenström A., Falhammar H.et al. Gender role behavior, sexuality, and psychosocial adaptation in women with congenital adrenal hyperplasia due to CYP21 A2 deficiency. J Clin Endocrinol Metab. 2009; 94(9): 3432–9.
27. Erdoğan S., Kara C., Uçaktürk A., Aydin M. Etiological classification and clinical assessment of children and adolescents with disorders of sex development. J Clin Res Pediatr Endocrinol. 2011; 3(2): 77–83.
28. Kousta E., Papathanasiou A., Skordis N. Sex determination and disorders of sex development according to the revised nomenclature and classification in 46, XX individuals. Hormones. 2010; 9(3): 218–31.
GO TO REFERENCE Crossref Google Scholar
29. Frisén L., Nordenström A., Falhammar H.et al. Gender role behaviour, sexuality, and psychosocial adaptation in women and congenital adrenal hyperplasia due to CYP21 A2 deficiency. J Clin Endocrinol Metab. 2009; 94(9): 3432–9.
GO TO REFERENCE Crossref ISI Google Scholar
30. Liang H.Y., Chang H.L., Chen C.Y., Chang P.Y., Lo F.S., Lee L.W. Psychiatric manifestation in young females with congenital adrenal hyperplasia in Taiwan. Chang Gung Med J. 2008; 31: 66–73.
GO TO REFERENCE Google Scholar
31. Blackless M., Charuvastra A., Derryck A., Fausto-Sterling A., Lauzanne K., Lee E. How sexually dimorphic are we? Review and synthesis. Am J Hum Biol. 2000; 12: 151–66.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
32. NTP (National Toxicology Program). Final report of the endocrine disruptors low-dose peer review panel. Endocrine Disruptors Low-Dose Peer Review. Research Triangle Park: NTP; 2003. Available at: http://ntp.niehs.nih.gov/ntp/htdocs/liason/lowdosepeerfinalrpt.pdf Accessed March, 22, 2016.
GO TO REFERENCE Google Scholar
33. Vom Saal F.S., Timms B.G., Montano M.M.et al. Prostate enlargement in mice due to fetal exposure to low doses of estradiol or diethylstilbestrol and opposite effects at high doses. Proc Natl Acad Sci USA. 1997; 94: 2056–62.
Crossref PubMed ISI Google Scholar
34. Palanza P., Howdeshell K.L., Parmigiani S., vom Saal F.S. Exposure to a low dose of Bisphenol A during fetal life or in adulthood alters material behavior in mice. Env Health Perspect. 2002; 110(Suppl 3): 415–22.
35. Zoeller R.T., Brown T.R., Doan L.L.et al. Endocrine-disrupting chemicals and public health protection: a statement of principles from The Endocrine Society. Endocrinology. 2012; 153(9): 4097–110.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
36. Ostby J., Monosson E., Kelce W.R., Gray L.E. Jr. Environmental antiandrogens: low doses of the fungicide vinclozolin alter sexual differentiation of the male rate. Toxicol Ind Health. 1999; 15: 48–64.
Crossref PubMed ISI Google Scholar
37. Prener A., Engholm G., Jensen O.M. Genital anomalies and risk for testicular cancer in Danish men. Epidemiology. 1996; 7(1): 14–9.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
38. Wang M.H., Baskin L.S. Endocrine disruptors, genital development, and hypospadias. J Androl. 2008; 29(5): 499–505.
GO TO REFERENCE Crossref PubMed Google Scholar
39. Newbold R.R. Developmental exposure to endocrine-disrupting chemicals programs for reproductive tract alterations and obesity in later years. Am J Clin Nutr. 2011; 94(6 supple): 1939S–42S.
GO TO REFERENCE Crossref ISI Google Scholar
40. Skakkebaek N.E., Rajpert-De Meyts E., Main K.M. Testicular dysgenesis syndrome: an increasingly common developmental disorder with environmental aspects: opinion. Hum Reprod. 2001; 16(5): 972–8.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
41. Bartman T., Hove J. Mechanics and function in heart morphogenesis. Dev Dyn. 2005; 233: 373–81.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
42. Anderson R.H., Webb S., Brown N.A., Lamers W., Moorman A. Development of the heart: (3) formations of the ventricular outflow tracts, arterial valves and intrapericardial arterial trunks. Heart. 2003; 9(9): 1110–8.
43. Costa V.M., Carvalho F., Duarte J.A., de Lourdes Bastos M., Remião F. The heart as a target for xenobiotic toxicity: the cardiac susceptibility to oxidative stress. Chem Res Toxicol. 2013; 26: 1285–311.
44. Korones S. Anatomic aspects of fetal development. Glob Libr Womens Med. 2008: 1–22.
45. Rauhut-Klaban M., Bruska M., Woźniak W. Early trabeculation and close of the interventricular foramen in staged human embryos. Folia Morphol. 2008; 67(1): 13–8.
46. Anderson R.H., Webb S., Brown N.A., Lamers W., Moorman A. Development of the heart: (3) formations of the ventricular outflow tracts, arterial valves and intrapericardial arterial trunks. Heart. 2003; 9(9): 1110–8.
GO TO REFERENCE Crossref Google Scholar
47. Artamonova G.V., Shapovlova E.B., Maksimov S.A., Skripchenko A.E., Ogarkov Mlu. The environment as a risk factor for coronary heart disease in urbanized regions with developed chemical industry. Kardiologiia. 2012; 52(10): 86–90.
GO TO REFERENCE ISI Google Scholar
48. Thornton P.S., Satin-Smith M.S., Glaser H.K.et al. Familial hyperinsulism with apparent autosomal dominant inheritance: clinical and genetic differences from the autosomal recessive variant. J Pediatr. 1998; 132(1): 9–14.
49. Costa V.M., Carvalho F., Duarte J.A., de Lourdes Bastos M., Remião F. The heart as a target for xenobiotic toxicity: the cardiac susceptibility to oxidative stress. Chem Res Toxicol. 2013; 26: 1285–311.
50. Gorini F., Chiappi E., Gargani L., Picano E. Potential effects of environmental chemical contamination in congenital heart disease. Pediatr Cardiol. 2014; 35: 559–68.
GO TO REFERENCE Crossref ISI Google Scholar
51. Gorlin R.J., Kantaputra P., Aughton D.J., Julliken J.B. Marked female predilection in some syndromes associate with facial hemangiomas. Am J Med Genet. 1994; 52: 130–5.
GO TO REFERENCE Crossref ISI Google Scholar
52. Ermito S., Dinatale A., Carrara S., Cavaliere A., Imbruglia L., Recupero S. Prenatal diagnosis of limb abnormalities: role of fetal ultrasonography. J Prenat Med. 2009; 3(2): 18–22.
53. Lingaiah K., Parshwanath B.A., Mysore S.R., Krishnamurthy B., Ramachandra N.B. A rare case of congential heart disease with ambiguous genitalia. Indian J Hum Genet. 2010; 16(3): 166–8.
GO TO REFERENCE Crossref Google Scholar
54. Low Y., Deshpande A.V., Hutson J.M. Lethal comorbidity with genital anomaly in the infant. J Pediatr Urol. 2006; 2(6): 534–8.
GO TO REFERENCE Crossref Google Scholar
55. Bondy C.A., Ceniceros I., Van P.L., Bakalov V.K., Rosing D.R. Prolonged rate-corrected QT interval and other electrocardiogram abnormalities in girls with Turner Syndrome. Pediatrics. 2006; 118(4): e1220–5.
GO TO REFERENCE Crossref ISI Google Scholar
56. Lippe B. Turner syndrome. Endocrinol Metab Clin North Am. 1991; 20: 121–52.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
57. Davenport M.L. Approach to the patient with Turner Syndrome. J Clin Endocrinol Metab. 2010; 95: 1487–95.
Crossref PubMed ISI Google Scholar
58. Stenberg A.E., Nylen O., Windh M., Hultcrantz M. Otological problems in children with Turner’s syndrome. Hear Res. 1998; 124(1-2): 85–90.
GO TO REFERENCE Crossref ISI Google Scholar
59. Bondy C.A., Ceniceros I., Van P.L., Bakalov V.K., Rosing D.R. Prolonged rate-corrected QT interval and other electrocardiogram abnormalities in girls with Turner Syndrome. Pediatrics. 2006; 118(4): e1220–5.
60. Bolar K., Hoffman A.R., Maneatis T., Lippe B. Long-term safety of recombinant human growth hormone in turner syndrome. J Clin Endocrinol Metab. 2008; 93(2): 344–51.
GO TO REFERENCE Crossref ISI Google Scholar
61. Low Y., Deshpande A.V., Hutson J.M. Lethal comorbidity with genital anomaly in the infant. J Pediatr Urol. 2006; 2(6): 534–8.
GO TO REFERENCE Crossref Google Scholar
62. Liang H.Y., Chang H.L., Chen C.Y., Chang P.Y., Lo F.S., Lee L.W. Psychiatric manifestation in young females with congenital adrenal hyperplasia in Taiwan. Chang Gung Med J. 2008; 31: 66–73.
GO TO REFERENCE Google Scholar
63. Fausto-Sterling A. The dynamic development of gender variability. J Homosex. 2012; 59: 398–421.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
64. Laino L., Majore S., Presiosi N.et al. Disorders of sex development: a genetic study of patients in a multidisciplinary clinic. Endocr Connect. 2014; 3(4): 180–192.
GO TO REFERENCE Crossref ISI Google Scholar
65. The American Psychiatric Association. Gender Dysphoria. 2013. Available at: http://www.dsm5.org/documents/genderdysphoriafactsheet.pdf. Accessed April 13, 2016.
GO TO REFERENCE Google Scholar
66. Guillette L.J. Jr., Gross T.S., Masson G.R., Matter J.M., Percival H.F., Woodward A.R. Developmental abnormalities of the gonad and abnormal sex hormone concentrations in juvenile alligators from contaminated and control lakes in Florida. Environ Health Perspect. 1994; 102: 680–8.
Crossref PubMed ISI Google Scholar
67. Colborn T., Clement C., eds. Chemically Induced Alterations in Sexual and Functional Development: The Wildlife/Human Connection. Princeton, NJ: Princeton Scientific Pub. Co.; 1992.
GO TO REFERENCE Google Scholar
68. Semenza J.C., Tolbert P.E., Rubin C.H., Guillette L.J. Jr., Jackson R.J. Reproductive toxins and alligator abnormalities at Lake Apopka, Florida. Environ Health Perspect. 1997; 105(10): 1030–2.
GO TO REFERENCE Crossref ISI Google Scholar
69. Bortone S.A., Davis W.P. Fish intersexuality as indicator of environmental stress. Bioscience. 1994: 165–72.
GO TO REFERENCE Crossref ISI Google Scholar
70. Jobling S., Beresford N., Nolan M.et al. Altered sexual maturation and gamete production in wild roach (Rutilus rutilus) living in rivers that receive treated sewage effluents. Biol Reprod. 2002; 66(2): 272–81.
GO TO REFERENCE Crossref ISI Google Scholar
71. Parks L.G., Lambright C.S., Orlando E.F., Guilette L.J. Jr., Ankley G.T., Gray L.E. Jr. Masculinization of female mosquitofish in Kraft Mill effluent-contaminated Fenholloway River water is associated with androgen receptor agonist activity. Toxicol Sci. 2001; 62: 257–67.
GO TO REFERENCE Crossref ISI Google Scholar
72. Aravindakshan J., Paquet V., Gregory M.et al. Consequences of xenoestrogen exposure on male reproductive function in spottail shiners (Notropis hudsonius). Toxicol Sci. 2004; 78: 156–65.
GO TO REFERENCE Crossref ISI Google Scholar
73. Ortiz-Zarragoitia M., Bizarro C., Rojo-Bartolomé I., de Cerio O.D., Cajaraville M.P., Cancio I. Mugilid fish are sentinels of exposure to endocrine disrupting compounds in coastal and estuarine environments. Mar Drugs. 2014; 12(9): 4756–82.
GO TO REFERENCE Crossref ISI Google Scholar
74. Niemuth N.J., Klapper R.D. Emerging wastewater contaminant metformin causes intersex and reduced fecundity in fish. Chemosphere. 2015; 135: 38–45.
GO TO REFERENCE rossref PubMed ISI Google Scholar
75. Jobling S., Burn R.W., Thorpe K., Williams R., Tyler C. Statistical modeling suggest that antiandrogens in effluents from wastewater treatment works contribute to widespread sexual disruption in fish living in English rivers. Environ Health Perspect. 2009; 117: 797–802.
76. Blazer V.S., Iwanowica L.R., Henderson H.et al. Reproductive endocrine disruption in small mouth bass (Micropterus dolomieu) in the Potomac River base: spatial and temporal comparisons of biological effects. Environ Monit Assess. 2012; 184: 4309–34.
77. Bjerregaard L.B., Korsgaard B., Bjerregaard P. Intersex in wild roach (Rutilus rutilus) from Danish sewage effluent-receiving streams. Ecotoxicol Environ Saf. 2006; 64: 321–8.
78. Jobling S., Burn R.W., Thorpe K., Williams R., Tyler C. Statistical modeling suggest that antiandrogens in effluents from wastewater treatment works contribute to widespread sexual disruption in fish living in English rivers. Environ Health Perspect. 2009; 117: 797–802.
GO TO REFERENCE Crossref ISI Google Scholar
79. Hayes T.B., Collins A., Lee M.et al. Hermaphroditic, demasculinized frogs after exposure to the herbicide atrazine at low ecologically relevant doses. Proc Natl Acad Sci USA. 2002; 99(8): 5476–80.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
80. Rey F., González M., Zayas M.A.et al. Prenatal exposure to pesticides disrupts testicular histoarchitecture and alters testosterone levels in male Caiman latirostris. Gen Comp Endocrinol. 2009; 162(3): 286–92.
GO TO REFERENCE Crossref ISI Google Scholar
81. Merchant-Larios H., Díaz-Hernández V. Environmental sex determination mechanisms in reptiles. Sex Dev. 2013; 7: 95–102.
GO TO REFERENCE Crossref ISI Google Scholar
82. Kohno S., Parrott B.B., Yatsu R.et al. Gonadal differentiation in reptiles exhibiting environmental sex determination. Sex Dex. 2015; 8: 208–26.
GO TO REFERENCE Crossref ISI Google Scholar
83. Olmstead A.W., LeBlanc G.A. The environmental-endocrine basis of gynandromorphism (intersex) in a crustacean. Int J Biol Sci. 2007; 3(2): 77–84.
84. Sullivan J. Environmental fate of pyriproxyfen (white paper); 2002. Available at: www.cdpr.ca.gov/docs/emon/pubs/fatememo/pyrprxfn.pdf. Accessed July 27, 2015.
GO TO REFERENCE Google Scholar
85. Grove R.A., Henny C.J., Kaiser J.L. Osprey: worldwide sentinel species for assessing and monitoring environmental contamination in rivers, lakes, reservoirs and estuaries. As levels of DDE increased research showed a direct correlation to chick survival and reproductive success in predator birds. J Toxicol Environ Health B Crit Rev. 2009; 12(1): 25–44.
GO TO REFERENCE ISI Google Scholar
86. Blus L.J., Henny C.J. Field studies on pesticides and birds: unexpected and unique relations. Ecol Appl. 1997; 7(4): 1125–32.
87. Bouwman H., Polder A., Venter B., Skaare J.U. Organochlorine contaminants in cormorant, darter, egret and ibis eggs from South Africa. Chemosphere. 2008; 71(2): 227–41.
GO TO REFERENCE Crossref ISI Google Scholar
88. Wren C.D. Cause-effect linkages between chemicals and populations of mink (Mustela vison) and otter (Lutra canadensiss) in the Great Lakes Basin. J Toxicol Environ Health. 1991; 33: 549–85.
GO TO REFERENCE Crossref Google Scholar
89. Brunstrom B., Lund B.O., Bergman A.et al. Reproductive toxicity in mink (Mustel vison) chronically exposed to environmentally relevant polychlorinated biphenyl concentrations. Environ Toxicol Chem. 2001; 20: 2318–27.
90. Gisey J.P., Verbrugge D.A., Othout R.A.et al. Contaminants in fish from Great Lakes-influenced sections and above dams of three Michigan rivers: II: implications for health of mink. Arch Environ Contam Toxicol. 1994; 27: 213–23.
GO TO REFERENCE ISI Google Scholar
91. Roos A., Greyerz E., Olsson M., Sandegren F. The otter (Lutra lutra) in Sweden – population trends in relation to DDT and total PCB concentrations during 1968-99. Environ Poll. 2001; 111: 457–69.
GO TO REFERENCE Crossref ISI Google Scholar
92. De Wit C.A. Effects of endocrine disrupters in wild birds and mammals. In: Grotmol T., Bernhoft A., Eriksen G.S., Flaten T.P., eds. Endocrine Disrupters. Oslo: The Norwegian Academy of Science and Letters; 2006. Available at: http://www.dnva.no/binfil/download.php?tid=48846. Accessed May 21, 2016.
GO TO REFERENCE Google Scholar
93. Helle E., Olsson M., Jensen S. DDT and PCB levels and reproduction in ringed seal from the Bothnian Bay. Ambio. 1976; 5: 188–9.
94. Olsson M., Andersson Ö, Bergman ÄÄ, Blomkvist G., Frank A., Rappe C. Contaminants and diseases in seals from Swedish waters. Ambio. 1992; 21: 561–2.
GO TO REFERENCE ISI Google Scholar
95. Gajezcka M. The effects of experimental administration of low doses of zearalenone on the histology of ovaries in pre-pubertal bitches. Pol J Vet Sci. 2012; 15(4): 685–91.
96. Wooten K.J., Smith P.N. Canine toys and training devices as sources of exposure to phthalates and bisphenol A: quantitation of chemicals in leachate and in vitro screening for endocrine activity. Chemosphere. 2013; 93: 2245–53.
97. Meijer G.A.S., deBree J.A., Wagenaar J.A., Spoelstra S.F. Sewer gas overflows put production and fertility of dairy cows at risk. J Environ Qual. 1999; 28: 1381–3.
GO TO REFERENCE Crossref ISI Google Scholar
98. Rhind S.M. Are endocrine disrupting compounds a threat to farm animal health. Welfare and productivity? Repro Dom Anim. 2005; 40: 282–90.
GO TO REFERENCE Crossref ISI Google Scholar
99. Hyder S.M., Kirkland J.L., Loose-Mitchell D.S., Makela S., Stancel G.M. Differential regulation of gene expression by oestrogenic ligands: a potential basis for the toxicity of environmental oestrogens. In: Naz R.K., ed. Endocrine Disrupters’: Effects on Male and Female Reproductive Systems. Boca Raton: CRC Press; 1999: 165–86.
GO TO REFERENCE Google Scholar
100. Lyche J.L., Skaare J.U., Larsen H.J.S., Ropstad E. Levels of PCB 126 and PCB 153 in plasma and tissues in goats exposed during gestation and lactation. Chemosphere. 2004; 55: 621–9.
101. Lyche J.L., Larsen H.J.S., Skaare J.U.et al. Effects of perinatal exposure to low doses of PCB 153 and PCB 126 on lymphocyte proliferation and hematology in goat kids. J Toxicol Environ Health A. 2004; 67: 889–904.
102. Oskam I.C., Lyche J.L., Frogenaes A.et al. Effects of long-term maternal exposure to low doses of PCB126 and PCB 153 on the reproductive system and related hormones of young male goats. Reproduction. 2005; 130: 731–42.
GO TO REFERENCE Crossref ISI Google Scholar
103. Rhind S.M., Evans N.P., Bellingham M.et al. Effects on environmental pollutants on the reproduction and welfare of ruminants. Animal. 2010; 4(7): 1227–39.
GO TO REFERENCE Crossref ISI Google Scholar
104. Blake C.A., Ashiru O.A. Disruption of rat estrous cyclicity by the environmental estrogen 4-tert-octylphenol. Proc Soc Exp Biol Med. 1997; 216(3): 446–51.
GO TO REFERENCE Crossref ISI Google Scholar
105. Markey C.M., Luque E.H., Munoz de Toro M., Sonnenschein C. In utero exposure to bisphenol-A alters the development and tissue organization of the mouse mammary gland. Biol Reprod. 2001; 64: 1215–23.
GO TO REFERENCE Crossref ISI Google Scholar
106. McLachlan J.A., Simpson E., Martin M. Endocrine disrupters and female reproductive health. Best Pract Res Clin Endocrinol Metab. 2006; 20(1): 63–75.
GO TO REFERENCE Crossref ISI Google Scholar
107. Crain D.A., Janssen S.J., Edwards T.M.et al. Female reproductive disorders: the roles of endocrine-disrupting compounds and development timing. Fertil Steril. 2008; 90(4): 911–40.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
108. Bellingham M., Fowler P.A., Amezaga M.R.et al. Foetal hypothalamic and pituitary expression of gonadotrophin-releasing hormone and galanin systems is disturbed by exposure to sewage sludge chemicals via maternal ingestion. J Neuroendocrinol. 2010; 22: 527–33.
GO TO REFERENCE Crossref ISI Google Scholar
109. Fowler P.A., Bellingham M., Sinclair K.D.et al. Impact of endocrine-disrupting compounds (EDCs) on female reproductive health. Mol Cell Endocrinol. 2012; 355: 231–9.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
110. Dickerson S.M., Gore A.C. Estrogenic environmental endocrine-disrupting chemical effects on reproductive neuroendocrine function and dysfunction across the life-cycle. Rev Endocr Metab Disorder. 2007; 8: 143–59.
GO TO REFERENCE Crossref PubMed ISI Google Scholar
111. Svechnikov K., Stukenborg J.B., Savchuck I., Söder O. Similar causes of various reproductive disorders in early life. Asian J Androl. 2014; 16: 50–9.
GO TO REFERENCE Crossref ISI Google Scholar
112. Ratcliffe J.M., Schrader S.M., Steenland K., Clapp D.E., Turner T., Hornung R.W. Semen quality in papaya workers with long term exposure to ethylene dibromide. Br J Ind Med. 1987; 44(5): 317–26.
113. Gaspari L., Paris F., Jandel C.et al. Prenatal environmental risk factors for genital malformations in a population of 1442 French male newborns: a nested case–control study. Hum Reprod. 2011; 26(11): 3155–62.
GO TO REFERENCE Crossref ISI Google Scholar
114. Bertazzi P.A., Bernucci I., Brambilla G., Consonni D., Pesatori A.C. The Seveso studies on early and long-term effects of Dioxin exposure: a review. Environ Health Perspect. 1998; 106(Suppl 2): 625–33.
GO TO REFERENCE Google Scholar
115. Mocarelli P., Gerthoux P.M., Ferrari E.et al. Paternal concentration of dioxin and sex ratio of offspring. Lancet. 2000; 355: 1858–63.
GO TO REFERENCE Crossref ISI Google Scholar
116. U.S. Environmental Protection Agency. Dioxins and Furans. Available at: http://www.epa.gov/pbt/pubs/dioxins.htm. Updated April 18, 2011. Accessed July 21, 2015.
GO TO REFERENCE Google Scholar
117. White P.C., Speiser P.W. Congenital adrenal hyperplasia due to 21-hydroxylas deficiency. Endocr Rev. 2013; 21(3): 245–91.
GO TO REFERENCE Google Scholar
118. Chapin C.C. In: Klaassen C.D., ed. Toxic Responses of the Endocrine Systems. Casarett & Doull’s Toxicology: The Basic Science of Poisons. 6th ed. New York, NY: McGraw-Hill Companies, Inc; 2001: 719–23.
GO TO REFERENCE Google Scholar
119. Dalvi P.S., Dalvi R.R., Billups L.H. Potentiation of the hepatic toxicity of carbon disulfide by chlordane. Toxico Int. 2013; 20: 132–7.
GO TO REFERENCE Crossref Google Scholar
120. Chapin C.C. In: Klaassen C.D., ed. Casarett & Doull’s Toxicology: The Basic Science of Poisons. 6th ed. New York, NY: McGraw-Hill Companies, Inc; 2001: 719–23.
GO TO REFERENCE Google Scholar
121. Le Moal J., Sharpe R.M., Jorgensen N.et al. Toward a multi-country monitoring system of reproductive health in the context of endocrine disrupting chemical exposure. Eur J Public Health. 2016; 26(1): 76–83.
GO TO REFERENCE Crossref ISI Google Scholar
122. World Health Organization (WHO) Genomic Resource Centre. Gender and Genetics. Available at: http://www.who.int/genomics/gender/en. Accessed March 21, 2016.
GO TO REFERENCE Google Scholar
123. Allen C. It’s a boy! Gender expectations intrude on the study of sex determination. DNA Cell Biol. 2006; 26(10): 699–705.
GO TO REFERENCE Crossref ISI Google Scholar
124. Bodenhausen G. Diversity in the person, diversity in the group: challenges of identity complexity for social perception and social interaction. Eur J Soc Psychol. 2010; 40: 1–16.
GO TO REFERENCE ISI Google Scholar
125. Allen C. It’s a boy! Gender expectations intrude on the study of sex determination. DNA Cell Biol. 2006; 26(10): 699–705.
126. World Health Organization (WHO). Sexual and reproductive health: eliminating forced, coercive and otherwise involuntary sterilization. Available at: http://www.who.int/reproductivehealth/publications/gender_rights/eliminating-forced-sterilization. Accessed February 17, 2016.
127. United Nations General Assembly. Human Rights Council, 22nd Session: report of the Special rapporteur on torture and other cruel, inhuman or degrading treatment or punishment. 2013. Available at: http://www.ohchr.org/Documents/HRBodies/HRCouncil/RegularSession/Session22/A.HRC.22.53_English.pdf. Accessed February 10, 2016.
128. Rupprecht M. Childrens’ right to physical integrity. Parliamentary Assembly Council of Europe Report: Committee on Social Affairs, Health and Sustainability Development Doc. 13297. 2013. Available at: http://assembly.coe.int/nw/xml/XRef/X2H-Xref-ViewPDF.asp?FileID=20057&.lang=en. Accessed February 17, 2016.
GO TO REFERENCE Google Scholar
129. Australian Parliament. Second report: involuntary and coerced sterilization of intersex people in Australia. 2013. Available at: http://www.aph.gov.au/Parliamentary_Business/Committees/Senate/Community_Affairs/Involuntary_Sterilisation/Sec_Report/index. Accessed February 06, 2016.
GO TO REFERENCE Google Scholar
130. Wiesemann C., Ude-Koeller S., Sinnecker G.H., Thyen U. Ethical principles and recommendations for the medical management of differences of sex development (DSD)/intersex in children and adolescents. Eur J Pediatr. 2010; 169(6): 671–9.