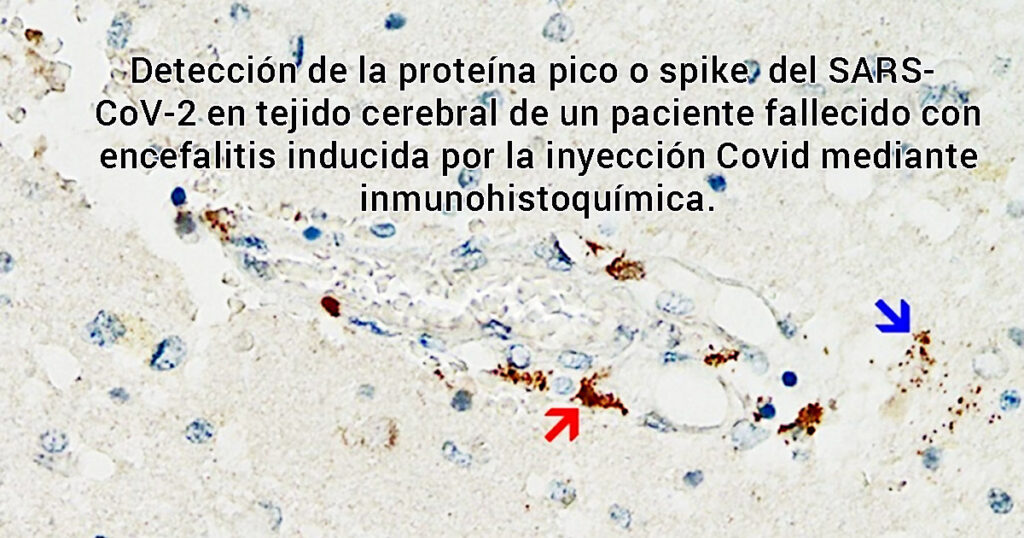
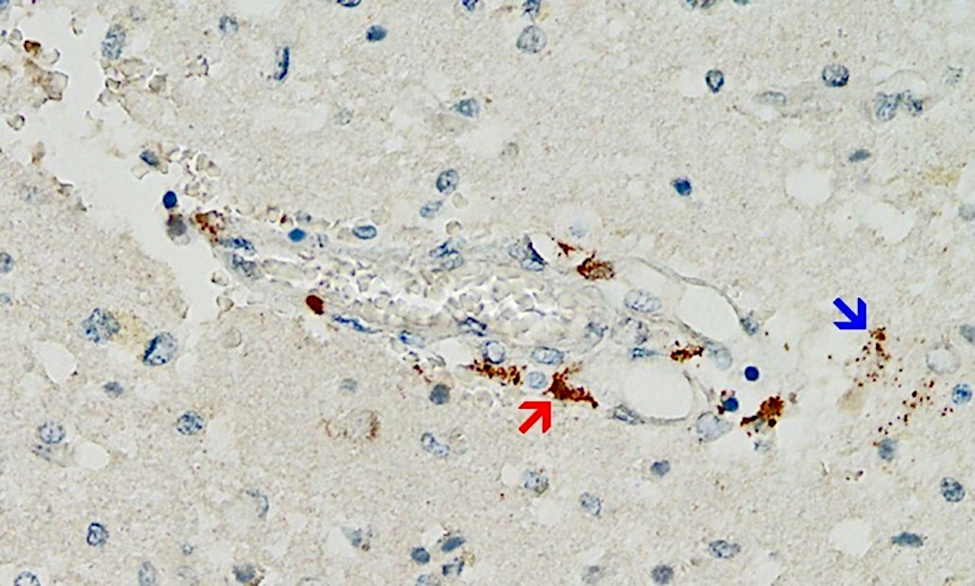
Detección de proteína pico Spike de SARS-CoV-2 en tejido cerebral de un paciente fallecido con encefalitis inducida por inyección mal llamada «vacuna», mediante inmunohistoquímica. Los depósitos de pigmento marrón indican la presencia de proteína espiga dentro de la pared de un vaso sanguíneo pequeño (flecha roja) y dentro de varias células gliales del tejido cerebral circundante (flecha azul). Fotografía tomada de Mörz [25]. https://doctors4covidethics.org/mrna-vaccines-against-covid-19-und-their-effects-on-the-central-nervous-system/
por Michael Palmer, MD, actualización sobre la distribución, persistencia y expresión de la vacuna Mrna⧸Lnp https://www.bitchute.com/video/PrPt6noNEooM/
Estudios mencionados en este video:
1. Boettler, T. et al. (2022) SARS-CoV-2 vaccination can elicit a CD8 T-cell dominant hepatitis. J. Hepatol. 77:653-659
2. Fertig, T.E. et al. (2022) Vaccine mRNA Can Be Detected in Blood at 15 Days Post-Vaccination. Biomedicines 10:1538
3. Magen, E. et al. (2022) Clinical and Molecular Characterization of a Rare Case of BNT162b2 mRNA COVID-19 Vaccine-Associated Myositis. Vaccines 10
4. Martin-Navarro, L. et al. (2022) In situ detection of vaccine mRNA in the cytoplasm of hepatocytes during COVID19 vaccine-related hepatitis. J. Hepatol. DOI:10.1016/j.jhep.2022.08.039
5.Mörz, M. (2022) A Case Report: Multifocal Necrotizing Encephalitis and Myocarditis after BNT162b2 mRNA Vaccination against Covid-19. Vaccines 10:2022060308
6. RÃķltgen, K. et al. (2022) Immune imprinting, breadth of variant recognition and germinal center response in human SARS-CoV-2 infection and vaccination. Cell DOI:10.1016/j.cell.2022.01.018
7. Bansal, S. et al. (2021) Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer-BioNTech) Vaccination prior to Development of Antibodies: A Novel Mechanism for Immune Activation by mRNA Vaccines. J. Immunol. 207:2405-2410
8. Choi, S. et al. (2021) Myocarditis-induced Sudden Death after BNT162b2 mRNA COVID-19 Vaccination in Korea: Case Report Focusing on Histopathological Findings. J. Korean Med. Sci. 36:e286
9. Vuille-Lessard, E. et al. (2021) Autoimmune hepatitis triggered by SARS-CoV-2 vaccination. J. Autoimmun. 123:102710
10. Bruininks, B.M. et al. (2020) A molecular view on the escape of lipoplexed DNA from the endosome. Elife 9
11. Feng, Z. et al. (2020) Detection of the SARS-CoV-2 Nucleocaspid Protein (NP) Using Immunohistochemistry. Bio Protoc. 10
12. Francia, V. et al. (2020) The Biomolecular Corona of Lipid Nanoparticles for Gene Therapy. Bioconjug. Chem. 31:2046-2059
13. Anonymous, (2020) SARS-CoV-2 mRNA Vaccine (BNT162, PF-07302048) 2.6.4 Summary statement of the pharmacokinetic study [English translation].
14. Huang, Q. et al. (2006) Preparation of a chimeric armored RNA as a versatile calibrator for multiple virus assays. Clin. Chem. 52:1446-8
Inyecciones de ARNm contra COVID-19 y sus efectos en el sistema nervioso central
Michael Palmer, MD y Sucharit Bhakdi, MD
Este documento fue escrito para responder a tres preguntas que nos hizo un abogado que cuestiona las aprobaciones y los mandatos de la inyección COVID-19 en su país de origen. Las respuestas también pueden ser de interés para los lectores de este sitio web.
1. ¿Qué evidencia está disponible actualmente para mostrar que las partículas de la inyección de ARNm cruzan la barrera hematoencefálica?
Esta pregunta no ha sido estudiada rigurosamente en humanos o animales. A continuación se presenta una descripción general de la limitada evidencia disponible.
1.1. Pruebas en animales con inyecciones modelo
Tanto Pfizer [ 1 ] como Moderna [ 2 ] han realizado estudios en animales con inyecciones modelo que contenían los mismos lípidos que las respectivas inyecciones contra la COVID-19, pero diferentes ARNm. En ambos casos, también se encontraron componentes de estas inyecciones modelo en el tejido cerebral; Pfizer detectó el componente lipídico y Moderna detectó el ARNm. En ambos casos, las concentraciones en el tejido cerebral fueron significativamente más bajas que las de la sangre. Sin embargo, como quedará claro a continuación, estos hallazgos no significan que estas inyecciones no dañarán el cerebro.
1.2. Sobre el mecanismo de transporte a través de la barrera hematoencefálica
In vivo, las nanopartículas lipídicas del tipo utilizado en las inyecciones de Pfizer y Moderna adquirirán una “corona biomolecular”, es decir, una capa exterior formada por las propias proteínas del cuerpo. Con este recubrimiento, se comportan de manera similar a las partículas transportadoras de grasa naturales del cuerpo, las lipoproteínas . La captación celular de las nanopartículas lipídicas y su transporte a través de la barrera hematoencefálica están mediados en particular por el recubrimiento con las proteínas ApoB y ApoE [ 3 , 4 ] , que también cumplen el mismo propósito con las lipoproteínas del propio cuerpo.
1.3. ¿Puede la proteína espiga o spike afectar el transporte a través de la barrera hematoencefálica?
Si bien las nanopartículas de lípidos son importantes, no se debe pasar por alto un posible papel del ARNm contenido en la inyección. Se sabe que la proteína espiga del SARS-CoV-2 puede afectar la función de la barrera hematoencefálica [ 5 – 8 ]. Muy posiblemente, las partículas de la inyección pueden ser absorbidas inicialmente por células fuera del cerebro, que luego producen y liberan proteína de punta en el torrente sanguíneo. Esta proteína de pico circulante podría actuar sobre la barrera hematoencefálica y facilitar el paso de más partículas de inyección al tejido cerebral. Por lo tanto, habría sido muy importante realizar estos estudios en animales con las inyecciones COVID-19 reales en lugar de solo con inyecciones modelo. Esto no habría sido particularmente difícil desde un punto de vista técnico. Con toda probabilidad, los fabricantes realizaron estos estudios, pero optaron por mantener los resultados en el gabinete de veneno, o se saltearon deliberadamente estos experimentos para evitar el riesgo de obtener resultados desfavorables para ellos.
1.4. Barrera hematoencefálica e inyecciones de refuerzo
La barrera hematoencefálica consta de dos capas de células: el endotelio de los pequeños vasos sanguíneos forma la capa interna y las células gliales del tejido cerebral circundante forman la capa externa. Es bien sabido que la barrera hematoencefálica se vuelve permeable durante la inflamación. Hasta que se demuestre lo contrario, se debe suponer que esto también se aplica a la inflamación de los vasos sanguíneos (vasculitis) en el cerebro que fue inducida por las inyecciones de ARNm; que estas inyecciones de hecho causan varias formas de vasculitis ahora está ampliamente documentado en la literatura [ 9 – 14 ] .
En este contexto, parece probable que la primera inyección de una inyección de ARNm provoque inflamación de los vasos cerebrales, lo que ablandaría la barrera hematoencefálica. Las partículas de inyección aplicadas con la segunda inyección podrían pasar sin obstáculos al tejido cerebral. Por lo tanto, no es suficiente investigar el transporte de inyecciones de ARNm a través de la barrera hematoencefálica solo después de una sola inyección, como hicieron Pfizer y Moderna en sus experimentos con animales; en cambio, el transporte también debería haberse medido después de inyecciones repetidas.
1.5. Inyección intravenosa accidental de las inyecciones
Las inyecciones COVID-19 se inyectan por vía intramuscular. Con esta forma de aplicación se pretende aplicar el fármaco o inyección en cuestión en el espacio extracelular fuera del torrente sanguíneo, para que permanezca en los tejidos, al menos inicialmente; a partir de ahí, puede llegar al torrente sanguíneo solo lentamente o no llegar en absoluto. Los estudios en animales de los fabricantes citados anteriormente encontraron que, de hecho, una gran proporción de las inyecciones modelo inyectadas por vía intramuscular permanecieron en el tejido muscular. Las evaluaciones de riesgo publicadas por las diversas agencias reguladoras nacionales e internacionales asumen que este siempre será el caso.
Sin embargo, todo médico debe saber que incluso con una técnica cuidadosa, es decir, con una aspiración previa [ 15 – 17 ] , la inyección puede ocurrir accidentalmente en el torrente sanguíneo. En estudios con animales, se ha observado que la miocarditis causada por inyecciones de ARNm es más grave después de la inyección intravenosa que después de la intramuscular [ 18 ] . Se debe suponer que ocurre lo mismo con los humanos y con el daño a otros órganos, incluido el cerebro.
1.6. Conclusión
En resumen, los datos disponibles no son suficientes para una estimación cuantitativa fiable del transporte de las inyecciones de ARNm a través de la barrera hematoencefálica, pero prueban cualitativamente, no obstante, que las nanopartículas lipídicas entran en el cerebro. Las evaluaciones optimistas de las autoridades reguladoras sobre este tema no tienen en cuenta los riesgos graves y los factores de confusión importantes y, por lo tanto, no son realistas.
2. ¿Cuánto tiempo pueden permanecer las nanopartículas de la inyección en el cerebro?
En primer lugar, se debe aclarar que las nanopartículas como tales probablemente no duran mucho en ninguna parte del cuerpo: poco después de su absorción en una célula, los lípidos se separarán del ARN. Solo después de que el ARN se haya liberado de esta manera, puede iniciar la síntesis de la proteína de pico dentro de la célula. A partir de ese momento, lo más probable es que el período de tiempo de la actividad biológica se decida por la estabilidad del ARN, aunque los componentes lipídicos también pueden contribuir a la toxicidad de la inyeccion de ARNm.
Al igual que con la cuestión del transporte al cerebro, los fabricantes no han proporcionado datos suficientes y fiables sobre la persistencia de los ARNm de la inyección en el tejido cerebral. El documento de EMA sobre Moderna nuevamente solo contiene datos sobre la inyección modelo, no sobre la inyección COVID real. Según se informa, tres días después de la inyección, el ARNm de la inyección modelo permaneció detectable solo en el tejido muscular, los ganglios linfáticos y el bazo. Pfizer no informó mediciones directas de ARN, sino solo datos sobre la actividad de la proteína codificada por la inyección modelo (luciferasa). Esta actividad decayó con una vida media de aproximadamente un día [ 1 ] . Sin embargo, no se realizaron mediciones en los cerebros de los animales.
En ambos casos, sigue siendo incierto en qué medida estos hallazgos de los experimentos con animales se aplican a la vida útil, dentro del cerebro humano, del ARNm que codifica la proteína de punta del SARS-CoV-2. Sin embargo, veremos en la siguiente sección que hay razones para creer que la expresión de la proteína de pico en el cerebro humano, inducida por la vacunación, puede durar mucho más de lo que sugieren estos datos en animales.
3. ¿Qué daño pueden causar las nanopartículas de inyecciones en el cerebro?
Debemos señalar desde el principio que, cuando se trata de daño al cerebro, la barrera hematoencefálica es menos crucial de lo que se podría suponer; las razones se aclararán a continuación.
3.1. Ataque
Ahora está claro que los eventos adversos causados por las inyecciones COVID modificadas genéticamente (basadas tanto en ARNm como en adenovirus) comienzan muy a menudo con daño a los vasos sanguíneos (ver Figura 1 ) . La lesión vascular conduce entonces a la formación de coágulos de sangre; los tejidos y órganos que dependen de estos vasos obstruidos para su suministro de sangre se dañarán o incluso perecerán. Los accidentes cerebrovasculares y los ataques cardíacos son ejemplos sencillos y prácticamente importantes de este mecanismo patogénico [ 19 – 21 ] . Otra variación es la hemorragia que sigue a la ruptura de vasos sujetos a la inflamación inducida por la inyección [ 22 – 24 ]. Para estas formas de lesión, es suficiente que las partículas de inyección sean absorbidas desde la sangre circulante hacia las células de las paredes de los vasos sanguíneos. Estas células luego expresarán la proteína espiga, un antígeno extraño, y por lo tanto incurrirán en la ira del sistema inmunitario, que luego causará el daño real. Tenga en cuenta, sin embargo, que en este escenario las partículas no necesitan cruzar ninguna barrera anatómica importante; y en particular, no es necesario que crucen la barrera hematoencefálica para dañar los vasos cerebrales y provocar un accidente cerebrovascular.
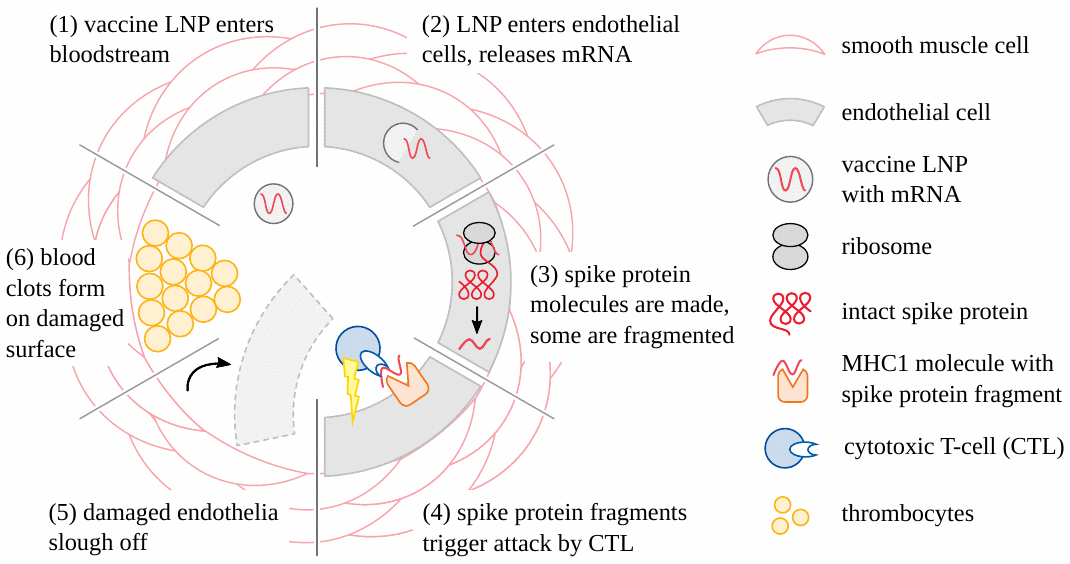
3.2. Inflamación del cerebro y la médula espinal
Además del accidente cerebrovascular, las inyecciones de ARNm también han causado muchos casos de encefalitis y mielitis, es decir, inflamación del cerebro y de la médula espinal, respectivamente, ya veces también de ambos a la vez (encefalomielitis). Los mecanismos patogénicos son los mismos con las tres enfermedades; en aras de la simplicidad, utilizaremos sólo el término ‘encefalitis’ a continuación.
3.2.1. Encefalitis debida a una reacción inmunitaria contra la proteína espiga
Debe esperarse que este mecanismo patogénico opere desde los primeros principios de la inmunología. ¿Cómo podría probarse en un caso dado de encefalitis? Los siguientes criterios harían que tal diagnóstico fuera al menos altamente probable:
- aparición dentro de los días a unas pocas semanas de la inyección de la inyección;
- detección de linfocitos y otras células inflamatorias dentro del tejido cerebral;
- detección de proteína espiga en los focos de inflamación.
Cabe señalar que los criterios 2 y 3 solo pueden cumplirse mediante exámenes histopatológicos; con el encéfalo, por lo general sólo se realizan después de la autopsia, ya que las biopsias de este órgano son particularmente precarias.
Aunque es probable que este mecanismo sea de gran importancia, la evidencia de respaldo hasta el momento es escasa, simplemente porque los patólogos no la han estado buscando. Sin embargo, acaba de publicarse un primer informe de caso que cumple con todos los criterios anteriores [ 25 ] (ver Figura 2 ). Este estudio muy meticuloso también descartó que la expresión detectada de la proteína espiga fuera causada por la infección con el virus en sí y no por la vacunación.
El paciente en cuestión había recibido inicialmente una sola inyección de la inyección basada en adenovirus de AstraZeneca, seguida de dos inyecciones de la inyección de ARNm de Pfizer. La última inyección se había administrado tres semanas antes del momento de la muerte. Se detectó una marcada expresión de la proteína espiga en los capilares cerebrales y también en las células gliales del tejido cerebral, muy probablemente causada por la dosis más reciente de la inyección de ARNm. Por lo tanto, se debe suponer que la proteína del pico sobrevive durante al menos varias semanas después de la aplicación de las inyecciones de ARNm, y lo más probable es que también se sintetice continuamente durante este tiempo. Este hallazgo se hace eco de estudios previos en varios tejidos además del cerebro y en la sangre [ 26 – 29 ]. La expresión de la proteína espiga en las células gliales también muestra inequívocamente que cualquiera de las inyección o ambas pueden atravesar la barrera hematoencefálica.
3.2.2. Encefalitis autoinmune
En este mecanismo patogénico, la conexión con la vacunación es indirecta: la inyección primero desencadena una inflamación, que puede que ni siquiera tenga que afectar directamente al cerebro; y en el contexto de esta inflamación se activa una respuesta inmunitaria no solo contra la proteína espiga sino también contra una o más proteínas propias del organismo u otras biomoléculas (autoantígenos). Entonces, el sistema inmunitario puede atacar estos mismos autoantígenos dentro de los órganos diana inicialmente no afectados, incluido el cerebro, y desencadenar allí también una inflamación.
Los síntomas clínicos, y también los hallazgos de la autopsia cuando se usan métodos de rutina, probablemente serán muy similares a los de una reacción inmunitaria al pico. Por lo tanto, ¿cómo se podría decidir si la encefalitis es desencadenada por la proteína espiga o por un autoantígeno? En una encefalitis autoinmune verdadera, uno debe esperar los siguientes hallazgos:
- los autoanticuerpos contra los autoantígenos en cuestión deben ser detectables en muestras de sangre;
- la proteína espiga no debe ser detectable en las lesiones inflamatorias;
- la conexión temporal con la vacunación podría ser menos estrecha, porque los autoantígenos se producen en el cuerpo perpetuamente.
Referenciass
- Anonymous, (2020) SARS-CoV-2 mRNA Vaccine (BNT162, PF-07302048) 2.6.4 Summary statement of the pharmacokinetic study [English translation].
- Anonymous, (2021) EMA Assessment report: COVID-19 Vaccine Moderna.
- Kreuter, J. et al. (2002) Apolipoprotein-mediated transport of nanoparticle-bound drugs across the blood-brain barrier. Journal of drug targeting 10:317-25
- Francia, V. et al. (2020) The Biomolecular Corona of Lipid Nanoparticles for Gene Therapy. Bioconjug. Chem. 31:2046-2059
- Buzhdygan, T.P. et al. (2020) The SARS-CoV-2 spike protein alters barrier function in 2D static and 3D microfluidic in-vitro models of the human blood-brain barrier. Neurobiol. Dis. 146:105131
- DeOre, B.J. et al. (2021) SARS-CoV-2 Spike Protein Disrupts Blood-Brain Barrier Integrity via RhoA Activation. J. Neuroimmune Pharmacol. 16:722-728
- Petrovszki, D. et al. (2022) Penetration of the SARS-CoV-2 Spike Protein across the Blood-Brain Barrier, as Revealed by a Combination of a Human Cell Culture Model System and Optical Biosensing. Biomedicines 10 (preprint)
- Rhea, E.M. et al. (2021) The S1 protein of SARS-CoV-2 crosses the blood-brain barrier in mice. Nat. Neurosci. 24:368-378
- Fillon, A. et al. (2022) De novo and relapsing necrotizing vasculitis after COVID-19 vaccination. Clin. Kidney J. 15:560-563
- Fiorillo, G. et al. (2022) Leukocytoclastic vasculitis (cutaneous small-vessel vasculitis) after COVID-19 vaccination. J. Autoimmun. 127:102783
- Ishizuka, K. et al. (2022) Giant cell arteritis presenting with chronic cough and headache after BNT162b2 mRNA COVID-19 vaccination. QJM (preprint)
- Kim, B.C. et al. (2022) A Case Report of MPO-ANCA-Associated Vasculitis Following Heterologous mRNA1273 COVID-19 Booster Vaccination. J. Korean Med. Sci. 37:e204
- Nakatani, S. et al. (2022) New-onset kidney biopsy-proven IgA vasculitis after receiving mRNA-1273 COVID-19 vaccine: case report. CEN Case Rep. (preprint)
- Nakatani, K. et al. (2022) Systemic Vasculitis Following SARS-CoV-2 mRNA Vaccination Demonstrated on FDG PET/CT. Clin. Nucl. Med. 47:e403-e405
- Rzymski, P. and Fal, A. (2022) To aspirate or not to aspirate? Considerations for the COVID-19 vaccines. Pharmacol. Rep. (preprint)
- Workman, B. (1999) Safe injection techniques. Nurs. Stand. 13:47-53; quiz 54
- Weir, M.R. (1988) Intravascular injuries from intramuscular penicillin. Clin. Pediatr. Phila 27:85-90
- Li, C. et al. (2021) Intravenous injection of COVID-19 mRNA vaccine can induce acute myopericarditis in mouse model. Clin. Infect. Dis. (preprint)
- Jabagi, M.J. et al. (2022) Myocardial Infarction, Stroke, and Pulmonary Embolism After BNT162b2 mRNA COVID-19 Vaccine in People Aged 75 Years or Older. JAMA 327:80-82
- Lee, T. et al. (2022) Acute gastric and non-mesenteric colonic infarction following mRNA COVID-19 vaccination. Asian J. Surg. 45:1469-1470
- Masumoto, A. et al. (2022) Isolated Renal Arteritis With Infarction Identified After SARS-CoV-2 Vaccine. Circ. J. 86:1144
- Kim, B.H. and Yoo, M.C. (2022) Intracranial Hemorrhage Due to Potential Rupture of an Arteriovenous Malformation after BNT162b2 COVID-19 mRNA Vaccination in a Young Korean Woman: Case Report. Vaccines 10 (preprint)
- Takeyama, R. et al. (2022) Intracerebral hemorrhage due to vasculitis following COVID-19 vaccination: a case report. Acta Neurochir. Wien 164:543-547
- Chida, K. et al. (2022) Rupture of Vertebral Artery Dissecting Aneurysm after mRNA Anti-COVID-19 Vaccination: A Report of Two Cases. NMC Case Rep. J. 9:95-100
- Mörz, M. (2022) A Case Report: Multifocal Necrotizing Encephalitis and Myocarditis after BNT162b2 mRNA Vaccination against Covid-19. Vaccines 10:2022060308
- Bansal, S. et al. (2021) Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer-BioNTech) Vaccination prior to Development of Antibodies: A Novel Mechanism for Immune Activation by mRNA Vaccines. J. Immunol. 207:2405-2410
- Magen, E. et al. (2022) Clinical and Molecular Characterization of a Rare Case of BNT162b2 mRNA COVID-19 Vaccine-Associated Myositis. Vaccines 10 (preprint)
- Röltgen, K. et al. (2022) Immune imprinting, breadth of variant recognition and germinal center response in human SARS-CoV-2 infection and vaccination. Cell (preprint)
- Yamamoto, M. et al. (2022) Persistent varicella zoster virus infection following mRNA COVID‐19 vaccination was associated with the presence of encoded spike protein in the lesion. J. Cutan. Immunol. Allergy (preprint)
- Jarius, S. et al. (2022) MOG encephalomyelitis after vaccination against severe acute respiratory syndrome coronavirus type 2 (SARS-CoV-2): case report and comprehensive review of the literature. J. Neurol. (preprint)
- Asioli, G.M. et al. (2022) Anti-LGI1 encephalitis following COVID-19 vaccination: a case series. J. Neurol. (preprint)
- Poli, K. et al. (2022) Multiple Autoimmune Syndromes Including Acute Disseminated Encephalomyelitis, Myasthenia Gravis, and Thyroiditis Following Messenger Ribonucleic Acid-Based COVID-19 Vaccination: A Case Report. Front. Neurol. 13:913515
- Vogrig, A. et al. (2021) Acute disseminated encephalomyelitis after SARS-CoV-2 vaccination. Clin. Neurol. Neurosurg. 208:106839
- Werner, J. et al. (2022) New-onset refractory status epilepticus due to autoimmune encephalitis after vaccination against SARS-CoV-2: First case report. Front. Neurol. 13:946644
- Gao, J. et al. (2022) Acute encephalitis after COVID-19 vaccination: A case report and literature review. Hum. Vaccin. Immunother. p. 2082206
 CienciaySaludNatural.com
CienciaySaludNatural.com




