Review: N1-methyl-pseudouridine (m1Ψ): Friend or foe of cancer? https://doi.org/10.1016/j.ijbiomac.2024.131427 – https://www.sciencedirect.com/science/article/abs/pii/S0141813024022323

Las inyecciones de ARNm ayudan al desarrollo del cáncer debido al uso de ARNm modificado diseñado para suprimir la inmunidad, según un estudio publicado en el International Journal of Biological Macromolecules . Este resumen resume los hallazgos
El ARNm utilizado en las vacunas contra la COVID-19 difiere del ARNm natural, que se ha modificado para evitar la degradación inmunitaria cuando se inyecta. Los investigadores sostienen que la modificación (específicamente, la modificación de N1-metil-pseudouridina) del ARNm provoca una supresión inmunitaria que puede contribuir al desarrollo del cáncer.
La uridina es un componente clave del ARNm. Sin embargo, cuando se inyecta uridina en el cuerpo, el sistema inmunológico la degrada rápidamente.Por lo tanto, los científicos de Pfizer y Moderna modificaron la uridina a N1-metil-pseudouridina (m1-psi) para que pudiera durar más .
El ARN modificado y el natural estimulan diferentes respuestas en el cuerpo. El ARN modificado tiende a producir proteínas más aberrantes, lo que potencialmente contribuye a la inestabilidad del genoma celular. Lo más importante es que el ARN modificado induce una respuesta más silenciosa en el cuerpo que el ARN natural, lo que puede tener amplias implicaciones para la capacidad del cuerpo para combatir otras infecciones y cánceres.
Estas inyecciones no ayudan a prevenir hospitalizaciones y enfermedades graves en personas con comorbilidades debido a la rápida disminución de la inmunidad que provocan. Cada vez hay más pruebas que indican que estas inyecciones, como muchas otras, no generan inmunidad, lo que deja a las personas vulnerables a infecciones recurrentes.
Además, se ha descubierto que las inyecciones de ARNm inhiben vías inmunológicas esenciales, perjudicando así la señalización temprana del interferón. En el marco de la vacunación contra la COVID-19, esta inhibición garantiza una síntesis adecuada de las proteínas pico o spike y una activación inmunitaria reducida.
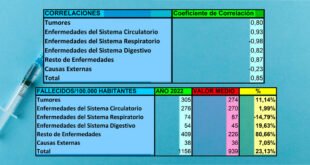
Se proporciona evidencia de que agregar el 100% de N1-metil-pseudouridina (m1Ψ) a la inyección de ARNm [como con las inyecciones de Pfizer y Moderna] en un modelo de melanoma estimuló el crecimiento del cáncer y la metástasis , mientras que las inyecciones de ARNm no modificadas indujeron resultados opuestos, por lo tanto lo que sugiere que las inyecciones de ARNm de COVID-19 podrían ayudar al desarrollo del cáncer .
Con base en esta evidencia convincente, sugerimos que los ensayos clínicos futuros para cánceres o enfermedades infecciosas no deberían usar inyecciones de ARNm con una modificación de m1Ψ del 100% , sino aquellas con un porcentaje más bajo de modificación de m1Ψ para evitar la supresión inmune.
El desarrollo de terapias de ARNm, al igual que otros métodos de tratamiento basados en ácidos nucleicos, se ha visto obstaculizado por varios desafíos de entrega. Antes de llegar a los ribosomas, una molécula de ARN, por ejemplo, puede ser destruida por ribonucleasas o capturada por endosomas [9]. Otro obstáculo en la entrega de ARNm está relacionado con el hecho de que el ARN cruza las membranas biológicas debido a su columna vertebral de fosfodiéster cargada negativamente [10].
Este problema supuestamente se resolvió encerrando el ARN en una envoltura hecha de nanopartículas lipídicas (LNP) y guiándolo hacia los ribosomas. Estos lípidos se exploraron como sistemas de administración de ARN a células de mamíferos hace décadas [[11], [12], [13]]. Además de las dificultades de entrega mencionadas anteriormente, el ARNm terapéutico enfrentó al menos otros dos obstáculos importantes: cuando se administraba a animales, el ARNm transcrito in vitro (IVT) sería: 1) susceptible a la degradación de las nucleasas; y 2) inducir una inmunogenicidad innata comparable a la que se experimenta cuando se infecta con un patógeno [14].
La pseudouridina (Ψ), una alteración del ARN ampliamente reconocida que puede utilizarse para sustituir la uridina en el ARNm de IVT, proporcionó una solución a estos problemas. Se ha demostrado que la inclusión de Ψ aumenta la estabilidad del ARN y al mismo tiempo amortigua la respuesta inmune anti-ARN [15,16]. Dado que se demostró que la modificación Ψ podría ayudar al ARNm a evitar respuestas inmunes innatas [16], se llevó a cabo una búsqueda de derivados Ψ con características mejoradas.
Como resultado, se descubrió que el N1-metil-Ψ (m1Ψ) disminuía la funcionalidad de los sensores inmunes innatos y funcionaba correctamente (e incluso mejor que Ψ) cuando se probó en varias células humanas básicas. En ratones, m1Ψ mejoró la eficiencia de traducción y redujo la citotoxicidad del ARNm modificado administrado por vía intramuscular y a través de la piel [17].
El papel de los receptores de reconocimiento de patrones en el cáncer
Los receptores de reconocimiento de patrones (PRR) se descubrieron en 1990 [18], y su papel en la estimulación de las células de los sistemas inmunológicos innato y adaptativo ha estado en el centro de atención de muchos investigadores desde entonces [19]. Por este trabajo, Jules A. Hoffman y Bruce A. Beutler recibieron el Premio Nobel de Fisiología o Medicina 2011, junto con el reconocimiento de las contribuciones de Ruslan Medzhitov y Charles A. Janeway Jr. Los receptores codificados por línea germinal, o PRR, son esencial para ambos
La vacunación con ARNm altera la vía de señalización RIG-I: implicaciones para el desarrollo del cáncer
Los PRR citoplasmáticos conocidos como RLR son capaces de identificar ARN bicatenarios tanto internos como virales. Las ARN helicasas de la caja DEXH RIG-I, el gen 5 asociado a la diferenciación del melanoma (MDA5) y el receptor tipo RIG-I LGP2 (también conocido como ARN helicasa DHX58 dependiente de ATP) son los tres miembros de la familia RLR que se han descubierto. en este punto [20]. A través de sus Dominios de Reclutamiento y Activación de Caspasa (CARD), inician un proceso de señalización. Interferones tipo I (IFN) y proinflamatorios
Uso de m1Ψ en inyecciones de ARNm COVID-19
m1Ψ se añadió en 2020 a la inyecciones candidata de ARNm COVID-19 de Pfizer-BioNTech (Comirnaty® o BNT162b2), que codifica toda la proteína de pico transmembrana (S) del SARS-CoV-2 [36]. Mediante IVT extensiva se generó una cantidad significativa de ARNm de pico de SARS-CoV-2 (COVID-19) modificado con m1Ψ. Después de demostrar un historial de seguridad favorable y una protección del 95 % contra la enfermedad después de un protocolo de dos inoculación (inyección intramuscular), la inyección de Pfizer se convirtió en la primera inyección de ARNm en obtener licencia completa.
¿Es m1Ψ amigo o enemigo del cáncer?
Los creadores de las inyecciones de ARNm contra el SARS-CoV-2 sólo destacaron los aspectos positivos relacionados con la adición de m1Ψ: era fundamental disminuir la desintegración de este ARNm sintetizado, así como su inmunogenicidad, para evitar una respuesta inmune demasiado agresiva. Sin embargo, importantes investigaciones realizadas durante esta pandemia han demostrado que las inyecciones inactivadas y basadas en ARNm interrumpen temporalmente la señalización de IFN [[46], [47], [48], [49]]. Es importante revelar aquí que en
Traducción imperfecta del ARNm m1Ψ que conduce a la síntesis de diferentes proteínas en lugar de la producción uniforme de la proteína de pico.
Sorprendentemente, se sabe poco sobre cómo la alteración de los ribonucleótidos influye en la síntesis de proteínas, especialmente para la traducción de ARNm de IVT terapéuticos, considerando su uso generalizado. Una nueva investigación encontró que durante la traducción del ARNm, m1Ψ aumenta drásticamente el cambio de marco ribosómico +1 [90]. El proceso de traducción de ARNm es un método de síntesis de proteínas estrictamente regulado y fuertemente conservado. Incluso con mecanismos sofisticados de control de la calidad de las proteínas, la deficiencia de aminoácidos en
Discusión
El impacto de la pandemia de COVID-19 provocó un nivel sin precedentes de participación de la comunidad en investigación biomédica, lo que hizo posible el proceso de producción de inyecciones más rápido de la historia [36]. El uso de inyecciones de ARNm tiene una serie de ventajas sobre otras plataformas. Esta plataforma combina la composición bien definida y la seguridad de las vacunas muertas o de subunidades con las propiedades inmunológicas de las vacunas vivas atenuadas, incluida la expresión de antígenos endógenos y la inducción de células T [126].
Las inyecciones COVID tienen al menos tres mecanismos mediante los cuales podrían iniciar un cáncer o podrían promover un cáncer existente por Peter McCullough
1.) El ARN mensajero de las inyecciones de COVID-19 podría alterar gravemente la capacidad del cuerpo para reparar el ADN dañado. Esta alteración de los procesos celulares básicos podría provocar mutaciones incontroladas, lo que aumentaría considerablemente el riesgo de desarrollar cáncer.
Dr Peter McCullough: Las inyecciones de ARNm contra K0 B1T podrían ayudar al desarrollo del cáncer, no ayudan a prevenir hospitalizaciones ni enfermedades graves debido a la rápida disminución de la inmunidad que provocan. https://www.bitchute.com/video/DdRTTeF3pm3f/
2.) Se sugiere que el segmento S2 de la proteína de pico, administrado específicamente a través de la vacuna, suprime de manera crítica proteínas supresoras de tumores clave como P53 y BRCA. Esta supresión desarma eficazmente las defensas primarias del cuerpo contra el crecimiento de células cancerosas, allanando el camino para que los tumores florezcan sin control.
3.) La formulación de inyecciones de ARNm incluye impurezas relacionadas con el proceso del ADN que podrían tener propiedades protooncogénicas. “Y los fragmentos que se detectan son el potenciador, el promotor y el origen de inserción de SV40, así como fragmentos de resistencia a los antibióticos que se utilizan en el proceso de fabricación”.
«Entonces, en resumen, las inyecciones contra la COVID tienen al menos tres mecanismos mediante los cuales podrían iniciar un cáncer, o podrían promover un cáncer existente, y puede ocurrir más rápidamente porque los sistemas de defensa del tumor se derriban», dijo el Dr. McCullough.
Pfizer invierte 43 mil millones de u$s para «combatir» el cáncer Las inyecciones de ARNm contra K0 B1T causan cáncer, no ayudan a prevenir hospitalizaciones, ni enfermedades graves debido a la rápida disminución de la inmunidad que provocan. Tampoco detienen la transmisión. Pero es el mejor negocio para Pfizer y Moderna, laboratorios del grupo Vanguard -Black Rock… es decir el Foro Económico Mudial, que maneja a la OMS, la ONU, el Pentagono, la NATO y varios gobiernos. https://www.pfizer.com/news/press-release/press-release-detail/pfizer-invests-43-billion-battle-cancer
Ver más sobre este tema: https://cienciaysaludnatural.com/category/cancer/
Colabore por favor con nosotros para que podamos incluir mas información y llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
Via PAYPAL: Euros o dólares click aqui
ARGENTINA 10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Solicite nuestro CBU contactenos
Referencias
- K. Karikó et al.Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stabilityMol. Ther.(2008)
- K. Karikó et al.Suppression of RNA recognition by toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNAImmunity(2005)
- O. Andries et al.N1-methylpseudouridine-incorporated mRNA outperforms pseudouridine-incorporated mRNA by providing enhanced protein expression and reduced immunogenicity in mammalian cell lines and miceJ. Control. Release(2015)
- T. Shekarian et al.Pattern recognition receptors: immune targets to enhance cancer immunotherapyAnn. Oncol.(2017)
- O. Takeuchi et al.Pattern recognition receptors and inflammationCell(2010)
- J.G. van den Boorn et al.Turning tumors into vaccines: co-opting the innate immune systemImmunity(2013)
- M.B. Fuertes et al.Type I interferon response and innate immune sensing of cancerTrends Immunol.(2013)
- D. Goubau et al.Cytosolic sensing of virusesImmunity(2013)
- S. Seneff et al.Innate immune suppression by SARS-CoV-2 mRNA vaccinations: the role of G-quadruplexes, exosomes, and MicroRNAsFood Chem. Toxicol.(2022)
- C.S. Benn et al.A small jab–a big effect: nonspecific immunomodulation by vaccinesTrends Immunol.(2013)
- P. Aaby et al.Developing the concept of beneficial non-specific effect of live vaccines with epidemiological studiesClin. Microbiol. Infect.(2019)
- E.N. Ivanova et al.mRNA COVID-19 vaccine elicits potent adaptive immune response without the acute inflammation of SARS-CoV-2 infectioniScience(2023)
- K. Föhse et al.The impact of BNT162b2 mRNA vaccine on adaptive and innate immune responsesClin. Immunol.(2023)
- C. Pollard et al.Type I IFN counteracts the induction of antigen-specific immune responses by lipid-based delivery of mRNA vaccinesMol. Ther.(2013)
- C.G. Kim et al.Dynamic changes in circulating PD-1+ CD8+ T lymphocytes for predicting treatment response to PD-1 blockade in patients with non-small-cell lung cancerEur. J. Cancer(2021)
- A. Garcia-Diaz et al.Interferon receptor signaling pathways regulating PD-L1 and PD-L2 expressionCell Rep.(2017)
- P.R. Taylor et al.Monocyte heterogeneity and innate immunityImmunity(2003)
- A. Sica et al.Tumour-associated macrophages are a distinct M2 polarised population promoting tumour progression: potential targets of anti-cancer therapyEur. J. Cancer(2006)
- M.L. Novak et al.Phenotypic transitions of macrophages orchestrate tissue repairAm. J. Pathol.(2013)
- M. François et al.Human MSC suppression correlates with cytokine induction of indoleamine 2, 3-dioxygenase and bystander M2 macrophage differentiationMol. Ther.(2012)
- K. Kessenbrock et al.Matrix metalloproteinases: regulators of the tumor microenvironmentCell(2010)
- R. Yuan et al.Reversing the polarization of tumor-associated macrophages inhibits tumor metastasisInt. Immunopharmacol.(2017)
- W. He et al.TLR4 signaling promotes immune escape of human lung cancer cells by inducing immunosuppressive cytokines and apoptosis resistanceMol. Immunol.(2007)
- M. Fukata et al.Toll-like receptor-4 promotes the development of colitis-associated colorectal tumorsGastroenterology(2007)
- X. Wang et al.Toll-like receptor 4–induced inflammatory responses contribute to the tumor-associated macrophages formation and infiltration in patients with diffuse large B-cell lymphomaAnn. Diagn. Pathol.(2015)
- A. Schoenemeyer et al.The interferon regulatory factor, IRF5, is a central mediator of toll-like receptor 7 signalingJ. Biol. Chem.(2005)
- D.A. Chistiakov et al.The impact of interferon-regulatory factors to macrophage differentiation and polarization into M1 and M2Immunobiology(2018)
- J. Champagne et al.Oncogene-dependent sloppiness in mRNA translationMol. Cell(2021)
- J. Champagne et al.Slippy-Sloppy translation: a tale of programmed and induced-ribosomal frameshiftingTrends in Genetics(2022)
- A. Akinc et al.Targeted delivery of RNAi therapeutics with endogenous and exogenous ligand-based mechanismsMol. Ther.(2010)
- V.K. Nagarajan et al.XRN 5′→ 3′ exoribonucleases: structure, mechanisms and functionsBiochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms(2013)
- P. Morais et al.The critical contribution of pseudouridine to mRNA COVID-19 vaccinesFrontiers in Cell and Developmental Biology(2021)
- S. PascoloMessenger RNA-based vaccinesExpert. Opin. Biol. Ther.(2004)
- J. Probst et al.Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependentGene Ther.(2007)
- N.A. Jackson et al.The promise of mRNA vaccines: a biotech and industrial perspectivenpj Vaccines(2020)
- S. PascoloSynthetic messenger RNA-based vaccines: from scorn to hypeViruses(2021)
- P.A. Krieg et al.Functional messenger RNAs are produced by SP6 in vitro transcription of cloned cDNAsNucleic Acids Res.(1984)
- D. Melton et al.Efficient in vitro synthesis of biologically active RNA and RNA hybridization probes from plasmids containing a bacteriophage SP6 promoterNucleic Acids Res.(1984)
- J.A. Wolff et al.Direct gene transfer into mouse muscle in vivoScience(1990)
- A. Wadhwa et al.Opportunities and challenges in the delivery of mRNA-based vaccinesPharmaceutics(2020)
- S.F. DowdyOvercoming cellular barriers for RNA therapeuticsNat. Biotechnol.(2017)
- G.J. DimitriadisTranslation of rabbit globin mRNA introduced by liposomes into mouse lymphocytesNature(1978)
- M.J. Ostro et al.Evidence for translation of rabbit globin mRNA after liposomemediated insertion into a human cell lineNature(1978)
- R.W. Malone et al.Cationic liposome-mediated RNA transfectionProc. Natl. Acad. Sci.(1989)
- F. Martinon et al.Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNAEur. J. Immunol.(1993)
- C.A. JanewayApproaching the asymptote? Evolution and revolution in immunology
- A. Iwasaki et al.Regulation of adaptive immunity by the innate immune systemScience(2010)
- C. Termeer et al.Oligosaccharides of hyaluronan activate dendritic cells via toll-like receptor 4J. Exp. Med.(2002)
- L.-J. Jiang et al.RA-inducible gene-I induction augments STAT1 activation to inhibit leukemia cell proliferationProc. Natl. Acad. Sci.(2011)
- M.B. Fuertes et al.Host type I IFN signals are required for antitumor CD8+ T cell responses through CD8α+ dendritic cellsJ. Exp. Med.(2011)