Este protocolo fue un esfuerzo de colaboración basado en la experiencia de una docena de médicos de renombre mundial. El Dr. Pierre Kory y el Dr. Paul Marik agradecen las contribuciones de: Dr. Keith Berkowitz; Dr. Flavio Cadegiani; Dra. Suzanne Gazda; Dra. Meryl Nass; la Dra. Tina Peers; la Dra. Robin Rose; Dr. Yusuf (JP) Saleeby; Dr. Eugene Shippen; Dr. Mobeen Syed; y el Dr. Fred Wagshul.

I-RECOVER: Divulgación
Este documento está destinado principalmente a ayudar a los profesionales de la salud a brindar la atención médica adecuada a los pacientes lesionados por vacunas. Los pacientes siempre deben consultar a su proveedor de atención médica antes de embarcarse en cualquier tratamiento nuevo.
Definición
Aunque no existe una definición oficial para el síndrome post-vacuna COVID-19, una correlación temporal entre un paciente que recibe una vacuna COVID-19 y el comienzo o empeoramiento de las manifestaciones clínicas es suficiente para diagnosticar una lesión inducida por la vacuna COVID-19, cuando los síntomas no son explicados por otras causas concurrentes.
Dado que los ensayos clínicos de Fase 3 y Fase 4 aún están en curso, no se puede determinar completamente el perfil completo de seguridad y toxicidad de las inyecciones contra el COVID-19. Desde una perspectiva bioética, los casos de cualquier signo, síntoma o anormalidad de nueva aparición o empeoramiento después de cualquier dosis de la inyección COVID-19 deben considerarse como una lesión causada por la inyección, hasta que se demuestre lo contrario.
Tenga en cuenta que existen superposiciones significativas entre los síntomas y las características del síndrome de COVID prolongado/síndrome de larga duración y el síndrome posterior a la inyección. Sin embargo, una serie de características clínicas parecen ser características del síndrome posvacunal; en particular, los síntomas neurológicos graves parecen ser más comunes después de la vacunación. Para complicar aún más las cosas, los pacientes con COVID prolongado a menudo también se vacunan, lo que dificulta aún más la definición.
Epidemiología
Los Centros para el Control de Enfermedades (CDC), los Institutos Nacionales de Salud (NIH), la Administración de Alimentos y Medicamentos (FDA) y la Organización Mundial de la Salud (OMS) no reconocen las lesiones posteriores a la inyección y no existe un código de clasificación (International Classification of Diseases, ICD) específico para esta enfermedad. Por lo tanto, se desconoce la prevalencia exacta del síndrome posvacunal. [1]
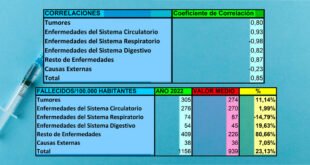
Sin embargo, hasta el 16 de mayo de 2022, se informaron 815.385 eventos adversos solo en los Estados Unidos después de la vacunación contra el COVID-19. Además, se han registrado más de 5.309 casos de miocarditis, 151.796 eventos adversos graves y 14.613 muertes en el Sistema de notificación de eventos adversos de vacunas (VAERS, por sus siglas en inglés) de EE. UU. después de la vacunación contra el COVID-19. Tenga en cuenta que la base de datos VAERS está limitada por el subregistro, por un factor de al menos 30 veces. [2]
Además, los datos de ensayos publicados sugieren que al menos del 1 al 1,5 por ciento de los pacientes vacunados desarrollan eventos adversos graves después de la vacunación. [2,3] Dado que se han administrado 572 millones de dosis de una vacuna contra el COVID-19 en los EE. UU., y 11.000 millones en todo el mundo, es probable que haya millones de pacientes lesionados por vacunas en todo el mundo y al menos 2 millones de casos en los EE. UU.
Como la comunidad médica no reconoce este grave desastre humanitario, lamentablemente estos pacientes han sido rechazados y se les ha negado el acceso a la atención médica que necesitan y merecen.
Además, hay datos clínicos, moleculares y patológicos limitados sobre estos pacientes para informar un enfoque para tratar la afección. En consecuencia, nuestro enfoque para el manejo de pacientes lesionados por vacunas se basa en el presunto mecanismo patogénico, así como en las observaciones clínicas de los médicos y los propios pacientes.
Patogénesis
La proteína pico (spike), en particular el segmento S1, es probablemente el principal factor patogénico que conduce al síndrome posvacunal. [4,5] La proteína S1 es significativamente tóxica. Múltiples procesos fisiopatológicos que se entrecruzan y superponen probablemente contribuyan al amplio espectro de lesiones por vacunas: [1,6]
- La reacción aguda e inmediata (en cuestión de minutos a horas) es probablemente el resultado de una reacción de hipersensibilidad mediada por IgE tipo I aguda. La respuesta de tipo I puede deberse a anticuerpos preformados contra ARNm, polietilenglicol [7] u otros componentes de la partícula nanolipídica.
- La miocarditis aguda/síndrome de muerte cardíaca súbita que ocurre después de la vacunación (dentro de horas a 48 horas), observada particularmente en atletas jóvenes, puede ser causada por una «miocardiopatía por estrés» debido al exceso de catecolaminas producidas por la médula suprarrenal en respuesta al aumento de proteínas. aberraciones metabólicas inducidas. [8]
- Es probable que la miocarditis subaguda y crónica sea el resultado de una respuesta inflamatoria inducida por proteína pico (spike) mediada por pericitos y macrófagos. [9,10]
- Las lesiones subagudas (días) y crónicas (semanas a años) relacionadas con la vacuna probablemente se deban a los efectos superpuestos de una respuesta inflamatoria inducida por S1, la producción de autoanticuerpos, la activación de la cascada de la coagulación y la reactivación viral secundaria.
- La respuesta inflamatoria está mediada por la activación de células mononucleares inducida por la proteína pico en casi todos los órganos del cuerpo, pero más notablemente en el cerebro, el corazón y los órganos endocrinos.
Debido al mimetismo molecular con la proteína pico (spike), se produce un espectro diverso de autoanticuerpos. [11-20] Estos autoanticuerpos son la causa probable del síndrome de Guillain-Barré (GBS), mielitis transversa, trombocitopenia inmune y neuropatía de fibras pequeñas (SFN)/neuropatía autonómica. [21-28]
Muchos de estos anticuerpos están dirigidos contra receptores de membrana celular acoplados a proteína G. [17,19] Es probable que los anticuerpos antineuronales contribuyan a la miríada de hallazgos neurológicos. SFN/neuropatía autonómica parece ser un trastorno característico después de la vacunación y está fuertemente asociado con una amplia gama de autoanticuerpos. Además, los autoanticuerpos pueden provocar una serie de síndromes específicos, incluido el síndrome antifosfolípido, el lupus eritematoso sistémico (LES), la artritis reumatoide, etc.
La neuropatía autonómica se produce cuando se dañan los nervios que controlan las funciones corporales involuntarias. Puede afectar la presión arterial, el control de la temperatura, la digestión, la función de la vejiga e incluso la función sexual.
La proteína pico es altamente trombogénica y activa directamente la cascada de la coagulación; además, la vía de la coagulación se inicia a través de mediadores inflamatorios producidos por células mononucleares y plaquetas. [5] La activación de la cascada de la coagulación da lugar tanto a coágulos grandes (que provocan accidentes cerebrovasculares y embolias pulmonares) como a microcoágulos (que provocan microinfartos en muchos órganos, pero sobre todo en el cerebro).
Los datos emergentes sugieren que las inyecciones pueden inducir una diátesis alérgica (eccema, erupciones cutáneas, asma, picazón en la piel y los ojos, alergias alimentarias, etc.). Esto parece deberse a una desregulación inmunitaria única con cambio de clase de anticuerpos (por las células B) y la producción de anticuerpos IgE. Existe una superposición con el Síndrome de Activación de Mastocitos (MCAS) y la distinción entre los dos trastornos no está clara. [29,30] Sin embargo, por definición, el MCAS no tiene causas identificables, no es causado por IgE específica de alérgeno y no tiene expansión clonal detectable de mastocitos. [29]
Y finalmente, debido a la función inmunológica alterada, puede ocurrir la activación de virus latentes y patógenos bacterianos, lo que resulta en la reactivación de la infección por Herpes Simplex, Herpes Zoster, Epstein Barr Virus (EBV) y citomegalovirus (CMV), así como la reactivación de la enfermedad de Lyme y micoplasma. [31-33]
El factor común que subyace al mecanismo patogénico en el paciente lesionado por la vacuna es la “desregulación inmunitaria”. El desarrollo de la disfunción inmunitaria y la gravedad de la disfunción probablemente sean el resultado de una serie de factores que se entrecruzan, entre ellos:
- Genética : los familiares de primer grado de pacientes que han sufrido una lesión por vacuna parecen tener un riesgo muy alto de lesión por vacuna.
- Carga de ARNm y cantidad de proteína de pico producida : esto puede estar relacionado con lotes de inyecciones específicos que contienen una concentración más alta de ARNm. [1]
- Sexo : parece que alrededor del 80 por ciento de los pacientes lesionados por inyecciones son mujeres. Además, se ha informado que el tratamiento con estrógenos empeora o precipita un evento/recaída. Se sabe que las mujeres tienen un riesgo mucho mayor de enfermedades autoinmunes (especialmente LES) y esto probablemente explica este hallazgo. Los estrógenos interfieren con la señalización del receptor de glucocorticoides. [34] Además, los estrógenos modulan la función de las células B y T.
- Estado nutricional subyacente y comorbilidades : Es probable que ciertas condiciones preexistentes hayan preparado al sistema inmunitario para que sea más reactivo después de la vacunación. Esto incluye a aquellos con trastornos autoinmunes preexistentes y enfermedades inflamatorias crónicas como la enfermedad de Lyme. Las personas con mutaciones en el gen de la metilentetrahidrofolato reductasa (MTHFR) y síndromes de tipo Ehlers-Danlos pueden tener un mayor riesgo, así como aquellas con deficiencias de nutrientes como la vitamina B12, la vitamina D y el magnesio.
Una serie de principios son esenciales para el manejo óptimo del síndrome posvacunal:
- Es importante recalcar que no existen informes publicados que detallen el manejo de los pacientes lesionados por inyecciones COVID. Nuestro enfoque de tratamiento se basa, por lo tanto, en el mecanismo patogénico postulado, la observación clínica y las anécdotas de los pacientes.
- El problema central en el síndrome posvacunal es la «desregulación inmunitaria» crónica. El objetivo principal del tratamiento es ayudar al cuerpo a restaurar y normalizar el sistema inmunitario; en otras palabras, dejar que el cuerpo se cure por sí mismo. Recomendamos el uso de agentes inmunomoduladores e intervenciones para amortiguar y normalizar el sistema inmunológico en lugar del uso de medicamentos inmunosupresores, que pueden empeorar la condición. Sin embargo, el uso concomitante de un curso controlado de un fármaco inmunosupresor puede ser apropiado en pacientes con enfermedades autoinmunes específicas.
- El tratamiento debe individualizarse de acuerdo con los síntomas de presentación y los síndromes de la enfermedad de cada paciente. Es probable que no todos los pacientes respondan por igual a la misma intervención; esto sugiere que el tratamiento debe individualizarse de acuerdo con la respuesta específica de cada paciente. Un hallazgo peculiar es que una intervención en particular (p. ej., la oxigenoterapia hiperbárica) puede salvar la vida de un paciente y ser totalmente ineficaz para otro. Oxigenoterapia hiperbárica, es un tratamiento que utiliza una cámara especial para aumentar la cantidad de oxígeno en la sangre.
- Los pacientes deben servir como sus propios controles y la respuesta al tratamiento debe dictar la modificación del plan de tratamiento.
- El tratamiento temprano es esencial; es probable que la respuesta al tratamiento se atenúe cuando se retrase el tratamiento.
- Los pacientes deben comenzar con el protocolo de tratamiento primario; esto debe, sin embargo, individualizarse de acuerdo con las características clínicas particulares del paciente. La respuesta al protocolo de tratamiento primario debe dictar la adición o sustracción de intervenciones terapéuticas adicionales. Las terapias de segunda línea deben iniciarse en aquellos que han respondido mal a las terapias centrales y en pacientes con enfermedad incapacitante grave.
- Los pacientes con síndrome posvacunal no deben recibir más inyecciones contra el COVID-19 de ningún tipo. Asimismo, los pacientes con COVID prolongado deben evitar todas las inyecciones contra el COVID.
- Los pacientes con síndrome posvacunal deben hacer todo lo posible para evitar contraer la COVID-19. Esto puede incluir un protocolo preventivo (ver protocolos FLCCC). En caso de que contraigan el virus o sospechen infección, el tratamiento temprano es esencial (consulte los protocolos de FLCCC). Es probable que el COVID-19 exacerbe los síntomas de la lesión por la inyección.
- Los pacientes lesionados por inyecciones con frecuencia están desesperados por probar cualquier medicamento o intervención que crean que pueda ayudarlos. Desafortunadamente, los proveedores sin escrúpulos se aprovecharán de estos pacientes muy vulnerables y les venderán remedios costosos y no probados.
- De manera similar, los pacientes a menudo se someten a una extensa batería de pruebas de diagnóstico. Estas pruebas rara vez son útiles, por lo general confunden la situación y conducen a intervenciones terapéuticas inapropiadas. Los pacientes se someten con frecuencia a pruebas de diagnóstico que son “experimentales”, no validadas y clínicamente sin sentido; los pacientes deben evitar hacerse tales pruebas. Recomendamos una serie de pruebas de detección simples y básicas que deben repetirse, según esté clínicamente indicado, cada 4 a 6 meses. Recuerde el dicho: solo haga una prueba si el resultado cambiará su plan de tratamiento.
Se debe considerar la oxigenoterapia hiperbárica (TOHB) en casos de
- lesión neurológica y en pacientes que muestran un curso cuesta abajo rápido (ver más abajo).
- Los pacientes deben evitar los programas de «desintoxicación de proteínas Spike» no científicos y mal validados.
Pruebas de referencia
- Hemograma completo, complete blood count (CBC), con diferencial y recuento de plaquetas
- Química sanguínea estándar, incluidas las pruebas de función hepática.
- Dímero D: como marcador de la activación de la coagulación
- PCR: como marcador de inflamación en curso (un panel completo y extenso de citoquinas/quimioquinas es innecesario y muy costoso, y los resultados no cambiarán el enfoque del tratamiento).
- Cortisol matutino: algunos pacientes desarrollan insuficiencia suprarrenal autoinmune) El cortisol es una hormona producida por las glándulas suprarrenales, las cuales se localizan justo encima de los riñones.
- TSH: para descartar enfermedad tiroidea
- HbA1C: los pacientes lesionados por vacunas tienen un mayor riesgo de desarrollar diabetes.
- Troponina, pro-BNP, galectina-3 y ST2: para excluir enfermedad cardíaca.
- Serología/PCR para CMV, EBV, Herpes simplex, HHV6 y micoplasma: para excluir la reactivación viral/bacteriana (en pacientes que responden mal a la terapia, puede ser útil buscar enfermedades transmitidas por garrapatas de Lyme (Bb), Bartonella y Babesia, p. , https://igenex.com/ y https://www.mdlab.com/ )
- Nivel de vitamina D (25OH vitamina D)
- En pacientes con características alérgicas y aquellos que experimentaron una reacción aguda a la vacuna, las siguientes pruebas pueden ser útiles: recuento de eosinófilos; Niveles de IgE, pruebas RAST y/o pruebas cutáneas. La triptasa sérica, la histamina sérica y/o la N-metilhistamina en orina de 24 h deben considerarse en MCAS. [29]
- Autoanticuerpos de detección limitada. Anticoagulante lúpico (si microglobulina B2 positiva, etc.) y ANA. Los pacientes lesionados por inyecciones, en particular aquellos con disfunción autonómica/SFN, con frecuencia tienen una amplia variedad de autoanticuerpos dirigidos contra los receptores de superficie celular acoplados a proteína G, [17,19] ACE-2, [35] neuronas, mielina y otros autoepítopos . La presencia o ausencia de estos anticuerpos tiene poco impacto en el manejo de estos pacientes.
Terapias de primera línea (sin síntomas específicos; enumeradas en orden de importancia)
- Ayuno diario intermitente o ayuno diario periódico; El ayuno tiene un efecto profundo en la promoción de la homeostasis del sistema inmunitario, en parte al estimular la autofagia y eliminar las proteínas extrañas y mal plegadas, promover la mitofagia y mejorar la salud mitocondrial, así como aumentar la producción de células madre. [36-42] Es probable que el ayuno intermitente tenga un papel importante en la promoción de la descomposición y eliminación de la proteína pico.
- ivermectina; 0,2-0,3 mg/kg, diariamente durante un máximo de 4-6 semanas . La ivermectina tiene potentes propiedades antiinflamatorias. [43-45] También se une a la proteína pico, lo que ayuda a que el huésped la elimine. [46-48] Es probable que la ivermectina y el ayuno intermitente actúen de forma sinérgica para eliminar la proteína pico del organismo. Se debe considerar una prueba de ivermectina como terapia de primera línea. Parece que los pacientes pueden agruparse en dos categorías: i) respondedores a la ivermectina y ii) no respondedores a la ivermectina. Esta distinción es importante, ya que este último grupo es más difícil de tratar y requiere una terapia más agresiva.
- dosis baja de naltrexona , Low dose naltrexone (LDN); Se ha demostrado que la dosis baja de naltrexona, LDN tiene propiedades antiinflamatorias, analgésicas y neuromoduladoras. [49,50] Comience con 1 mg/día y aumente a 4,5 mg/día, según sea necesario. Puede tomar de 2 a 3 meses para ver el efecto completo. La naltrexona es un antagonista opiáceo que actúa por competición específica con los receptores localizados en el Sistema Nervioso Central, SNC y periférico, antagonizando las acciones de los opiáceos de administración exógena.
- melatonina; 2-6 mg de liberación lenta/liberación prolongada antes de acostarse. La melatonina tiene propiedades antiinflamatorias y antioxidantes y es un poderoso regulador de la función mitocondrial. [51-55] La dosis debe comenzar con 750 mcg (μg) a 1 mg por la noche y aumentar según la tolerancia. Los pacientes que son metabolizadores lentos pueden tener sueños muy desagradables y vívidos con dosis más altas.
- Aspirina; 81 mg/día.
- Vitamina C; 1000 mg por vía oral tres a cuatro veces al día. La vitamina C tiene importantes propiedades antiinflamatorias, antioxidantes y potenciadoras del sistema inmunitario, incluida una mayor síntesis de interferones de tipo I. [56-60] Evitar en pacientes con antecedentes de cálculos renales. La vitamina C oral ayuda a promover el crecimiento de poblaciones bacterianas protectoras en el microbioma.
- vitamina D y vitamina K2 ; La dosis de vitamina D debe ajustarse de acuerdo con el nivel inicial de vitamina D. Sin embargo, una dosis de 4000-5000 unidades/día de vitamina D, junto con 100 mcg/día de vitamina K2 es una dosis inicial razonable.
- quercetina; 250-500 mg/día (o flavonoides mixtos). Los flavonoides tienen propiedades antiinflamatorias de amplio espectro, inhiben los mastocitos [61-65] y se ha demostrado que reducen la neuroinflamación. [66] Debido a la posible interacción farmacológica entre la quercetina y la ivermectina (ver a continuación), estos medicamentos no deben tomarse simultáneamente (es decir, deben escalonarse por la mañana y la noche). El uso de quercetina rara vez se ha asociado con hipotiroidismo. [67] El impacto clínico de esta asociación puede limitarse a aquellas personas con enfermedad tiroidea preexistente o con tiroidismo subclínico. La quercetina debe usarse con precaución en pacientes con hipotiroidismo y deben controlarse los niveles de TSH.
- nigella sativa; 200-500 mg dos veces al día. [68-71] Cabe señalar que la timoquinona (el ingrediente activo de Nigella Sativa) disminuye la absorción de ciclosporina y fenitoína. Por lo tanto, los pacientes que toman estos medicamentos deben evitar tomar Nigella Sativa. [72] Además, se informaron dos casos de síndrome serotoninérgico en pacientes que tomaban Nigella Sativa y que se sometieron a anestesia general (probable interacción con opiáceos). [73]
- Probióticos/prebióticos ; Los pacientes con síndrome posvacunal presentan clásicamente una disbiosis severa con pérdida de Bifidobacterium. [74-76] El kéfir es un suplemento nutricional altamente recomendado con alto contenido de probióticos. [77] Los probióticos sugeridos incluyen Megasporebiotic (Microbiome labs) y TrueBifidoPro (US Enzymes).
- magnesio ; 500 mg/día.
- Ácidos grasos omega-3 : Vascepa, Lovaza o DHA/EPA; 4 g/día. Los ácidos grasos omega-3 juegan un papel importante en la resolución de la inflamación al inducir la producción de resolvina. [78,79]
Terapias complementarias/de segunda línea (enumeradas en orden de importancia)
Hidroxicloroquina (HCQ); 200 mg dos veces al día durante 1 a 2 semanas, luego reduzca según lo tolere a 200 mg/día. HCQ es el agente de segunda línea preferido. La HCQ es un potente agente inmunomodulador y se considera el fármaco de elección para el lupus eritematoso sistémico (LES), donde se ha demostrado que reduce la mortalidad por esta enfermedad. Por lo tanto, en pacientes con autoanticuerpos positivos o en los que se sospeche que la autoinmunidad es un mecanismo subyacente destacado, se debe considerar antes la HCQ. Además, cabe señalar que el LES y el síndrome posvacunal tienen muchas características en común. HCQ es seguro durante el embarazo; de hecho, este medicamento se ha utilizado para tratar la preeclampsia. [80-84] Con el uso a largo plazo, la dosis debe reducirse (100 o 150 mg/día) en pacientes que pesan menos de 61 kg (135 lb).
- vitamina C intravenosa ; 25 g semanales, junto con vitamina C oral 1000 mg (1 gramo) 2-3 veces al día. Las dosis altas de vitamina C por vía intravenosa son «cáusticas» para las venas y deben administrarse lentamente durante 2 a 4 horas. Además, para evaluar la tolerabilidad del paciente, la dosis inicial debe estar entre 7,5 y 15 g. Las dosis diarias totales de 8-12 g han sido bien toleradas, sin embargo, las dosis altas crónicas se han asociado con el desarrollo de cálculos renales, por lo que la duración del tratamiento debe ser limitada. [85-90] Retirar la vitamina C IV según se tolere.
- fluvoxamina ; Comience con una dosis baja de 12,5 mg/día y aumente lentamente según lo tolere.
- “Optimizador de energía mitocondrial” con pirroloquinolina quinona (p. ej., Life Extension Energy Optimizer o ATP 360®). [91-93]
- N-acetilcisteína (NAC) ; 600-1500 mg/día. [94-96]
- Sulforafano (extracto de brócoli) ; 400 mcg/día. [97-99]
- corticosteroides en dosis bajas ; 10-15 mg/día de prednisona durante 3 semanas. Disminuir a 10 mg/día y luego 5 mg/día, según se tolere.
- La modificación del comportamiento, la terapia de atención plena [100] y el apoyo psicológico pueden ayudar a mejorar el bienestar general y la salud mental de los pacientes. [101] El suicidio es un problema real en el paciente lesionado por vacunas. Los grupos de apoyo y la consulta con profesionales de la salud mental son importantes.
- taichí ; El Tai Chi es una forma de arte marcial chino tradicional que promueve la salud y ha demostrado ser beneficiosa para prevenir y tratar enfermedades, incluido el COVID prolongado. [102,103] Se debe tener en cuenta que la COVID prolongada se caracteriza por una fatiga grave posterior al esfuerzo y/o un empeoramiento de la sintomatología, por lo tanto, se debe aconsejar a los pacientes que realicen un esfuerzo moderado, aumentando lentamente solo según lo toleren. [104]
Terapia de tercera línea
- Terapia de oxígeno hiperbárico (TOHB) [105-113]; HBOT tiene potentes propiedades antiinflamatorias, disminuyendo las citoquinas proinflamatorias mientras aumenta la IL-10. Además, TOHB polariza los macrófagos hacia el fenotipo M2 y mejora la función mitocondrial. Sorprendentemente, es el aumento de la presión, más que el aumento de la concentración de oxígeno disuelto, lo que parece mediar estos efectos. Si bien la dosis óptima y el programa de dosificación no están claros, parece ser necesaria una presión de entre 1,5 y 2,0 ATM para mediar los efectos antiinflamatorios; sin embargo, otros han informado mejoras con tan solo 1,3 ATM. Presiones arriba. ATM solo se puede lograr usando cámaras de cubierta dura. Si bien hay datos publicados muy limitados sobre el tratamiento de la COVID prolongada y el síndrome posterior a la vacuna, se han informado anecdóticamente beneficios notables para salvar vidas. Esta terapia está limitada por problemas logísticos y de costo.
Otros tratamientos potenciales (requiere evaluación adicional)
- plasmaféresis ; La plasmaféresis mejora los niveles sistémicos de citocinas, la coagulopatía y la capacidad de respuesta inmunitaria en pacientes con COVID grave con un posible beneficio en la mortalidad. [115-122] Kiprov, et. Alabama. han publicado un informe de caso de una mejora clínica dramática en un paciente con COVID prolongado. [123] En este informe, los marcadores de macrófagos inflamatorios del paciente disminuyeron y los marcadores de linfocitos, incluidas las células asesinas naturales y las células T CD8 citotóxicas, aumentaron; además, las proteínas inflamatorias circulantes disminuyeron. Además, es probable que la plasmaféresis elimine los autoanticuerpos y mejore la coagulopatía de estos pacientes. Nosotros
están al tanto de informes anecdóticos de marcada mejoría en los síntomas neurológicos, especialmente SFN y niebla cerebral en pacientes lesionados por vacunas tratados con esta modalidad terapéutica. Sin embargo, este es un recurso limitado y costoso que, en sí mismo, no está exento de complicaciones. Además, es necesario determinar la durabilidad de la respuesta clínica. Si bien la plasmaféresis/recambio de plasma es una opción terapéutica para el paciente con discapacidad neurológica grave después de la vacunación, se requieren datos adicionales antes de que esta modalidad pueda recomendarse ampliamente.
- pentoxifilina (PTX); Se debe considerar PTX ER, 400 mg tres veces al día, en aquellos pacientes con trastornos microcirculatorios graves. PTX es un fármaco fosfodiesterasa no selectivo que tiene efectos antiinflamatorios y antioxidantes. [124] Además, la PTX mejora la deformabilidad de los glóbulos rojos y reduce la viscosidad de la sangre, por lo que puede mitigar la hiperviscosidad y la hiperagregación de glóbulos rojos, que está relacionada con el desarrollo de coagulopatía en los lesionados por la vacuna.
- maraviroc; 300 mg por vía oral dos veces al día. Si han transcurrido de 6 a 8 semanas y los síntomas significativos persisten a pesar de las terapias anteriores, se puede considerar este medicamento. Tenga en cuenta que Maraviroc puede ser costoso y tiene riesgo de efectos secundarios e interacciones farmacológicas importantes. Maraviroc es un antagonista del receptor de quimiocinas CC tipo 5 (CCR5). Si bien muchos pacientes con COVID prolongado y después de la vacuna han sido tratados con Maraviroc, el papel de este medicamento requiere una evaluación adicional. [114]
- ácido valproico [125,126]; Depakote, 250 mg 2-3 veces al día. El ácido valproico tiene efectos antiinflamatorios y polariza los macrófagos hacia un fenotipo M2. [127] Los inhibidores de HDAC se están estudiando para la regeneración neuronal. Además, el ácido valproico tiene importantes efectos anticoagulantes y antiplaquetarios. [128] El ácido valproico puede ser útil para los síntomas neurológicos.
- Sildenafil con o sin L-arginina-L-citrulina [129-134]; Dosis de sildenafilo aumentadas de 25 a 100 mg 2-3 veces al día con L-arginina/L-citrulina 5000 mg en polvo dos veces al día. Puede ser útil para la niebla mental, así como para la enfermedad microvascular con coagulación y perfusión deficiente. Cabe señalar que la curcumina, el resveratrol, el EGGG y el ácido valproico potencian los inhibidores de la fosfodiesterasa 5 (PDE5).
- VEDICINALES® 9 ; _ una suspensión terapéutica única basada en fitofármacos que consta de nueve compuestos bioactivos con propiedades antivirales, antiinflamatorias, inmunomoduladoras, antipiréticas y analgésicas. Los compuestos incluyen baicalina, quercetina, luteolina, rutina, hesperidina, curcumina, galato de epigalocatequina, piperina y glicirricina. ( https://www.vedicinals.com/vedicinals-9/ ). Varios de estos compuestos están incluidos en nuestro protocolo y se desconoce el beneficio adicional de esta combinación de 9 fitofármacos sobre las combinaciones de flavonoides más ampliamente disponibles. [135]
- fullerenos C60 o C60 [136,137]; C60, abreviatura de Carbon 60, está compuesto por 60 átomos de carbono que forman algo que parece un balón de fútbol hueco y se considera una «esponja de radicales libres». C60 se considera el antioxidante más poderoso jamás descubierto. Robert Curl, Harold Kroto y Richard Smalley recibieron el Premio Nobel de química en 1996 por su descubrimiento.
- hidroterapia fría (por ejemplo, duchas frías) [138,139]; Evite los baños de agua tibia/caliente.
Complementos terapéuticos específicos de la enfermedad
Neuropatía de fibras pequeñas (SFN)/neuropatía autonómica
- Antidepresivos tricíclicos (comenzar con dosis bajas y aumentar según se tolere)
- gabapentina; 300 mg dos veces al día y aumentar según tolerancia
- Ácido alfa lipoico; 600 mg/día
- POTS: asegure una hidratación suficiente y considere el uso de medias de compresión o fajas abdominales
- POTS – Clonidina; 0,1 mg dos veces al día según tolerancia
- POTS – fludrocortisona; 0,1 a 0,2 mg/día o raíz de regaliz (tiene ácido glicirrícinico, un compuesto similar a la aldosterona).
- POTS – midodrina; 5-10 mg tres veces al día
- Un ensayo de oxigenoterapia hiperbárica (TOHB)
- Cabe señalar que el diagnóstico de neuropatía de fibras pequeñas/neuropatía autonómica es un diagnóstico clínico. [21-28] NO se requieren pruebas complejas y costosas para hacer este diagnóstico. Cabe señalar que SFN está estrechamente asociado con múltiples autoanticuerpos. La prueba de estos autoanticuerpos no tiene ningún propósito clínico útil.
Síntomas neurológicos generalizados/lesiones/“niebla cerebral”/fatiga
- LDN parece desempeñar un papel fundamental en el tratamiento de muchos síntomas neurológicos
- fluvoxamina; Comience con una dosis baja de 12,5 mg/día y aumente lentamente según lo tolere. Algunos pacientes informan una mejora significativa con fluvoxamina, mientras que otros pacientes parecen tolerar mal este medicamento. La fluoxetina 20 mg/día es una alternativa, al igual que los antidepresivos tricíclicos.
- nigella sativa; 200-500 mg dos veces al día.
- El ácido valproico y la pentoxifilina pueden ser valiosos en estos pacientes.
- Estos síntomas pueden estar mediados por el Síndrome de Activación de Mastocitos (MCAS); ver tratamiento específico a continuación.
Pacientes con una DIC elevada y aquellos con evidencia de trombosis
- Estos pacientes deben ser tratados con NOAC o coumadin durante al menos tres meses y luego reevaluados para la anticoagulación en curso.
- Los pacientes deben continuar con 81 mg/día de AAS a menos que tengan un alto riesgo de hemorragia.
- La lumbroquinasa activa la plasmina y degrada la fibrina. por ejemplo, Lumbroxym (enzimas estadounidenses). [140] La lumbroquinasa parece ser bien absorbida por el tracto GI. [141]
- Cúrcuma (Curcumina) 500 mg BID. La curcumina tiene propiedades anticoagulantes, antiplaquetarias y fibrinolíticas. [142]
- Se debe considerar la anticoagulación triple en pacientes seleccionados. [143] Tratar no más de un mes. La triple anticoagulación aumenta el riesgo de hemorragia grave; los pacientes deben ser asesorados con respecto a esta complicación.
- En aquellos pacientes con enfermedad microvascular/trombosis marcada, la combinación de pentoxifilina y sildenafilo debe probarse terapéuticamente. [124,144]
Miocarditis/pericarditis inducida por vacunas
- Inhibidor de la ECA/ARB, junto con carvedilol según se tolere para prevenir/limitar el deterioro progresivo de la función cardíaca.
- Colchicina en pacientes con pericarditis – 0,6 mg/día por vía oral; aumentar a 0,6 mg dos veces al día si es necesario. Reducir la dosis si los pacientes desarrollan diarrea. Vigilar el recuento de glóbulos blancos. Disminuir la dosis con insuficiencia renal.
- Derivación a un cardiólogo o sala de emergencias en caso de dolor torácico persistente u otros signos y síntomas de eventos cardíacos.
Síndrome de reactivación del virus del herpes
- L-lisina; 1000 mg dos veces al día [145,146]
- Valtrex; 500-1000 mg dos veces al día durante 7-10 días
Tinnitus
- Esta es una complicación frecuente e incapacitante reportada en el síndrome posvacunal.
- El tinnitus se refiere a la sensación de sonido en ausencia de un estímulo acústico externo correspondiente y, por lo tanto, puede clasificarse como un fenómeno fantasma. Las sensaciones de tinnitus suelen ser de naturaleza acústica no formada, como zumbidos, silbidos o pitidos. El tinnitus se puede localizar unilateral o bilateralmente, pero también se puede describir que surge dentro de la cabeza. [147]
- Idealmente, los pacientes deben ser evaluados por un otorrinolaringólogo o un audiólogo para descartar trastornos subyacentes.
- Existen varios enfoques de tratamiento para controlar esta enfermedad incapacitante, entre ellos: [147-149]
- Terapia cognitiva conductual [150]
- Terapia especializada que incluye terapia de reentrenamiento de tinnitus, audífonos, terapia de sonido, entrenamiento de percepción auditiva y estimulación magnética transcraneal repetitiva. [147]
- Se han utilizado varios agentes farmacológicos para tratar el tinnitus. Los anticonvulsivos, incluida la carbamazepina, en general han sido decepcionantes. Los siguientes medicamentos han mostrado algún beneficio clínico.
- Agentes antidepresivos tricíclicos, particularmente nortriptilina y amitriptilina. [151,152] Además, el ISRS sertralina ha mostrado cierta eficacia. [153]
- Clonazepam y otras benzodiazepinas. Estos medicamentos pueden proporcionar un alivio temporal, sin embargo, debido a la cuestión de la dependencia, no se recomienda su uso a largo plazo. [154]
- Melatonina de liberación lenta 2-6 mg al acostarse. [155]
Parálisis de Bell/parestesia facial, problemas visuales
- Naltrexona en dosis bajas. Comience con 1 mg/día y aumente a 4,5 mg/día según sea necesario. Puede tomar 2-3 meses para el efecto completo.
- Corticoides a dosis bajas: 10-15 mg/día de prednisona durante 3 semanas. Disminuya a 10 mg/día y luego a 5 mg/día según lo tolere.
- Reducción de la carga de trabajo, estrés y ejercicios ligeros durante un par de meses.
Pacientes con diátesis alérgica de nueva aparición y aquellos con características del Síndrome de Activación de Mastocitos (MCAS)
- Se informa que el nuevo flavonoide luteína es un potente inhibidor de mastocitos. [61,62,64,65] Se sugiere 20-100 mg/día de luteína.
- cúrcuma (curcumina); 500 mg/día. Se ha informado que la curcumina bloquea los receptores H1 y H2 y limita la desgranulación de los mastocitos. [156,157]
- bloqueadores de los receptores H1. Loratadina 10 mg/día, Cetirizina 5-10 mg/día, Fexofenadina 180 mg/día.
- Bloqueadores de los receptores H2. Famotidina 20 mg dos veces al día según tolerancia. [158]
- Montelukast 10 mg/día. Precaución ya que puede causar depresión en algunos pacientes. Se ha cuestionado la eficacia de montelukast como “estabilizador de mastocitos”. [29]
- Vitamina C; 1000 mg dos veces al día. La vitamina C se recomienda encarecidamente para las condiciones alérgicas y MCAS. La vitamina C modula la función de las células inmunitarias y es un potente inhibidor de la histamina. Dieta baja en histamina.
Tratamiento IVIG (tratamiento con inmunoglobulina intravenosa)
- Generalmente, no se recomienda el tratamiento con IVIG.
- La respuesta a la IVIG en la población general de pacientes lesionados por vacunas es mixta, y muy pocos muestran una mejoría a largo plazo. Muchos pacientes que informan una mejoría inicial recaerán en 2 a 3 semanas. Otros pacientes no informan ningún beneficio, mientras que algunos parecen empeorar. Debido a la presencia de anticuerpos anti-SARS-CoV-2 no neutralizantes, existe la posibilidad real de que la IVIG provoque una mejora inmunitaria dependiente de anticuerpos (ADE) con una exacerbación grave de los síntomas.
- Sin embargo, IVIG se recomienda en síndromes autoinmunes específicos que incluyen el síndrome de Guillain Barré, mielitis transversa y trombocitopenia inmune. Estos pacientes deben ser tratados concomitantemente con las terapias inmunomoduladoras centrales.
- IVIG demostró ser ineficaz en un ECA que inscribió a pacientes con neuropatía de fibras pequeñas. [159]
- El hecho de que muchos pacientes notifiquen una respuesta inicial a la IVIG respalda la idea de que muchos aspectos de esta enfermedad se deben a los autoanticuerpos. IVIG eliminará los anticuerpos preformados, pero no evita que las células B sigan produciendo anticuerpos; por lo tanto, es probable que la respuesta sea de corta duración y, por lo tanto, se requieren intervenciones que limiten la producción de autoanticuerpos (terapias de modulación inmunitaria central).
Terapias inmunosupresoras
- Como regla general, debe evitarse la terapia inmunosupresora, ya que estos medicamentos pueden exacerbar la disfunción inmunitaria en pacientes lesionados por vacunas y evitar la restauración de la homeostasis inmunitaria.
- Una prueba de terapia inmunosupresora puede estar indicada en pacientes con un síndrome autoinmune establecido que han fracasado con otras intervenciones terapéuticas.
Dr. Pierre Kory: Nuevo Protocolo para Lesionados por Inyecciones K0 B1T
Los médicos Critical Care Alliance han desarrollado protocolos de tratamiento de Covid que salvan vidas utilizando medicamentos reutilizados altamente efectivos, seguros, ampliamente disponibles y probados exhaustivamente.
En esta entrevista el Dr. Pierre Kory, describió cómo la gran cantidad de estadounidenses vacunados desarrollan un síndrome posterior a la inyección que se manifiesta principalmente en fatiga, confusión mental, mareos y otros trastornos neurológicos. Dado que las autoridades de los Estados Unidos no reconocen las lesiones posteriores a la vacuna Covid, la FLCCC llenó el vacío y desarrolló el protocolo I-RECOVER para ayudar a las víctimas de la vacuna.
El Dr. Kory está certificado por la junta en medicina interna, enfermedades pulmonares y medicina de cuidados intensivos. También es un experto ampliamente publicado sobre enfoques terapéuticos para COVID-19 y tiene una gran experiencia en el tratamiento de COVID-19 en todas sus fases. Puede encontrar más información sobre la experiencia del Dr. Kory.
Para obtener más información sobre la FLCCC, vaya a: https://covid19criticalcare.com/
Para seguir el trabajo del Dr. Kory, consulte su Substack: https://pierrekory.substack.com/
Referencias
1.Blaylock RL. COVID Update: What is the truth? Surgical Neurology International 2022; 13.
2.Rose J. A report on the U.S. Vaccine Adverse Events Reporting System (VAERS) of the COVID-19messenger ribonucleic acid 9mRNA) biologicals. Science, Public Health Policy, and Law 2021;2:59-80.
3.Neil M, Fenton N, Smalley J et al. Latest statistics on England mortality data suggest systematicmis-categorisation of vaccine status and uncertain effectiveness of Covid-19 vaccination.Research Gate 2021.
4.Colunga Biancatelli RM, Solopov P, Sharlow E et al. The SARS-CoV-2 spike protein subunit 1induces COVID-19 like acute lung injury in K18-hACE2 transgenic mice and barrier dysfunction inhuman endothelial cells. Am J Physiol Lung Cell Mol Physiol 2021; 321:L477-L484.
5.Marik P, Iglesias J, Varon J et al. A Scoping Review of the pathophysiology of COVID-19.International Journal of Immunopathology and Pharmacology 2021.
6.Seneff S, Nigh G, Kyriakopoulos AM et al. Innate immune suppression by SARS-C-V-2 mRNAvaccinations: The role of G-quadruplexes, exosomes and microRNAs. Food & ChemicalToxicology 2022; 164:113008.
7.Chen BM, Cheng TL, Roffler SR. Polyethylene glycol immunogenicity: Theorectical, clinical andpractical aspects of anti-polyethylene glycol antibodies. ASC Nano 2021; 15:14022-48.
8.Cadegiani FA. Catecholamines are the key trigger of mRNA SARS-CoV-2 and mRNA COVID-19vaccine-induced myocarditis and sudden deahts: a compelling hypothesis supprted byepidemiological, anatomopathological, molecular and physiological findings. medRxiv 2022.
9.Schauer J, Buddhe S, Gulhane A et al. Persistent cardiac MRI findings in a cohort of adolescentswith post COVID-19 mRNA vaccine myopericarditis. J Pediatr 2022.
10.Verma AK, Lavine KJ, Lin CY. Myocarditis after COVID-19 mRNA vaccination. N Engl J Med 2022;385:1332-34.
11.Schiaffino MT, Di Natale M, Garcia-Martinez E et al. Immunoserologic detection and diagnosticrelevance of cross-reactive autoantibodies in Coronavirus disease 2019 patients. J Infect Dis2020; 222:1439-43.
12.Trahtemberg U, Fritzler MJ. COVID-19-associated autoimmunity as a feature of acute respiratoryfailure. Intensive Care Med 2021.
13.Woodruff MC, Ramoneli RP, Lee FE et al. Broadly-targeted autoreactivity is common in severeSARS-CoV-2 infection. medRxiv 2020.
14.Zuo Y, Estes SK, Ali RA et al. Prothrombotic autoantibodies in the serum from patientshospitalized with COVID-19. Sci Translation Med 2020.
15.Pascolini S, Vannini A, Deleonardi G et al. COVID-19 and immunological dysregulation: canautoantibodies be useful? Clin Trans Sci 2021; 14:502-8.
16.Wang EY, Mao T, Klein J et al. Diverse functional autoantibodies in patients with COVID-19.Nature 2021; 595:283-88.
17.Cabral-Marques O, Halpert G, Schimke LF et al. Autoantibodies targeting GPCRs and RAS-relatedmolecules associated with COVID-19 severity. Nature Communications 2022; 13:1220.
18.Arthur JM, Forrest JC, Boehme KW et al. Development of ACE2 autoantibodies after SARS-CoV-2infection. PloS ONE 2021; 16:e0257016.
19.Wallukat G, Hohberger B, Wenzel K et al. Functional autoantibodies against G-protein coupledreceptors in patients with persistent Long-Covid-19 symptoms. Journal of TranslationalAutoimmunity 2021; 4:100100.
20.Levine TD, Kafaie J, Zeidman LA et al. Cryptogenic small-fiber neuropathies: Serum autoantibodybinding to trisulfated heparin disaccharide and fibroblast growth factor receptor-3. Muscle &Nerve 2020; 61:512-15.
21.Oaklander AL, Mills AJ, Kelley M et al. Peripheral neuropathy evaluations of patients withprolonged long COVID. Neurol Neuroimmunol Neuroinflamm 2022; 9:e1146.
22.Burakgazi AZ. Small-fiber neuropathy possibly associated with COVID-19. Case Rep Neurol 2022;14:208-12.
23.Shouman K, Vanichkachorn G, Chesire WP et al. Autonomic dysfunction following COVID-19infection: an early experience. Clinical Autonomic Research 2021; 31:385-94.
24.Hinduja A, Moutairou A, Calvet JH. Sudomotor dysfunction in patients recovered from COVID-19.Clinical Neurophysiology 2021; 51:193-96.
25.Abdelnour L, Abdalla ME, Babiker S. COVID 19 infection presenting as motor peripheralneuropathy. Journal of the Formosan Medical Association 2020; 119:1119-20.
26.Abrams RM, Simpson DM, Navis A et al. Small fiber neuropathy associated with SARS-CoV-2infection. Muscle & Nerve 2021.
27.Zhou L, Shin S. Small fiber neuropathy. Practical Neurology 2021;36.
28.Bednarik J, Bursova S, Dusek L et al. Etiology of small-fiber neuropathy. Journal of the PeripheralNervous System 2009; 14:177-83.
29.Theoharides TC, Tsilioni I, Ren H. Recent advances in our understanding of mast cell activation-or should it be mast cell mediator disorders? Expert Rev Clin Immunol 2019; 15:639-56.
30.Weinstock LB, Brook JB, Walters AS et al. Mast cell activation symptoms are prevalent in Long-COVID. International Journal of Infectious Diseases 2021; 112:217-26.
31.Gold JE, Okyay R, Licht WE et al. Investigation of Long COVID prevalence and its relationship toEpstein-Barr Virus reactivation. Pathogens 2021; 10:763.
32.Chen T, Song J, Liu H et al. Positive Epstein-Barr virus detection in coronavirus disease 2019(COVID-19) patients. Scientific Reports 2021; 11:10902.
33.Le Balc’h P, Pinceaux K, Pronier C et al. Herpes simplex virus and cytomegalovirus reactivationsamong severe COVID-19 patients. Crit Care 2020; 24:530.
34.Duma D, Collins JB, Chou JW et al. Sexually dimorphic actions of glucocorticoids provide a link toinflammatory diseases with gender differences in prevalence. Science Signaling 2010; 3:ra74.
35.Tomassetti F, Nuccetelli M, Sarubbi S et al. Evaluation of S-RBD and high specificity ACE-2binding antibodies on SARS-CoV-2 patients after six months from infection. InternationalImmunopharmacology 2021; 99:108013.
36.Fung J, Moore J. The complete guide to fasting. Victory Belt Publishing; 2016.
37.deCabo R, Mattson MP. Effects of intermittent fasting on health, aging, and disease. N Engl JMed 2019; 381:2541-51.
38.Hannan A, Rahman A, Rahman S et al. Intermittent fasting, a possible priming tool for hostdefense against SARS-CoV-2 infection: Crosstalk among calorie restriction, autophagy andimmune response. Immunology Letters 2020; 226:38-45.
39.Zhao Y, Jia M, Chen W et al. The neuroprotective effects of intermittent fasting on brain agingand neurodegenerative diseases via regulating mitochondrial function. Free Radical Biology &Medicine 2022; 182:206-18.
40.Beckman JA. Thrombolytic therapy for pulmonary embolism. JAMA 2014; 311:2385-86.
41.Cheng CW, Adams GB, Perin L et al. Prolonged fasting reduces IGF-1/PKA to promotehematopoietic-stem-cell-based regeneration and reverse immunosppression. Cell Stem Cell2014; 14:810-823.
42.Hine C, Mitchell JR. Saying No to drugs: Fasting protects hematopoietic stem cells fromchemotherapy and aging. Cell Stem Cell 2014; 14:704.
43.Ci X, Li H, Yu Q et al. Avermectin exerts anti-inflammatory effect by downregulating the nucleartranscription factor kappa-B and mitogen activated protein kinase pathway. Fundamental &Clinical Pharmacology 2009; 23:449-55.
44.DiNicolantonio JJ, Barroso-Arranda J, McCarty M. Ivermectin may be a clinically useful anti-inflammatory agent for late-stage COVID-19. Open Heart 2020; 7:e001350.
45.Yan S, Ci X, Chen N et al. Anti-inflammatory effects of ivermectin in mouse model of allergicasthma. Inflamm Res 2011; 60:589-96.
46.Saha JK, Raihan J. The binding mechanism of ivermectin and levosalbutamol with spike proteinof SARS-CoV-2. Research Square 2021.
47.Bello M. Elucidation of the inhibitory activity of ivermectin with host nuclear importin alpha andseveral SARS-CoV-2 targets. Journal of Biomolecular Structure and Dynamics 2021.
48.Lehrer S, Rheinstein PH. Ivermectin docks to the SARS-CoV-2 spike receptor-binding domainattached to ACE2. In Vivo 2020; 34:3023-26.
49.Younger J, Parkitny L, McLain D. The use of low-dose naltrexone (LDN) as a novel anti-inflammatory treatment for chronic pain. Clin Rheumatol 2014; 33:451-59.
50.Toljan K, Vrooman B. Low-dose naltrexone (LDN) – Review of therapeutic utilization. Med Sci2018; 6:82.
51.Molina-Carballo A, Palacios-Lopez R, Jerez-Calero A et al. Protective effect of melatoninadministration against SARS-CoV-2 infection: A systematic review. Current Issues in MolecularBiology 2022; 44:31-45.
52.Hasan ZT, AlAtrakji MQ, Mehuaiden AK. The effect of melatonin on thrombosis, sepsis andmortality rate in COVID-19 patients. International Journal of Infectious Diseases 2022; 114:79-84.
53.Reiter RJ, Sharma R, Ma Q et al. Plasticity of glucose metabolism in activated immune cells:advantages for melatonin inhibition of COVID-19 disease. Melatonin Res 2020; 3:362-79.
54.Reiter RR, Sharma R, Castillo R et al. Coronavirus-19,Monocyte/Macrophage glycolysis andinhibition by melatonin. J SARS-CoV2 COVID 2021; 2:29-31.
55.Colunga Biancatelli RM, Berrill M, Mohammed YH et al. Melatonin for the treatment of sepsis:the scientific rationale. J Thorac Dis 2020; 12 (Suppl 1):S54-S65.
56.Marik PE. Hydrocortisone, Ascorbic Acid and Thiamine (HAT therapy) for the treatment of sepsis.Focus on ascorbic acid. Nutrients 2018; 10:1762.
57.Marik PE. Vitamin C for the treatment of sepsis: The scientific rationale. Pharmacol Therapeut2018; 189:63-70.
58.Colunga Biancatelli RM, Berrill M, Marik PE. The antiviral properties of vitamin C. Expert Rev AntiInfect Ther 2020; 18:99-101.
59.Miranda-Massari JR, Toro AP, Loh D et al. The effects of vitamin C on the multiple pathologicalstages of COVID-19. Life 2021; 11:1341.
60.Holford P, Carr AC, Zawari M et al. Vitamin C intervention for Critical COVID-19: A pragmaticreview of the current level of evidence. Life 2021; 11:1166.
61.Theoharides TT, Cholevas C, Polyzoidis K et al. Long-COVID syndrome-associated brain fog andchemofog: Luteolin to the rescue. Biofactors 2021; 47:232-41.
62.Theoharides TC. COVID-19, pulmonary mast cells, cytokine storms, and beneficial actions ofluteolin. Biofactors 2020; 46:306-8.
63.Bawazeer MA, Theoharides TC. IL-33 stimulates human mast cell release of CCL5 and CCL2 viaMAPK and NF-kB, inhibited by methoxyluteolin. Eur J Pharmacol 2019; 865:172760.
64.Weng Z, Patel AB, Panagiotidou S et al. The novel flavone tetramethoxyluteolin is a potentinhibitor of human mast cells. J Allergy Clin Immunol 2015; 135:1044-52.
65.Patel AB, Theoharides TC. Methoxyluteolin inhibits neuropeptide-stimulated proinflammatorymediator release via mTOR activation from human mast cells. J Pharmacol Exp Ther 2017;361:462-71.
66.Calis Z, Mogulkoc R, Baltaci AK. The roles of flavonols/flavonoids in neurodegeneration andneuroinflammation. Mini Rev Med Chem 2020; 20:1475-88.
67.Sathyapalan T, Manuchehri AM, Thatcher NJ et al. The effect of soy phytoestrogensupplementation on thyroid status and cardiovascular risk markers in patients with subclinicalhypothyroidism: A randomized, double-blind, crossover study. J Clin Endocrinol Metab 2020;96:1422-49.
68.Islam MT, Guha B, Hosen S et al. Nigellalogy: A review on Nigella Sativa. MOJ Bioequiv Availab2017; 3:00056.
69.Barbash IJ, Davis BS, Yabes JG et al. Treatment patterns and clinical outcomes after theintroduction of the Medicare Sepsis Performance Measure (SEP-1). Ann Intern Med 2021.
70.Ashraf S, Ashraf S, Ashraf M et al. Honey and Nigella sativa against COVID-19 in Pakistan (HNS-COVID-PK): A multi-center placebo-controlled randomized clinical trial. medRxiv 2021.
71.Fakhar-e-Alam Kulyar M, Li R, Mehmood K et al. Potential influence of Nagella sativa (Blackcumin) in reinforcing immune system: A hope to decelerate the COVID-19 pandemic.Phytomedicine 2021; 85:153277.
72.Hannan MA. Black Cumin (Nigella sativa L.): A Comprehensive Review on Phytochemistry, HealthBenefits, Molecular Pharmacology, and Safety. Nutrients 2021; 13.
73.Warner ME, Naranjo J, Pollard EM et al. Serotonergic medications, herbal supplements, andperioperative serotonin syndrome. Can J Anaesth 2017; 64:940-946.
74.Gutierrez-Castrellon P, Gandara-Marti T, Abreu AT et al. Probiotic improves symptomatic andviral clearance in Covid-19 outpatients: a randomized, quadruple-blinded, placebo-conttrolledtrial. GUT Microbes 2022; 14:e2018899.
75.Zuo T, Wu X, Wen W et al. Gut microbiome alterations in COVID-19. Genomics, Proteomics &Bioinformatics 2021.
76.Chen Y, Gu S, Chen Y et al. Six-month follow-up of gut microbiota richness in patients withCOVID-19. Gut 2021.
77.Rosa DD, Dias MM, Grzeskowiak LM et al. Milk kefir: nutritional, micobiological and healthbenefits. Nutrition Research Reviews 2017; 30:82-96.
78.Lee CR, Zeldin DC. Resolvin infectious inflammation by targeting the host response. N Engl J Med2015; 373:2183-85.
79.Serhan CN. Novel pro-resolving lipid mediators in inflammation are leads for resolutionphysiology. Nature 2014; 510:92-101.
80.Shukla AM, Shukla AW. Expanding horizons for clinical applications of chloroquine,hydroxychloroquine and related structural analogues. Drugs in Context 2019; 8:2019-9-1.
81.Plantone D, Koudriavtseva T. Current and future use of chloroquine and hydroxychloroquine ininfectious, immune, neoplastic and neurological diseases: A mini review. Clin Drug Invest 2018;38:653-71.
82.Ruiz-Irastorza G, Khamashta MA. Hydroxychloroquine: the cornerstone of lupus therapy. Lupus2008; 17:271-73.
83.de Moreuil C, Alavi Z, Pasquier E. Hydroxychloroquine may be beneficial in preeclampsia andrecurrent miscarriage. Br J Clin Pharmac 2020; 86:39-49.
84.Siso A, Ramos-Casals M, Bove A et al. Previous antimalarial therapy in patients diagnosed withlupus nephritis: Influence on outcomes and survival. Lupus 2008; 17:281-88.
85.Fontana F, Cazzato S, Giovanella S et al. Oxalate nephropathy caused by excessive vitamin Cadministration in 2 patients with COVID-19. Kidney Int Rep 2020; 5:1815-22.
86.Auer BL. Relative hyperoxaluria, crystalluria and haematuria after megadose ingestion of vitaminC.Eur J Clin Invest 1998; 28:695-700.
87.Mashour S, Turner JF, Merrell R. Acute renal failure, oxalosis, and vitamin C supplementation: acase report and review of the literature. Chest 2000; 118:561-63.
88.McHugh GJ, Graber ML, Freebairn RC. Fatal vitamin C-associated acute renal failure. AnaesthIntensive Care 2008; 36:585-88.
89.Lawton JM, Conway LT, Crosson JT et al. Acute oxalate nephropathy after massive ascorbic acidadministration. Arch Intern Med 1985; 145:950-951.
90.Fletcher RH. The risk of taking ascorbic acid. JAMA Intern Med 2013; 173:388-89.
91.Misra HS, rajpurohit YS, Khairnar NP. Pyrroloquinoline-quinone and its versatile roles inbiological processes. J Biosci 2012; 37:312-25.
92.Akagawa M, Nakano M, Ikemoto K. Recent progress in studies on the health benefits ofpyrroloquinoline quinone. Bioscience, Biotenchnology, and Biochemistry 2016; 80:13-22.
93.Hamilton D, Jensen GS. Nutraceutical support of mitochoncrial function associated withreduction of long-term fatigue and inflammation. Alternative Therapies in Health & Medicine2021; 27:8-18.
94.Izquierdo JL, Soriano JB, Gonzalez Y et al. Use of N-Acetylcysteine at high doses as an oraltreatment for patients with COVID-19. Science Progress 2022; 105.
95.Shi Z, Puyo CA. N-Acetylcysteine to combat COVID-19: an evidence review. Therapeutics andClinical Risk Management 2020; 16:1047-55.
96.De Flora S, Balansky R, La Maestra S. Rationale for the use of N-acetylcysteine in bothprevention and adjuvant therapy of COVID-19. FASEB J 2020.
97.Houghton CA, Fassett RG, Coombes JS. Sulforane: translational research from laboratory benchto clinic. Nutr Rev 2013; 71:709-26.
98.Kim JK, Park SU. Current potential health benefits of sulforaphane. EXCLI Journal 2016; 15:571-77.
99.Mokhtari RB, Baluch N, Homayouni TS et al. The role of sulforaphane in cancerchemoprevention and health benefits: a mini-review. J Cell Commun Signal 2018; 12:91-101.
100.Sanabria-Mazo JP, Montero-Marin J, Feliu-Soler A et al. Mindfulness-based program plusamygdala and inusla retraining (MAIR) for the treatment of women with fibromyalgia: A pilotramdomized controlled trial. J Clin Med 2020; 9:3246.
101.Yong SJ. Long-haul COVID-19: Putative pathophysiology, risk factors, and treatments. medRxiv2020.
102.Shu C, Feng S, Cui Q et al. Impact of Tai Chi on CRP, TNF-alpha and IL-6 in inflammation: asystematic review and meta-analysis. Ann Palliat Med 2021; 10:7468-6478.
103.Zhang Z, Ren JG, Guo JL et al. Effects of Tai Chi and Qigong on rehabilitation after COVID-19: aprotocl for systematic review and meta-analysis. BMJ Open 2022; 12:e059067.
104.Brown JT, Saigal A, Karia N et al. Ongoing exercise intolerance following COVID-19: A magneticresonance-Augmented Cardiopulmonary excercise Test Study. J Am Heart Assoc 2022;11:e024207.
105.Robbins T, Gonevski M, Clark C et al. Hyperbaric oxygen therapy for the treatment of longCOVID: early evaluation of a highly promising intervention. Clinical Medicine 2021; 21:e629-e632.
106.Oliaei S, Mehrtak M, Karimi A et al. The effects of hyperbaric oxygen therapy (HBOT) oncoronavirus disease-2019 (COVID-19): a systematic review. Eur J Med Res 2021; 26:96.
107.Senniappan K, Jeyabalan S, Rangappa P et al. Hyperbaric oxygen therapy: Can it be a novelsupportive therap in COVID-19? Indian Journal of Anaesthesia 2020; 64:835-41.
108.Kjellberg A, De Maio A, Lindholm P. Can hyperbaric oxygen safely serve as an inti-inflammatorytreatment for COVID-19? Medical Hypotheses 2020; 144:110224.
109.Hadanny A, Abbott S, Suzin G et al. Effect of hyperbaric oxygen therapy on chronicneurocognitive deficits of post-traumatic brain injury patients: retrospective analysis. BMJ Open2018; 8:e023387.
110.Han CH, Zhang PX, Xu WG et al. Polarization of macrophages in the blood after decompression inmice. 7 2017;240.
111.De Maio A, Hightower LE. COVID-19, acute respiratory distress syndrome (ARDS), and hyperbaricoxygen therapy (HBOT): what is the link? Cell Stress & Chaperones 2020; 25:717-20.
112.Buras JA, Holt D, Orlow D et al. Hyperbaric oxygen protects from sepsis mortality via aninterleukin-10-dependent mechanism. Crit Care Med 2006; 34:2624-29.
113.Tezgin D, Giardina C, Perdrizet GA et al. The effect of hyperbaric oxygen on mitochondrial andglycolytic energy metabolism: the caloristasis concept. Cell Stress and Chaperones 2020; 25:667-77.
114.Patterson B, Yogendra R, Guevara-Coto J et al. Targeting the monocytic-endothelial-platelet axiswith maraviroc and pravastatin as a therapeutic option to treat long COVID/Post-acute sequelaeof COVID (PASC). Research Square 2022.
115.Jamme M, Mazeraud A. Plasmapheresis efficiency in Coronavirus disease 2019: More related towhat you add and not what you take away? Crit Care Med 2021.
116.Patidar GK, Land KJ, Vrielink H et al. Understanding the role of therapeutic plasma exchange inCOVID-19: preliminary guidance and practices. Vox Sanguinis 2021.
117.Hashemian SM, Shafigh N, Afzal G et al. Plasmapheresis reduces cytokine and immune cell levelsin COVID-19 patients with acute respiratory distress syndrome (ARDS). Pulmonary 2021; 27:486-92.
118.Balagholi S, Dabbaghi R, Eshghi P et al. Potential of therapeutic plasmapharesis in treatment ofCOVID-19 patients: immunopathogenesis and coagulopathy. Transfusion and Apheresis Science2020; 59:102993.
119.Keith P, Day M, Perkins L et al. A novel treatment approach to the novel coronavirus: anargument for the use of therapeutic plasma exchange for fulminant COVID-19. Crit Care 2020;24:128.
120.Morath C, Weigand MA, Zeier M et al. Plasma exchange in critically ill COVID-19 patients. CritCare 2020; 24:481.
121.Fernandez J, Gratacos-Gines J, Olivas P et al. Plasma exchange: An effective rescue therapy incritically ill patients with Coronavirus Disease 2019 infection. Crit Care Med 2020.
122.Gucyetmez B, Atalan HK, Sertdemir I et al. Therapeutic plasma exchange in patients with COVID-19 pneumonia in intensive care unit: a retrospective study. Crit Care 2020; 24:492.
123.Kiprov DD, Herskowitz A, Kim D et al. Case report. Therapeutic and immunomodulatory effectsof plasmapheresis in long-haul COVID. F1000Research 2022; 10:1189.
124.Mostafa-Hedeab G, Al-kuraishy HM, Al-Gareeb AA et al. A raising dawn of pentoxifylline in themanagement of inflammatory disorders in Covid-19. Inflammopharmacology 2022.
125.Pitt B, Sutton NR, Wang Z et al. Potential repurposing of the HDAC inhibitor valproic acid forpatients with COVID-19. Eur J Pharmacol 2021; 898:173988
126.Unal G, Turan B, Balcioglu YH. Immunopharmacological management of COVID-19: Potentialtherapeutic role of valproic acid. Medical Hypotheses 2020; 14:109891.
127.Wu C, Li A, Leng Y et al. Histone deacetylase inhibition by sodium valproate regulatespolarization of macrophage subsets. DNA and Cell Biology 2012; 31:592-99.
128.Larsson P, Alwis I, Niego B et al. Valproic acid selectively increases vascular endothelial tissue -type plasminogen activator production and reduces thrombus formation in the mouse. J ThrombHaemost 2016; 14:2496-508.
129.Santamarina MG, Boisier D, Contreras R et al. COVID-19: a hypothesis regarding the ventilation-perfusion mismatch. Crit Care 2020; 24:395.
130.Mario L, Roberto M, Marta L et al. Hypothesis of COVID-19 therapy with sildenafil. InternationalJournal of Preventive Medicine 2020; 11:76.
131.Santamarina MG, Beddings I, Martinez Lomakin F et al. Sildenafil for treating patients withCOVID-19 and perfusion mismatch: a pilot randomized trial. Crit Care 2022; 26:1.
132.Kniotek M, Boguska A. Sildenafil can affect innate and adaptive immune system in bothexperimental animals and patients. Journal of Immunology Research 2017; 2017:4541958.
133.Isidori AM, Giannetta E, Pofi R et al. Targeting the NO-cGMP-PDE5 pathoway in COVID-19infection. The DEDALO project. Andrology 2021; 9:33-38.
134.Al-kuraishy HM, Ali-Gareeb AI, Al-Niemi MS et al. COVID-19 and phosphodiesterase enzyme type5 inhibitors. J Microsc Ultrastruct 2022; 8:141-45.
135.Harasstaini OA, Moin S, Tham CL et al. Flavonoid combinations cause synergistic inhibition ofproinflammatory mediator secretion form lipopolysaccharide-induced RAW 264.7 cells.Inflammation Research 2010; 59:711-21.
136.Marforio TD, Mattioli EJ, Zerbetto F et al. Fullerenes against COVID-19: Repurposing C50 and C70to clog the active site of SARS-CoV-2 protease. Molecules 2022; 27:1916.
137.Hurmach Vv, Platonov MO, Prylutska SV et al. C60 fullerene against SARS-CoV-2 coronavirus: anin silico insight. Scientific Reports 2021; 11:17748.
138.Shevchuk N. Adapted cold shower as a potential treatment for depression. Medical Hypotheses2008; 70:995-1001.
139.Mooventhan A, Nivethitha L. Scientific evidence-based effects of hydrotherapy on varioussystems of the body. North American Journal of Medical Sciences 2014; 6:199-209.
140.Wang YH, Li SA, Huang CH et al. Sirt1 activation by post-ischemic treatment with lumbrokinaseprotects against myocardial ischemia-reperfusion injury. Fronteirs in Pharmacology 2018; 9:636.
141.Yan XM, Kim CH, Lee CK et al. Intestinal absorption of fibrinolytic and proteolytic lumbrokinaseextracted from earthworm, Eisenia andrei. Korean J Physiol Pharmacol 2010; 14:71-75.
142.Keihanian F, Saeidinia A, Bagheri RK et al. Curcumin, hemostasis, thrombosis, and coagulation. JCell Physiol 2018; 233:4497-511.
143.Pretorius E, Venter C, Laubshder G et al. Combined triple treatment of fibrin amyloid microclotsand platelet pathology in individuals with long COVID/Post -acute sequelae of COVID-19 (PASC)can resolve their persistent symptoms. Research Square 2021.
144.Ng WK, Rosenblatt Y, Brock GB et al. Phosphodiesterase inhibitors in vascular ischemia: A casereport and review of their use in ischemic conditions. Can J Plast Surg 2010; 18:e5-e9.
145.Griffith RS, Wlash DE, Myrmel KH et al. Sucess of L-Lysine therapy in frequently recurrent Herpessimplex infection. Treatment and prophylaxis. Dermatologica 1987; 175:183-90.
146.Griffith RS, Norins AL, Kagan C. A multicentered study of Lysine therapy in Herpes simplexinfection. Dermatologica 1978; 156:257-67.
147.Langguth B. Treatment of tinnitus. Curr Opin Otolaryngol Head Neck Surg 2015; 23:361-68.
148.Langguth B. Pharmacological approaches to the treatment of tinnitus. Drug Discovery Today2010; 15:300-305.
149.Langguth B, Elgoyhen AB, Cederroth CR. Therapeutic approaches to the treatment of tinnitus.Ann Rev Pharmacol Toxicol 2019; 59:291-313.
150.MartinezDevesda P, Waddell A, Perera R et al. Cognitive behavioral therapy for tinnitus(Review). Cochrane Database of Syst Rev 2007.
151.Sullivan M, Katon W, Russo J et al. A randomized trial of nortriptyline for severe chronic tinnituseffects on depression, disability, and tinnitus symptoms. Arch Intern Med 1993; 153:2251-59.
152.Bayar N, Boke B, Turan E et al. Efficacy of amitriptyline in the treatment of subjective tinnitus.Journal of Otolaryngology 2001; 30:300-303.
153.Zoger S, Svedlund J, Holgers KM. The effects of sertraline on severe tinnitus suffering – Arandomized, double-blind, placebo-controlled study. J Clin Psychopharmacology 2006; 26:32-39.
154.Bahmad FM, Venosa AR, Oliveira CA. Benzodiazepines and GABAergics in treating severedisabling tinnitus of predominantly cochlear origin. 12 2006;144.
155.Hosseinzadeh A, Kamrava SK, Moore BC et al. Molecular aspects of melatonin treatment intinnitus: A review. Current Drug Targets 2019; 20:1112-28.
156.Jacob A, Wu R, Zhou M et al. Mechanism of the anti-inflammatory effect of Curcumin: PPAR-gamma activation. PPAR Research 2007; 2007:89369.
157.Kakavas S, Karayiannis D, Mastora Z. The complex interplay between immunonutrition, mastcells, and histamine signaling in COVID-19. Nutrients 2021; 13:3458.
158.Afrin LB, Weinstock LB, Molderings GJ. COVID-19 hyperinflammation and post-Covid-19 illnessmay be rooted in mast cell activation syndrome. Int J Infect DIs 2020.
159.Geerts M, de Greef BT, Sopacua M et al. Intravenous immunoglobulin therapy in patients withpainful idiopathic small fiber neuropathy. Neurology 2022; 96:e2534-e2545.