La FDA autorizó la inyección BNT162b2 COVID-19 de Pfizer bajo Autorización de uso de emergencia (EUA) para los EE. UU. a partir del 10 de diciembre de 2020. Otras inyecciones COVID-19 distribuidas en los EE. UU. bajo EUA incluyen la inyección de Moderna mRNA-1273, la inyección Johnson & Johnson Janssen y las vacunas Novavax Nuvaxovid y Covovax. La FDA otorgó la aprobación total a las inyecciones Pfizer (Comirnaty) y Moderna (Spikevax).
Las inyecciones de Pfizer y Moderna se basan en tecnología de ARNm, las vacunas de Novavax se basan en tecnología de proteínas recombinantes y la inyección de Johnson & Johnson se basa en tecnología de adenovirus humanos. A partir del 7 de mayo de 2023, la inyección Johnson & Johnson Janssen ya no está disponible en EE.UU.
En Europa, la inyección de AZD1222 de Oxford-AstraZeneca se basa en el adenovirus de chimpancé modificado ChAdOx1; y en China, la vacuna Sinovac CoronaVac es una vacuna de virus inactivado.
Muchos investigadores han publicado estudios que investigan los vínculos entre diferentes tipos de inyecciones COVID-19 y eventos adversos graves que incluyen:
- Miocarditis,
- pericarditis,
- trastornos de la coagulación sanguínea,
- culebrilla,
- pérdida de audición,
- hospitalizaciones y
- muerte.
Este artículo presenta estudios en los que los investigadores compararon directamente a individuos vacunados con controles no vacunados.
Estudios que demuestran que las vacunas pueden causar autismo, por Brian Hooker Ph.D https://www.bitchute.com/video/O8OF03Q32gOh/
Eventos adversos, parálisis de Bell
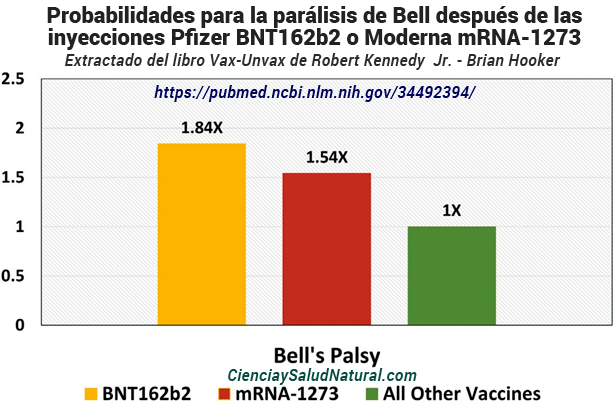
La figura 10.1 muestra los resultados del artículo “Parálisis del nervio facial después de la administración de inyecciones de ARNm de COVID-19: análisis de una base de datos de autoinforme”, publicado en el International Journal of Infectious Diseases en 2021.1 El autor principal, el Dr. Kenichiro Sato, está afiliado al Departamento de Neurología de la Escuela de Graduados en Medicina de la Universidad de Tokio en Japón. En la mayoría de los casos, los médicos informaron la aparición de parálisis del nervio facial tres o cuatro días después de la vacunación con ARNm.
Los pacientes que recibieron la inyección BNT162b2 de Pfizer mostraron la mayor incidencia de parálisis de Bell en comparación con todas las demás vacunas informadas en la base de datos VAERS (IC del 95% de 1,65 a 2,06). 2 La parálisis de Bell es un trastorno neurológico que causa parálisis o debilidad en un lado de la cara. 3 La parálisis facial puede variar de un paciente a otro y puede ser leve o grave. Los pacientes suelen recuperar algunas o todas sus funciones faciales en un plazo de unas pocas semanas a seis meses. Sin embargo, la debilidad facial y la parálisis pueden ser permanentes.
Figura 10.1—Probabilidades para la parálisis de Bell después de las inyecciones Pfizer BNT162b2 o Moderna mRNA-1273 en comparación con controles no vacunados según los informes del VAERS (Sato et al. 2021).
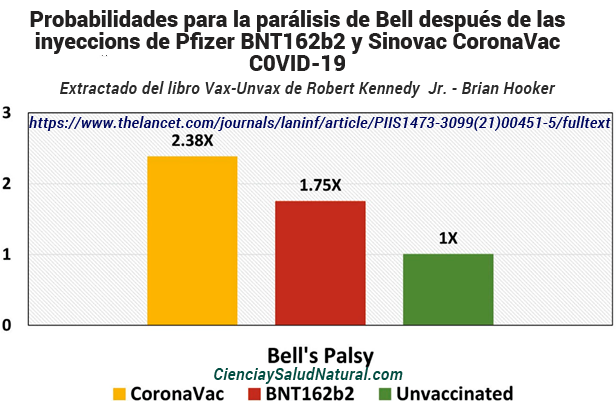
La figura 10.2 muestra los resultados del artículo “Parálisis de Bell después de la vacunación con ARNm (BNT162b2) y vacunas inactivadas (CoronaVac) SARS-CoV-2: una serie de casos y un estudio de casos y controles anidados” en la revista Lancet Infectious Diseases en 2022 . 4 El autor principal, el Dr. Eric Yuk Fai Wan, está afiliado al Centro para la Investigación y la Práctica Segura de Medicamentos, Departamento de Farmacología y Farmacia, Facultad de Medicina Li Ka Shing de la Universidad de Hong Kong en China. Este estudio utiliza datos de pacientes del sistema de notificación en línea de eventos adversos a la vacuna COVID-19 de Hong Kong. Los pacientes que recibieron las vacunas BNT162b2 de Pfizer y CoronaVac de Sinovac tuvieron un mayor riesgo de parálisis de Bell que los pacientes no vacunados, con odds ratios de 1,75 y 2,38 e intervalos de confianza del 95% de 0,886 a 3,477 y 1,415 a 4,002, respectivamente. 5
Figura 10.2—Probabilidades para la parálisis de Bell después de las inyeccions de Pfizer BNT162b2 y Sinovac CoronaVac C0VID-19 en comparación con personas no vacunadas (Wan et al. 2022).
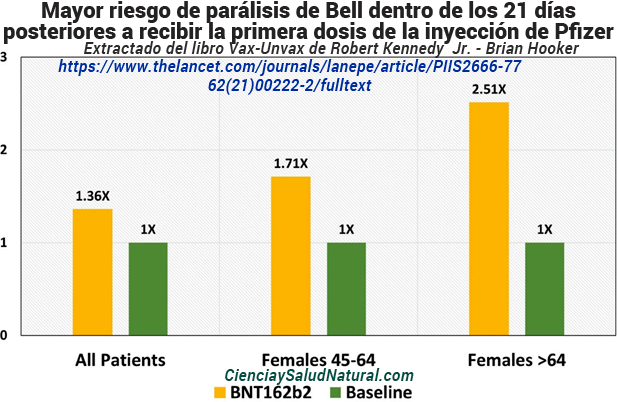
La figura 10.3 muestra los resultados de “Asociación entre la vacunación con la vacuna COVID-19 de ARNm BNT162b2 y la parálisis de Bell: una población-Based Study”, publicado en la revista Lancet Regional Health – Europe en 2021. 6 La autora principal, Dra. Rana Shibli, MD, está afiliada al Departamento de Medicina Comunitaria y Epidemiología del Centro Médico Lady Davis Carmel, Haifa, Israel. Este estudio de cohorte retrospectivo recuperó datos sobre la vacunación contra el COVID-19 con ARNm BNT162b2 (Pfizer) desde diciembre de 2020 hasta abril de 2021 y la incidencia de la parálisis de Bell de la base de datos del mayor proveedor de atención médica de Israel, que incluía más de 2,5 millones de receptores de vacunas. El número de casos observados de parálisis de Bell (designada por la codificación médica de la CIE [Clasificación Internacional de Enfermedades] y el llenado de una receta de prednisona dentro de las dos semanas posteriores al diagnóstico) que ocurrieron dentro de los 21 días posteriores a la primera dosis de la vacuna y dentro de los 30 días posteriores a la segunda vacuna. Las dosis se compararon con los casos esperados, según las tasas de 2019. 7 La primera dosis de vacuna se asoció con un mayor riesgo de parálisis de Bell con un índice de incidencia estandarizado (SIR) de 1,36 (IC del 95%: 1,14 a 1,61). 8 Las mujeres de 45 a 64 años mostraron una SIR más alta de 1,71 (IC del 95 % de 1,10 a 2,54), y las mujeres de ≥65 años mostraron una SIR de 2,51 (IC del 95%: 1,65 a 3,68). 9 SIR es similar al riesgo relativo o índice de riesgo, donde se compara la incidencia del grupo vacunado con la incidencia del grupo de control no vacunado.
Figura 10.3 – Mayor riesgo de parálisis de Bell dentro de los 21 días posteriores a recibir la primera dosis de la inyección de Pfizer BNT162b2 C0VID-19 en comparación con el número de casos esperados según las tasas de 2019 (Shibli et al. 2021).
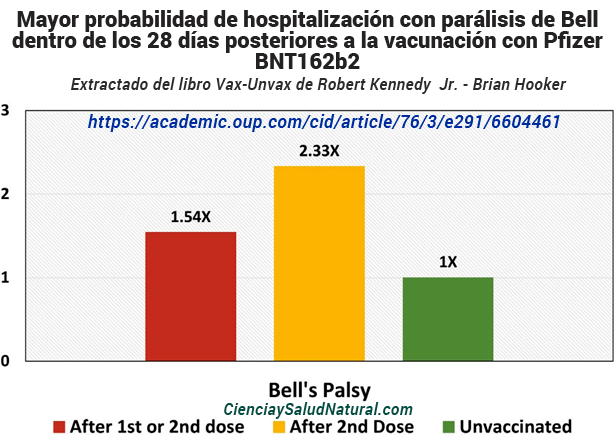
La figura 10.4 muestra los resultados de “Vacunación con BNT162b2 para la enfermedad de coronavirus de ARN mensajero 2019 (COVID-19), mayor riesgo de parálisis de Bell: un estudio de serie de casos autocontrolados y casos anidados”, publicado en la revista Clinical Infectious Diseases en 2023 . 10 El autor principal, el Dr. Eric Yuk Fai Wan, está afiliado al Centro para la Investigación y la Práctica Segura de Medicamentos , Departamento de Farmacología y Farmacia, Facultad de Medicina Li Ka Shing de la Universidad de Hong Kong en China. Este estudio de casos y controles autocontrolado utilizó datos de registros médicos electrónicos poblacionales de personas de 16 años o más en Hong Kong para evaluar el diagnóstico de parálisis de Bell en un entorno hospitalario dentro de los 28 días posteriores a la vacunación con Pfizer BNT162b2 entre marzo de 2021 y julio de 2021. La vacunación con Pfizer BNT162b2 (primera o segunda dosis) produjo un aumento de las probabilidades de diagnóstico de parálisis de Bell de 1,543 (IC del 95 % de 1,123 a 2,121). 11 Además, se registró un aumento de las probabilidades de parálisis de Bell de 2,325. observado durante los primeros 14 días después de la segunda dosis de BNT162b2 (IC del 95% de 1,414 a 3,821). 12
Figura 10.4 – Mayores probabilidades de hospitalización con diagnóstico de parálisis de Bell en un entorno hospitalario dentro de los 28 días posteriores a la vacunación con Pfizer BNT162b2 (Wan et al. 2023).
Eventos adversos cardíacos
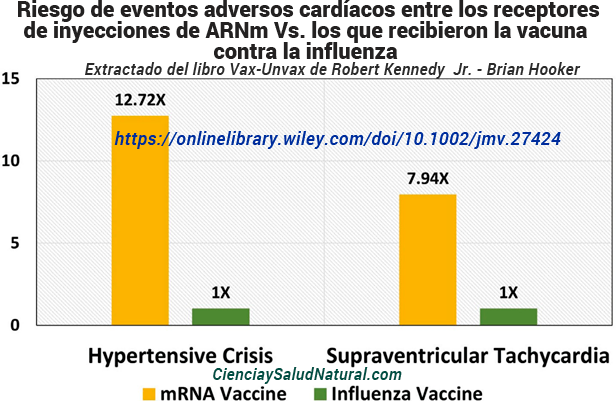
Figura 10.5: Riesgo de crisis hipertensiva o taquicardia supraventricular entre los receptores de vacunas de ARNm C0VID-19 versus pacientes que recibieron la vacuna contra la influenza (Kim et al. 2021).
La figura 10.5 muestra los resultados del artículo “Seguridad comparativa de las vacunas de ARNm contra la COVID-19 con las vacunas contra la influenza: un análisis de farmacovigilancia utilizando la base de datos internacional de la OMS”, publicado en el Journal of Medical Virology en 2021.13 El autor principal del estudio, el Dr. Min Seo Kim, está afiliado a la Facultad de Medicina de la Universidad de Corea en Seúl, Corea del Sur. En este estudio, los investigadores compararon los eventos adversos cardíacos de la inyección de ARNm contra la COVID-19 con los de las vacunas contra la influenza utilizando la VigiBase de la OMS para eventos adversos. En general, las personas que reciben COVID-19 vacunas de ARNm mostraron una incidencia 12,72 veces mayor de crisis hipertensiva cardíaca (IC del 95% de 2,47 a 65,54) y una incidencia 7,94 veces mayor de taquicardia supraventricular (IC del 95% de 2,62 a 24,00) que aquellos que recibieron la vacuna contra la influenza. 14 Los Índices de probabilidades se basaron en la incidencia relativa de cada evento adverso por número de cada tipo de vacuna distribuida.
Eventos adversos de miocarditis y pericarditis
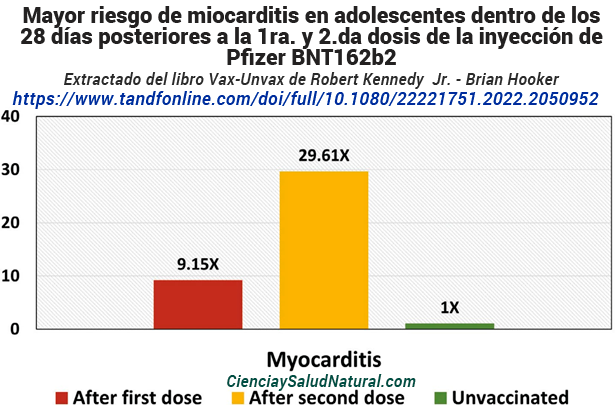
Figura 10.6: Mayor riesgo de miocarditis en adolescentes dentro de los 28 días posteriores a la primera y segunda dosis de la vacuna Pfizer BNT162b2 C0VID-19 (Lai et al. 2022).
La figura 10.6 muestra los resultados del artículo “Eventos adversos de especial interés después del uso de BNT162b2 en adolescentes: un estudio de cohorte retrospectivo basado en la población”, publicado en la revista Emerging Microbes & Infections en 2022.15 El autor principal, el Dr. Francisco Tsz Tsun Lai, está afiliado al Centro para la Investigación y la Práctica Segura de Medicamentos, Departamento de Farmacología y Farmacia, Facultad de Medicina Li Ka Shing, Universidad de Hong Kong en China. En este estudio, los adolescentes de 12 a 18 años en Hong Kong que recibieron la primera dosis de la vacuna Pfizer BNT162b2 tuvieron un riesgo 9,15 veces mayor de miocarditis en comparación con los adolescentes no vacunados (IC del 95% de 1,14 a 73,16). 16 Quienes recibieron la segunda dosis tuvieron un riesgo 29,61 veces mayor de miocarditis en comparación con los adolescentes no vacunados (IC 95% de 4,04 a 217,07). 17 investigadores evaluaron los riesgos dentro de los 28 días posteriores a la vacunación. Además, después de su segunda dosis de la vacuna Pfizer BNT162b2, los adolescentes vacunados tenían un riesgo 2,06 veces mayor de sufrir alteraciones o trastornos del sueño en comparación con los adolescentes no vacunados (IC del 95 % de 1,01 a 4,24). 18
La miocarditis es una enfermedad grave que indica daño al miocardio (músculo cardíaco). Las personas con mayor riesgo incluyen hombres adultos jóvenes, aunque las mujeres también pueden contraer miocarditis. Casi el 20% de todas las muertes súbitas en jóvenes se deben a miocarditis. 19 La tasa de supervivencia de la miocarditis es del 80% después de un año y del 50% después de cinco años. 20
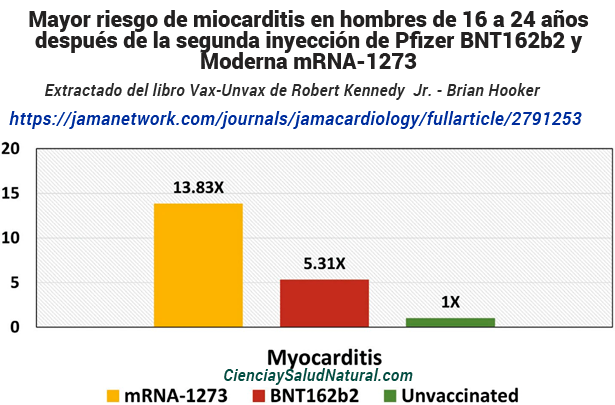
La figura 10.7 muestra los resultados del artículo “Vacunación contra el SARS-CoV-2 y miocarditis en un estudio de cohorte nórdico de 23 millones de residentes”, publicado en la revista JAMA Cardiology en 2022. 21 El autor principal, el Dr. Oystein Karlstad, está afiliado con el Departamento de Enfermedades Crónicas del Instituto Noruego de Salud Pública en Oslo, Noruega. Los participantes en el estudio incluyeron 23.122.522 residentes de países nórdicos de 12 años o más. Los investigadores observaron el mayor riesgo en hombres de entre 16 y 24 años después de recibir el segundo ARNm-1273 de Moderna (índice de tasa de incidencia de 13,83 y un IC del 95 % de 8,08 a 23,68) o Pfizer BNT162b2 (índice de tasa de incidencia de 5,31 y 95). % IC de 3,68 a 7,68) vacuna de ARNm. 22
Figura 10.7: Mayor riesgo de miocarditis en hombres de 16 a 24 años después de la segunda vacuna Pfizer BNT162b2 y Moderna mRNA-1273 C0VID-19 (Karlstad et al. 2022).
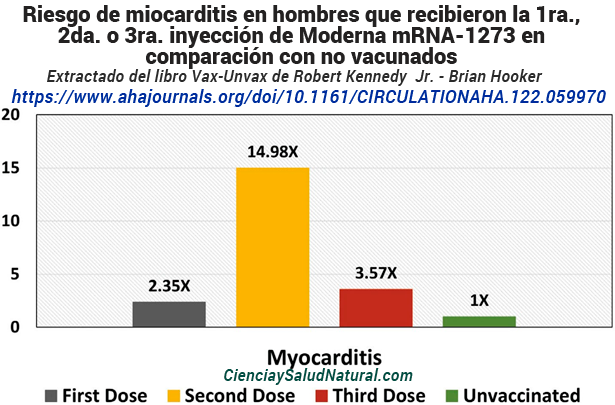
La figura 10.8 muestra los resultados del artículo “Riesgo de miocarditis después de dosis secuenciales de vacunas COVID-19 e infección por SARS-CoV-2 por edad y sexo”, publicado en la revista Circulation en 2022.23 La autora principal , Dra . Martina Patone, está afiliado al Departamento de Servicios de Atención Primaria de Salud de Nuffield en Oxford, Inglaterra. Los investigadores consideraron personas en Inglaterra de 13 años o más. Este fue un estudio autocontrolado, lo que significa que los investigadores compararon la incidencia de la enfermedad de los participantes antes y después de la inyección COVID-19. Los hombres que recibieron la segunda dosis de la vacuna Moderna mRNA-1273 mostraron los niveles más altos de miocarditis con un riesgo relativo de 14,98 y un IC del 95% de 8,61 a 26,07. 24
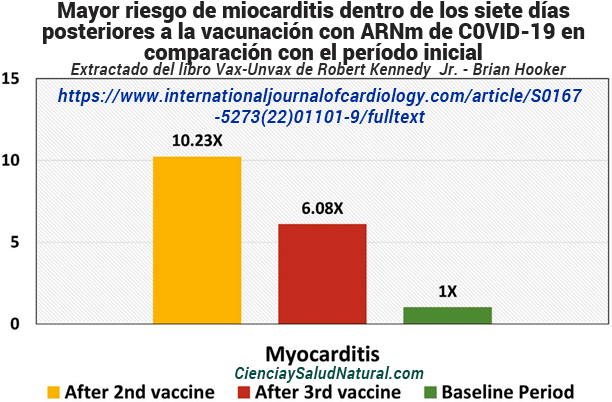
La figura 10.9 muestra los resultados del artículo “Miocarditis aguda después de una tercera dosis de inyección de ARNm contra la COVID-19 en adultos”, publicado en el International Journal of Cardiology en 2022.25 El autor principal, el Dr. Anthony Simone, está afiliado a la Departamento de Cardiología de el Centro Médico Kaiser Permanente Los Ángeles en California. Este estudio incluyó a todos los pacientes de Kaiser Permanente del Sur de California que recibieron de una a tres dosis de vacunas de ARNm COVID-19 entre el 14 de diciembre de 2020 y el 18 de febrero de 2022.
El riesgo de miocarditis dentro de los siete días posteriores a la segunda vacuna fue 10,23 veces mayor que en el período inicial (valor de p < 0,0001 y un IC del 95% de 6,09 a 16,4). 26 El riesgo de miocarditis dentro de los siete días posteriores a la tercera vacuna (refuerzo) fue 6,08 veces mayor que en el período inicial (valor de p <0,0003 y un IC del 95%: 2,34 a 13,3). 27 El período de referencia fue de 365 días, especificado dentro de los dos años anteriores a la fecha de vacunación. No se asoció ningún riesgo estadísticamente significativo con la primera dosis de la vacuna de ARNm recibida en este estudio.
Figura 10.8: Riesgo de miocarditis en hombres que recibieron la primera, segunda o tercera vacuna Moderna mRNA-1273 C0VID-19 en comparación con hombres no vacunados (Patone et al. 2022).
Figura 10.9: Mayor riesgo de miocarditis dentro de los siete días posteriores a la vacunación con ARNm de C0VID-19 en comparación con el período inicial (Simone et al. 2022).
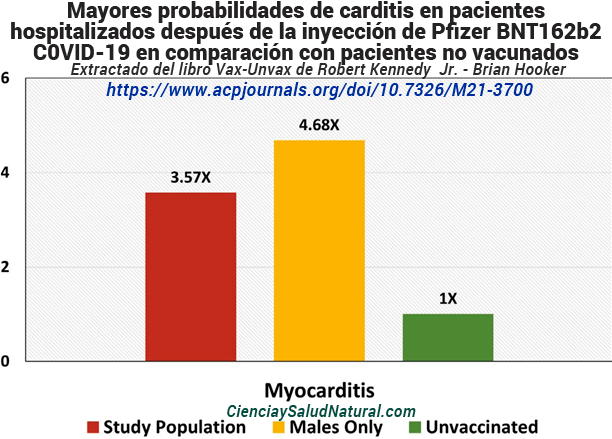
La figura 10.10 muestra los resultados del artículo “Carditis después de la vacunación contra la COVID-19 con una vacuna de ARN mensajero y una vacuna de virus inactivado: un estudio de casos y controles”, publicado en Annals of Internal Medicine en 2022. 28 Los autores principales, el Dr. Francisco Tsz Tsun Lai, PhD, y el Dr. Xue Li, PhD, están afiliados al Centro para la Investigación y la Práctica Segura de Medicamentos, Departamento de Farmacología y Farmacia, Facultad de Medicina Li Ka Shing, Universidad de Hong Kong y Laboratorio de Datos. Discovery for Health (D24H), Parque Científico de Hong Kong, Parque Científico y Tecnológico de Hong Kong, Región Administrativa Especial de Hong Kong, China.
Figura 10.10 – Mayores probabilidades de carditis en pacientes hospitalizados después de la inyección de Pfizer BNT162b2 C0VID-19 en comparación con pacientes no vacunados (Lai et al. 2022).
Este estudio de casos y controles de pacientes hospitalizados de 12 años o más en Hong Kong de febrero a agosto de 2021 evaluó a 160 pacientes con carditis y niveles elevados de troponina y 1533 pacientes de control. Los análisis multivariables que controlaban los factores de riesgo de enfermedad cardiovascular mostraron que los receptores de la vacuna Pfizer BNT162b2 tenían 3,57 veces más probabilidades de carditis que los pacientes no vacunados (IC del 95% de 1,93 a 6,60). 29 Para los hombres que recibieron la vacuna, las probabilidades fueron 4,68 veces mayores (IC del 95% de 2,25 a 9,71). 30 Además, el riesgo fue mayor después de la segunda dosis de BNT162b2 que de la primera. 31
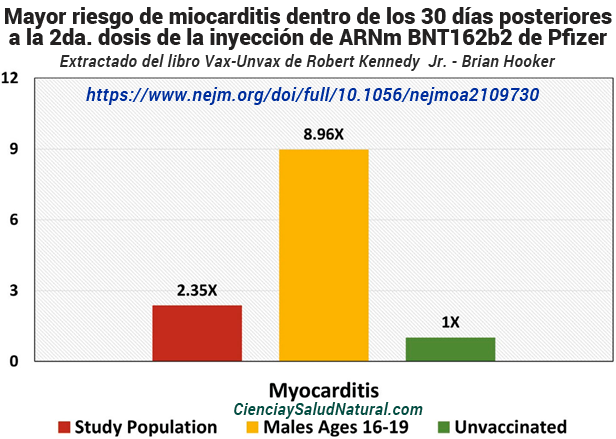
La figura 10.11 muestra los resultados del artículo “Miocarditis después BNT162b2 mRNA Vaccine Against Covid-19 in Israel”, publicado en The New England Journal of Medicine en 2021. 32 El autor principal, el Dr. Dror Mevorach, MD, está afiliado al Departamento de Medicina Interna B, División de Inmunología-Reumatología e Instituto Wohl de Medicina Traslacional, Centro Médico Hadassah en Israel. En este estudio de cohorte retrospectivo de datos del Ministerio de Salud de Israel, la incidencia de miocarditis dentro de los 30 días posteriores a la segunda dosis de la vacuna de ARNm BNT162b2 de Pfizer fue 2,35 veces mayor que en personas no vacunadas (IC del 95% de 1,10 a 5,02). La tasa de incidencia fue más alta en los receptores masculinos de entre 16 y 19 años, con 8,96 casos por 10.857 (IC del 95% de 4,50 a 17,83) o aproximadamente uno por 1.000. 33 Los investigadores determinaron que la tasa de miocarditis en la población general no vacunada era de uno entre 10.857. 34
Figura 10.11: Mayor riesgo de miocarditis dentro de los 30 días posteriores a la segunda dosis de la vacuna de ARNm BNT162b2 de Pfizer para toda la población del estudio y para los receptores masculinos de entre 16 y 19 años, en comparación con las personas no vacunadas (Mevorach et al. 2021).
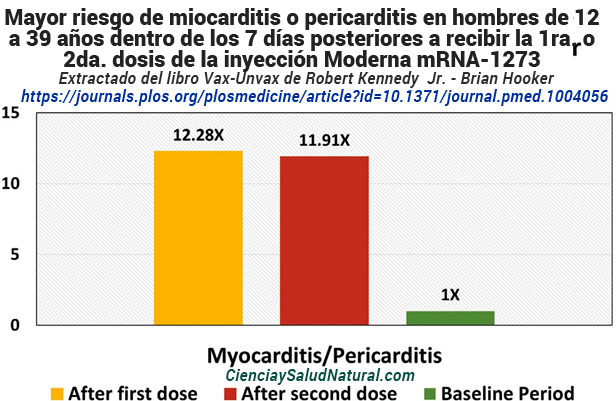
La figura 10.12 muestra los resultados del artículo “Postmarketing Active Surveillance of Myocarditis and Pericarditis After Vaccination with COVID-19 mRNA Vaccines in Persons Aged 12 to 39 years in Italy: A Multi-Database, Self-Controlled Case Series Study”, publicado en la revista PLOS Medicine en 2022. 35 El autor principal, el Dr. Marco Massari, está afiliado al Centro Nacional de Investigación y Evaluación de Medicamentos del Istituto Superiore di Sanità en Roma, Italia. En este estudio, los hombres que recibieron la primera o segunda dosis de ARNm-1273 tuvieron aproximadamente un riesgo doce veces mayor de miocarditis (IC del 95% de 4,09 a 36,83) o pericarditis (IC del 95% de 3,88 a 36,53) dentro de los siete días posteriores a la vacunación en comparación con al período de referencia del 27 de diciembre de 2020 al 30 de septiembre de 2021, excluyendo el intervalo de 0 a 21 días después de la primera o segunda vacuna. 36
Figura 10.12: Mayor riesgo de miocarditis o pericarditis en hombres de 12 a 39 años dentro de los siete días posteriores a recibir la primera o segunda dosis de la vacuna Moderna mRNA-1273 C0VID-19 (Massari et al. 2022).
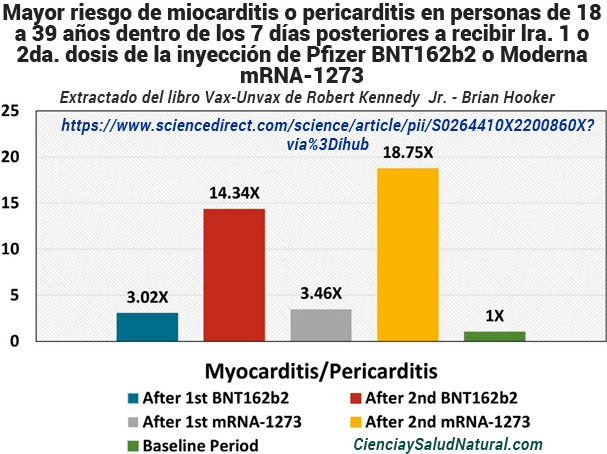
La figura 10.13 muestra los resultados del estudio “Riesgo de miocarditis y pericarditis después de la vacunación contra la COVID-19 con BNT162b2 y mRNA-1273”, publicado en la revista Vaccine en 2022.37 La autora principal, la Dra. Kristin Goddard, está afiliada al Kaiser Centro Permanente de Estudios de Vacunas, Kaiser Permanente Northern California, en Oakland, California. Los coautores, el Dr. Eric Weintraub, el Dr. Tom Shimabukuro y el Dr. Matthew Oster, están afiliados a la Oficina de Seguridad de las Inmunizaciones de los CDC en Atlanta, Georgia. Los participantes del estudio de ocho sistemas integrados de prestación de atención médica en el Vaccine Safety Datalink de los CDC mostraron un riesgo significativamente mayor de miocarditis o pericarditis dentro de los siete días posteriores a recibir la primera o segunda dosis de Pfizer (valor de p = 0,044 y un IC del 95% de 1,03 a 8,33 y valor de p < 0,001 y un IC del 95 % de 6,45 a 34,85, respectivamente) o Moderna (valor de p = 0,031 y un IC del 95 % de 1,12 a 11,07 y valor de p < 0,001 y un IC del 95 % de 6,73 a 64,94, respectivamente) vacunas COVID-19 en comparación con los participantes dentro del período inicial del estudio del 14 de diciembre de 2020 al 15 de enero de 2022, excluyendo los períodos de 0 a 7 días después de la vacunación. 38
Figura 10.13: Mayor riesgo de miocarditis o pericarditis en personas de 18 a 39 años dentro de los 7 días posteriores a recibir la primera o segunda dosis de la vacuna Pfizer BNT162b2 o Moderna mRNA-1273 C0VID-19 (Goddard et al. 2022).
Trombocitopenia y trombosis
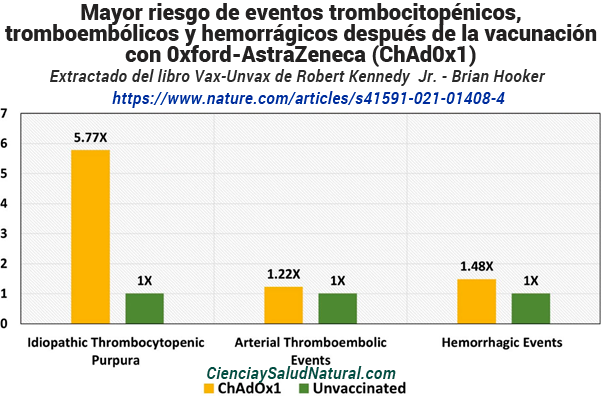
Figura 10.14: Mayor riesgo de eventos trombocitopénicos, tromboembólicos y hemorrágicos después de la vacunación con 0xford-AstraZeneca (ChAd0x1) C0VID-19, en comparación con personas no vacunadas (Simpson et al. 2021).
La figura 10.14 muestra los resultados de las “Vacunas contra la COVID-19 de primera dosis de ChAdOx1 y BNT162b2 y eventos trombocitopénicos, tromboembólicos y hemorrágicos en Escocia”, publicado en la revista Nature Medicine en 2021. 39 El autor principal , Dr. Colin R. Simpson, PhD , está afiliado a la Escuela de Salud de la Facultad de Salud de Wellington, la Universidad Victoria de Wellington en Nueva Zelanda y al Instituto Usher de la Universidad de Edimburgo, en el Reino Unido. Este estudio de cohorte prospectivo nacional de Escocia incluyó a más de 2,5 millones de personas mayores de 18 años vacunadas entre diciembre de 2020 y abril de 2021. La vacunación Oxford-AstraZeneca (ChAdOx1) se asoció con un riesgo 5,77 veces mayor de púrpura trombocitopénica idiopática (trastorno de la coagulación autoinmune) 0 a 27 días después de la vacunación (IC del 95% de 2,41 a 13,83). 40 La vacuna Oxford-AstraZeneca también se asoció con un mayor riesgo de eventos tromboembólicos arteriales (coágulos sanguíneos arteriales) con un riesgo relativo ajustado de 1,22, 0 a 27 días después de la vacunación (IC 95% de 1,12 a 1,34), y eventos hemorrágicos (sangrado excesivo) con un riesgo relativo ajustado de 1,48, 0 a 27 días después de la vacunación (IC 95% de 1,12 a 1,96). 41
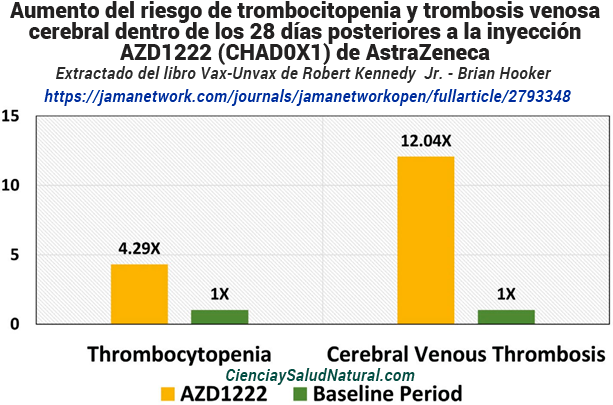
La figura 10.15 muestra los resultados del artículo “Análisis de eventos tromboembólicos y trombocitopénicos después de AZD1222, BNT162b2 y mRNA-1273 en tres países nórdicos”, publicado en la revista JAMA Network Open en 2022.42 El autor principal del estudio , el Dr. Jacob Dag Berild, está afiliado al Departamento de Control de Infecciones y Vacunas del Instituto Noruego de Salud Pública en Oslo, Noruega. En este estudio, los investigadores utilizaron registros hospitalarios de Noruega, Finlandia y Dinamarca para medir la incidencia de trombocitopenia y trombosis venosa cerebral dentro de los 28 días posteriores a varias vacunas COVID-19 disponibles.
La trombocitopenia es una deficiencia de plaquetas en la sangre circulante y puede provocar hemorragias espontáneas. La trombosis venosa cerebral ocurre cuando un coágulo de sangre bloquea el flujo de sangre que sale del cerebro y puede ser una causa de accidente cerebrovascular. Los investigadores observaron los riesgos más altos para los pacientes que recibieron la vacuna AstraZeneca COVID-19, con un riesgo 4,29 veces mayor de trombocitopenia (IC del 95% de 2,96 a 6,20) y un riesgo 12,04 veces mayor de trombosis venosa cerebral (IC del 95% de 5,37 a 26,99). ). 43 El período de referencia para la comparación fue entre el 1 de enero de 2020 y el 16 de mayo de 2021, excluyendo la ventana de 28 días después de la vacunación para cada paciente considerado.
Figura 10.15: aumento del riesgo de trombocitopenia y trombosis venosa cerebral dentro de los 28 días posteriores a la vacuna AZD1222 (CHAD0X1) de AstraZeneca en comparación con el período basal (Berild et al. 2022).
Herpes
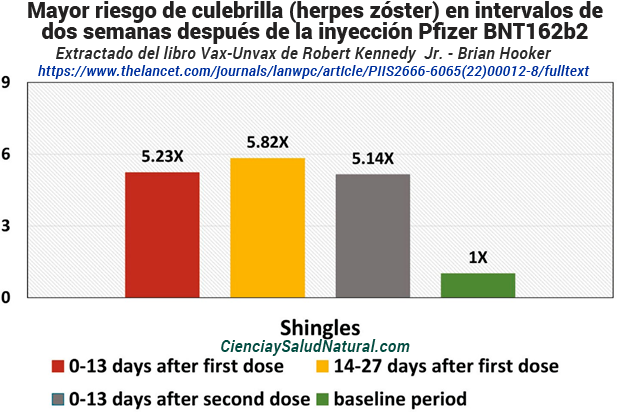
La figura 10.16 muestra los resultados del artículo “Hospitalización relacionada con herpes zóster después de la vacunación con SARS-CoV-2 inactivada (CoronaVac) y ARNm (BNT162b2): una serie de casos autocontrolados y un estudio de casos y controles anidados”, publicado en la revista Lancet . Salud regional: Pacífico occidental en 2022. 44 El autor principal es el Dr. Eric Yuk Fai Wan. Los pacientes de este estudio que recibieron la vacuna Pfizer BNT162b2 tenían más de cinco veces más probabilidades de contraer culebrilla en los intervalos de 0 a 13 (IC del 95 % de 1,61 a 17,03) y de 14 a 27 días desde la primera vacuna recibida (IC del 95 % de 1,61 a 17,03). de 1,62 a 20,91) y de 0 a 13 días después de recibir la segunda vacuna (IC del 95% de 1,29 a 20,47) que durante el período inicial, que fue en cualquier momento entre el 23 de febrero y el 31 de julio de 2021, fuera del tiempo especificado marcos de vacunación. 45 Además, los pacientes que reciben CoronaVac vacunados tenían 2,67 veces más probabilidades de contraer culebrilla dentro de los 13 días posteriores a la vacunación (IC del 95%: 1,08 a 6,59). 46
El herpes zóster es una afección dolorosa, a veces grave, que resulta de la reactivación del virus del herpes zoster que causa la varicela. Cualquiera que haya tenido varicela o haya recibido la vacuna contra la varicela puede correr riesgo de sufrir esta reactivación cuando su sistema inmunológico está comprometido o suprimido.
Figura 10.16: Mayor riesgo de culebrilla (herpes zóster) en intervalos de dos semanas después de la vacuna Pfizer BNT162b2 en comparación con un período inicial (Wan et al. 2022).
Pérdida de la audición
La figura 10.17 muestra los resultados del artículo “Asociación entre la vacuna COVID-19 de ARN mensajero BNT162b2 y el riesgo de pérdida auditiva sensorineural repentina”, publicado en la revista JAMA Otolaryngology – Head & Neck Surgery en 2022.47 El autor principal es el Dr. Yoav Yanir del Departamento de Otorrinolaringología-Cirugía de Cabeza y Cuello, Centro Médico Lady David Carmel, Haifa, Israel. Esto es un estudio poblacional de una gran organización de atención médica en Israel. Los índices de incidencia estandarizados (SIR) para la pérdida auditiva neurosensorial repentina asociada con la primera y segunda dosis de Pfizer BNT162b2 fueron 1,35 (IC del 95% de 1,09 a 1,65) y 1,23 (IC del 95% de 0,98 a 1,53), respectivamente. Los riesgos fueron mayores después de la primera dosis en mujeres de 16 a 44 años (TIE 1,92; IC del 95 %: 0,98 a 3,43) y en mujeres mayores de 65 años (TIE 1,68; IC del 95%: 1,15 a 2,37) y después de la segunda dosis en hombres de 16 años a 44 años (TIE 2,45; IC 95%: 1,36 a 4,07). 48 Los pacientes con pérdida auditiva neurosensorial repentina pueden experimentar tinnitus. También puede provocar una pérdida auditiva permanente.
Figura 10.17: Mayor riesgo de pérdida auditiva neurosensorial repentina después de la vacuna Pfizer BNT162b2 C0VID-19 (Yanir et al. 2022).
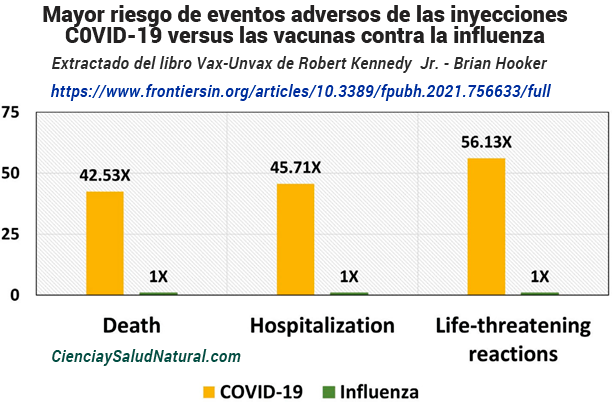
Eventos adversos de las vacunas contra la COVID-19 versus las vacunas contra la influenza La figura 10.18 muestra los resultados del artículo “Frequency and Associations of Adverse Reactions to COVID-19 Vaccines Reported to Pharmacovigilance Systems in the European Union and the United States”, publicado en Frontiers in Public Health en 2022. 49 El autor del artículo, Dr. Diego Montano, está afiliado al Departamento de Medicina Poblacional del Instituto de Ciencias de la Salud de la Universidad de Tubingen en Alemania. El Dr. Montano comparó los informes de eventos adversos de EudraVigilance (la base de datos europea de sospechas de reacciones adversas a medicamentos) para las vacunas contra la COVID-19 y la influenza. Estos se normalizaron según las estimaciones de los Centros Europeos para la Prevención y las Enfermedades (ECDC) del número total de cada tipo de vacuna administrada. Los informes de muerte (IC del 99% de 33,49 a 54,01), hospitalización (IC del 99% de 41,26 a 50,65) y reacciones potencialmente mortales (IC del 99% de 44,51 a 70,78) por unidad de vacuna contra el COVID-19 administrada eclipsaron con creces los de la influenza. vacuna. 50 El autor también informó riesgos relativos significativos de trombosis, coagulación y reacciones de los órganos sexuales asociados con las vacunas COVID-19. 51
Figura 10.18: Mayor riesgo de eventos adversos de las vacunas C0VID-19 versus las vacunas contra la influenza según los informes de eventos adversos de la Base de datos europea de sospechas de reacciones adversas a medicamentos (Montano 2022).
Varios eventos adversos
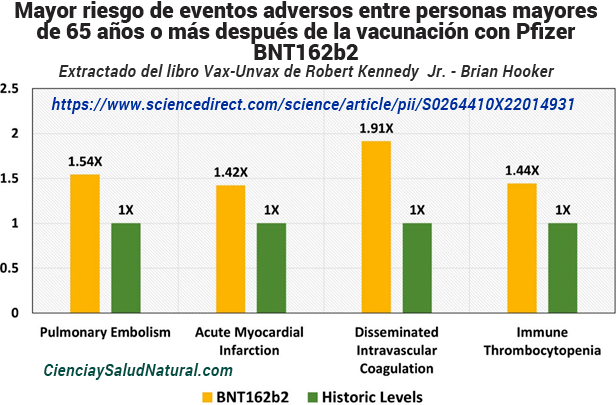
La figura 10.19 muestra los resultados del artículo “Surveillance of COVID-19 Vaccine Safety Among Elderly Persons Aged 65 Years and Older”, publicado en Vaccine en 2023.52 El autor principal, Dr. Hui-Lee Wong, PhD, está afiliado a la Administración de Alimentos y Medicamentos, Silver Spring, Maryland. Este estudio prospectivo patrocinado por la FDA rastreó los datos de reclamaciones de Medicaid de EE. UU. de más de 30 millones de pacientes de 65 años o más desde diciembre de 2020 hasta enero de 2022. Las pruebas secuenciales semanales revelaron cuatro resultados que alcanzaron el umbral de una señal estadística después de la vacunación con Pfizer BNT162b2 en comparación con los datos anteriores a la COVID. -19 niveles históricos vacunales: embolia pulmonar (coágulo de sangre en los pulmones), con un riesgo relativo de 1,54 entre 1 y 28 días posvacunación; infarto agudo de miocardio (ataque cardíaco), con un riesgo relativo de 1,42 entre 1 y 28 días posvacunación; coagulación intravascular diseminada (coagulación sanguínea anormal en todo el cuerpo), con un riesgo relativo de 1,91 entre 1 y 28 días después de la vacunación; y trombocitopenia inmune (plaquetas bajas en sangre debido a un ataque autoinmune), con un riesgo relativo de 1,44 entre 1 y 42 días después de la vacunación. 53
Figura 10.19: Mayor riesgo de diversos eventos adversos entre personas mayores de 65 años o más después de la vacunación con Pfizer BNT162b2 en comparación con una población no vacunada antes de la pandemia (Wong et al., 2023).
Eventos adversos graves
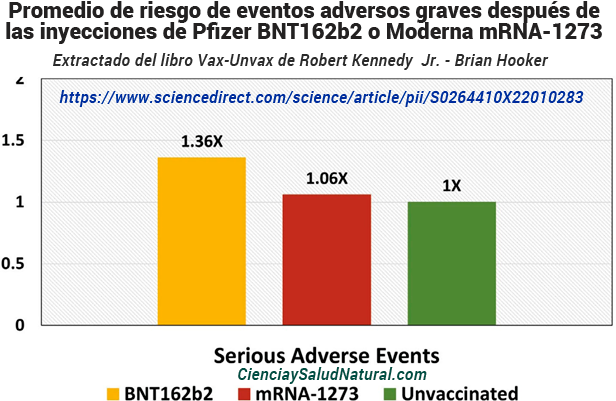
La figura 10.20 muestra los resultados del artículo “Eventos adversos graves de especial interés después de la vacunación contra el COVID-19 con ARNm en ensayos aleatorios en adultos”, publicado en Vaccine en 2022.54 El autor principal, el Dr. Joseph Fraiman, está afiliado a Thibodaux Regional Sistema de Salud en Thibodaux, Luisiana. El autor correspondiente, el Dr. Peter Doshi, está afiliado a la Facultad de Farmacia de la Universidad de Maryland en Baltimore y es editor senior de BMJ .
Utilizando datos de los ensayos clínicos de fase III de las vacunas Pfizer BNT162b2 y Moderna mRNA-1273, los investigadores compararon directamente a los receptores de la vacuna con los receptores de control de placebo. En general, los receptores de cualquiera de las vacunas de ARNm tenían un riesgo 1,16 veces mayor de sufrir efectos adversos graves, eventos en comparación con los controles no vacunados (IC del 95% de 0,97 a 1,39). 55 El resultado fue marginalmente significativo desde el punto de vista estadístico.
Figura 10.20: Promedio de riesgo de eventos adversos graves después de las inyecciones de Pfizer BNT162b2 o Moderna mRNA-1273 en comparación con controles no vacunados (Fraiman et al. 2022).
Los autores del estudio también completaron una evaluación de riesgos y beneficios de ambas vacunas. Descubrieron que la vacuna Pfizer BNT162b2 mostraba un riesgo excesivo de eventos adversos graves de especial interés de 10,1 por 10.000 vacunados (IC del 95 % de -0,4 a 20,6), al tiempo que prevenía hospitalizaciones por COVID-19 en 2,3 por 10.000 vacunados en comparación con el grupo de placebo. 56 Asimismo, la vacuna Moderna mRNA-1273 mostró un riesgo excesivo de eventos adversos graves de especial interés de 15,1 por 10.000 vacunados (IC del 95% de -3,6 a 33,8) al tiempo que evitó hospitalizaciones por COVID-19 en 6,4 por 10.000 vacunados en comparación con el placebo. grupo. 57
En este trabajo se definió evento adverso grave de especial interés como la muerte, que pusiera en peligro la vida en el momento del evento; hospitalización como paciente internado, o prolongación de la hospitalización existente; discapacidad/incapacidad persistente o significativa; una anomalía congénita/defecto de nacimiento; o un evento médicamente importante basado en el criterio médico.
Referencias:
- 1 Kenichiro Sato et al., “Facial Nerve Palsy Following the Administration of COVID-19 mRNA Vaccines: Analysis of a Self-Reporting Database,” International Journal of Infectious Diseases : IJID : Official Publication of the International Society for Infectious Diseases 111, (2021): 310- 312, doi:10.1016/j.ijid.2021.08.071.
- 2 Ibid.
- National Institute of Neurological Disorders and Stroke, “Bell’s Palsy,” accessed on April 16, 2023, https://www.ninds.nih.gov/health-information/disorders/bells-palsy.
- 4 Erik Y. F. Wan et al., “Bell’s Palsy Following Vaccination with mRNA (BNT162b2) and Inactivated (CoronaVac) SARS-CoV-2 Vaccines: A Case Series and Nested Case-Control Study,” The Lancet Infectious Diseases 22, no. 1 (2022): 64-72, doi:10.1016/S1473-3099(21)00451-5.
- 5 Ibid.
- 6 Rana Shibili et al., “Association Between Vaccination with the BNT162b2 mRNA COVID-19 Vaccine and Bell’s Palsy: A Population-Based Study,” The Lancet Regional Health. Europe 11 (2021); 100236, doi:10.1016/j.lanepe.2021.100236.
- 7 Ibid.
- 8 Ibid.
- 9 Ibid.
- 10 Eric Yuk Fai Wan et al., “Messenger RNA Coronavirus Disease 2019 (COVID-19) Vaccination With BNT162b2 Increased Risk of Bell’s Palsy: A Nested Case-Control and Self-Controlled Case Series Study,” Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America 76, no. 3 (2023); e291-e298, doi:10.1093/cid/ciac460.
- 11 Ibid.
- 12 Ibid.
- 13 Min S. Kim et al., “Comparative Safety of mRNA COVID-19 Vaccines to Influenza Vaccines: A Pharmacovigilance Analysis Using WHO International Database,” Journal of Medical Virology 94, no. 3 (2022), doi:10.1002/jmv.27424.
- 14 Ibid.
- 15 Francisco T. T. Lai et al., “Adverse Events of Special Interest Following the Use of BNT162b2 in Adolescents: A Population-Based Retrospective Cohort Study,” Emerging Microbes and Infections 11, no.1 (2022): 885-893, doi:10.1080/22221751.2022.2050952.
- 16 Ibid.
- 17 Ibid.
- 18 Ibid.
- 19 Cleveland Clinic, “Myocarditis,” accessed on April 16, 2023, https://my.clevelandclinic.org/heal th/diseases/22129-myocarditis.
- 20 Ibid.
- 21 Øystein Karlstad et al., “SARS-CoV-2 Vaccination and Myocarditis in a Nordic Cohort Study of 23 Million Residents,” Journal of American Medical Association Cardiology 7, no. 6 (2022): 600-612, doi:10.1001/jamacardio.2022.0583.
- 22 Ibid.
- 23 Martina Patone et al., “Risk of Myocarditis After Sequential Doses of COVID-19 Vaccine and SARS-CoV-2 Infection by Age and Sex,” Circulation 146, no. 10: 743-754, doi:10.1161/CIRCULATIONAHA.122.059970.
- 24 Ibid.
- 25 Anthony Simone et al., “Acute Myocarditis Following a Third Dose of COVID-19 mRNA Vaccination in Adults,” International Journal of Cardiology, 365 (2022): 41-43, doi:10.1016/j.ijcard.2022.07.031.
- 26 Ibid.
- 27 Ibid.
- 28 Francisco Tsz Tsun Lai et al., “Carditis After COVID-19 Vaccination With a Messenger RNA Vaccine and an Inactivated Virus Vaccine: A Case-Control Study,” Annals of Internal Medicine 175, no. 3 (2022); 362-370, doi:10.7326/M21-3700.
- 29 Ibid.
- 30 Ibid.
- 31 Ibid.
- 32 Dror Mevorach et al., “Myocarditis after BNT162b2 mRNA Vaccine against Covid-19 in Israel,” The New England Journal of Medicine 385, no. 23 (2021); 2140-2149, doi:10.1056/NEJMoa2109730.
- 33 Ibid.
- 34 Ibid.
- 35 Marco Massari et al., “Postmarketing Active Surveillance of Myocarditis and Pericarditis Following Vaccination with COVID-19 mRNA Vaccines in Persons Aged 12 to 39 years in Italy: A Multi-Database, Self-Controlled Case Series Study,” PLoS Medicine 19, no. 7 (2022): e1004056, doi:10.1371/journal.pmed.1004056.
- 36 Ibid.
- 37 Kristin Goddard et al., “Risk of Myocarditis and Pericarditis following BNT162b2 and mRNA- 1273 COVID-19 Vaccination,” Vaccine 40, no. 35 (2022): 5153-5159, doi:10.1016/j.vaccine.2022.07.007.
- 38 Ibid.
- 39 C.R. Simpson et al., “First-Dose ChAdOx1 and BNT162b2 COVID-19 Vaccines and Thrombocytopenic, Thromboembolic and Hemorrhagic Events in Scotland,” Nature Medicine 27, no. 7 (2021); 1290-1297, doi:10.1038/s41591-021-01408-4.
- 40 Ibid.
- 41 Ibid.
- 42 Jacob D. Berild et al., “Analysis of Thromboembolic and Thrombocytopenic Events After the AZD1222, BNT162b2, and MRNA-1273 COVID-19 Vaccines in 3 Nordic Countries,” Journal of the American Medical Association Network Open 5, no. 6: e2217375, doi:10.1001/jamanetworkopen.2022.17375.
- 43 Ibid.
- 44 Erik Y.F. Wan et al., “Herpes Zoster Related Hospitalization after Inactivated (CoronaVac) and mRNA (BNT162b2) SARS-CoV-2 Vaccination: A Self-Controlled Case Series and Nested Case-Control Study,” The Lancet Regional Health: Western Pacific 21, no. 100393 (2022), doi:10.1016/j.lanwpc.2022.100393.
- 45 Ibid.
- 46 Ibid.
- 47 Yoav Yanir et al., “Association Between the BNT162b2 Messenger RNA COVID-19 Vaccine and the Risk of Sudden Sensorineural Hearing Loss,” Journal of the American Medical Association-Otolaryngology—Head and Neck Surgery 148, no. 4 (2022): 299-306, doi:10.1001/jamaoto.2021.4278.
- 48 Ibid.
- 49 Diego Montano, “Frequency and Associations of Adverse Reactions of COVID-19 Vaccines Reported to Pharmacovigilance Systems in the European Union and the United States,” Frontiers in Public Health 9 (2022): 756633, doi:10.3389/fpubh.2021.756633.
- 50 Ibid.
- 51 Ibid.
- 52 Hui-Lee Wong et al., “Surveillance of COVID-19 Vaccine Safety among Elderly Persons Aged 65 Years and Older,” Vaccine 41, no. 2 (2023): 532-539, doi:10.1016/j.vaccine.2022.11.069.
- 53 Ibid.
- 54 Joseph Fraiman et al., “Serious Adverse Events of Special Interest following mRNA COVID-19 Vaccination in Randomized Trials in Adults,” Vaccine 40, no. 40 (2022): 5798-5805, doi:10.1016/j.vaccine.2022.08.036.
- 55 Ibid.
- 56 Ibid.
- 57 Ibid.
- 58 Kristin Goddard et al., Risk of Myocarditis and Pericarditis Following BNT162b2 and mRNA- 1273 COVID-19 Vaccination,” Vaccine 40, no. 35 (2022): 5153-5159, doi:10.1016/j.vaccine.2022.07.007.
- 59 Francisco T. T. Lai et al., “Adverse Events of Special Interest Following the Use of BNT162b2 in Adolescents: A Population-Based Retrospective Cohort Study,” Emerging Microbes and Infections 11, no.1 (2022): 885-893, doi:10.1080/22221751.2022.2050952.
- 60 Marco Massari et al., “Postmarketing Active Surveillance of Myocarditis and Pericarditis following Vaccination with COVID-19 mRNA Vaccines in Persons Aged 12 to 39 years in Italy: A Multi-Database, Self-Controlled Case Series Study,” PLoS Medicine 19, no. 7 (2022): e1004056, doi:10.1371/journal.pmed.1004056.
- 61 Anthony Simone et al., “Acute Myocarditis Following a Third Dose of COVID-19 mRNA Vaccination in Adults,” International Journal of Cardiology, 365 (2022): 41-43, doi:10.1016/j.ijcard.2022.07.031.
- 62 Øystein Karlstad et al., “SARS-CoV-2 Vaccination and Myocarditis in a Nordic Cohort Study of 23 Million Residents,” Journal of American Medical Association Cardiology 7, no. 6 (2022): 600-612, doi:10.1001/jamacardio.2022.0583.
- 63 Martina Patone et al., “Risk of Myocarditis After Sequential Doses of COVID-19 Vaccine and SARS-CoV-2 Infection by Age and Sex,” Circulation 146, no. 10: 743-754, doi:10.1161/CIRCULATIONAHA.122.059970.
- 64 Hui-Lee Wong et al., “Surveillance of COVID-19 Vaccine Safety Among Elderly Persons Aged 65 Years and Older,” Vaccine 41, no. 2 (2023): 532-539, doi:10.1016/j.vaccine.2022.11.069.
- 65 Dror Mevorach et al., “Myocarditis after BNT162b2 mRNA Vaccine against Covid-19 in Israel,” The New England Journal of Medicine 385, no. 23 (2021); 2140-2149, doi:10.1056/NEJMoa2109730.
- 66 Eric Yuk Fai Wan et al., “Messenger RNA Coronavirus Disease 2019 (COVID-19) Vaccination with BNT162b2 Increased Risk of Bell’s Palsy: A Nested Case-Control and Self-Controlled Case Series Study,” Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America 76, no. 3 (2023); e291-e298, doi:10.1093/cid/ciac460.
- 67 Kenichiro Sato et al., “Facial Nerve Palsy following the Administration of COVID-19 mRNA Vaccines: Analysis of a Self-Reporting Database,” International Journal of Infectious Diseases : IJID : Official Publication of the International Society for Infectious Diseases 111, (2021): 310- 312, doi:10.1016/j.ijid.2021.08.071.
- 68 Rana Shibili et al., “Association between Vaccination with the BNT162b2 mRNA COVID-19 Vaccine and Bell’s Palsy: A Population-Based Study,” The Lancet Regional Health. Europe 11 (2021); 100236, doi:10.1016/j.lanepe.2021.100236.
- 69 Erik Y.F. Wan et al., “Herpes Zoster Related Hospitalization after Inactivated (CoronaVac) and mRNA (BNT162b2) SARS-CoV-2 Vaccination: A Self-Controlled Case Series and Nested Case-Control Study,” The Lancet Regional Health: Western Pacific 21, no. 100393 (2022), doi:10.1016/j.lanwpc.2022.100393.
 CienciaySaludNatural.com
CienciaySaludNatural.com