Paracetamol (acetaminophen) overdose and hepatotoxicity: mechanism, treatment, prevention measures, and estimates of burden of disease https://doi.org/10.1080/17425255.2023.2223959 – https://www.tandfonline.com/doi/full/10.1080/17425255.2023.2223959
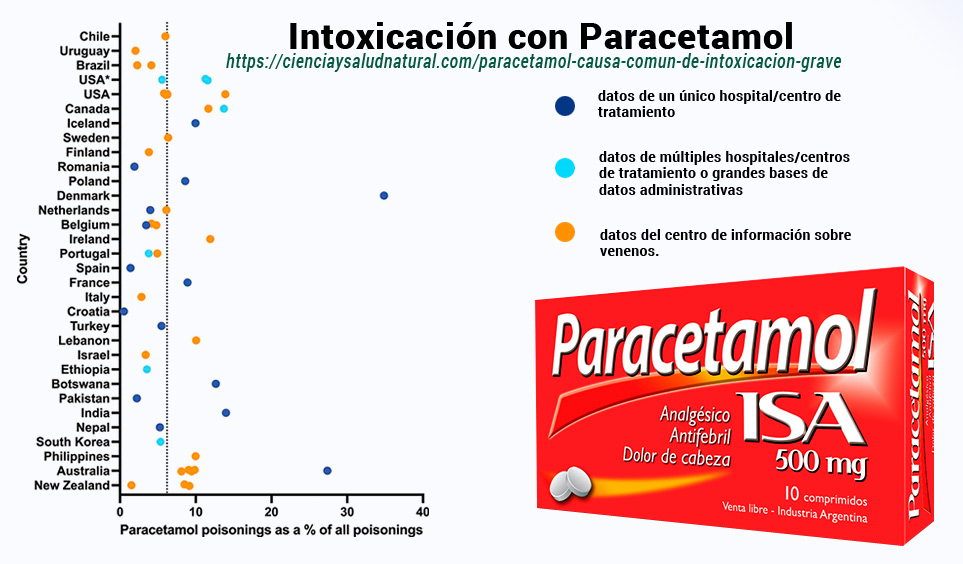
Porcentaje de intoxicaciones relacionadas con paracetamol. https://www.tandfonline.com/doi/full/10.1080/17425255.2023.2223959
- Los puntos de color azul oscuro representan datos de un único hospital/centro de tratamiento,
- los puntos de color azul claro representan datos de múltiples hospitales/centros de tratamiento o grandes bases de datos administrativas
- los puntos naranja representan datos del centro de información sobre venenos.
- La línea de puntos muestra la media ponderada entre fuentes del 6,2%.
Fuentes de datos que utilizan el registro de casos ToxIC, que se basa principalmente en datos de EE. UU., pero también puede incluir datos de Canadá, Australia, Israel, Arabia Saudita y Tailandia. Una fuente de datos en Bélgica también contiene datos de Luxemburgo. Una fuente en Brasil contiene datos de un Centro de Información sobre Toxicología combinados con datos de múltiples hospitales/centros de tratamiento. Las fuentes de datos de Chile y Dinamarca informaron sobre intoxicaciones por drogas/productos farmacéuticos únicamente. Una fuente de Portugal (3,8%) informó únicamente de intoxicaciones accidentales o no intencionales. Una fuente de datos de EE.UU. (16,5%) y la fuente etíope informaron sobre envenenamientos cometidos únicamente por mujeres.
El paracetamol es uno de los medicamentos más utilizados en todo el mundo y es la causa de intoxicación más común en los países de altos ingresos. En caso de sobredosis, el paracetamol provoca hepatotoxicidad dosis dependiente. La acetilcisteína es un antídoto eficaz, pero a pesar de su uso todavía se producen hepatotoxicidad y muchas muertes.
Esta revisión resume la sobredosis y la toxicidad de paracetamol (incluidos los mecanismos, los factores de riesgo, la evaluación de riesgos y el tratamiento). Además, resumimos la epidemiología de la sobredosis de paracetamol en todo el mundo. Se realizó una búsqueda bibliográfica en PubMed sobre epidemiología y mortalidad por intoxicación desde el 1 de enero de 2017 hasta el 26 de octubre de 2022 para estimar las tasas de sobredosis de paracetamol, daño hepático y muertes en todo el mundo.
Las intoxicaciones en unidades de cuidados intensivos (UCI) representan un subconjunto grave de intoxicaciones y no se agruparon con las tasas generales. Las intoxicaciones por analgésicos representan el 8,0% de las intoxicaciones en las UCI en Francia [Citación184 ] y el 12,4% en Alemania [Citación185 ]. Una fuente iraní informó que el paracetamol representaba sólo el 0,7% de las intoxicaciones en las UCI [Citación186].
Opinión experta
El paracetamol está ampliamente disponible y, sin embargo, es sustancialmente más tóxico que otros analgésicos disponibles sin receta. Cuando hubo datos disponibles, estimamos que el paracetamol participa en el:
- 6% de las intoxicaciones,
- el 56% de las lesiones hepáticas agudas graves y
- la insuficiencia hepática aguda, y el
- 7% de las lesiones hepáticas inducidas por fármacos.
Estas estimaciones están limitadas por la falta de datos disponibles de muchos países, particularmente en Asia, América del Sur y África. La reducción del daño causado por el paracetamol es posible mediante una mejor identificación de las sobredosis de alto riesgo y mejores regímenes de tratamiento.
Las sobredosis grandes y las que involucran paracetamol de liberación modificada son de alto riesgo y pueden abordarse mediante cambios legislativos.
Muerte a manos del Paracetamol
El dengue hemorragico es cuando el paracetamol ha destruido su higado y lo mata,
el dengue no mata, es el paracetamol quien destruye el hígado.
EL Dr. Renán Marino, profesor de pediatría en la FARMERP (Faculdade de Medicina de Sao Jose del Rio Preto-sp) dice:
«Hasta 1957, cuando surgió en el mercado la droga llamada Paracetamol fue inmediatamente indicada como tratamiento para el Dengue, por Ministerios de Salud, a pesar de no existir ningún estudio que compruebe la eficacia de este tratamiento del Dengue.
A partir de 1957, el Dengue comenzó a derivar en muertes. El Paracetamol es una droga que destruye el hígado del paciente.
El virus de la hepatitis C, ya “detona” el hígado y con el veneno del Paracetamol, ese hígado es destruido lo que lleva al paciente a la muerte.
El Dengue hemorrágico, nada más es la reacción del organismo cuando el hígado, destruido por el Paracetamol, provoca la muerte del enfermo.
Si el paciente no toma Paracetamol, tendrá todos los síntomas del Dengue: malestar, fiebre, dolores en las juntas, vómitos, comezones y dolor en los fondos de los ojos, pero, después de una o dos semanas, estará vivo y bien.
Si toma Paracetamol, corre el riesgo de morir. Y pensar que la gente le da a sus hijos sin ninguna prescripción médica. En los Estados Unidos e Inglaterra, el Paracetamol está prohibido hace tiempo».
1. Introducción
El paracetamol (acetaminofén) es uno de los medicamentos más utilizados en todo el mundo y está disponible sin receta en la mayoría de los países.1 . Está incluido en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud (OMS) 2 . Se recomienda como tratamiento de primera línea para la mayoría de los casos de dolor y fiebre y su uso es seguro en niños de hasta un mes de edad, así como en mujeres embarazadas.3 . Viene en una variedad de formas y concentraciones, que incluyen tabletas orales, cápsulas y formulaciones líquidas, así como supositorios rectales.
En comparación con otros analgésicos disponibles sin receta, el paracetamol tiene un índice terapéutico relativamente estrecho. La toxicidad puede ocurrir después de errores de dosificación, ingestiones exploratorias accidentales en niños y sobredosis deliberadas de autolesión.
El paracetamol puede causar hepatotoxicidad grave con tan solo 10 g (o 200 mg/kg para pacientes de menos de 50 kg) en una sobredosis aguda.
La ingestión supraterapéutica repetida puede causar toxicidad en dosis sólo ligeramente superiores a la dosis terapéutica diaria máxima. 4 . Existe un antídoto eficaz contra el paracetamol (N-acetilcisteína o NAC); Sin embargo, a pesar de esto, la toxicidad del paracetamol sigue siendo la principal causa de insuficiencia hepática aguda (IFA) en la mayoría de los países de altos ingresos.5-10 .
Los casos graves pueden requerir un trasplante de hígado o provocar la muerte.9, 11.
Esta revisión explora estimaciones recientes de las tasas de sobredosis y hepatotoxicidad por paracetamol, incluidos el mecanismo, el diagnóstico y los tratamientos. Exploramos patrones globales de epidemiología del envenenamiento por paracetamol. A los efectos de esta revisión, definimos envenenamiento como el contacto, ya sea intencional o accidental, con una sustancia que puede causar daño.
1.1. Busqueda de literatura
Se realizaron dos búsquedas bibliográficas separadas para esta revisión.
Intentamos analizar los datos disponibles para determinar el número de exposiciones a intoxicaciones por paracetamol en todo el mundo ( Sección 5 ). Cuando no estuvieron disponibles datos específicos sobre el paracetamol, se utilizaron datos sobre analgésicos.
2. Descubrimiento y uso
El paracetamol es un derivado de la anilina. La acetanilida fue el primer derivado de anilina utilizado como antipirético y analgésico en 1886.1, 12 . Sin embargo, se encontró que tenía efectos tóxicos frecuentes (particularmente metahemoglobinemia) 13 y así comenzó la exploración de más derivados de anilina 1 .
Esto llevó al descubrimiento de la fenacetina y el paracetamol a finales del siglo XIX. 14, 15 . La fenacetina se consideró más segura y se utilizó con frecuencia durante unos 50 años 1,. Sin embargo, a finales de la década de 1940 se descubrió que el paracetamol era el metabolito principal menos tóxico de la fenacetina y la acetanilida y que no causaba metahemoglobinemia.1, 16. Esto, combinado con un bajo riesgo de nefrotoxicidad, hizo que el paracetamol estuviera disponible comercialmente en la década de 1950. 1, 14 ]. Otras preocupaciones sobre la seguridad de la aspirina en la década de 1970 llevaron al uso actual de primera línea del paracetamol como antipirético y analgésico.1, 14.
El mecanismo de acción del paracetamol aún no se comprende del todo. Se cree que los efectos antipiréticos se deben a la inhibición de la producción de prostaglandinas. 17 . Sin embargo, no muestra ningún efecto antiinflamatorio (cf. medicamentos antiinflamatorios no esteroides (AINE)), lo que sugiere que sólo actúa de forma central y no periférica.17.
Los efectos analgésicos también pueden deberse a la interferencia con las vías descendentes del dolor serotoninérgico a través de su activación. 17 . Como tal, estos efectos analgésicos pueden ser inhibidos por los antagonistas de la serotonina. 17, 18 .
El paracetamol generalmente se considera un analgésico de primera línea y se prefiere a los AINE en ciertos grupos de pacientes. A pesar de esto, una revisión sistemática reciente encontró que había evidencia suficiente para el uso de paracetamol en sólo 4 de 44 condiciones dolorosas y evidencia de que no era efectivo para algunas indicaciones comunes. 19.
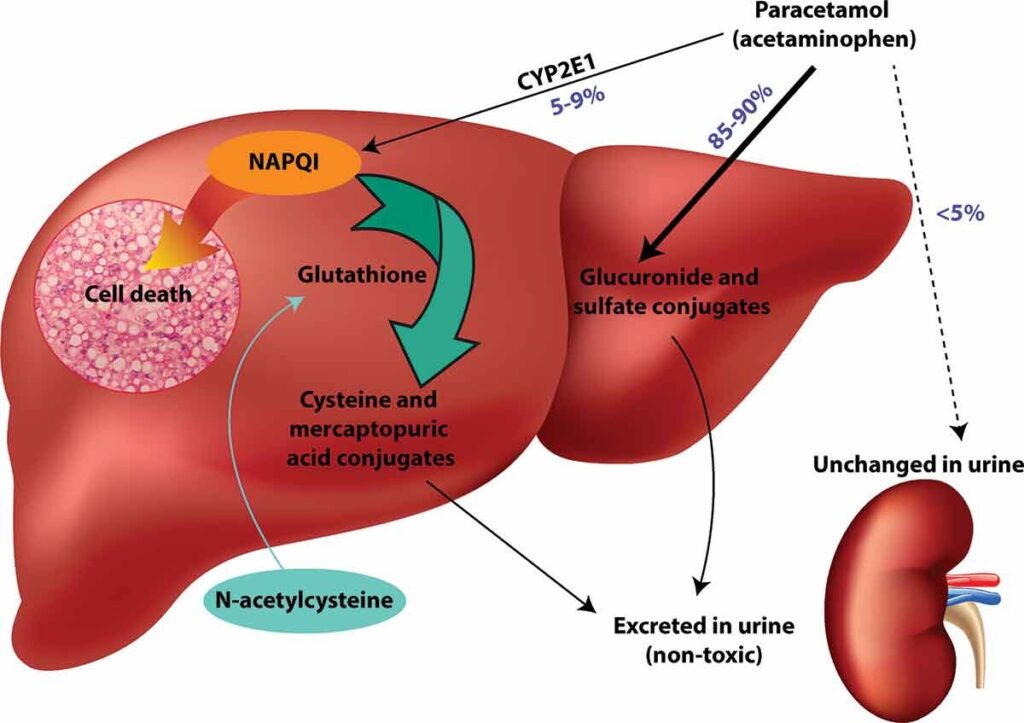
En uso terapéutico, el paracetamol se absorbe rápidamente alcanzando niveles terapéuticos después de 30 minutos y concentraciones plasmáticas máximas en 2 horas. 20 . Se puede tomar paracetamol de liberación inmediata cada 4 a 6 h y de liberación modificada/prolongada (MR/ER) cada 8 h para mantener las concentraciones terapéuticas. 3 . La mayor parte del paracetamol se metaboliza mediante glucuronidación y sulfatación y estos metabolitos luego se excretan por vía renal. [1, 10, 21 ]. Las pequeñas cantidades restantes se convierten en N-acetil-p-benzoquinoneimina (NAPQI), un metabolito tóxico, o se excretan sin cambios en la orina. 1, 10, 21.
Mecanismo tóxico del paracetamol y mecanismo de acción de la acetilcisteína. El paracetamol se desintoxica principalmente mediante conjugados de glucurónido y sulfato que luego se excretan en la orina.
Un pequeño porcentaje es metabolizado por CYP2E1 al intermediario reactivo NAPQI. En condiciones normales, NAPQI puede desintoxicarse mediante reacción con glutatión para formar conjugados de cisteína y ácido mercaptopúrico. Si se agota el glutatión (por ejemplo, en una sobredosis de paracetamol), NAPQI se une a las macromoléculas celulares provocando la muerte de los hepatocitos. El antídoto acetilcisteína repone la cisteína, que es el factor limitante de la síntesis de glutatión.
3. Toxicidad
3.1. Mecanismo y manifestaciones de toxicidad.
El principal efecto tóxico del paracetamol es la hepatoxicidad. El paracetamol es un «proveneno» que ejerce su efecto tóxico a través del metabolito reactivo tóxico, NAPQI. Este metabolito está formado por las enzimas del citocromo P-450 (CYP), principalmente CYP2E1 y CYP3A4. NAPQI se forma en pequeñas cantidades en dosis terapéuticas donde se desintoxica fácilmente mediante conjugación con glutatión. 1, 10, 21 ].
En caso de sobredosis, puede haber una cantidad insuficiente de glutatión para desintoxicar NAPQI, lo que hace que se una a las proteínas celulares (formación de aductos) [10, 21 ]. NAPQI se une principalmente a los residuos de cisteína, pero también puede dañar proteínas en los residuos de metionina, triptófano y tirosina. 22 .
Las mitocondrias son un objetivo clave para la formación de aductos NAPQI. La formación de especies reactivas de oxígeno causa estrés oxidativo y conduce a la activación de la quinasa N-terminal c-jun (JNK). 23 ].
La enzima JNK se traslada a las mitocondrias, provocando disfunción mitocondrial, cese de la formación de ATP y rotura de la membrana mitocondrial. 23 . Esto conduce a la necrosis celular. El papel de las mitocondrias en la hepatotoxicidad por paracetamol se ha revisado ampliamente. 24-27 .
La lesión hepática grave provoca pérdida de la función hepática sintética y coagulopatía e hipoglucemia. La pérdida de las funciones metabólicas hepáticas conduce a encefalopatía y acidosis láctica. 20, 28 .
Las manifestaciones clínicas de hepatotoxicidad se retrasan y los niveles máximos de transaminasas séricas se producen dos o tres días después de la sobredosis. 10, 28 . Aproximadamente entre el 12 y el 13% de las sobredosis agudas provocan hepatotoxicidad incluso con tratamiento.29 , y del 2 al 5% progresa a insuficiencia hepática 30 y 0,2-0,5 % con resultado de muerte 30.
También puede ocurrir lesión renal aguda, incluso en ausencia de insuficiencia hepática, y puede retrasarse. 31, 32 ]. La nefrotoxicidad puede ser directa debido a la necrosis tubular. 31-34 de la producción renal de NAPQI o indican síndrome hepatorrenal 32 ,33.
El paracetamol también es una toxina mitocondrial directa y en concentraciones muy altas puede provocar depresión del sistema nervioso central (SNC). El coma puede ocurrir en ausencia de hepatotoxicidad u otros fármacos que causen depresión del SNC y puede provocar un retraso en el diagnóstico y tratamiento de la sobredosis de paracetamol. 35–37.
3.2. Factores de riesgo de toxicidad.
Varios factores pueden aumentar el riesgo de toxicidad, principalmente al afectar las vías metabólicas del paracetamol.
3.2.1. Sobredosis masivas
La ingestión de sobredosis «masivas» (>30 g) aumenta la producción del metabolito reactivo NAPQI . Esto se verá exacerbado cuando las principales vías metabólicas se saturen. 10, 20. La sulfatación se satura en concentraciones más bajas que la glucuronidación. 38, que satura con una sobredosis masiva. El riesgo de hepatotoxicidad oscila entre el 13% y el 24% en pacientes que ingieren una sobredosis masiva.39 – 41 ]. La hepatotoxicidad puede ocurrir a pesar del tratamiento temprano con acetilcisteína dentro de las 8 h posteriores a la ingestión.39 – 41.
3.2.2. Presentación retrasada
Los síntomas de hepatotoxicidad pueden retrasarse hasta 48 h después de la ingestión. 28 . Incluyen náuseas, vómitos y dolor o sensibilidad abdominal, y pueden incitar a una persona a buscar atención. 10 .
La terapia con acetilcisteína debe iniciarse dentro de las 8 h posteriores a la ingestión para que sea más efectiva (descrito a continuación, 42 . Por lo tanto, los presentadores tardíos tienen mayor riesgo y a menudo ya tienen hepatotoxicidad grave. 20, 29.
3.2.3. Inductores enzimáticos
Los medicamentos que inducen la actividad de la enzima CYP2E1 del citocromo P450 (CYP), como la carbamazepina o la isoniazida, en teoría pueden aumentar la producción de NAPQI y contribuir a la toxicidad 3.
3.2.4. Agotamiento del glutatión
La desintoxicación de NAPQI depende de los niveles de glutatión. Las personas que están en ayunas, desnutridas o anoréxicas tienen un mayor riesgo de toxicidad debido a los niveles más bajos de glutatión. 44 . La hepatotoxicidad puede ocurrir a pesar de la ingestión o concentraciones por debajo de los umbrales tóxicos habituales. 45.
3.2.5. Consumo de alcohol
El consumo 45 . Esto puede deberse a la inducción de CYP2E1 43, 46, 47 o mala nutrición y reservas de glutatión más bajas 46. Se recomienda precaución contra el uso regular de paracetamol en este contexto.
Los consumidores crónicos de alcohol son una población con mayor probabilidad de sufrir sobredosis y que a menudo se presentan tarde, lo que podría ser responsable de peores resultados. 48 . También se ha informado que las personas que consumen crónicamente grandes cantidades de alcohol toman mayores sobredosis de paracetamol. 49 . Por lo tanto, esta asociación probablemente refleja tanto factores conductuales como metabólicos.
Por el contrario, la ingestión aguda de alcohol en el momento de una sobredosis de paracetamol protege contra el desarrollo de toxicidad.50 . El etanol también es un sustrato para las enzimas CYP responsables de la generación de NAPQI y compite con el paracetamol por el CYP2E1, reduciendo la cantidad de NAPQI que se produce. 43.
3.2.6. Ingestión de paracetamol de liberación modificada (MR) y de liberación prolongada (ER)
Las formulaciones de libe 51, 52 . El paracetamol ER está disponible en el mercado estadounidense y contiene 650 mg de paracetamol, 50 % de liberación inmediata y 50 % de liberación lenta. 53 . Tanto las formulaciones MR como ER están diseñadas para proporcionar alivio del dolor durante hasta 8 h.
La sobredosis de paracetamol MR se ha asociado con una absorción muy prolongada y múltiples picos. 54 en las concentraciones de paracetamol pueden ocurrir después de una sobredosis y los pacientes a menudo requieren un tratamiento prolongado debido a las concentraciones continuamente elevadas 51, 54, 55 . Puede haber formación de farmacobezoares 51, 56 lo que hace que la absorción sea aún más errática y esto también puede observarse en sobredosis masivas de paracetamol de liberación inmediata 39, 57 . Existe un mayor riesgo de hepatotoxicidad incluso con el tratamiento temprano, probablemente debido a las dosis generalmente más altas y a una discrepancia entre el momento de administración de acetilcisteína y altas concentraciones de paracetamol.
Una revisión retrospectiva encontró que en Australia había una tasa cada vez mayor de sobredosis de paracetamol con la formulación MR y que a menudo implicaban un mayor número de comprimidos. 58 . Además, las muertes por esta formulación representaron un tercio del total de casos registrados entre 2009 y 2017 58.
Para el paracetamol ER, los primeros datos sugirieron un riesgo similar entre la liberación inmediata y la sobredosis de paracetamol ER. 59 . Sin embargo, desde entonces ha habido informes de picos retrasados y cruce de la línea del nomograma retrasado (donde el nivel inicial estaba por debajo de la línea de tratamiento y los niveles posteriores están por encima de la línea) 55.
Si bien en general se acepta que el nomograma de Rumack-Matthew (descrito a continuación, Sección 3.3.1) no se puede utilizar de manera segura para la evaluación de riesgos en la sobredosis por RM y ER 60 , no está claro si los riesgos documentados del paracetamol MR se extienden a la formulación ER.
El paracetamol MR tiene un Tmax más largo que el paracetamol ER 60 . Además, los productos MR y ER están formulados de manera diferente. Las tabletas MR utilizan un recubrimiento de hidroxipropilmetilcelulosa 53, y los comprimidos ER son comprimidos de dos capas en los que un lado contiene paracetamol de liberación inmediata y el otro de liberación lenta (en una formulación matricial) 59 .
Se necesitan más estudios para determinar los riesgos del paracetamol ER en comparación con las formulaciones de liberación inmediata y MR. En ausencia de estos, es prudente asumir que el riesgo es mayor para todas las preparaciones de paracetamol de liberación sostenida.
3.2.7. Ingestión supraterapéutica repetida y sobredosis escalonadas
Las ingestiones supraterapéuticas repetidas ocurren cuando los pacientes exceden las dosis recomendadas de paracetamol durante un período prolongado con fines terapéuticos. El dolor dental parece estar asociado con ingestiones supraterapéuticas repetidas, en comparación con otros tipos de dolor.61 .
La ingestión supraterapéutica repetida conlleva un mayor riesgo de hepatotoxicidad en comparación con una sobredosis única aguda. En un estudio de un solo centro en los EE. UU., la hepatotoxicidad ocurrió en el 52% de los pacientes con sobredosis accidental (supraterapéutica repetida), en comparación con el 14% de aquellos con sobredosis deliberada. 62 . Esto fue a pesar de que el grupo accidental ingirió sobredosis más pequeñas 62 .
Los casos accidentales se presentaron más tarde y tenían más probabilidades de tener un trastorno crónico por consumo de alcohol, lo que probablemente contribuyó al aumento de la morbilidad. 62.
Otros estudios han comparado las sobredosis repetidas supraterapéuticas y deliberadas de paracetamol y de manera similar encontraron que la desventura terapéutica es un factor de riesgo de hepatotoxicidad y muerte.63, 64 . Aquellos que desarrollan hepatotoxicidad significativa típicamente tienen aminotransferasas elevadas en la presentación. 65, 66.
Las sobredosis repetidas también pueden ocurrir con intención de autolesionarse (a menudo denominadas sobredosis «escalonadas»). Al igual que aquellas con intención terapéutica, estas exposiciones tienen un mayor riesgo de hepatotoxicidad en comparación con las sobredosis agudas de autolesión.67 . Es probable que esto se deba a un retraso en la presentación 67.
3.2.8. Otros factores de riesgo
Si bien los factores anteriores son los factores de riesgo mejor establecidos de toxicidad después de una sobredosis de paracetamol, están surgiendo otros factores de riesgo potenciales. Un gran estudio retrospectivo realizado en los EE. UU. encontró un riesgo significativamente mayor de lesión hepática aguda en personas infectadas con el virus de la hepatitis C y en personas con enfermedad del hígado graso no alcohólico (NAFLD) 44. La infección por el virus de la hepatitis C también se asoció con un mayor riesgo de progresión a enfermedad hepática grave y mortalidad. 44.
La NAFLD también se ha identificado como un factor de riesgo de lesión hepática tras una sobredosis de paracetamol. 44 . Se ha estimado que el mayor riesgo de NAFLD es similar al de la enfermedad hepática alcohólica. 68. Es probable que este riesgo esté relacionado con la NAFLD, más que con la obesidad en sí, ya que algunos estudios no han demostrado un mayor riesgo de hepatotoxicidad por paracetamol en personas obesas en comparación con personas no obesas.69, 70.
Se ha postulado que el riesgo de hepatotoxicidad por paracetamol en un individuo obeso dependerá de la presencia de NAFLD y del equilibrio de factores protectores (p. ej., mayor glucuronidación, mayor volumen de distribución, absorción más lenta y actividad reducida de CYP3A4) y factores negativos (aumento de la hepatotoxicidad por paracetamol). Actividad CYP2E1, menores reservas de glutatión) 71.
Se ha identificado que los polimorfismos genéticos en las enzimas responsables del metabolismo del paracetamol tienen el potencial de aumentar el riesgo de hepatotoxicidad. Heruth y otros 72 han revisado 147 polimorfismos de un solo nucleótido potencialmente asociados con la hepatotoxicidad del paracetamol.
Se necesitan más estudios para determinar la relevancia clínica de estos polimorfismos.72]. Es posible que la variabilidad genética pueda explicar las elevaciones de la alanina aminotransferasa (ALT) en adultos sanos a los que se les administra paracetamol en la dosis terapéutica máxima de 4 g por día, y los raros casos de lesión hepática aguda en dosis terapéuticas. 72 . En un estudio genético de sujetos que tomaban paracetamol terapéutico, se analizaron 20 genes implicados en el metabolismo del paracetamol y en el desarrollo de lesión hepática inducida por fármacos (DILI). 73 . El único gen asociado con la ALT máxima fue SULT1E1 , que produce la enzima miembro 1 de la familia sulfotransferasa 1E.73.
3.3. Evaluación de riesgos de sobredosis de paracetamol
Los biomarcadores ayudan a determinar el riesgo de toxicidad, la necesidad de tratamiento y la eficacia del tratamiento. Las pruebas habituales que se utilizan para guiar el tratamiento de la sobredosis de paracetamol son: concentración sérica de paracetamol, pruebas de función hepática (particularmente alanina y aspartato aminotransferasas, ALT y AST) y índice internacional normalizado (INR).
3.3.1. Concentraciones de paracetamol y nomograma de Rumack-Matthew
La concentración de paracetamol se representa en función del tiempo desde la ingestión en el nomograma de Rumack-Matthew.74. Este nomograma se utiliza para ayudar a estimar el riesgo de toxicidad hepática y, por tanto, si está indicado el tratamiento con acetilcisteína (ver Sección 4.2 ) 75 .
Las concentraciones que se encuentran por encima de la línea indican que los pacientes necesitan acetilcisteína y las concentraciones superiores al doble de la línea indican un riesgo aún mayor.74. Algunas guías indican un aumento de la dosis de acetilcisteína en estos casos 74 . El nomograma de Rumack-Matthew no es útil para predecir el riesgo de presentaciones tardías (>24 h) o sobredosis repetidas.74, 75.
Si bien el nomograma de Rumack-Matthew se utiliza en la mayoría de los países, el Reino Unido ahora utiliza un nomograma con una línea inferior (la mitad del umbral de tratamiento original) 76–78. Este nuevo nomograma se introdujo en 2012 debido a un caso fatal aislado en el que la concentración de paracetamol estaba por debajo de la línea del nomograma y no se administró ningún tratamiento.77, 78 ]. La línea inferior del nomograma ha aumentado considerablemente el número de pacientes que reciben acetilcisteína, aumentando los costos de atención médica. 77,79 . Estos pacientes pueden estar expuestos innecesariamente a la acetilcisteína y posibles reacciones adversas. 76, 77. Además, varios estudios han demostrado que los pacientes con niveles más bajos de paracetamol tienen una mayor tasa de experimentar efectos adversos cuando son tratados con NAC. 77, 80.
3.3.2. Alanina y aspartato aminotransferasa (ALT y AST)
ALT y AST son enzimas hepáticas que se liberan a la sangre después del daño celular hepático y se utilizan para diagnosticar o excluir una lesión hepática aguda.42, 76 . Las dosis terapéuticas de paracetamol pueden provocar pequeños aumentos de las enzimas hepáticas con un tratamiento prolongado.81 ]. Sin embargo, las aminotransferasas vuelven a los rangos normales con el tratamiento continuo. Después de una sobredosis aguda, ALT/AST puede aumentar después de 8 h 42 , sin embargo, pueden permanecer dentro del rango normal hasta 24 h antes de que la hepatotoxicidad se haga evidente 82.
La tasa de aumento de ALT/AST parece importante, siendo los niveles iniciales de aminotransferasa los más altos en los pacientes que desarrollaron la toxicidad más grave.83 . Entre la presentación y el pico de aminotransferasa, la ALT y la AST generalmente aumentan en una proporción de 1:1. 84 . La ALT generalmente cae más lentamente que la AST, y una relación AST:ALT <0,4 indica que las aminotransferasas han alcanzado su punto máximo y están cayendo.84 . Si la relación AST:ALT es > 2 en el momento de la presentación, esto puede presagiar peores resultados y también se ha asociado con el uso crónico excesivo de etanol. 84 . La mayor gravedad de la hepatotoxicidad también se asocia con una caída más lenta de la AST y de la relación AST:ALT. 84.
La lesión hepática inducida por paracetamol provoca elevaciones marcadas de las aminotransferasas, en comparación con la mayoría de las otras causas de lesión hepática. La hepatotoxicidad inducida por paracetamol generalmente se define como AST o ALT > 1000 UI/L. En pacientes con toxicidad grave, son posibles concentraciones de aminotransferasas > 10 000 UI/L; sin embargo, una vez que se diagnostica la hepatotoxicidad, el pronóstico está mejor indicado por otros marcadores, por ejemplo, INR, pH y lactato (consulte la Sección 3.3.5 ).
La ALT/AST a menudo se mide en el momento de la presentación y periódicamente para indicar la necesidad de continuar el tratamiento. Vale la pena señalar que ALT/AST no es específico para la lesión hepática y también puede carecer de sensibilidad en la lesión hepática temprana.42, 85, 86.
3.3.3. El producto de multiplicación de paracetamol-aminotransferasa.
El producto de multiplicación de ALT y la concentración de paracetamol se ha propuesto como una herramienta de estratificación de riesgo para predecir la hepatotoxicidad después de una sobredosis de paracetamol. 87 . Un beneficio es que este método se puede utilizar cuando se desconoce el momento exacto de la ingestión y para sobredosis escalonadas y supraterapéuticas. La precisión diagnóstica de este producto ha sido confirmada, con un producto de multiplicación inicial de > 10.000 mg/L x UI/L fuertemente asociado con hepatotoxicidad 88 . Era muy poco probable que los pacientes con un producto <1500 mg/L x UI/L desarrollaran hepatotoxicidad 88 . También se ha demostrado que esta herramienta es precisa para la sobredosis de paracetamol por RM 89 . Una revisión sistemática reciente ha concluido que el producto de multiplicación de paracetamol-aminotransferasa puede complementar el nomograma de Rumack-Matthew, especialmente para presentaciones tardías e ingestiones escalonadas.90.
3.3.4. Ratio normalizado internacional (INR)
El INR se utiliza para determinar la gravedad de la hepatotoxicidad, ya que el hígado es responsable de la producción de muchos factores de coagulación.42 . Sin embargo, la sobredosis de paracetamol y acetilcisteína pueden causar directamente un INR ligeramente prolongado y, por lo tanto, la prueba sólo es útil en hepatotoxicidad establecida.91 . Los niveles de INR se utilizan luego para indicar la gravedad, el pronóstico y la duración del tratamiento con acetilcisteína.74.
3.3.5. Criterios de derivación a la unidad hepática
Estas investigaciones guían el tratamiento con acetilcisteína y estratifican el riesgo. Las pautas varían internacionalmente, sin embargo, generalmente ALT >1000 U/L se considera un indicador de lesión hepática grave, y INR >3 indica insuficiencia hepática aguda (ALF) y justifica la derivación a la unidad hepática.74 . Otros criterios que justifican la derivación a una unidad hepática especializada incluyen: oliguria o creatinina > 200 micromol/L, acidosis (pH < 7,3) o lactato > 3 mmol/L, hipoglucemia, trombocitopenia, hipotensión y encefalopatía (ver Sección 4.7).74.
3.3.6. Nuevos biomarcadores
Existen muchos otros biomarcadores potenciales para predecir el desarrollo de toxicidad hepática y guiar el tratamiento.42, 75, 76, 86 ]. Los biomarcadores ideales detectarían el daño hepático antes que la ALT y el INR y también predecirían la gravedad y el pronóstico. Los candidatos prometedores incluyen marcadores de daño mitocondrial y necrosis y aductos de proteína de paracetamol que miden el metabolito tóxico NAPQI unido a proteínas celulares. 42, 75, 76, 82 ]. Se ha demostrado que los aductos de paracetamol-proteína son marginalmente superiores a los biomarcadores tradicionales para predecir la lesión hepática aguda y pueden diagnosticar la hepatotoxicidad inducida por paracetamol en ausencia de antecedentes de ingestión.38, 82, 92, 93].
4. Tratamiento de la sobredosis de paracetamol
4.1. Carbón
El carbón activado se une al paracetamol y, por lo tanto, puede reducir la cantidad de paracetamol absorbido en el tracto gastrointestinal. 94 ]. Puede ser útil en sobredosis agudas de paracetamol que se presentan en centros de atención primaria dentro de las 2 h posteriores a la ingestión (o 4 h para sobredosis «masivas» o exposiciones a preparaciones de RM/ER) 74 . Sin embargo, no es útil en pacientes que ingieren formulaciones líquidas debido a la rápida absorción. 74 . Tampoco se recomienda después de ingestiones supraterapéuticas repetidas 74 . El carbón vegetal puede reducir las concentraciones máximas de paracetamol, la necesidad de NAC y disminuir el riesgo de hepatotoxicidad. 39, 95.
4.2. N-acetilcisteína (NAC)
La NAC es el pilar del tratamiento de la sobredosis de paracetamol. La NAC restaura el glutatión al reponer la cisteína, el factor limitante de la síntesis de glutatión. 96, 97 ]. Esto permite la desintoxicación de NAPQI y previene la hepatotoxicidad en la mayoría de los casos. 98 ]. El riesgo de desarrollar hepatotoxicidad se reduce sustancialmente cuando se administra NAC dentro de las 8 h posteriores a la ingestión. 21].
Antes de la disponibilidad del tratamiento con NAC, la morbilidad y mortalidad después de una sobredosis de paracetamol eran considerables; muchos desarrollaron lesión hepática aguda y entre el 3 y el 5% murieron 99, 100 ]. Desde que la acetilcisteína se ha convertido en el tratamiento estándar, las muertes son raras, menos del 1% en la mayoría de las cohortes. 94.
Se han utilizad 101 . Ambas vías son efectivas, aunque la formulación intravenosa ahora se usa más comúnmente y tiene ventajas cuando hay factores que pueden afectar la absorción oral, incluidos vómitos, afecciones gastrointestinales o evidencia de insuficiencia hepática. 29 . Varios regímenes intravenosos han sido objeto de ensayos clínicos y el «régimen de 3 bolsas» fue el más común durante muchos años 74, 94, 101. El uso de regímenes simplificados de «2 bolsas» reduce las reacciones adversas a los medicamentos, pero tiene una eficacia comparable. 74, 102-104 . La modificación más simple es una bolsa de 200 mg/kg entregada en 4 h, seguida de una bolsa de 100 mg/kg entregada en 16 h.Citación74 . Los regímenes de dos o tres bolsas también se pueden combinar en una bolsa de infusión administrada con tasas variables, lo que puede reducir el riesgo de lagunas en el tratamiento.105.
A veces se utilizan regímenes abreviados de NAC en el tratamiento de la ingestión supraterapéutica repetida. En Australia, se utiliza un régimen de NAC de 8 h en ingestiones supraterapéuticas repetidas donde la ALT permanece estática y las concentraciones de paracetamol permanecen bajas.74 ]. Un estudio retrospectivo indicó que esto probablemente sea seguro (no hubo casos de nueva presentación con hepatotoxicidad) y reduce la duración de la estancia hospitalaria.106 ]. En los EE. UU., el protocolo del Rocky Mountain Poison and Drug Center trata a los pacientes con ingestión supraterapéutica repetida con 12 h de NAC, y el tratamiento solo continúa si ALT/AST aumenta o la concentración de paracetamol es elevada.107].
Cada vez se reconoce más que la dosificación de NAC en función del peso corporal puede no ser suficiente para prevenir lesiones en pacientes que toman dosis altas de paracetamol. Esto ha llevado a la práctica de aumentar la dosis de NAC en pacientes de alto riesgo. Por ejemplo, duplicar la dosis de NAC administrada en la segunda o tercera bolsa cuando las concentraciones de paracetamol son más del doble de la línea del nomograma reduce el riesgo de hepatotoxicidad.39, 74 . Recientemente se han revisado los regímenes de dosificación óptimos de NAC y las direcciones futuras 108.
Se utilizan biomarcadores que incluyen enzimas hepáticas, INR y concentraciones de paracetamol para guiar la duración de la NAC.74 . Se deben administrar infusiones prolongadas de NAC en pacientes de alto riesgo (p. ej., pacientes con concentraciones de paracetamol persistentemente elevadas o hepatotoxicidad establecida) 74.
4.3. metionina
Antes del uso activo de acetilcisteína, se utilizaban otros tratamientos como la metionina.Citación94,Citación99,Citación109 ]. Al igual que la NAC, la metionina es un antídoto utilizado para aumentar el glutatión y tratar o prevenir la hepatotoxicidad.Citación109 ]. Aunque se administra principalmente por vía oral, se ha administrado por vía intravenosa.Citación99,Citación109,Citación110 ]. La metionina puede causar efectos secundarios gastrointestinales, neurológicos o cardiovasculares que limitan su aceptabilidad.Citación109,Citación110 ] por lo que ya no se recomienda de forma rutinaria. Aunque inicialmente la OMS consideró que tenía un perfil de eficacia y seguridad similar al de la acetilcisteína.Citación94 ], la metionina ya no figura en la Lista de Medicamentos Esenciales más reciente de la OMS [Citación2].
4.4. Cimetidina
La cimetidina es un antagonista del receptor de histamina-2 y un inhibidor del CYP2E1.Citación111 ]. Basado en esta inhibición, se ha propuesto como un tratamiento potencial para la sobredosis de paracetamol.Citación111 ]. Hay muchos estudios en animales que muestran que la cimetidina reduce la hepatotoxicidad del paracetamol, resumidos por Mullins et al [Citación111 ]. Sin embargo, lamentablemente no se ha demostrado la eficacia clínica en humanos, aunque se han realizado estudios pequeños con pocos pacientes de alto riesgo.Citación111].
4.5. fomepizol
El fomepizol es mejor conocido como tratamiento para la intoxicación por alcohol tóxico, donde inhibe la alcohol deshidrogenasa.Citación112 ]. Recientemente se ha propuesto fomepizol como tratamiento para prevenir la hepatotoxicidad tras una sobredosis de paracetamol. El mecanismo no está relacionado con la alcohol deshidrogenasa, pero se cree que es el resultado de dos funciones.Citación112 ]. Fomepizol inhibe CYP2E1, reduciendo la conversión de paracetamol en NAPQI.Citación112 ]. En segundo lugar, también puede prevenir la activación de la enzima JNK y la disfunción mitocondrial resultante.Citación112,Citación113].
La evidencia para el uso de fomepizol en este contexto proviene principalmente de modelos animales [Citación113 ] y series de casos pequeños [Citación114,Citación115 ]. La interpretación de los resultados de series de casos observacionales ha sido controvertida [Citación112,Citación116,Citación117 ]. Algunos han abogado por el uso de fomepizol como complemento de la NAC en sobredosis masivas.Citación114 ]. Otros han pedido la necesidad de realizar grandes estudios comparativos para generar evidencia antes de que el fomepizol se considere un tratamiento recomendado.Citación116 ]. Si los primeros resultados prometedores se replican en ensayos clínicos sólidos, el fomepizol podría cubrir una necesidad no cubierta en este espacio, particularmente para los pacientes en los que la NAC es menos efectiva (sobredosis masiva, presentación tardía).
4.6. Calmangafodipir
La superóxido dismutasa de manganeso es una proteína mitocondrial que elimina los radicales libres y puede prevenir lesiones mitocondriales. Dosis tóxicas de paracetamol inhiben la superóxido dismutasa de manganeso en estudios con animales [Citación118 ]. Restaurar o imitar la actividad de la superóxido dismutasa de manganeso podría usarse como tratamiento para la sobredosis de paracetamol. El calmangafodipir es un mimético de la superóxido dismutasa.Citación119 ]. Se ha utilizado con éxito en ensayos de fase 2 para la neuropatía periférica inducida por quimioterapia mediada por estrés oxidativo. En un pequeño estudio en el que se utilizó calmangafodipir como complemento de la NAC en caso de sobredosis de paracetamol, no se identificaron problemas de seguridad.Citación119 ]. Ese ensayo también encontró que el calmangafodipir puede reducir los biomarcadores de lesión hepática; sin embargo, el tamaño y el diseño de la muestra no tenían la potencia necesaria para estudiar la eficacia, y la mayoría de los pacientes inscritos tenían un riesgo bajo de hepatotoxicidad.Citación119 ]. Se necesitan más estudios diseñados para evaluar la eficacia. Recientemente se han revisado fomepizol, calmangafodipir y otras posibles dianas terapéuticas para la hepatotoxicidad por paracetamol. 120].
4.7. Trasplante de hígado
En pacientes con insuficiencia hepática grave y pronóstico grave, se considera el trasplante hepático ortotópico.Citación121 ]. Los criterios de Kings College se utilizan ampliamente para predecir la probabilidad de que los pacientes mueran sin un trasplante de hígado.Citación121,Citación122 ]. Existe cierta controversia en torno a los beneficios del trasplante de hígado después de una sobredosis de paracetamol, y una revisión sistemática sugiere que el trasplante puede conferir pocos beneficios en la supervivencia a largo plazo.Citación121,Citación123].
4.8. Falta de directrices de tratamiento globales.
Las guías de práctica clínica permiten consolidar los materiales disponibles para guiar áreas como el diagnóstico, las recomendaciones de tratamiento y el seguimiento. Por lo general, son fáciles de navegar y brindan instrucciones claras sobre el curso de manejo de la afección sospechada. Su uso es invaluable en una variedad de afecciones con resultados potencialmente graves, incluida la intoxicación por paracetamol. Sin embargo, aparte del desarrollo de las directrices de Australia y Nueva Zelanda, aquellas que brindan orientación sobre el tratamiento de esta afección no están disponibles ni son de libre acceso.Citación74 ]. Es posible que muchos países hayan establecido pautas nacionales o regionales, aunque es posible que solo sean accesibles a través de recursos en línea basados en suscripción o mediante contacto con un Centro de información sobre venenos (PIC). Sin embargo, el desarrollo de directrices globales consistentes es difícil ya que el tratamiento de la intoxicación por paracetamol no es un enfoque único que sirva para todos. Varios países han adoptado regímenes alternativos de NAC o incluso límites de corte más bajos para iniciar el tratamiento basándose en el nomograma de Rumack-Matthew.Citación101 ]. Dinamarca incluso renuncia al uso de este nomograma y trata a todos los pacientes con un ciclo completo de NAC independientemente de las concentraciones de paracetamol.Citación80].
5. Epidemiología de la sobredosis de paracetamol
5.1. Metodología para estimar el impacto de la sobredosis de paracetamol a nivel mundial
La estrategia de búsqueda realizada para esta sección de la revisión se describe arriba (Sección 1.1) y con más detalle en Métodos complementarios.
Los datos se presentan como recuentos anuales por 100.000 habitantes donde se pudo determinar una población de cuenca y/o como un porcentaje de todas las exposiciones a intoxicaciones. Cuando fue posible, calculamos las tasas de letalidad dividiendo el número de muertes por intoxicación por causas específicas por el número de exposiciones.
Los promedios ponderados se calcularon mediante un metanálisis para tener en cuenta la heterogeneidad entre las fuentes de datos. El metanálisis se realizó en R 4.0.4. Para obtener detalles completos, incluidas las definiciones de analgésicos, DILI y ALF/ALI, consulte Métodos complementarios.
5.2. Disponibilidad de datos por región
Hubo un total de 115 fuentes de datos que contenían información sobre intoxicaciones por analgésicos y/o paracetamol. Los países de Europa, América del Norte y Asia fueron las mayores fuentes de contribución (Figura complementaria S1). Los datos disponibles no son proporcionales a la población 124 , y muchos continentes proporcionaron pocos datos. Algunas publicaciones incluían datos de varios países, aunque a menudo se trataba de países dentro de la misma zona geográfica. Dentro de los países, algunos conjuntos de datos contienen información de determinadas regiones únicamente. Además, las fuentes de datos disponibles diferían según el país. Como tal, en las figuras, los puntos de datos para cada país han sido codificados por colores según el tipo de fuente de datos: centros de información sobre intoxicaciones, un solo hospital/centro de tratamiento y múltiples hospitales/centros de tratamiento o grandes conjuntos de datos administrativos.
5.3. Exposiciones generales e intencionales
5.3.1. Tarifas como porcentaje
Cuando hubo datos disponibles, encontramos una media ponderada del 9,7% (rango 0,7-40,2%) de los casos de intoxicación atribuibles a analgésicos (Figura complementaria S2) 125-157 . Dinamarca tuvo la mayor proporción de intoxicaciones atribuibles a analgésicos con un 40,2%, señalando que se trataba de una proporción de intoxicaciones por drogas únicamente y no de todas las intoxicaciones 133 . La tasa más baja fue reportada por un Centro de Información sobre Toxicología alemán [151.
El paracetamol representó un promedio del 6,2% (rango 0,5-34,9%) de las intoxicaciones en las que había datos disponibles 125–131, 133, 135, 136, 138, 140, 142–144, 148, 150, 156–183 (incluidos datos adicionales de respuestas por correo electrónico, tabla complementaria S1). Representa más de una cuarta parte de todas las intoxicaciones por drogas en Dinamarca [Citación133 ] y de todas las intoxicaciones en una cohorte de > 17 000 pacientes en Australia [Citación159 ]. Croacia tuvo muy pocas intoxicaciones por paracetamol (<1%) [Citación162].

Figura 3. Porcentaje de intoxicaciones relacionadas con paracetamol. Los puntos de color azul oscuro representan datos de un único hospital/centro de tratamiento, los puntos de color azul claro representan datos de múltiples hospitales/centros de tratamiento o grandes bases de datos administrativas, mientras que los puntos naranja representan datos del centro de información sobre venenos. La línea de puntos muestra la media ponderada entre fuentes del 6,2%.*Se refiere a fuentes de datos que utilizan el registro de casos ToxIC, que se basa principalmente en datos de EE. UU., pero también puede incluir datos de Canadá, Australia, Israel, Arabia Saudita y Tailandia. Una fuente de datos en Bélgica también contiene datos de Luxemburgo. Una fuente en Brasil contiene datos de un Centro de Información sobre Toxicología combinados con datos de múltiples hospitales/centros de tratamiento. Las fuentes de datos de Chile y Dinamarca informaron sobre intoxicaciones por drogas/productos farmacéuticos únicamente. Una fuente de Portugal (3,8%) informó únicamente de intoxicaciones accidentales o no intencionales. Una fuente de datos de EE.UU. (16,5%) y la fuente etíope informaron sobre envenenamientos cometidos únicamente por mujeres.
Las intoxicaciones en unidades de cuidados intensivos (UCI) representan un subconjunto grave de intoxicaciones y no se agruparon con las tasas generales. Las intoxicaciones por analgésicos representan el 8,0% de las intoxicaciones en las UCI en Francia [Citación184 ] y el 12,4% en Alemania [Citación185 ]. Una fuente iraní informó que el paracetamol representaba sólo el 0,7% de las intoxicaciones en las UCI [Citación186].
Para las fuentes que informaron únicamente exposiciones intencionales, las intoxicaciones por analgésicos representaron el 16,3% (rango 6,2-29,2%) (Figura complementaria S3) 135, 148, 187–192].
Las intoxicaciones intencionales por paracetamol representaron el 11,8% (rango 1,8-37,3%) de todas las intoxicaciones intencionales, la más alta en Nueva Zelanda y la más baja en Croacia 125–128, 144, 148, 157, 162, 193, 194 ] (incluidos datos adicionales de respuestas por correo electrónico, Tabla complementaria S1).
5.3.2. Tasas por 100.000 habitantes por año
Encontramos una media ponderada de 11,5 (rango 0,1-88,9) intoxicaciones por analgésicos por 100.000 habitantes por año, la más baja en China y Botswana (Figura complementaria S4) [Citación125–128, 130–134, 136, 139, 145-157 ]. En promedio, las ingestiones intencionales de analgésicos contribuyeron a 4,9 (rango 0,4-26,0) intoxicaciones por 100.000 habitantes por año, con datos solo disponibles para cuatro países (Figura complementaria S5) 148, 188, 192, 195.
El paracetamol estuvo involucrado en un promedio de 7,4 (rango 0,1-63,6) intoxicaciones por 100.000 habitantes por año 58, 125–128, 130, 131, 133, 136,C 148,C 150, 156–160, 162, 163, n166, 168, 169, 171, 172, 174, 176–182, 196–200 (incluidos datos adicionales de respuestas por correo electrónico, tabla complementaria S1). La tasa más baja se informó en una fuente de datos que informaba únicamente sobre mujeres, en Etiopía [Citación163 ]. Australia tuvo la tasa más alta reportada con 63,6 por 100.000 habitantes por año [Citación182 ]. Centrándonos en las exposiciones intencionales, hubo 5,4 (rango 0,2-31,9) intoxicaciones intencionales por paracetamol por cada 100.000 habitantes por año [ 58, 125–128, 148,C 157,C 162, 194, 196,C 197, 200 ] (incluidos datos adicionales de respuestas por correo electrónico, tabla complementaria S1).
5.4. Tasas de hepatotoxicidad e insuficiencia hepática.
En general, el paracetamol representó una media ponderada del 55,7% (rango 50,0-77,8%) de lesión hepática aguda grave (ALI) y/o IHA.Citación201-208 ] y 7,3% (rango 1,2-29,2%) de lesión hepática inducida por fármacos (DILI) [Citación209-219 ] . El país con el mayor porcentaje de casos de DILI causados por paracetamol fue Estados Unidos con casi el 30% [Citación217 ] seguido por Pakistán con un 16% [Citación215 ]. Para las fuentes que examinan las causas de ALI/ALF, Escocia y Australia tuvieron el mayor número de casos relacionados con el paracetamol con aproximadamente el 78% [Citación204 ] y 63% [Citación201 ], respectivamente.
5.5. Muertes
Cuando había datos disponibles, los analgésicos contribuyeron a 0,1 (rango 0,0003-0,7) muertes por 100.000 habitantes por año (Figura complementaria S6) 125–128,C 157, 195, 220–224 ]. Cuando se eliminaron las fuentes de datos que incluían opioides, esta cifra se redujo a 0,04/100.000. Las fuentes que informaron sobre el paracetamol solo encontraron resultados similares, con una media ponderada de 0,04 (rango 0,0001-0,3) muertes por 100.000 habitantes por año atribuibles al paracetamol ) 58, 125–128, 148, 153, 157, 160,C 196, 221,C 222, 224–228.
La tasa de letalidad por intoxicaciones por analgésicos promedió 0,7% (rango 0,1-2,5%) (Figura complementaria S7) [Citación125–128,Citación141,Citación157,Citación195 ]. Una fuente de datos de la UCI alemana informó una tasa de letalidad del 4,1%, pero esto no se combinó con otras fuentes de datos debido al sesgo hacia intoxicaciones más graves en la UCI [Citación185 ]. La tasa de letalidad por intoxicaciones por paracetamol fue del 0,4% (rango 0,1-2,3%) (Figura complementaria S8) [Citación58,Citación125–128,Citación135,Citación143,Citación144,Citación148,Citación157,Citación160,Citación196,Citación229,Citación230].
5.6. Limitaciones de los datos disponibles
Hubo varias limitaciones que afectaron la cantidad y el tipo de datos que se recopilaron. Al realizar una búsqueda bibliográfica únicamente a través de PubMed, es posible que se hayan omitido algunos estudios relevantes. Aunque es posible que estos datos se hayan publicado en informes anuales, no todos los países tienen un PIC y también hay una clara falta de representación de los países de ingresos bajos y medianos en los datos disponibles. Utilizando el directorio de centros de toxicología de la OMS, se enviaron correos electrónicos a 280 PIC diferentes, pero solo hubo 11 respuestas directas y 66 correos electrónicos que no se pudieron entregar. Más de 50 sitios web eran inaccesibles y, aunque algunos PIC contaban con un informe anual, muchos no informaban sobre los datos necesarios para este análisis. Muchos sitios web eran un enlace directo al hospital en el que trabajaba el PIC en lugar del PIC en sí y muchos no contenían ningún informe anual. Los datos presentados en idiomas distintos del inglés pueden haberse interpretado incorrectamente y, como tal, algunos datos pueden no ser precisos.
Los modelos operativos de PIC varían en todo el mundo. Algunos brindan asesoramiento únicamente a los profesionales de la salud, mientras que otros también incluyen al público en general. Algunos actúan como servicios de toxicología dentro de los hospitales, mientras que otros brindan asesoramiento por teléfono o mediante un modelo híbrido con bases de datos en línea (como el Reino Unido, Nueva Zelanda y los Países Bajos). Esto podría dar lugar a variabilidad en las tasas registradas. Se hicieron intentos para identificar las poblaciones de cuenca para permitir el cálculo de las tasas de población, sin embargo, esto no estaba disponible en gran parte de la literatura, lo que resultó en el uso de tasas como porcentaje cuando estaban disponibles. Algunas fuentes de datos solo proporcionaron tasas sin proporcionar datos sin procesar ni poblaciones de captación [Citación195,Citación196 ] y como tales fueron excluidos del cálculo de las medias ponderadas. Además, algunos países tenían datos de determinadas regiones únicamente. Es poco probable que regiones particulares sean representativas de un país completo, lo que puede reducir la precisión de estos resultados.
Los datos de muerte provinieron de una variedad de fuentes de datos, incluidos centros toxicológicos donde se buscan datos de resultados (p. ej., EE. UU.), hospitales individuales y datos de estadísticas de muerte nacionales/forenses/coroniales. Cada una de estas fuentes de datos tiene sus limitaciones; por ejemplo, los conjuntos de datos de centros toxicológicos y hospitales no capturan las muertes fuera del hospital, y algunos pacientes se perderán durante el seguimiento del centro toxicológico. Los conjuntos de datos que utilizan datos coronales/forenses pueden sobrestimar los casos al contar aquellos en los que se detectó paracetamol en sobredosis de múltiples fármacos, pero no se produjo hepatotoxicidad. No hubo un patrón claro entre la fuente de datos y la estimación , lo que indica que la variabilidad puede deberse a diferencias específicas de cada país, así como a la captura de datos.
Muchas publicaciones contenían exclusiones como la edad o el sexo, y excluimos las fuentes de datos pediátricos únicamente, ya que es probable que las tasas sean muy diferentes de las tasas de toda la población donde predomina la sobredosis intencional. Algunas fuentes se limitaron únicamente a intoxicaciones por drogas, lo que probablemente dé lugar a la variedad de estimaciones observadas. Las definiciones de analgésicos no fueron consistentes en toda la literatura. Se intentó eliminar los datos relacionados con los opiáceos; sin embargo, a veces esto no fue posible porque los autores del estudio original ya agruparon los datos. Las consultas de los centros de toxicología no estaban bien definidas y pueden incluir exposiciones además de llamadas con respecto a información general, así como retiros del mercado por la misma exposición; por esta razón, solo incluimos datos de las exposiciones de los centros de toxicología.
6. Disponibilidad de paracetamol y sus impactos
6.1. Ventas fuera de farmacia, ventas en farmacia y restricciones de tamaño de paquete
El paracetamol está disponible sin receta en la mayoría de los países. Es uno de los analgésicos de venta libre (OTC) más comunes utilizados en sobredosis suicidas.Citación231 ]. Un estudio realizado en Irlanda encontró que el paracetamol se utilizó en más de la mitad de todas las sobredosis de medicamentos de venta libre.Citación232 ]. Los volúmenes que se pueden comprar y la disponibilidad de ventas no farmacéuticas difieren sustancialmente a nivel mundial (tabla 1). Un estudio de 21 países europeos encontró que más de la mitad de los países participantes, incluidos Francia, Italia y Suiza, no tenían paracetamol disponible para su compra fuera de las farmacias y que la tasa de consultas sobre intoxicaciones relacionadas con el paracetamol fue posteriormente menor en la mayoría de estos países.Citación233 ]. Países como el Reino Unido, Dinamarca e Irlanda permiten la venta de paracetamol fuera de las farmacias, aunque el tamaño de los envases está limitado a 5-8 g.Citación233 ]. La introducción de la venta de paracetamol en puntos de venta no farmacéuticos en Suecia en 2009 se asoció con un aumento en la tasa de intoxicaciones por paracetamol [Citación234 ], sin embargo, se reintrodujeron restricciones en 2015 [Citación233].
Tabla 1. Restricciones en el tamaño de los envases de venta sin receta (OTC) de paracetamol de liberación inmediata en farmacias y fuera de farmacias.
Descargar CSVMesa de visualización
Más de dos tercios de los países europeos tienen restricciones en el tamaño de los envases de paracetamol en las farmacias, que van de 8 a 30 g.Citación233 ]. El número de consultas sobre intoxicaciones relacionadas con el paracetamol fue mayor en algunos de estos países [Citación233].
En EE. UU. y Canadá, el paracetamol está disponible fuera de las farmacias en paquetes muy grandes [Citación30 ]. El paracetamol estuvo involucrado en casi la mitad de los suicidios/intentos de suicidio utilizando analgésicos de venta libre en los EE. UU.Citación235].
En Singapur, el paracetamol se puede vender fuera de las farmacias sin restricciones.Citación30 ]. En Australia, y de manera similar en Nueva Zelanda, se pueden vender fuera de las farmacias productos que contienen hasta 20 comprimidos de 500 mg de paracetamol de liberación inmediata.Citación236,Citación237 ]. No existen límites legales sobre la cantidad máxima (número de paquetes) de paracetamol que se puede comprar fuera de las farmacias. En Australia y Nueva Zelanda, en las farmacias los clientes pueden comprar paquetes de hasta 100 comprimidos de paracetamol de liberación inmediata sin la intervención de un farmacéutico.Citación236,Citación237].
6.2. RM/ER Paracetamol
El paracetamol MR presenta un desafío importante en caso de sobredosis y es más peligroso que el paracetamol de liberación inmediata. Puede causar hepatotoxicidad a pesar del tratamiento temprano con NAC, y el tratamiento con carbón y un aumento de NAC no son efectivos para prevenir la hepatotoxicidad incluso en aquellos que se presentan temprano.
Tras una decisión de la Agencia Europea de Medicamentos, países de la Unión Europea como el Reino Unido (anteriormente), Dinamarca e Irlanda no suministran paracetamol MR, ni siquiera con receta [Citación30,Citación238 ]. Por otro lado, países como Estados Unidos y Singapur no tienen restricciones sobre el paracetamol ER y también permiten que esta formulación se venda fuera de las farmacias.Citación30].
En Australia, la formulación MR estaba originalmente disponible en farmacias sin consultar a un farmacéutico, similar al paracetamol de liberación inmediata. En 2020, las preocupaciones por sobredosis llevaron a que se programara de manera que el suministro requiriera la aprobación de un farmacéutico (también ocurrieron cambios similares en Nueva Zelanda) [Citación236, Citación239].
6.3. Impacto de los cambios regulatorios
A nivel mundial se han realizado pocos estudios sobre cambios destinados a reducir la aparición de sobredosis de paracetamol y sus complicaciones. Algunos países han implementado restricciones en el tamaño de los paquetes y/o han tomado medidas para restringir el acceso al paracetamol fuera de las farmacias.
6.3.1. El Reino Unido
En el Reino Unido, en 1998 se introdujo una legislación para reducir el tamaño de los envases de paracetamol disponibles tanto dentro como fuera de las farmacias.Citación240 ]. Los clientes podrían comprar hasta 8 g de paracetamol en tiendas generales y hasta 16 g en farmacias pero sin asistencia; cualquier cantidad mayor requirió discusión con un farmacéutico [Citación240 ]. En el año siguiente a la intervención, hubo una reducción significativa tanto en el número total de sobredosis de paracetamol como en el número de sobredosis graves de paracetamol en el Royal Free Hospital [Citación241 ]. Las sobredosis de benzodiazepinas se utilizaron como control y se mantuvieron estables.Citación241 ]. Un estudio que combinó datos de la Oficina de Estadísticas Nacionales con información de seis unidades de hígado y sistemas de monitoreo en hospitales generales encontró resultados consistentes [Citación242 ]. Las muertes por suicidio se redujeron en un 22% en el primer año, cifra que se mantuvo durante los dos años siguientes.Citación242 ]. Los ingresos a unidades hepáticas y los trasplantes de hígado se redujeron en aproximadamente un 30% y las sobredosis grandes se redujeron en un 20%.Citación242 ]. Hubo un aumento simultáneo en las sobredosis de ibuprofeno, pero poco o ningún efecto sobre los suicidios.Citación242].
Algunos estudios de esta intervención han tenido resultados neutrales o negativos. Un estudio que utilizó datos nacionales de muertes y admisiones hospitalarias encontró una disminución de la mortalidad y las admisiones hospitalarias por paracetamol entre 1993 y 2002 [Citación243 ]. Sin embargo, los autores concluyeron que la contribución de la intervención de 1998 no estaba clara [Citación243 ]. Un análisis de series temporales interrumpidas encontró una disminución en la mortalidad por intoxicación por paracetamol asociada con la intervención [Citación244 ]. También disminuyó la intoxicación mortal por algunos otros agentes (incluidos los compuestos de paracetamol no afectados por la legislación) [Citación244 ]. Los autores concluyeron que la reducción observada podría haber sido parte de una tendencia más amplia [Citación244].
Un estudio escocés sobre hospitalizaciones y muertes por paracetamol no encontró ninguna reducción en la frecuencia de sobredosis de paracetamol ni en la mortalidad después de la intervención de 1998.Citación245].
Una revisión sistemática que examinó los efectos de esta intervención encontró que se redujo significativamente la cantidad de paracetamol adquirido y una reducción en el número de admisiones a unidades de hígado y trasplantes posteriores.Citación240 ]. También hubo una disminución significativa en el número total de muertes causadas por el paracetamol, aunque todavía supera las 100 muertes por año [Citación246].
Se ha cuestionado el cumplimiento de la legislación por parte de los minoristas. Un estudio sobre «compradores misteriosos» realizado en el sur de Londres en 2004 probó si se podían comprar cantidades superiores a las establecidas por la legislación de 1998 en establecimientos farmacéuticos y no farmacéuticos [Citación247 ]. Los investigadores pudieron comprar > 32 tabletas en cuatro de ocho farmacias y > 16 tabletas en 13 de otros 16 minoristas [Citación247 ]. El mismo estudio encuestó a pacientes de un hospital de Londres que tomaron sobredosis de paracetamol. Aproximadamente la mitad de los pacientes que ingirieron > 16 comprimidos de paracetamol compraron paracetamol con el fin de tomar una sobredosis.Citación247 ]. De estas 35 personas, 15 fueron a varias tiendas diferentes, mientras que 16 pudieron comprar varios paquetes en una tienda [Citación247].
Es importante destacar que, si bien se exigieron tamaños máximos de paquetes, la Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido (MHRA) no implementó límites al número de paquetes que se podían comprar. Por lo tanto, las tiendas que vendían más de un paquete en el estudio anterior contravenían el espíritu de la legislación de 1998 pero no infringían la ley [Citación248 ]. En 2009, la MHRA introdujo directrices que establecían que «ningún minorista debería vender más de dos paquetes de paracetamol (500 mg) en una transacción, se debería disuadir a los minoristas de promover la venta de más de un paquete a la vez y que es ilegal vender más de 100 comprimidos de paracetamol (500 mg)… en una sola transacción’ [Citación248 ]. A pesar de esto, un estudio más reciente sobre compradores misteriosos en establecimientos no farmacéuticos encontró que el 58% de los minoristas vendieron más de la cantidad recomendada y el 23% vendieron más de la cantidad legal.Citación248].
En conjunto, la evidencia del Reino Unido sugiere que los cambios en la disponibilidad de paracetamol pueden reducir las autointoxicaciones graves y las muertes, pero estos cambios son más modestos de lo que se esperaba inicialmente.Citación249 ]. La falta de aplicación de directrices y leyes probablemente redujo el impacto de esta legislación. Los países que estén considerando una legislación similar deberían considerar límites legales al número de paquetes que se pueden comprar y su aplicación activa.
6.3.2. Dinamarca
Dinamarca llevó a cabo dos intervenciones [Citación250 ]. El primero, en 2011, restringió las ventas a personas mayores de 18 años, mientras que el segundo, en 2013, restringió el tamaño de los envases a 20 comprimidos para compras sin receta en farmacias [Citación250 ]. Después de la restricción de edad, hubo una reducción en el número de intoxicaciones en personas de 10 a 17 años, pero no hubo cambios en el total de intoxicaciones por analgésicos no opioides.Citación250 ]. Esta restricción también puede haber contribuido a reducir el número de casos de autolesión observados en adolescentes en Dinamarca [Citación251 ]. La introducción de la restricción del tamaño de los envases provocó una disminución en el número total de intoxicaciones y su gravedad.Citación250].
6.3.3. América del norte
En 2014, Estados Unidos intentó reducir las sobredosis no intencionadas y, por tanto, la hepatotoxicidad, reduciendo la cantidad de paracetamol cuando se combina con opioides a 325 mg por comprimido.Citación252 ]. Sin embargo, los datos de PIC de antes y después del cambio no identificaron variaciones significativas en las tasas de tratamiento por intoxicación o hepatotoxicidad.Citación252 ]. Canadá intentó reducir el riesgo de sobredosis accidental de paracetamol actualizando las normas de etiquetado en dos ocasiones (2009 y 2016); sin embargo, no se produjeron cambios significativos [Citación253].
6.3.4. Australia
En respuesta a las crecientes tasas de sobredosis con paracetamol MR en Australia y al mayor riesgo de toxicidad con paracetamol MR, Australia aumentó la programación del paracetamol MR de «Solo farmacia» a «Solo farmacéutico» en 2020 [Citación239 ]. Esto significaba que el paracetamol MR sólo podía adquirirse detrás del mostrador del farmacéutico, y un farmacéutico tenía que participar en la venta. La evaluación temprana de esta intervención indica que no se asoció con una reducción de las intoxicaciones con paracetamol MR [Citación254].[Citación253]
7. Conclusiones
El paracetamol es uno de los medicamentos más utilizados en el mundo. Esto a pesar de que una revisión sistemática reciente indica falta de eficacia para muchas afecciones para las que se considera de primera línea. Está ampliamente disponible sin receta, sin embargo, el acceso varía mucho a nivel internacional. El paracetamol es una de las sustancias más utilizadas en caso de sobredosis en muchas partes del mundo y la principal causa de lesión hepática aguda en muchos países. Cuando hubo datos disponibles, estimamos que se utiliza en el 6% de las intoxicaciones, implicado en el 56% de los casos de lesión hepática aguda grave e insuficiencia hepática aguda y en el 7% de la lesión hepática inducida por fármacos. Aproximadamente el 0,4% de los casos de sobredosis de paracetamol son mortales. La acetilcisteína es un antídoto eficaz y, sin embargo, todavía se producen hepatotoxicidad y muerte. Los tres factores principales que aumentan la probabilidad de hepatotoxicidad son (i) sobredosis mayores, (ii) sobredosis de paracetamol MR/ER y (iii) retrasos en el tratamiento. Investigaciones recientes se han centrado en cambios en los regímenes de acetilcisteína para reducir las reacciones adversas y mejorar la eficacia en caso de sobredosis de alto riesgo, así como en la exploración de nuevos biomarcadores y tratamientos metabólicos. Además, se han evaluado intervenciones de salud pública, como restricciones en el tamaño de los paquetes y límites de edad para comprar paracetamol, y se ha demostrado que son una forma eficaz de reducir los daños causados por una sobredosis de paracetamol.
8. Opinión de expertos
Si el paracetamol se descubriera hoy, los reguladores de medicamentos probablemente impondrían restricciones más estrictas que las actualmente vigentes debido al riesgo de hepatotoxicidad. A pesar de su uso y disponibilidad generalizados, el paracetamol tiene un margen de seguridad estrecho en comparación con otros analgésicos de venta libre. Por ejemplo, la dosis tóxica de paracetamol es 10 veces la dosis terapéutica, mientras que la dosis tóxica de ibuprofeno es 60 veces la dosis terapéutica. La accesibilidad mundial del paracetamol varía sustancialmente. En términos generales, Europa continental tiene reglas estrictas: muchos países no permiten las ventas fuera de las farmacias y las ventas dentro de las farmacias generalmente se limitan a paquetes pequeños. El Reino Unido redujo los tamaños de envase disponibles en 1998 en respuesta a las crecientes tasas de sobredosis y muertes. En EE.UU., no parece haber límites en el tamaño de los envases (se pueden comprar paquetes de 1.000 comprimidos).
En muchos países se desconoce la magnitud del problema del paracetamol. A pesar de nuestros mejores esfuerzos por capturar los estudios publicados y la literatura gris, nuestras estimaciones de la carga de intoxicación por paracetamol a nivel mundial pueden no ser representativas a nivel internacional, y muchos países no tenían datos disponibles. Esto es algo sorprendente, ya que existe un código ICD-10 para la sobredosis de paracetamol, por lo que esta información debería recopilarse en la mayoría de los países. Lamentablemente, los estudios sobre la carga mundial de enfermedades informan específicamente sólo sobre la intoxicación por monóxido de carbono con todas las demás intoxicaciones combinadas. Es vital mejorar las estimaciones mundiales de la carga de morbilidad por intoxicación.
El paracetamol se ha considerado durante mucho tiempo la intoxicación común más importante en los países de ingresos altos y se utiliza cada vez más en sobredosis en los países de ingresos bajos y medianos.Citación255 ]. La acetilcisteína es un antídoto eficaz: sin ella se estima que entre el 3 y el 5% de las sobredosis serían letales.Citación99,Citación100 ]. A pesar de su uso a largo plazo, persisten controversias en el tratamiento de la sobredosis. Encontramos pocas pautas de tratamiento accesibles públicamente; sin embargo, sabemos que el tratamiento difiere sustancialmente a nivel mundial. Esto incluye la reducción del Reino Unido de la línea de tratamiento en el nomograma Rumack-Matthew y algunos países que tratan todas las sobredosis, independientemente de las concentraciones séricas. Los regímenes de acetilcisteína difieren y recientemente se han introducido nuevos regímenes en muchos países para reducir los efectos adversos relacionados con la dosis de carga grande.
Los cambios en los patrones de uso, incluido el aumento de las sobredosis «masivas» y el uso de paracetamol de liberación modificada, presentan desafíos para el tratamiento. Las innovaciones recientes en los regímenes de dosificación de N-acetilcisteína, los nuevos antídotos y un mayor reconocimiento del papel del carbón activado pueden mejorar los resultados para los pacientes. La identificación de nuevos biomarcadores tiene el potencial de mejorar la identificación temprana de la hepatotoxicidad y mejorar los tratamientos dirigidos. Esta es un área de investigación activa en curso.
Los antídotos potenciales emergentes que apuntan a los efectos mitocondriales de NAPQI incluyen fomepizol y calmangafodipir. Si los primeros resultados clínicos se confirman mediante ensayos sólidamente diseñados, estos antídotos podrían llenar un vacío muy necesario en escenarios en los que la acetilcisteína es menos efectiva. Esto incluye a personas que se presentan tardíamente y con hepatotoxicidad establecida. El campo de la toxicología clínica debería aprender de la experiencia con la hidroxicloroquina y la COVID-19, donde los primeros estudios (experimentos con animales, pequeñas series de casos) mostraron resultados prometedores, que luego fueron refutados por un sólido ensayo de plataforma. Dada la frecuencia de sobredosis de paracetamol, deberían ser posibles ensayos clínicos amplios y bien diseñados de estos antídotos antes de que se consideren atención de rutina. Dentro de 10 años, el aspecto del manejo del paracetamol puede verse completamente diferente si nuevos biomarcadores y nuevos tratamientos se vuelven comunes.
La innovación continua para mejorar los resultados nunca ha sido más importante. Muchos países se enfrentan a una epidemia de autointoxicación, especialmente entre las adolescentes. Esto se ha observado en EE. UU., Canadá, Australia, Egipto y Noruega, y probablemente esté sucediendo de forma indocumentada en muchos otros países. El paracetamol es el agente que toman con mayor frecuencia las mujeres jóvenes, que tienen tasas más altas de sobredosis de medicamentos de venta libre en comparación con los adultos (probablemente debido al acceso reducido a los medicamentos recetados). En 2022, el regulador nacional de medicamentos de Australia inició una investigación sobre las sobredosis de paracetamol en jóvenes en respuesta al aumento de las tasas.
Los factores que impulsan el aumento de las tasas de autolesiones entre los jóvenes son complejos. Sin embargo, existen soluciones sencillas para reducir el daño causado por una sobredosis de paracetamol. Cualquier intervención debe estar dirigida a los factores de riesgo de hepatotoxicidad más modificables: tamaño de la sobredosis y sobredosis con paracetamol MR/ER. Las sobredosis de autolesiones tienden a ser impulsivas, muchas personas contemplan su sobredosis durante menos de 5 minutos. Las personas suelen tomar lo que tienen disponible en casa y, a menudo, consumen todas las tabletas a las que tienen acceso. Se espera que la reducción de la «carga de tabletas» de paracetamol en los hogares mediante la reducción del tamaño de los paquetes disponibles sin receta repercuta en el tamaño de la sobredosis y, por tanto, en el daño. Esto ocurrió en el Reino Unido, donde las restricciones en el tamaño de los envases redujeron las grandes sobredosis, los trasplantes de hígado y las muertes sin sufrir daños por la sustitución de métodos. Sin embargo, la intervención del Reino Unido no fue tan eficaz como esperaban los legisladores y la intoxicación por paracetamol sigue siendo motivo de preocupación. Este efecto subóptimo posiblemente se deba a que algunos minoristas incumplen el espíritu de la legislación, como lo indican los estudios sobre compradores misteriosos. Otros países que estén considerando restricciones en el tamaño de los paquetes deberían limitar la cantidad de paquetes que se pueden vender en una transacción. Es cierto que esto puede ser más difícil de legislar y hacer cumplir que simples límites al tamaño de los paquetes.
Además, reducir el uso ocasional de paracetamol MR/ER minimizaría su uso en sobredosis por parte de personas vulnerables. Datos recientes de Australia indican que hacer que el paracetamol MR sólo esté disponible después de consultar con un farmacéutico no frenó las intoxicaciones. La experiencia australiana previa con la codeína ha indicado que una reprogramación más restrictiva para prescripción sólo tuvo un efecto mucho más fuerte en las intoxicaciones que la reprogramación «solo para farmacéuticos». La Agencia Europea de Medicamentos suspendió la comercialización del paracetamol de liberación modificada debido a un perfil de seguridad inaceptable en caso de sobredosis. El único beneficio terapéutico del paracetamol MR es una ligera simplificación de la pauta posológica (tres dosis/día en lugar de cuatro). Se podrían considerar restricciones en otras partes del mundo.
La relativa falta de estudios que evalúen las intervenciones en caso de intoxicación por paracetamol indica que las medidas legislativas a menudo se implementan sin planes de evaluación. Por ejemplo, no pudimos encontrar ningún dato publicado sobre el impacto de la suspensión del paracetamol MR por parte de la EMA sobre la hepatotoxicidad y la muerte del paracetamol. La evaluación prospectiva de cualquier legislación destinada a reducir los daños causados por el envenenamiento es esencial para orientar futuras intervenciones e informar las respuestas en otras jurisdicciones.
Es importante mantener esto en perspectiva. Cada día se consumen toneladas de paracetamol en todo el mundo, la mayoría sin causar daños. El paracetamol tiene un muy buen perfil de seguridad en uso terapéutico. Tiene reacciones adversas mínimas si se toma adecuadamente, una breve lista de interacciones medicamentosas clínicamente significativas y puede ser tomado por bebés pequeños, mujeres embarazadas y personas que no toleran los AINE. A pesar de las recientes preocupaciones sobre la eficacia, hay muchas personas para quienes el paracetamol seguirá siendo el tratamiento de primera línea para el dolor. Se necesitan medidas de salud pública e innovaciones clínicas continuas para garantizar un perfil riesgo-beneficio aceptable.
Colabore por favor con nosotros para que podamos llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Via PAYPAL: Euros o dólares click aqui
Solicite nuestro CBU contactenos
Artículos destacados
- El paracetamol (acetaminofén) es uno de los medicamentos más utilizados en todo el mundo. Comúnmente se toma en sobredosis, donde puede causar hepatotoxicidad.
- Los factores de riesgo de toxicidad incluyen: sobredosis, sobredosis con paracetamol de liberación modificada, retrasos en el tratamiento, tratamiento con inductores enzimáticos, desnutrición y consumo crónico de alcohol.
- La acetilcisteína es un antídoto eficaz. Repone las reservas de glutatión, permitiendo la desintoxicación del metabolito reactivo tóxico del paracetamol. Recientemente, han surgido muchos cambios en los regímenes de tratamiento con acetilcisteína para tratar mejor las sobredosis de alto riesgo y minimizar las reacciones adversas. Otros tratamientos potenciales emergentes incluyen fomepizol y calmangafodipir.
- Los datos epidemiológicos sobre la intoxicación por paracetamol son limitados o inexistentes en muchas partes del mundo. Según los datos disponibles, estimamos que el paracetamol está involucrado en el 6% de las intoxicaciones globales, el 56% de las lesiones hepáticas agudas graves y la insuficiencia hepática aguda, y el 7% de las lesiones hepáticas inducidas por fármacos. Estimamos que el 0,4% de los casos de intoxicación por paracetamol son mortales.
- El acceso al paracetamol difiere mucho a nivel internacional: algunos países permiten ventas ilimitadas fuera de farmacia, mientras que otros solo permiten ventas en farmacias. Los tamaños de envase disponibles también varían sustancialmente.
- Algunos países han introducido intervenciones efectivas destinadas a reducir las intoxicaciones por autolesiones con paracetamol. Esto incluye restricciones en el tamaño de los paquetes en el Reino Unido y Dinamarca, y Dinamarca impone un límite de edad a las ventas.
Referencias
- Brune K, Renner B, Tiegs G. Acetaminophen/Paracetamol: a history of errors, failures and false decisions. Eur J Pain. 2015;19(7):953–965. doi: 10.1002/ejp.621PubMed Web of Science ®Google Scholar
- WHO model list of essential medicines – 22nd list, 2021. Geneva (Switzerland): World Health Organization; 2021.Google Scholar
- Paracetamol [Internet]. Adelaide (Australia): Australian Medicines Handbook Pty Ltd; 2022 [cited 2022 Aug 16]. Available from: https://amhonline-amh-net-au/chapters/analgesics/drugs-pain-relief/non-opioid-analgesics/paracetamolGoogle Scholar
- Acheampong P, Thomas SH. Determinants of hepatotoxicity after repeated supratherapeutic paracetamol ingestion: systematic review of reported cases. Br J Clin Pharmacol. 2016;82(4):923–931. doi: 10.1111/bcp.13028PubMed Web of Science ®Google Scholar
- Larson AM, Polson J, Fontana RJ, et al. Acetaminophen-induced acute liver failure: results of a United States multicenter, prospective study. Hepatology. 2005;42(6):1364–1372. doi: 10.1002/hep.20948PubMed Web of Science ®Google Scholar
- Schiødt FV, Atillasoy E, Shakil AO, et al. Etiology and outcome for 295 patients with acute liver failure in the united states. Liver Transpl Surg. 1999;5(1):29–34. doi: 10.1002/lt.500050102PubMedGoogle Scholar
- Bernal W, Wendon J. Acute liver failure; clinical features and management. Eur J Ganstroenterol Hepatol. 1999;11(9):977–984. doi: 10.1097/00042737-199909000-00005PubMed Web of Science ®Google Scholar
- Wei G, Bergquist A, Broomé U, et al. Acute liver failure in Sweden: etiology and outcome. J Intern Med. 2007;262(3):393–401. doi: 10.1111/j.1365-2796.2007.01818.xPubMed Web of Science ®Google Scholar
- Ostapowicz G, Fontana RJ, Schiødt FV, et al. Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States. Ann Intern Med. 2002;137(12):947–954. doi: 10.7326/0003-4819-137-12-200212170-00007PubMed Web of Science ®Google Scholar
- Bunchorntavakul C, Reddy KR. Acetaminophen-related hepatotoxicity. Clin Liver Dis. 2013;17(4):587–607. doi: 10.1016/j.cld.2013.07.005PubMed Web of Science ®Google Scholar
- Gulmez SE, Larrey D, Pageaux GP, et al. Liver transplant associated with paracetamol overdose: results from the seven-country SALT study. Br J Clin Pharmacol. 2015;80(3):599–606. doi: 10.1111/bcp.12635PubMed Web of Science ®Google Scholar
- Cahn A, Hepp P. Das Antifebrin, ein neues Fiebermittel. Centralbl Klin Med. 1886;7:561–564. German.Google Scholar
- Mallet C, Eschalier A. Landmark papers in pain: seminal papers in pain with expert commentaries. Oxford (United Kingdom): Oxford University Press. Chapter 4, The rediscovery of paracetamol;2018. p. 12–16. doi: 10.1093/med/9780198834359.003.0004Google Scholar
- Aronoff DM. Aspirin and Reyes syndrome: discovery of aspirin and paracetamol. Drug Saf. 2002;25(10):751. doi: 10.2165/00002018-200225100-00007PubMed Web of Science ®Google Scholar
- von Mering J. Beiträge zur Kenntnis der Antipyretica. Ther Monatsch. 1893;7:577–587. German.Google Scholar
- Brodie BB, Axelrod J. The fate of acetophenetidin (phenacetin) in man and methods for the estimation of acetophenetidin and its metabolites in biological material. J Pharmacol Exp Ther. 1949;97(1):58–67.PubMed Web of Science ®Google Scholar
- Anderson BJ. Paracetamol (Acetaminophen): mechanisms of action. Pediatr Anesth. 2008;18(10):915–921. doi: 10.1111/j.1460-9592.2008.02764.xPubMed Web of Science ®Google Scholar
- Graham GG, Davies MJ, Day RO, et al. The modern pharmacology of paracetamol: therapeutic actions, mechanism of action, metabolism, toxicity and recent pharmacological findings. Inflammopharmacology. 2013;21(3):201–232. doi: 10.1007/s10787-013-0172-xPubMed Web of Science ®Google Scholar
- Abdel Shaheed C, Ferreira GE, Dmitritchenko A, et al. The efficacy and safety of paracetamol for pain relief: an overview of systematic reviews. Med J Aust. 2021;214(7):324–331. doi: 10.5694/mja2.50992PubMed Web of Science ®Google Scholar
- Agrawal S, Khazaeni B. Acetaminophen Toxicity. Florida (United States of America): StatPearls Publishing; 2022.Google Scholar
- Hodgman MJ, Garrard AR. A review of acetaminophen poisoning. Crit Care Clin. 2012;28(4):499–516. doi: 10.1016/j.ccc.2012.07.006PubMed Web of Science ®Google Scholar
- Leeming MG, Gamon LF, Wille U, et al. What are the potential sites of protein arylation by N-Acetyl-p-benzoquinone Imine (NAPQI)? Chem Res Toxicol. 2015;28(11):2224–2233. doi: 10.1021/acs.chemrestox.5b00373PubMed Web of Science ®Google Scholar
- Hinson JA, Roberts DW, James LP. Mechanisms of acetaminophen-induced liver necrosis. Handb Exp Pharmacol. 2010;196:369–405.PubMedGoogle Scholar
- Ramachandran A, Jaeschke H. A mitochondrial journey through acetaminophen hepatotoxicity. Food Chem Toxicol. 2020;140:111282. doi: 10.1016/j.fct.2020.111282PubMed Web of Science ®Google Scholar
- Ramachandran A, Jaeschke H. Acetaminophen hepatotoxicity: a mitochondrial perspective. Advances in Pharmacology Volume 85. Academic Press;2019; p. 195–219. doi: 10.1016/bs.apha.2019.01.007Google Scholar
- Moles A, Torres S, Baulies A, et al. Mitochondrial–Lysosomal axis in acetaminophen hepatotoxicity. Front Pharmacol. 2018;9:453. doi: 10.3389/fphar.2018.00453PubMed Web of Science ®Google Scholar
- Jaeschke H, Duan L, Nguyen NT, et al. Mitochondrial damage and biogenesis in acetaminophen-induced liver injury. Liver Res. 2019;3(3–4):150–156. doi: 10.1016/j.livres.2019.10.002PubMedGoogle Scholar
- Saccomano SJ. Acute acetaminophen toxicity in adults. Nurse Pract. 2019;44(11):42–47. doi: 10.1097/01.NPR.0000586020.15798.c6PubMed Web of Science ®Google Scholar
- Green JL, Heard KJ, Reynolds KM, et al. Oral and intravenous acetylcysteine for treatment of acetaminophen toxicity: a systematic review and meta-analysis. West J Emerg Med. 2013;14(3):218–226. doi: 10.5811/westjem.2012.4.6885PubMedGoogle Scholar
- Buckley N, Calear A, Cairns R, et al. Independent expert report on the risks of intentional self-poisoning with paracetamol. Canberra (Australia): Department of Health and Aged Care (Therapeutic Goods Administration); 2022.Google Scholar
- Waring WS, Jamie H, Leggett GE. Delayed onset of acute renal failure after significant paracetamol overdose: a case series. Hum Exp Toxicol. 2010;29(1):63–68. doi: 10.1177/0960327109350799PubMed Web of Science ®Google Scholar
- Eguia L, Materson BJ. Acetaminophen-related acute renal failure without fulminant liver failure. Pharmacotherapy. 1997;17(2):363–370.PubMed Web of Science ®Google Scholar
- Loh CS, Ponampalam R. Nephrotoxicity associated with acute paracetamol overdose: a case report and review of the literature. Hong Kong J Of Emerg Med. 2006;13(2):105–110. doi: 10.1177/102490790601300202Google Scholar
- Hart SGE, Beierschmitt WP, Wyand DS, et al. Acetaminophen nephrotoxicity in CD-1 Mice: i. evidence of a role for in situ activation in selective covalent binding and toxicity. Toxicol Appl Pharmacol. 1994;126(2):267–275. doi: 10.1006/taap.1994.1116PubMed Web of Science ®Google Scholar
- Flanagan RJ, Mant TGK. Coma and metabolic acidosis early in severe acute paracetamol poisoning. Hum Toxicol. 1986;5(3):179–182. doi: 10.1177/096032718600500305PubMedGoogle Scholar
- Roth B, Woo O, Blanc P. Early metabolic acidosis and coma after acetaminophen ingestion. Ann Emerg Med. 1999;33(4):452–456. doi: 10.1016/S0196-0644(99)70312-4PubMed Web of Science ®Google Scholar
- Wiegand TJ, Margaretten M, Olson KR. Massive acetaminophen ingestion with early metabolic acidosis and coma: treatment with IV NAC and continuous venovenous hemodiafiltration. Clin Toxicol (Phila). 2010;48(2):156–159. doi: 10.3109/15563650903524142PubMed Web of Science ®Google Scholar
- Vliegenthart ADB, Kimmitt RA, Seymour JH, et al. Circulating acetaminophen metabolites are toxicokinetic biomarkers of acute liver injury. Clin Pharmacol Ther. 2017;101(4):531–540. doi: 10.1002/cpt.541PubMed Web of Science ®Google Scholar
- Chiew AL, Isbister GK, Kirby KA, et al. Massive paracetamol overdose: an observational study of the effect of activated charcoal and increased acetylcysteine dose (ATOM-2). Clin Toxicol (Phila). 2017;55(10):1055–1065. doi: 10.1080/15563650.2017.1334915.PubMed Web of Science ®Google Scholar
- Downs JW, Cumpston KL, Kershner EK, et al. Clinical outcome of massive acetaminophen overdose treated with standard-dose N-acetylcysteine. Clin Toxicol (Phila). 2021;59(10):932–936. doi: 10.1080/15563650.2021.1887493PubMed Web of Science ®Google Scholar
- Lewis JC, Lim M, Lai L, et al. Evaluation of N-acetylcysteine dose for the treatment of massive acetaminophen ingestion. Clin Toxicol (Phila). 2022;60(4):507–513. doi: 10.1080/15563650.2021.1984503PubMed Web of Science ®Google Scholar
- Gloor Y, Schvartz D, Samer CF. Old problem, new solutions: biomarker discovery for acetaminophen liver toxicity. Expert Opin Drug Metab Toxicol. 2019;15(8):659–669. doi: 10.1080/17425255.2019.1642323PubMed Web of Science ®Google Scholar
- The Flockhart Cytochrome P450 Drug-Drug Interaction Table [Internet]. Indiana (United States of America): Division of Clinical Pharmacology, Indiana University School of Medicine; [updated 2021, cited 2022 Oct 4]. Available from: https://drug-interactions.medicine.iu.edu/MainTable.aspxGoogle Scholar
- Nguyen GC, Sam J, Thuluvath PJ. Hepatitis C is a predictor of acute liver injury among hospitalizations for acetaminophen overdose in the United States: a nationwide analysis. Hepatology. 2008;48(4):1336–1341. doi: 10.1002/hep.22536PubMed Web of Science ®Google Scholar
- Whitcomb DC, Block GD. Association of Acetaminophen Hepatotoxicity with Fasting and Ethanol Use. JAMA. 1994;272(23):1845–1850. doi: 10.1001/jama.1994.03520230055038PubMed Web of Science ®Google Scholar
- Seeff LB, Cuccherini BA, Zimmerman HJ, et al. Acetaminophen Hepatotoxicity in Alcoholics. Ann Intern Med. 1986;104(3):399–404. doi: 10.7326/0003-4819-104-3-399PubMed Web of Science ®Google Scholar
- Peterson FJ, Holloway DE, Erickson RR, et al. Ethanol induction of acetaminophen toxicity and metabolism. Life Sci. 1980;27(18):1705–1711. doi: 10.1016/0024-3205(80)90646-3PubMed Web of Science ®Google Scholar
- Prescott LF. Paracetamol, alcohol and the liver. Br J Clin Pharmacol. 2000;49(4):291–301. doi: 10.1046/j.1365-2125.2000.00167.xPubMed Web of Science ®Google Scholar
- Bray GP, Mowat C, Muir DF, et al. The Effect of Chronic Alcohol Intake on Prognosis and Outcome in Paracetamol Overdose. Hum Exp Toxicol. 1991;10(6):435–438. doi: 10.1177/096032719101000612PubMed Web of Science ®Google Scholar
- Waring WS, Stephen AF, Malkowska AM, et al. Acute Ethanol Coingestion Confers a Lower Risk of Hepatotoxicity after Deliberate Acetaminophen Overdose. Acad Emerg Med. 2008;15(1):54–58. doi: 10.1111/j.1553-2712.2007.00019.xPubMed Web of Science ®Google Scholar
- Graudins A, Chiew A, Chan B. Overdose with modified-release paracetamol results in delayed and prolonged absorption of paracetamol. Intern Med J. 2010;40(1):72–76. doi: 10.1111/j.1445-5994.2009.02096.xPubMed Web of Science ®Google Scholar
- Li J, Chiew AL, Isbister GK, et al. Population pharmacokinetics of immediate-release and modified-release paracetamol and its major metabolites in a supratherapeutic dosing study. Clin Toxicol (Phila). 2022;60(1):25–32. doi: 10.1080/15563650.2021.1928163PubMed Web of Science ®Google Scholar
- Spyker DA, Dart RC, Yip L, et al. Population pharmacokinetic analysis of acetaminophen overdose with immediate release, extended release and modified release formulations. Clin Toxicol (Phila). 2022;60(10):1113–1121. doi: 10.1080/15563650.2022.2114361PubMed Web of Science ®Google Scholar
- Chiew AL, Isbister GK, Page CB, et al. Modified release paracetamol overdose: a prospective observational study (ATOM-3). Clin Toxicol (Phila). 2018;56(9):810–819. doi: 10.1080/15563650.2018.1439950.PubMed Web of Science ®Google Scholar
- Michienzi A, Tobarran N, Hieger MA. Extended Release Acetaminophen Overdose with Delayed Peak Concentrations. Am J Ther. 2022;29(6):e655–e656. doi: 10.1097/MJT.0000000000001329PubMed Web of Science ®Google Scholar
- Hoegberg LCG, Refsgaard F, Pedersen SH, et al. Potential pharmacobezoar formation of large size extended-release tablets and their dissolution – an in vitro study. Clin Toxicol (Phila). 2019;57(4):271–281. doi: 10.1080/15563650.2018.1513138PubMed Web of Science ®Google Scholar
- Li YK, Lam KF, Wong CLW, et al. In vitro study of pharmacobezoar formation in simulated acetaminophen overdose. Clin Toxicol (Phila). 2020;58(9):900–906. doi: 10.1080/15563650.2019.1705971PubMed Web of Science ®Google Scholar
- Cairns R, Brown JA, Wylie CE, et al. Paracetamol poisoning‐related hospital admissions and deaths in Australia, 2004–2017. Med J Aust. 2019;211(5):218–223. doi: 10.5694/mja2.50296PubMed Web of Science ®Google Scholar
- Dart RC, Green JL, Bogdan GM. The Safety Profile of Sustained Release Paracetamol During Therapeutic Use and Following Overdose. Drug Saf. 2005;28(11):1045–1056. doi: 10.2165/00002018-200528110-00005PubMed Web of Science ®Google Scholar
- Chiew AL, Buckley NA. Comment on: “population pharmacokinetic analysis of acetaminophen overdose with immediate release, extended release and modified release formulations”. Clin Toxicol (Phila). 2023;61(2):139–140. doi: 10.1080/15563650.2022.2135519PubMed Web of Science ®Google Scholar
- Vogel J, Heard KJ, Carlson C, et al. Dental pain as a risk factor for accidental acetaminophen overdose: a case-control study. Am J Emerg Med. 2011;29(9):1125–1129. doi: 10.1016/j.ajem.2010.08.006PubMed Web of Science ®Google Scholar
- Schiødt FV, Rochling FA, Casey DL, et al. Acetaminophen Toxicity in an Urban County Hospital. New Engl J Med. 1997;337(16):1112–1118. doi: 10.1056/NEJM199710163371602PubMed Web of Science ®Google Scholar
- Gyamlani GG, Parikh CR. Acetaminophen toxicity: suicidal vs accidental. Crit Care. 2002;6(2):155–159. doi: 10.1186/cc1475PubMed Web of Science ®Google Scholar
- Myers RP, Shaheen AAM, Li B, et al. Impact of Liver Disease, Alcohol Abuse, and Unintentional Ingestions on the Outcomes of Acetaminophen Overdose. Clin Gastroenterol Hepatol. 2008;6(8):918–925. doi: 10.1016/j.cgh.2008.02.053PubMed Web of Science ®Google Scholar
- Egan H, Isbister GK, Robinson J, et al. Retrospective evaluation of repeated supratherapeutic ingestion (RSTI) of paracetamol. Clin Toxicol (Phila). 2019;57(8):703–711. doi: 10.1080/15563650.2018.1547829PubMed Web of Science ®Google Scholar
- Alhelail MA, Hoppe JA, Rhyee SH, et al. Clinical course of repeated supratherapeutic ingestion of acetaminophen. Clin Toxicol (Phila). 2011;49(2):108–112. doi: 10.3109/15563650.2011.554839PubMed Web of Science ®Google Scholar
- Craig DGN, Bates CM, Davidson JS, et al. Staggered overdose pattern and delay to hospital presentation are associated with adverse outcomes following paracetamol-induced hepatotoxicity. Br J Clin Pharmacol. 2012;73(2):285–294. doi: 10.1111/j.1365-2125.2011.04067.xPubMed Web of Science ®Google Scholar
- Myers RP, Shaheen AAM. Hepatitis C, alcohol abuse, and unintentional overdoses are risk factors for acetaminophen-related hepatotoxicity. Hepatology. 2009;49(4):1399–1400. doi: 10.1002/hep.22798PubMed Web of Science ®Google Scholar
- Rutherford A, Davern T, Hay JE, et al. Influence of High Body Mass Index on Outcome in Acute Liver Failure. Clin Gastroenterol Hepatol. 2006;4(12):1544–1549. doi: 10.1016/j.cgh.2006.07.014PubMed Web of Science ®Google Scholar
- Radosevich JJ, Patanwala AE, Erstad BL. Hepatotoxicity in Obese versus Nonobese Patients with Acetaminophen Poisoning Who are Treated with Intravenous N-Acetylcysteine. Am J Ther. 2016;23(3):e714–e719. doi: 10.1097/01.mjt.0000434043.62372.00PubMed Web of Science ®Google Scholar
- Michaut A, Moreau C, Robin MA, et al. Acetaminophen-induced liver injury in obesity and nonalcoholic fatty liver disease. Liver Int. 2014;34(7):e171–e179. doi: 10.1111/liv.12514PubMed Web of Science ®Google Scholar
- Heruth DP, Shortt K, Zhang N, et al. Genetic Association of Single Nucleotide Polymorphisms with Acetaminophen-Induced Hepatotoxicity. J Pharmacol Exp Ther. 2018;367(1):95–100. doi: 10.1124/jpet.118.248583PubMed Web of Science ®Google Scholar
- Monte AA, Arriaga Mackenzie I, Pattee J, et al. Genetic variants associated with ALT elevation from therapeutic acetaminophen. Clin Toxicol (Phila). 2022;60(11):1198–1204. doi: 10.1080/15563650.2022.2117053PubMed Web of Science ®Google Scholar
- Chiew AL, Reith D, Pomerleau A, et al. Updated guidelines for the management of paracetamol poisoning in Australia and New Zealand. Med J Aust. 2020;212(4):175–183. doi: 10.5694/mja2.50428PubMed Web of Science ®Google Scholar
- Wong A, Graudins A. Risk prediction of hepatotoxicity in paracetamol poisoning. Clin Toxicol (Phila). 2017;55(8):879–892. doi: 10.1080/15563650.2017.1317349PubMed Web of Science ®Google Scholar
- Dear JW, Antoine DJ. Stratification of paracetamol overdose patients using new toxicity biomarkers: current candidates and future challenges. Expert Rev Clin Pharmacol. 2014;7(2):181–189. doi: 10.1586/17512433.2014.880650PubMed Web of Science ®Google Scholar
- Bateman DN, Carroll R, Pettie J, et al. Effect of the UK’s revised paracetamol poisoning management guidelines on admissions, adverse reactions and costs of treatment. Br J Clin Pharmacol. 2014;78(3):610–618. doi: 10.1111/bcp.12362PubMed Web of Science ®Google Scholar
- Gosselin S, Hoffman RS, Juurlink DN, et al. Treating acetaminophen overdose: thresholds, costs and uncertainties. Clin Toxicol (Phila). 2013;51(3):130–133. doi: 10.3109/15563650.2013.775292PubMed Web of Science ®Google Scholar
- Bateman DN, Dear JW, Carroll R, et al. Impact of reducing the threshold for acetylcysteine treatment in acute paracetamol poisoning: the recent United Kingdom experience. Clin Toxicol (Phila). 2014;52(8):868–872. doi: 10.3109/15563650.2014.954125PubMed Web of Science ®Google Scholar
- Schmidt LE, Dalhoff K. Risk factors in the development of adverse reactions to N-acetylcysteine in patients with paracetamol poisoning. Br J Clin Pharm. 2001;51(1):87–91. doi: 10.1046/j.1365-2125.2001.01305.xPubMed Web of Science ®Google Scholar
- Watkins PB, Kaplowitz N, Slattery JT, et al. Aminotransferase Elevations in Healthy Adults Receiving 4 Grams of Acetaminophen Daily: a Randomized Controlled Trial. JAMA. 2006;296(1):87–93. doi: 10.1001/jama.296.1.87PubMed Web of Science ®Google Scholar
- Chiew AL, James LP, Isbister GK, et al. Early acetaminophen-protein adducts predict hepatotoxicity following overdose (ATOM-5). J Hepatol. 2020;72(3):450–462. doi: 10.1016/j.jhep.2019.10.030PubMed Web of Science ®Google Scholar
- Green TJ, Sivilotti MLA, Langmann C, et al. When do the aminotransferases rise after acute acetaminophen overdose? Clin Toxicol (Phila). 2010;48(8):787–792. doi: 10.3109/15563650.2010.523828PubMed Web of Science ®Google Scholar
- Curtis RM, Sivilotti MLA. A descriptive analysis of aspartate and alanine aminotransferase rise and fall following acetaminophen overdose. Clin Toxicol (Phila). 2015;53(9):849–855. doi: 10.3109/15563650.2015.1077968PubMed Web of Science ®Google Scholar
- Lindena J, Sommerfeld U, Höpfel C, et al. Catalytic Enzyme Activity Concentration in Tissues of Man, Dog, Rabbit, Guinea Pig, Rat and Mouse. Approach to a Quantitative Diagnostic Enzymology, III. Communication. J Clin Chem Clin Biochem. 1986;24(1):35–47. doi: 10.1515/cclm.1986.24.1.35PubMedGoogle Scholar
- Antoine DJ, Dear JW, Lewis PS, et al. Mechanistic biomarkers provide early and sensitive detection of acetaminophen-induced acute liver injury at first presentation to hospital. Hepatology. 2013;58(2):777–787. doi: 10.1002/hep.26294.PubMed Web of Science ®Google Scholar
- Sivilotti MLA, Green TJ, Langmann C, et al. Multiplying the serum aminotransferase by the acetaminophen concentration to predict toxicity following overdose. Clin Toxicol (Phila). 2010;48(8):793–799. doi: 10.3109/15563650.2010.523829PubMed Web of Science ®Google Scholar
- Wong A, Sivilotti MLA, Dargan PI, et al. External validation of the paracetamol-aminotransferase multiplication product to predict hepatotoxicity from paracetamol overdose. Clin Toxicol (Phila). 2015;53(8):807–814. doi: 10.3109/15563650.2015.1066507.PubMed Web of Science ®Google Scholar
- Wong A, Sivilotti MLA, Graudins A. Accuracy of the paracetamol-aminotransferase multiplication product to predict hepatotoxicity in modified-release paracetamol overdose. Clin Toxicol (Phila). 2017;55(5):346–351. doi: 10.1080/15563650.2017.1290253PubMed Web of Science ®Google Scholar
- Yau CE, Chen H, Lim BPY, et al. Performance of the paracetamol-aminotransferase multiplication product in risk stratification after paracetamol (acetaminophen) poisoning: a systematic review and meta-analysis. Clin Toxicol (Phila). 2023;61(1):1–11. doi: 10.1080/15563650.2022.2152350PubMed Web of Science ®Google Scholar
- Owens KH, Medlicott NJ, Zacharias M, et al. Population pharmacokinetic–pharmacodynamic modelling to describe the effects of paracetamol and N-acetylcysteine on the international normalized ratio. Clin Exp Pharmacol Physiol. 2015;42(1):102–108. doi: 10.1111/1440-1681.12327PubMed Web of Science ®Google Scholar
- Davern TJ II, James LP, Hinson JA, et al. Measurement of serum acetaminophen–protein adducts in patients with acute liver failure. Gastroenterology. 2006;130(3):687–694. doi: 10.1053/j.gastro.2006.01.033PubMed Web of Science ®Google Scholar
- James LP, Letzig L, Simpson PM, et al. Pharmacokinetics of acetaminophen-protein adducts in adults with acetaminophen overdose and acute liver failure. Drug Metab Dispos. 2009;37(8):1779–1784. doi: 10.1124/dmd.108.026195PubMed Web of Science ®Google Scholar
- Chiew AL, Gluud C, Brok J, et al. Interventions for paracetamol (acetaminophen) overdose. Cochrane Database Syst Rev. 2018;(2):CD003328. doi: 10.1002/14651858.CD003328.pub3PubMed Web of Science ®Google Scholar
- Buckley NA, Buckley N, Whyte IM, et al. Activated charcoal reduces the need for N-Acetylcysteine treatment after acetaminophen (paracetamol) overdose. J Toxicol Clin Toxicol. 1999;37(6):753–757. doi: 10.1081/CLT-100102452PubMed Web of Science ®Google Scholar
- Lauterburg BH, Corcoran GB, Mitchell JR. Mechanism of Action of N-Acetylcysteine in the Protection Against the Hepatotoxicity of Acetaminophen in Rats in vivo. J Clin Invest. 1983;71(4):980–991. doi: 10.1172/JCI110853PubMed Web of Science ®Google Scholar
- Tenório MCdS, Graciliano NG, Moura FA, et al. N-Acetylcysteine (NAC): impacts on human health. Antioxidants. 2021;10(6):967. doi: 10.3390/antiox10060967Web of Science ®Google Scholar
- Saito C, Zwingmann C, Jaeschke H. Novel mechanisms of protection against acetaminophen hepatotoxicity in mice by glutathione and N‐acetylcysteine. Hepatology. 2010;51(1):246–254. doi: 10.1002/hep.23267PubMed Web of Science ®Google Scholar
- Prescott LF, Illingworth RN, Critchley JA, et al. Intravenous N-acetylcystine: the treatment of choice for paracetamol poisoning. Br Med J. 1979;2(6198):1097–1100. doi: 10.1136/bmj.2.6198.1097PubMed Web of Science ®Google Scholar
- Clark R, Borirakchanyavat V, Davidson AR, et al. Hepatic damage and death from overdose of paracetamol. Lancet. 1973;301(7794):66–70. doi: 10.1016/S0140-6736(73)90466-2Google Scholar
- Bateman DN, Dear JW. Acetylcysteine in paracetamol poisoning: a perspective of 45 years of use. Toxicol Res (Camb). 2019;8(4):489–498. doi: 10.1039/C9TX00002JPubMed Web of Science ®Google Scholar
- Wong A, Graudins A. Simplification of the standard three-bag intravenous acetylcysteine regimen for paracetamol poisoning results in a lower incidence of adverse drug reactions. Clin Toxicol (Phila). 2016;54(2):115–119. doi: 10.3109/15563650.2015.1115055PubMed Web of Science ®Google Scholar
- McNulty R, Lim JME, Chandru P, et al. Fewer adverse effects with a modified two-bag acetylcysteine protocol in paracetamol overdose. Clin Toxicol (Phila). 2018;56(7):618–621. doi: 10.1080/15563650.2017.1408812PubMed Web of Science ®Google Scholar
- Pettie JM, Caparrotta TM, Hunter RW, et al. Safety and Efficacy of the SNAP 12-hour Acetylcysteine Regimen for the Treatment of Paracetamol Overdose. EClinicalMedicine. 2019;11:11–17.PubMedGoogle Scholar
- Johnson MT, McCammon CA, Mullins ME, et al. Evaluation of a Simplified N-Acetylcysteine Dosing Regimen for the Treatment of Acetaminophen Toxicity. Ann Pharmacother. 2011;45(6):713–720. doi: 10.1345/aph.1P613PubMed Web of Science ®Google Scholar
- Wong A, Gunja N, McNulty R, et al. Analysis of an 8-hour acetylcysteine infusion protocol for repeated supratherapeutic ingestion (RSTI) of paracetamol. Clin Toxicol (Phila). 2018;56(3):199–203. doi: 10.1080/15563650.2017.1359620PubMed Web of Science ®Google Scholar
- Daly FFS, O’Malley GF, Heard K, et al. Prospective evaluation of repeated supratherapeutic acetaminophen (paracetamol) ingestion. Ann Emerg Med. 2004;44(4):393–398. doi: 10.1016/j.annemergmed.2004.05.005PubMed Web of Science ®Google Scholar
- Janković SM. Acetaminophen toxicity and overdose: current understanding and future directions for NAC dosing regimens. Expert Opin Drug Metab Toxicol. 2022;18(11):745–753. doi: 10.1080/17425255.2022.2151893PubMed Web of Science ®Google Scholar
- Prescott LF, Sutherland GR, Park J, et al. Cysteamine, Methionine, and Penicillamine in the Treatment of Paracetamol Poisoning. Lancet. 1976;308(7977):109–113. doi: 10.1016/S0140-6736(76)92842-7Google Scholar
- Vale JA, Meredith TJ, Goulding R. Treatment of Acetaminophen Poisoning: the Use of Oral Methionine. Arch Intern Med. 1981;141(3):394–396. doi: 10.1001/archinte.1981.00340030126023PubMedGoogle Scholar
- Mullins ME, Yeager LH, Freeman WE. Metabolic and mitochondrial treatments for severe paracetamol poisoning: a systematic review. Clin Toxicol (Phila). 2020;58(12):1284–1296. doi: 10.1080/15563650.2020.1798979PubMed Web of Science ®Google Scholar
- Dear JW. Fomepizole should not be used more liberally in paracetamol overdose. Br J Clin Pharmacol. 2023;89(2):599–601. doi: 10.1111/bcp.15596PubMed Web of Science ®Google Scholar
- Akakpo JY, Ramachandran A, Duan L, et al. Delayed Treatment with 4-Methylpyrazole Protects Against Acetaminophen Hepatotoxicity in Mice by Inhibition of c-Jun n-Terminal Kinase. Toxicol Sci. 2019;170(1):57–68. doi: 10.1093/toxsci/kfz077PubMed Web of Science ®Google Scholar
- Link SL, Rampon G, Osmon S, et al. Fomepizole as an adjunct in acetylcysteine treated acetaminophen overdose patients: a case series. Clin Toxicol (Phila). 2022;60(4):472–477. doi: 10.1080/15563650.2021.1996591PubMed Web of Science ®Google Scholar
- Filip AB, Berg SE, Mullins ME, et al. Fomepizole as an adjunctive therapy for acetaminophen poisoning: cases reported to the toxicology investigators consortium (ToxIC) database 2015–2020. Clin Toxicol (Phila). 2022;60(9):1006–1011. doi: 10.1080/15563650.2022.2070071.PubMed Web of Science ®Google Scholar
- Bateman DN, Dear JW, Eddleston M, et al. Comment on Fomepizole as an adjunct in acetylcysteine treated acetaminophen overdose patients: a case series. Clin Toxicol (Phila). 2022;60(5):666–667. doi: 10.1080/15563650.2021.2009849PubMed Web of Science ®Google Scholar
- Link SL, Rampon G, Osmon S, et al. Reply to Comments on Fomepizole as an adjunct in acetylcysteine treated acetaminophen overdose patients: a case series. Clin Toxicol (Phila). 2022;60(5):668–669. doi: 10.1080/15563650.2021.2016799PubMed Web of Science ®Google Scholar
- Agarwal R, MacMillan-Crow LA, Rafferty TM, et al. Acetaminophen-Induced Hepatotoxicity in Mice Occurs with Inhibition of Activity and Nitration of Mitochondrial Manganese Superoxide Dismutase. J Pharmacol Exp Ther. 2011;337(1):110–118. doi: 10.1124/jpet.110.176321PubMed Web of Science ®Google Scholar
- Morrison EE, Oatey K, Gallagher B, et al. Principal results of a randomised open label exploratory, safety and tolerability study with calmangafodipir in patients treated with a 12 h regimen of N-acetylcysteine for paracetamol overdose (POP trial). EBioMedicine. 2019;46:423–430. doi: 10.1016/j.ebiom.2019.07.013PubMed Web of Science ®Google Scholar
- Akakpo JY, Ramachandran A, Jaeschke H. Novel strategies for the treatment of acetaminophen hepatotoxicity. Expert Opin Drug Metab Toxicol. 2020;16(11):1039–1050. doi: 10.1080/17425255.2020.1817896PubMed Web of Science ®Google Scholar
- Ding GKA, Buckley NA. Evidence and consequences of spectrum bias in studies of criteria for liver transplant in paracetamol hepatotoxicity. QJM. 2008;101(9):723–729. doi: 10.1093/qjmed/hcn077PubMed Web of Science ®Google Scholar
- O’Grady JG, Alexander GJM, Hayllar KM, et al. Early indicators of prognosis in fulminant hepatic failure. Gastroenterology. 1989;97(2):439–445. doi: 10.1016/0016-5085(89)90081-4PubMed Web of Science ®Google Scholar
- O’Grady J. Timing and benefit of liver transplantation in acute liver failure. J Hepatol. 2014;60(3):663–670. doi: 10.1016/j.jhep.2013.10.024PubMed Web of Science ®Google Scholar
- 7 continents [Internet]. Worldometer; [cited 2023 Jan 5]. Available from: https://www.worldometers.info/geography/7-continents/Google Scholar
- Gummin DD, Mowry JB, Spyker DA, et al. 2016 Annual Report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 34th Annual Report. Clin Toxicol (Phila). 2017;55(10):1072–1254. doi: 10.1080/15563650.2017.1388087PubMed Web of Science ®Google Scholar
- Gummin DD, Mowry JB, Spyker DA, et al. 2017 Annual Report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 35th Annual Report. Clin Toxicol (Phila). 2018;56(12):1213–1415. doi: 10.1080/15563650.2018.1533727PubMed Web of Science ®Google Scholar
- Gummin DD, Mowry JB, Spyker DA, et al. 2018 Annual Report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 36th Annual Report. Clin Toxicol (Phila). 2019;57(12):1220–1413. doi: 10.1080/15563650.2019.1677022PubMed Web of Science ®Google Scholar
- Gummin DD, Mowry JB, Beuhler MC, et al. 2019 Annual Report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 37th Annual Report. Clin Toxicol (Phila). 2020;58(12):1360–1541. doi: 10.1080/15563650.2020.1834219PubMed Web of Science ®Google Scholar
- Descamps AMK, Vandijck DM, Buylaert WA, et al. Characteristics and costs in adults with acute poisoning admitted to the emergency department of a university hospital in Belgium. PLoS ONE. 2019;14(10):e0223479. doi: 10.1371/journal.pone.0223479PubMed Web of Science ®Google Scholar
- Descamps AK, Vandijck D, Buylaert W, et al. Hospital referrals of patients with acute poisoning by the Belgian Poison Centre: analysis of characteristics, associated factors, compliance and costs. Emerg Med J. 2021;38(7):511–519. doi: 10.1136/emermed-2019-209202PubMed Web of Science ®Google Scholar
- Mbongwe B, Moinami J, Masupe T, et al. Nature and sources of poisoning in patients admitted to a referral hospital in Gaborone, Botswana; findings and implications. Hosp Pract. 2020;48(2):100–107. doi: 10.1080/21548331.2020.1739415PubMedGoogle Scholar
- Zhang Y, Yu B, Wang N, et al. Acute poisoning in Shenyang, China: a retrospective and descriptive study from 2012 to 2016. BMJ Open. 2018;8(8):e021881. doi: 10.1136/bmjopen-2018-021881PubMed Web of Science ®Google Scholar
- Andersen CU, Nielsen LP, Møller JM, et al. Acute drug poisonings leading to hospitalization. Basic Clin Pharmacol Toxicol. 2022;130(2):328–336. doi: 10.1111/bcpt.13688PubMed Web of Science ®Google Scholar
- Afandiyev I, Kobidze T, Kereselidze M, et al. СРАВНИТЕЛЬНАЯ СТРУКТУРА ОСТРЫХ ОТРАВЛЕНИЙ В ДВУХ СТОЛИЧНЫХ ГОРОДАХ РЕГИОНА ЮЖНОГО КАВКАЗА [The comparative structure of acute poisonings in two capital cities of the South Caucasus region]. Georgian Med News. 2019;287(2):105–110. Russian.Google Scholar
- Gudjonsdottir GA, Thordardottir AM, Kristinsson J. Framskyggn rannsókn á eitrunum sem komu til meðferðar á bráðamóttökum Landspítala 2012 [A prospective study on acute poisonings presenting to the Emergency Department at Landspitali University Hospital in Iceland 2012]. Laeknabladid. 2017;103(6):275–280. Icelandic. doi: 10.17992/lbl.2017.06.140PubMed Web of Science ®Google Scholar
- Bentur Y, Lurie Y, Cahana A, et al. Poisoning in Israel: annual Report of the Israel Poison Information Center, 2017. Isr Med Assoc J. 2019;21(3):175–182.PubMed Web of Science ®Google Scholar
- Yehya A, Albals D, Issa R, et al. Retrospective assessment of acute poisoning incidents by pharmaceutical agents in Jordan: data from Pharmacy One™ Poison Call Center, 2014 to 2018-Part II. Pharmacol Res Perspect. 2020;8(2):e00583. doi: 10.1002/prp2.583PubMed Web of Science ®Google Scholar
- Hondebrink L, Rietjens SJ, Donker DW, et al. A quarter of admitted poisoned patients have a mild poisoning and require no treatment: an observational study. Eur J Intern Med. 2019;66:41–47. doi: 10.1016/j.ejim.2019.05.012PubMed Web of Science ®Google Scholar
- Liakoni E, Berger F, Klukowska-Rötzler J, et al. Characteristics of emergency department presentations requiring consultation of the national Poisons Information Centre. Swiss Med Wkly. 2019;149(5152):w20164. doi: 10.4414/smw.2019.20164PubMedGoogle Scholar
- Sungur S, Bilge U, Acar N, et al. Retrospective evaluation of adult poisoning cases admitted to emergency department of a University Hospital in Turkey. Niger J Clin Pract. 2018;21(8):1023–1028. doi: 10.4103/njcp.njcp_291_17PubMed Web of Science ®Google Scholar
- Friedman N, Shoshani-Levy M, Brent J, et al. Fatalities in poisoned patients managed by medical toxicologists. Clin Toxicol (Phila). 2020;58(7):688–691. doi: 10.1080/15563650.2019.1672877PubMed Web of Science ®Google Scholar
- Beauchamp GA, Carey JL, Adams T, et al. Sex Differences in Poisonings Among Older Adults: an Analysis of the Toxicology Investigators Consortium (ToxIC) Registry, 2010 to 2016. Clin Ther. 2018;40(8):1366–1374.e8. doi: 10.1016/j.clinthera.2018.06.012PubMed Web of Science ®Google Scholar
- Farrugia LA, Rhyee SH, Calello DP, et al. The Toxicology Investigators Consortium Case Registry-the 2016 Experience. J Med Toxicol. 2017;13(3):203–226. doi: 10.1007/s13181-017-0627-3PubMed Web of Science ®Google Scholar
- Spyres MB, Farrugia LA, Kang AM, et al. The Toxicology Investigators Consortium Case Registry-the 2019 Annual Report. J Med Toxicol. 2020;16(4):361–387. doi: 10.1007/s13181-020-00810-7PubMed Web of Science ®Google Scholar
- Leonard JB, Minhaj FS, Paterson E, et al. Exposures in pregnant patients reported to United States Poison Centers. Clin Toxicol (Phila). 2022;60(3):356–361. doi: 10.1080/15563650.2021.1968420PubMed Web of Science ®Google Scholar
- Babić Ž, Turk R. Izvješće Centra za kontrolu otrovanja za 2021 [Report of the Poison Control Centre for 2021]. Arh Hig Rada Toksikol. 2022;73(1): 88–93. Croatian.Google Scholar
- Tygerberg Poison Information Centre Annual Report 2018. Cape Town (South Africa): Tygerberg Poison Information Centre.Google Scholar
- Sebben VC, Lessa CAS. Relatório Anual 2020 [2020 Annual Report]. Porto Alegre (Brazil): Atendimentos do Centro de Informação Toxicológica do Rio Grande do Sul – CIT/RS; 2022. PortugeseGoogle Scholar
- Pan-Canadian Poison Centres 2020 Annual Report. Canada: Canadian Association of Poison Centres and Clinical Toxicology.Google Scholar
- Bekaert E, De Cock P, De Leener K, et al. Jaarrapport 2021 [Annual Report 2021]. Brussels (Belgium): Antigifcentrum – Centre Antipoisons; 2022. Dutch.Google Scholar
- Anhang zum EU Jahresbericht der VIZ 2014 [Annex to the EU Annual Report of the VIZ 2014]. Freiburg (Germany): Vergiftungs-Informations-Zentrale Freiburg; 2015. German.Google Scholar
- Jahresbericht 2021 [Annual Report 2021]. Göttingen (Germany): Giftinformationszentrum-Nord der Länder Bremen, Hamburg, Niedersachsen und Schleswig-Holstein (GIZ-Nord); 2022. German.Google Scholar
- Anhang zum Jahresbericht 2021 [Appendix to Annual Report 2021]. Zürich (Switzerland): Tox Info Suisse; 2022. German.Google Scholar
- Jahresbericht 2021 [Annual Report 2021]. Bonn (Germany): Informationszentrale gegen Vergiftungen des Landes Nordrhein-Westfalen. German.Google Scholar
- Boletim CIAV – Centro de Informação Antivenenos Dados Estatísticos 2021 [CIAV Bulletin – Antivenom Information Center Statistical Data 2021]. Lisbon (Portugal): CIAV – Centro de Informação Antivenenos. Portugese.Google Scholar
- Annual Report 2018 Victorian Poisons Information Centre. Heidelberg (Australia): Victorian Poisons Information Centre.Google Scholar
- Gummin DD, Mowry JB, Beuhler MC, et al. 2020 Annual Report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 38th Annual Report. Clin Toxicol (Phila). 2021;59(12):1282–1501. doi: 10.1080/15563650.2021.1989785PubMed Web of Science ®Google Scholar
- Huynh A, Cairns R, Brown JA, et al. Patterns of poisoning exposure at different ages: the 2015 annual report of the Australian Poisons Information Centres. Med J Aust. 2018;209(2):74–79. doi: 10.5694/mja17.01063PubMed Web of Science ®Google Scholar
- Pillans PI, Page CB, Ilango S, et al. Self-poisoning by older Australians: a cohort study. Med J Aust. 2017;206(4):164–169. doi: 10.5694/mja16.00484PubMed Web of Science ®Google Scholar
- Magalhães AFA, Caldas ED. Two health information systems to characterize poisoning in Brazil-a descriptive study. J Public Health. 2019;41(1):203–211. doi: 10.1093/pubmed/fdy008Google Scholar
- Kaur J, McFaull SR, Bang F. Trends in emergency department visits for acetaminophen-related poisonings: 2011-2019. Health Promot Chronic Dis Prev Can. 2020;40(4):130–133. doi: 10.24095/hpcdp.40.4.05PubMed Web of Science ®Google Scholar
- Klobučar I, Potočnjak I, Dumančić J, et al. Acute poisonings in Croatia: differences in epidemiology, associated comorbidities and final outcomes – a single-centre 15-year follow-up. Clin Toxicol (Phila). 2019;57(3):181–188. doi: 10.1080/15563650.2018.1506129PubMed Web of Science ®Google Scholar
- Eyasu M, Dida T, Worku Y, et al. Acute poisonings during pregnancy and in other non-pregnant women in emergency departments of four government hospitals, Addis Ababa, Ethiopia: 2010-2015. Trop Med Int Health. 2017;22(10):1350–1360. doi: 10.1111/tmi.12940PubMed Web of Science ®Google Scholar
- Salles J, Calonge J, Franchitto N, et al. Factors associated with hospitalization after self-poisoning in France: special focus on the impact of alcohol use disorder. BMC Psychiatry. 2018;18(1):287. doi: 10.1186/s12888-018-1854-0PubMedGoogle Scholar
- Nair SJ, Sujatha C, Chettiar KPS, et al. Toxico-epidemiology of acute poisoning; an exploratory study from a tertiary care hospital in South India along with global comparisons and solutions. J Forensic Leg Med. 2021;83:102247. doi: 10.1016/j.jflm.2021.102247PubMed Web of Science ®Google Scholar
- Hitti E, El Zahran T, Hamade H, et al. Toxicological exposures reported to a telephonic consultation service at a tertiary care hospital in Lebanon. Clin Toxicol (Phila). 2020;58(9):886–892. doi: 10.1080/15563650.2019.1709643PubMed Web of Science ®Google Scholar
- Thapa S, Dawadi BR, Upreti AR. Acute Poisoning among Patients Presenting to the Emergency Department of a Tertiary Care Center: a Descriptive Cross-sectional Study. JNMA J Nepal Med Assoc. 2020;58(227):470–473. doi: 10.31729/jnma.4997PubMed Web of Science ®Google Scholar
- Kumpula EK, Shieffelbien LM, Pomerleau AC. Enquiries to the New Zealand National Poisons Centre in 2018. Emerg Med Australas. 2021;33(1):45–51. doi: 10.1111/1742-6723.13563PubMed Web of Science ®Google Scholar
- Kumpula EK, Richards R, Norris P, et al. A retrospective analysis of calls to the New Zealand National Poisons Centre regarding Pacific patients. N Z Med J. 2021;134(1528):26–34.PubMed Web of Science ®Google Scholar
- Khan M, Khurram M, Raza S. Gender based differences in patients of poisoning managed at a Medical Unit. J Pak Med Assoc. 2019;69(7):1025–1028.PubMed Web of Science ®Google Scholar
- Garczewski B, Wiśniewski M, Waldman W, et al. ZATRUCIA PARACETAMOLEM LECZONE W POMORSKIM CENTRUM TOKSYKOLOGII W LATACH 2010–2015 [Acetaminophen poisonings hospitalized at the Pomeranian Center of Toxicology in 2010-2015]. Med Pr. 2019;70(6):733–738. Polish. doi: 10.13075/mp.5893.00885PubMedGoogle Scholar
- Scripcaru G, Mateus C, Nunes C. Adverse drug events-Analysis of a decade. A Portuguese case-study, from 2004 to 2013 using hospital database. PLoS ONE. 2017;12(6):e0178626. doi: 10.1371/journal.pone.0178626PubMed Web of Science ®Google Scholar
- Lionte C, Sorodoc V, Jaba E, et al. Development and validation of a risk-prediction nomogram for in-hospital mortality in adults poisoned with drugs and nonpharmaceutical agents: an observational study. Medicine. 2017;96(12):e6404. doi: 10.1097/MD.0000000000006404PubMed Web of Science ®Google Scholar
- Jung KY, Kim T, Hwang SY, et al. Availability of drug at convenient stores is not associated with an increased incidence of their poisoning. Pharmacoepidemiol Drug Saf. 2019;28(4):536–543. doi: 10.1002/pds.4760PubMed Web of Science ®Google Scholar
- Supervía Caparrós A, Pallàs Villaronga O, Clemente Rodríguez C, et al. Características diferenciales de las intoxicaciones en los pacientes ancianos atendidos en un servicio de urgencias [Characteristics of emergency poisoning cases in elderly versus younger patients]. Emergencias. 2017;29(5):335–338. Spanish.PubMedGoogle Scholar
- Bowman C, Thornton S, Oller L, et al. Utilization of a poison control center by critical access hospitals-one state’s experience. Clin Toxicol (Phila). 2021;59(11):1015–1022. doi: 10.1080/15563650.2021.1903485PubMed Web of Science ®Google Scholar
- Exposisiones Humanas A Produtos Farmaceuticos/Medicamentos. Datos de mayor incidencia de reportes a CITUC, durante el primer semestre del 2018 [Human Exposures to Pharmaceutical Products/Medications. Data with the highest incidence of reports to CITUC, during the first semester of 2018]. Centro de Información Toxicológica de la Pontificia Universidad Católica de Chile. http://cituc.uc.cl/infografias/. Spanish.Google Scholar
- Nugteren-van Lonkhuyzen JJ, van Velzen AG, Mulder-Spijkerboer HN, et al. Acute vergiftigingen bij mens en dier – NVIC Jaaroverzicht 2021. [Acute poisonings in humans and animals – NVIC Annual Review 2021]. Utrecht (Netherlands): Nationaal Vergiftigingen Informatie Centrum;2022. (NVIC Rapport 01/2022). Dutch.Google Scholar
- Swedish Poisons Information Centre Annual Report 2021. Solna (Sweden): Giftinformationscentralen (Swedish Poisons Information Centre).Google Scholar
- CIAV – Centro de Informação Antivenenos Dados Estatísticos 2021 [CIAV – Antivenom Information Center Statistical Data 2021]. Lisbon (Portugal): CIAV – Centro de Informação Antivenenos. Portugese.Google Scholar
- Queensland Poisons Information Centre Annual Report 2019. South Brisbane (Australia): Queensland Poisons Information Centre.Google Scholar
- Western Australian Poisons Information Centre Annual Report 2019. Perth (Australia): Western Australian Poisons Information Centre; 2020.Google Scholar
- 2021 Top 10 Agents (In-Patients + Telephone Referrals) [Internet]. Philippines: National Poison Management and Control Center; 2022 [cited 2023 Jan 5]. Available from: https://www.facebook.com/photo/?fbid=464531358795251&set=a.354201129828275Google Scholar
- Mainoli B, Gonçalves N, Ferreira JJ, et al. Potential drug-drug interactions in acute poisonings managed in the intensive care unit: occurrence, risk factors and relationship to patient severity on admission. Basic Clin Pharmacol Toxicol. 2022;130(2):337–345. doi: 10.1111/bcpt.13698PubMed Web of Science ®Google Scholar
- Siedler S, Trageser HB, Grensemann J, et al. Akute Intoxikationen auf der Intensivstation: eine 10-Jahres-Analyse [Acute intoxications in the intensive care unit: a 10-year analysis]. Med Klin Intensivmed Notfmed. 2022;117(2):129–136. German. doi: 10.1007/s00063-021-00839-8PubMed Web of Science ®Google Scholar
- Mehrpour O, Akbari A, Jahani F, et al. Epidemiological and clinical profiles of acute poisoning in patients admitted to the intensive care unit in eastern Iran (2010 to 2017). BMC Emerg Med. 2018;18(1):30. doi: 10.1186/s12873-018-0181-6PubMed Web of Science ®Google Scholar
- Gondim APS, Nogueira RR, Lima JGB, et al. Suicide attempts by exposure to toxic agents registered in a Toxicological Information and Assistance Center in Fortaleza, Ceará, Brazil, 2013. Epidemiol Serv Saude. 2017;26(1):109–119. doi: 10.5123/S1679-49742017000100012PubMedGoogle Scholar
- Song SJ, Park GJ, Lee JH, et al. The Characteristics of Elderly Individuals Who Attempted Suicide by Poisoning: a Nationwide Cross-sectional Study in Korea. J Korean Med Sci. 2020;35(35):e286. doi: 10.3346/jkms.2020.35.e286PubMed Web of Science ®Google Scholar
- Sein Anand Ł, Sein Anand J. Self-poisonings before and during the initial year of the COVID-19 pandemic in northern Poland. Int J Occup Med Environ Health. 2022;35(5):527–535. doi: 10.13075/ijomeh.1896.01838PubMed Web of Science ®Google Scholar
- Knipe D, Silva T, Aroos A, et al. Hospital presentations for self-poisoning during COVID-19 in Sri Lanka: an interrupted time-series analysis. Lancet Psychiatry. 2021;8(10):892–900. doi: 10.1016/S2215-0366(21)00242-XPubMed Web of Science ®Google Scholar
- Beauchamp GA, Fishbein J, Makar GA, et al. Sex differences in patients with suicidal intent that are managed by toxicologists: an analysis of the Toxicology Investigators’ Consortium (ToxIC) Registry. Am J Emerg Med. 2020;38(2):333–338. doi: 10.1016/j.ajem.2019.158450PubMed Web of Science ®Google Scholar
- Canner JK, Giuliano K, Selvarajah S, et al. Emergency department visits for attempted suicide and self harm in the USA: 2006-2013. Epidemiol Psychiatr Sci. 2018;27(1):94–102. doi: 10.1017/S2045796016000871PubMed Web of Science ®Google Scholar
- Kumpula EK, Lambie B, Quigley P, et al. Prescribers aware: a cross-sectional study from New Zealand emergency departments on the substances used in intentional self-poisoning and their sources. J Prim Health Care. 2020;12(3):235–243. doi: 10.1071/HC20017PubMed Web of Science ®Google Scholar
- Laher AE, Motara F, Gihwala R, et al. The profile of patients presenting with intentional self-poisoning to the Charlotte Maxeke Johannesburg Academic Hospital emergency department, South Africa. S Afr Med J. 2022;112(5):347–351. doi: 10.7196/SAMJ.2022.v112i5.16366PubMed Web of Science ®Google Scholar
- Kumpula EK, Nada-Raja S, Norris P, et al. A descriptive study of intentional self-poisoning from New Zealand national registry data. Aust N Z J Public Health. 2017;41(5):535–540. doi: 10.1111/1753-6405.12702PubMed Web of Science ®Google Scholar
- Friðriksdóttir ÞA, Jónsdóttir F, Snook CP, et al. Paracetamol poisoning: a population-based study from Iceland. Scand J Gastroenterol. 2021;56(7):832–839. doi: 10.1080/00365521.2021.1921254PubMed Web of Science ®Google Scholar
- Popiolek I, Hydzik P, Jagielski P, et al. Risk Factors for Hepatotoxicity Due to Paracetamol Overdose in Adults. Medicina (Kaunas). 2021;57(8):752. doi: 10.3390/medicina57080752PubMed Web of Science ®Google Scholar
- Huang HS, Ho CH, Weng SF, et al. Long-term mortality of acetaminophen poisoning: a nationwide population-based cohort study with 10-year follow-up in Taiwan. Scand J Trauma Resusc Emerg Med. 2018;26(1):5. doi: 10.1186/s13049-017-0468-8PubMedGoogle Scholar
- Chung YT, Chou CY, Tsai WC, et al. Acetaminophen Poisoning May Increase Coronary Artery Disease Risk: a Nationwide Cohort Study. Cardiovasc Toxicol. 2018;18(4):386–391. doi: 10.1007/s12012-017-9442-yPubMed Web of Science ®Google Scholar
- Mehrpour O, Saeedi F, Hoyte C. Decision tree outcome prediction of acute acetaminophen exposure in the United States: a study of 30,000 cases from the National Poison Data System. Basic Clin Pharmacol Toxicol. 2022;130(1):191–199. doi: 10.1111/bcpt.13674PubMed Web of Science ®Google Scholar
- Nash E, Sabih AH, Chetwood J, et al. Drug-induced liver injury in Australia, 2009-2020: the increasing proportion of non-paracetamol cases linked with herbal and dietary supplements. Med J Aust. 2021;215(6):261–268. doi: 10.5694/mja2.51173PubMed Web of Science ®Google Scholar
- Mallet M, Haq M, Tripon S, et al. Elevated procalcitonin is associated with bacterial infection during acute liver failure only when unrelated to acetaminophen intoxication. Eur J Gastroenterol Hepatol. 2017;29(7):811–816. doi: 10.1097/MEG.0000000000000862PubMed Web of Science ®Google Scholar
- Louvet A, Ntandja Wandji LC, Lemaître E, et al. Acute Liver Injury with Therapeutic Doses of Acetaminophen: a Prospective Study. Hepatology. 2021;73(5):1945–1955. doi: 10.1002/hep.31678PubMed Web of Science ®Google Scholar
- Moore JK, MacKinnon AC, Man TY, et al. Patients with the worst outcomes after paracetamol (acetaminophen)-induced liver failure have an early monocytopenia. Aliment Pharmacol Ther. 2017;45(3):443–454. doi: 10.1111/apt.13878PubMed Web of Science ®Google Scholar
- Spivak I, Arora J, Meinzer C, et al. Low Serum Hepcidin is Associated with Reduced Short-Term Survival in Adults with Acute Liver Failure. Hepatology. 2019;69(5):2136–2149. doi: 10.1002/hep.30486PubMed Web of Science ®Google Scholar
- Fontana RJ, Engle RE, Gottfried M, et al. Role of Hepatitis E Virus Infection in North American Patients with Severe Acute Liver Injury. Clin Transl Gastroenterol. 2020;11(11):e00273. doi: 10.14309/ctg.0000000000000273PubMedGoogle Scholar
- Koch DG, Speiser JL, Durkalski V, et al. The Natural History of Severe Acute Liver Injury. Am J Gastroenterol. 2017;112(9):1389–1396. doi: 10.1038/ajg.2017.98PubMed Web of Science ®Google Scholar
- Stravitz RT, Fontana RJ, Meinzer C, et al. Coagulopathy, Bleeding Events, and Outcome According to Rotational Thromboelastometry in Patients with Acute Liver Injury/Failure. Hepatology. 2021;74(2):937–949. doi: 10.1002/hep.31767PubMed Web of Science ®Google Scholar
- Santos G, Figueira ERR, D’Albuquerque LAC, et al. Evaluation of drug-induced liver injury as etiology for acute liver failure in Brazil. Ann Hepatol. 2021;23:100310. doi: 10.1016/j.aohep.2021.100310PubMed Web of Science ®Google Scholar
- Liu Y, Zhan SP, Song L, et al. Drug-Induced Liver Injury: clinical and Etiologic Features at a Large Tertiary Teaching Hospital in China. Med Sci Monit. 2020;26:e919435. doi: 10.12659/MSM.919435PubMed Web of Science ®Google Scholar
- Zhang C, Wu Y, Yuan S, et al. Characteristics of Drug-Induced Liver Injury in Northeast China: disease Spectrum and Drug Types. Dig Dis Sci. 2020;65(11):3360–3368. doi: 10.1007/s10620-019-06030-6PubMed Web of Science ®Google Scholar
- Das S, Behera SK, Xavier AS, et al. Agreement Among Different Scales for Causality Assessment in Drug-Induced Liver Injury. Clin Drug Investig. 2018;38(3):211–218. doi: 10.1007/s40261-017-0601-5PubMed Web of Science ®Google Scholar
- Rathi C, Pipaliya N, Patel R, et al. Drug Induced Liver Injury at a Tertiary Hospital in India: etiology, Clinical Features and Predictors of Mortality. Ann Hepatol. 2017;16(3):442–450. doi: 10.5604/01.3001.0009.8600PubMed Web of Science ®Google Scholar
- Bourhia M, Ullah R, Alqahtani AS, et al. Evidence of drug-induced hepatotoxicity in the Maghrebian population. Drug Chem Toxicol. 2022;45(3):985–989. doi: 10.1080/01480545.2020.1797088PubMed Web of Science ®Google Scholar
- Abid A, Subhani F, Kayani F, et al. Drug induced liver injury is associated with high mortality—A study from a tertiary care hospital in Pakistan. PLoS ONE. 2020;15(4):e0231398. doi: 10.1371/journal.pone.0231398PubMed Web of Science ®Google Scholar
- Ortland I, Mirjalili M, Kullak-Ublick GA, et al. Drug-induced liver injury in Switzerland: an analysis of drug-related hepatic disorders in the WHO pharmacovigilance database VigiBase™ from 2010 to 2020. Swiss Med Wkly. 2021;151(1920):w20503. doi: 10.4414/smw.2021.20503PubMedGoogle Scholar
- Yeboah-Korang A, Louissaint J, Tsung I, et al. Utility of a Computerized ICD-10 Algorithm to Identify Idiosyncratic Drug-Induced Liver Injury Cases in the Electronic Medical Record. Drug Saf. 2020;43(4):371–377. doi: 10.1007/s40264-019-00903-5PubMed Web of Science ®Google Scholar
- Yeboah-Korang A, Memon A, Patel N, et al. Impact of Prior Drug Allergies on the Risk, Clinical Features, and Outcomes of Idiosyncratic Drug-Induced Liver Injury in Adults. Dig Dis Sci. 2022;67(11):5262–5271. doi: 10.1007/s10620-022-07403-0PubMed Web of Science ®Google Scholar
- Louissaint J, Kassab I, Yeboah-Korang A, et al. Combining K-72 Hepatic Failure with 15 Individual T-Codes to Identify Patients with Idiosyncratic Drug-Induced Liver Injury in the Electronic Medical Record. Dig Dis Sci. 2022;67(8):4243–4249. doi: 10.1007/s10620-021-07223-8PubMed Web of Science ®Google Scholar
- Oliveira JdFMd, Wagner GA, Romano-Lieber NS, et al. Medicine poisoning mortality trend by gender and age group, São Paulo State, Brazil, 1996-2012. Cien Saude Colet. 2017;22(10):3381–3391. doi: 10.1590/1413-812320172210.12782017PubMed Web of Science ®Google Scholar
- Xiao L, Ye Y, Wang Y, et al. A 9-year retrospective study of poisoning-related deaths in Southwest China (Sichuan). Forensic Sci Int. 2021;318:110558. doi: 10.1016/j.forsciint.2020.110558PubMed Web of Science ®Google Scholar
- Koskela L, Raatiniemi L, Bakke HK, et al. Do pre-hospital poisoning deaths differ from in-hospital deaths? A retrospective analysis. Scand J Trauma Resusc Emerg Med. 2017;25(1):48. doi: 10.1186/s13049-017-0391-zPubMedGoogle Scholar
- Gunnarsdottir OS, Rafnsson V. Accidental poisoning, intentional self-harm and event of undetermined intent mortality over 20 years in Iceland: a population-based cohort study. BMJ Open. 2020;10(5):e034590. doi: 10.1136/bmjopen-2019-034590PubMed Web of Science ®Google Scholar
- Lynn E, Cousins G, Lyons S, et al. Comparing characteristics of suicide to non-suicide drug poisoning deaths, by sex, in Ireland. J Affect Disord. 2022;306:80–89. doi: 10.1016/j.jad.2022.03.030PubMed Web of Science ®Google Scholar
- Magalhães AFA, Caldas ED. Underreporting of fatal poisonings in Brazil – a descriptive study using data from four information systems. Forensic Sci Int. 2018;287:136–141. doi: 10.1016/j.forsciint.2018.03.040PubMed Web of Science ®Google Scholar
- Koskela L, Raatiniemi L, Bakke HK, et al. Fatal poisonings in Northern Finland: causes, incidence, and rural-urban differences. Scand J Trauma Resusc Emerg Med. 2017;25(1):90. doi: 10.1186/s13049-017-0431-8PubMedGoogle Scholar
- González-Santiago O, Morales-San Claudio PC, Cantú-Cárdenas LG, et al. Unintentional and self-poisoning mortalities in Mexico, 2000–2012. PLoS ONE. 2017;12(7):e0181708. doi: 10.1371/journal.pone.0181708PubMed Web of Science ®Google Scholar
- Gharbaoui M, Ben Khelil M, Harzallah H, et al. Pattern of suicide by self-poisoning in Northern Tunisia: an eleven-year study (2005-2015). J Forensic Leg Med. 2019;61:1–4. doi: 10.1016/j.jflm.2018.10.004PubMed Web of Science ®Google Scholar
- Schmidt LE, Rasmussen DN, Petersen TS, et al. Fewer adverse effects associated with a modified two-bag intravenous acetylcysteine protocol compared to traditional three-bag regimen in paracetamol overdose. Clin Toxicol (Phila). 2018;56(11):1128–1134. doi: 10.1080/15563650.2018.1475672PubMed Web of Science ®Google Scholar
- Wong A, Isbister G, McNulty R, et al. Efficacy of a two bag acetylcysteine regimen to treat paracetamol overdose (2NAC study). EClinicalMedicine. 2020;20:100288. doi: 10.1016/j.eclinm.2020.100288PubMedGoogle Scholar
- Shoib S, Patel V, Khan S, et al. Over-the-counter drug use in suicidal/self-harm behavior: scoping review. Health Sci Rep. 2022;5(3):e662. doi: 10.1002/hsr2.662PubMedGoogle Scholar
- Wazaify M, Kennedy S, Hughes CM, et al. Prevalence of over-the-counter drug-related overdoses at Accident and Emergency departments in Northern Ireland – a retrospective evaluation. J Clin Pharm Ther. 2005;30(1):39–44. doi: 10.1111/j.1365-2710.2004.00607.xPubMed Web of Science ®Google Scholar
- Morthorst BR, Erlangsen A, Nordentoft M, et al. Availability of Paracetamol Sold Over the Counter in Europe: a Descriptive Cross‐Sectional International Survey of Pack Size Restriction. Basic Clin Pharmacol Toxicol. 2018;122(6):643–649. doi: 10.1111/bcpt.12959PubMed Web of Science ®Google Scholar
- Gedeborg R, Svennblad B, Holm L, et al. Increased availability of paracetamol in Sweden and incidence of paracetamol poisoning: using laboratory data to increase validity of a population-based registry study. Pharmacoepidemiol Drug Saf. 2017;26(5):518–527. doi: 10.1002/pds.4166PubMed Web of Science ®Google Scholar
- Hopkins AG, Spiller HA, Kistamgari S, et al. Suicide-related over-the-counter analgesic exposures reported to United States poison control centers, 2000-2018. Pharmacoepidemiol Drug Saf. 2020;29(9):1011–1021. doi: 10.1002/pds.4997PubMed Web of Science ®Google Scholar
- Medicines Classification Database [Internet]. MEDSAFE: New Zealand medicines and medical devices safety authority; [Updated 2023 Jan 27; cited 2022 Dec 28]. Available from: https://www.medsafe.govt.nz/profs/class/classintro.asp.Google Scholar
- Poisons Standard October 2022. Canberra. Standard No. 37. Australian Capital Territory (Australia): Department of Health and Aged Care; 2022.Google Scholar
- Modified-release paracetamol-containing products to be suspended from EU market [Internet]. London (UK): European Medicines Agency; 2018 [cited 2023 Jan 19]. Available from: https://www.ema.europa.eu/en/medicines/human/referrals/paracetamol-modified-releaseGoogle Scholar
- 1.4. Final decision in relation to paracetamol (modified release) [Internet]. Canberra (Australia): Department of Health and Aged Care (Therapeutic Goods Administration); 2019 [updated 2019 Aug 26; cited 2022 Aug 31]. Available from. https://www.tga.gov.au/resources/publication/scheduling-decisions-final/notice-final-decision-amend-or-not-amend-current-poisons-standard-august-2019/14-final-decision-relation-paracetamol-modified-releaseGoogle Scholar
- Morgan O, Majeed A. Restricting paracetamol in the United Kingdom to reduce poisoning: a systematic review. J Public Health. 2005;27(1):12–18. doi: 10.1093/pubmed/fdh200Google Scholar
- Turvill JL, Burroughs AK, Moore KP. Change in occurrence of paracetamol overdose in UK after introduction of blister packs. Lancet. 2000;355(9220):2048–2049. doi: 10.1016/S0140-6736(00)02355-2Web of Science ®Google Scholar
- Hawton K, Simkin S, Deeks J, et al. UK legislation on analgesic packs: before and after study of long term effect on poisonings. BMJ. 2004;329(7474):1076. doi: 10.1136/bmj.38253.572581.7CPubMed Web of Science ®Google Scholar
- Morgan O, Griffiths C, Majeed A. Impact of paracetamol pack size restrictions on poisoning from paracetamol in England and Wales: an observational study. J Public Health. 2005;27(1):19–24. doi: 10.1093/pubmed/fdh216Google Scholar
- Morgan OW, Griffiths C, Majeed A, et al. Interrupted time-series analysis of regulations to reduce paracetamol (acetaminophen) poisoning. PLOS Med. 2007;4(4):e105. doi: 10.1371/journal.pmed.0040105PubMed Web of Science ®Google Scholar
- Bateman DN, Gorman DR, Bain M, et al. Legislation restricting paracetamol sales and patterns of self-harm and death from paracetamol-containing preparations in Scotland. Br J Clin Pharmacol. 2006;62(5):573–581. doi: 10.1111/j.1365-2125.2006.02668.xPubMed Web of Science ®Google Scholar
- Hawton K, Bergen H, Simkin S, et al. Long term effect of reduced pack sizes of paracetamol on poisoning deaths and liver transplant activity in England and Wales: interrupted time series analyses. BMJ. 2013;346():f403. doi: 10.1136/bmj.f403.PubMed Web of Science ®Google Scholar
- Greene SL, Dargan PI, Leman P, et al. Paracetamol availability and recent changes in paracetamol poisoning: is the 1998 legislation limiting availability of paracetamol being followed? Postgrad Med J. 2006;82(970):520–523. doi: 10.1136/pgmj.2005.042036PubMed Web of Science ®Google Scholar
- Molloy P, Chambers R, Cork T. How well are national guidelines relating to the general sales of aspirin and paracetamol, adhered to by retail stores: a mystery shopper study. BMJ Open. 2016;6(1):e010081. doi: 10.1136/bmjopen-2015-010081PubMed Web of Science ®Google Scholar
- Buckley NA, Gunnell D. Does restricting pack size of paracetamol (acetaminophen) reduce suicides? PLOS Med. 2007;4(4):e152. doi: 10.1371/journal.pmed.0040152PubMed Web of Science ®Google Scholar
- Morthorst BR, Erlangsen A, Chaine M, et al. Restriction of non-opioid analgesics sold over-the-counter in Denmark: a national study of impact on poisonings. J Affect Disord. 2020;268:61–68. doi: 10.1016/j.jad.2020.02.043PubMed Web of Science ®Google Scholar
- Steeg S, Carr MJ, Mok PLH, et al. Temporal trends in incidence of hospital-treated self-harm among adolescents in Denmark: national register-based study. Soc Psychiatry Psychiatr Epidemiol. 2020;55(4):415–421. doi: 10.1007/s00127-019-01794-8PubMed Web of Science ®Google Scholar
- Goldberger D, Vearrier D. Evaluation of a food and drug administration mandate to limit acetaminophen in prescription combination products. J Med Toxicol. 2017;13(4):303–308. doi: 10.1007/s13181-017-0622-8PubMed Web of Science ®Google Scholar
- Antoniou T, Guan Q, Martins D, et al. Impact of acetaminophen product labelling changes in Canada on hospital admissions for accidental acetaminophen overdose: a population-based study. CMAJ. 2022;194(15):E542–E548. doi: 10.1503/cmaj.210842PubMed Web of Science ®Google Scholar
- Cairns R, Noghrehchi F, Buckley NA. The impact on poisonings of up-scheduling of modified release paracetamol to Schedule 3 (pharmacist only medicine).Med J Aust. 2023;218(9):412–414. doi: https://doi.org/10.5694/mja2.51888PubMedGoogle Scholar
- de Silva V, Ratnayake A. Increased use of medicinal drugs in self-harm in urban areas in Sri Lanka. Arch Suicide Res. 2008;12(4):366–369. doi: 10.1080/13811110802325265PubMed Web of Science ®Google Scholar
 CienciaySaludNatural.com
CienciaySaludNatural.com