Los informes de casos incluidos en los documentos de ensayos clínicos de Pfizer, publicados el 1 de junio por la Administración de Drogas y Alimentos de los EE. UU., revelan una tendencia a clasificar casi todos los eventos adversos, y en particular los eventos adversos graves, como «no relacionados» con la vacuna.
La última publicación de la Administración de Drogas y Alimentos de los EE. UU. (FDA) de los documentos de la inyeccion de Pfizer-BioNTech COVID-19 revela numerosos casos de participantes que sufrieron eventos adversos graves durante los ensayos de Fase 3. Algunos de estos participantes se retiraron de los ensayos y otros murieron.
El caché de documentos de 80.000 páginas incluye un amplio conjunto de formularios de informes de casos (Case Report Form, CRF) de los ensayos de fase 3 de Pfizer realizados en varios lugares de los EE. UU., además de otra documentación relacionada con los participantes en los ensayos de inyecciones de Pfizer-BioNTech en los EE. UU. y en todo el mundo.
El 1 de junio, la FDA publicó los documentos, que pertenecen a la Autorización de uso de emergencia (EUA) de la inyección, como parte de un cronograma de divulgación ordenado por un tribunal derivado de una solicitud acelerada de la Ley de libertad de información (FOIA) presentada en agosto de 2021.
Public Health and Medical Professionals for Transparency (PHMPT), un grupo de médicos y profesionales de la salud pública, presentó la solicitud de FOIA.
Los muchos eventos adversos graves, y varias muertes, registrados durante los ensayos de Fase 3 también son evidentes en un documento separado y masivo de más de 2500 páginas, que cataloga dichos eventos adversos.
Este documento enumera una amplia gama de eventos adversos sufridos por los participantes del ensayo clasificados como nivel de toxicidad 4, el nivel más alto y más grave de este tipo.
Sin embargo, ninguno de los eventos adversos de nivel 4 (más graves) enumerados en este documento en particular está clasificado como relacionado con la vacunación.
Los eventos adversos de nivel 4 enumerados en el documento incluyen, entre otros, los siguientes, muchos de los cuales ocurrieron en múltiples pacientes:
- Colecistitis aguda
- Insuficiencia respiratoria aguda
- Carcinoma suprarrenal
- Choque anafiláctico
- Incompetencia de la válvula aórtica
- Apendicitis
- Arritmia supraventricular
- Arteriosclerosis
- Absceso cerebral
- Paro cardiaco
- Leucemia mieloide crónica
- Apendicitis complicada/apendicitis aguda con necrosis
- Cardiopatía congénita/anomalía cardíaca
- Oclusión de la arteria coronaria
- Enfermedad del COVID-19
- La trombosis venosa profunda
- diverticulitis
- Migraña hemipléjica
- Ataque hemorragico
- Enfermedad pulmonar intersticial
- Infarto de miocardio
- Hipotensión ortostática/posible hipotensión postural
- Osteoartritis
- Absceso pericólico
- absceso peritoneal
- Cólico renal
- divertículo roto
- Obstrucción del intestino delgado/obstrucción del intestino delgado
- Disección espontánea de la arteria coronaria
- Hemorragia subaracnoidea
- Ideación suicida (e ideación suicida con intento)
- Síncope
- Diabetes tipo 2
- Empeoramiento del dolor abdominal
- Un “evento invaluable/“desconocido de origen desconocido”
Del mismo modo, solo un pequeño número de eventos adversos de nivel de toxicidad 3 se indicaron como «relacionados» con la vacunación. Dichos eventos adversos incluyeron, entre otros, los siguientes, algunos de los cuales ocurrieron en múltiples participantes del ensayo:
- Artralgia
- Aumento de glucosa en sangre/pico de glucosa
- Sordera/pérdida auditiva
- Dispepsia
- Hipotensión
- Dolor de ganglios linfáticos
- Linfadenopatía/inflamación de los ganglios linfáticos
- Dolor torácico musculoesquelético (no cardíaco)
- Neutropenia
- Dolor en los dedos/manos bilaterales
- Prurito
- Pirexia/síndrome febril
- Dolor de cabeza intenso
- Lesión en el hombro relacionada con la administración de la inyección
- Trastorno del sueño/perturbación del sueño
- Taquicardia
- Urticaria
- arritmia ventricular
- Vértigo
La página 2.525 del documento en cuestión también enumera seis muertes de participantes del ensayo, con causas de muerte que incluyen arteriosclerosis, paro cardíaco, accidente cerebrovascular hemorrágico e infarto de miocardio.
La pequeña cantidad de eventos adversos enumerados como relacionados con la inyección sigue una tendencia señalada en el tramo anterior de documentos de Pfizer-BioNTech , publicado en mayo.
Un documento adicional publicado en el tramo de este mes cataloga a los pacientes que descontinuaron su participación en el ensayo de Fase 3, o cuya participación fue descontinuada por médicos u otros profesionales médicos.
Si bien muchos pacientes fueron descontinuados porque no pudieron ser localizados, por órdenes de un médico, porque se mudaron a otra región o por otras razones personales, numerosos pacientes terminaron su participación debido a eventos adversos, que incluyen, entre otros, los siguientes síntomas:
- Infarto agudo del miocardio
- Amnesia
- Anorexia
- Fibrilación auricular
- Infarto cerebral
- Insuficiencia cardiaca congestiva
- Enfermedad de la arteria coronaria
- Sordera (unilateral)
- Depresión
- pie diabético
- perforación diverticular
- Exposición durante el embarazo
- Dolor de ojo
- Inestabilidad de la marcha
- Adenocarcinoma gástrico
- Hemorragia gastrointestinal
- Hipertensión
- Ritmo cardíaco irregular
- Pérdida del gusto y el olfato
- Mialgia
- paraparesia
- parkinsonismo
- Presíncope
- Embolia pulmonar
- Pirexia
- Cara hinchada
- Taquicardia
- Ataque isquémico transitorio
- Urticaria
- alergia a las inyecciones
- Vértigo
En otros casos, los sujetos se retiraron debido a temores relacionados con la seguridad de la inyección o a la incomodidad de recibir la segunda dosis.
El documento de revisión clínica pasa por alto los eventos adversos durante los ensayos
En el volcado de documentos de la FDA de junio también se incluyó un documento de «revisión clínica» de 334 páginas , que parece haber sido aprobado por la FDA el 30 de abril de 2021 y que presenta «datos fundamentales» del estudio de fase 1/2/3 C4591001 , realizado en los EE. UU., junto con datos de fase 1/2 «de apoyo» del estudio BNT162-01, realizado en Alemania.
Este documento hace referencia tanto a la inección de Pfizer-BioNTech, que recibió una autorización de uso de la FDA, como a la inyección de Pfizer Comirnaty , que recibió la aprobación total de la FDA pero, según se informa, es casi imposible de encontrar en los lugares de vacunación en los EE. UU.
Como informó anteriormente , un juez federal determinó que las inyecciónes de Pfizer-BioNTech y Pfizer Comirnaty son legalmente distintas.
El documento de revisión clínica establece:
“BNT162b2 ha recibido autorizaciones temporales para suministro de emergencia en 28 países y autorizaciones de comercialización condicionales en 39 países a nivel mundial.
“El nombre del producto suministrado bajo autorización de uso temporal/de emergencia para todas las regiones aplicables es Pfizer-BioNTech COVID-19 Vaccine.
“El nombre del producto suministrado bajo autorización de comercialización condicional para todas las regiones aplicables es COMIRNATY [COVID-19 mRNA Vaccine (nucleósido modificado)]”.
El documento establece que a los participantes del ensayo se les administró una de las dos inyecciones candidatas, etiquetadas como BNT162b1 y BNT162b2 (la última de las cuales finalmente recibió una EUA de la FDA), o un placebo. También se probaron una variedad de niveles de dosificación, que van desde 10 μg a 100 μg para BNT162b1 y 10 μg a 30 μg para BNT162b2.
En la fase 1 del estudio BNT162-01, la revisión clínica informa que «del 40 % al 45 % de los participantes que recibieron BNT162b1 y BNT162b2 en todos los grupos de edad y en todos los niveles de dosis informaron uno o más AE [eventos adversos] desde la dosis 1 hasta los 28 días ( es decir, 1 mes) después de la dosis 2”.
En lo que resultará ser un patrón general a lo largo de la revisión clínica, se nos dice que «el investigador consideró que la mayoría de los Eventos Adversos, EA no estaban relacionados con la intervención del estudio y tenían una gravedad de leve a moderada, y todos los EA se informaron como resueltos».
Pfizer concluye que las inyecciones son «seguras y bien toleradas»
En general, a pesar de la incidencia de eventos adversos graves (algunos de los cuales se admitió que estaban relacionados con la inyección) y muertes, así como la falta admitida de datos sobre los resultados de las mujeres embarazadas que participaron en el ensayo, las «conclusiones de seguridad» de la revisión indican lo siguiente:
«Según los datos de la Fase 1 del estudio FIH BNT162-01, BNT162b1 y BNT162b2 fueron seguros y bien tolerados en adultos sanos de 18 a 55 años de edad, sin hallazgos de seguridad inesperados… y el perfil de EA y los resultados de laboratorio clínico no sugirieron cualquier problema de seguridad.
Como resultado, y en base a los datos anteriores, la revisión justifica la aprobación de BNT162b2:
“Del mismo modo, el perfil de riesgo y beneficio de BNT162b2 30 μg respalda un mayor desarrollo en poblaciones pediátricas, maternas y otras poblaciones en riesgo”.
Todos estos riesgos cuando (UCI, UCLA, Cornell, Stanford, Harvard) y el (Reino Unido, Islandia) muestran claramente que las inyecciones contra el COVID-19 no detienen la adquisición ni la transmisión del virus.
Negligencia total de Los Centros para el Control y la Prevención de Enfermedades (CDC)
Los Centros para el Control y la Prevención de Enfermedades (CDC) admitieron a mediados de junio que la agencia nunca analizó el Sistema de Informe de Eventos Adversos de Vacunas (VAERS) en busca de señales de seguridad para las inyecciones COVID-19 . La admisión se reveló en respuesta a una solicitud de la Ley de Libertad de Información (FOIA) presentada por Children’s Health Defense (CHD). La respuesta de la agencia a la solicitud de FOIA, dice que “los CDC no realizaron ningún Requisitos de Respuesta a la Pandemia del COVID-19 (PRR, por sus siglas en inglés).
El cálculo de PRR es una herramienta de farmacovigilancia contundente y está lejos de ser perfecta , tiene la ventaja de ser sencillo y difícil de manipular con trucos estadísticos.
Los PRR son una de las herramientas de farmacovigilancia más antiguas, básicas y mejor establecidas. Los cálculos son tan sencillos que el CDC los automatizó hace varios años , por lo que podría haberse hecho con solo presionar un botón.
Simplemente cuesta creer que los CDC no hayan podido hacer este simple cálculo. Incluso ahora, un artículo publicado por el personal de los CDC en marzo sobre la seguridad de las inyecciones de ARNm contra el COVID-19 sigue siendo puramente descriptivo sin cálculo de PRR.
Mientras tanto, un estudio publicado por un investigador no afiliado a los CDC en febrero en «Frontiers in Public Health» analiza los datos de VAERS y EudraVigilance utilizando un método similar a los PRR, revelando señales de seguridad claras y preocupantes.
Un informe independiente de farmacovigilancia confirma la evidencia para demandar el retiro del mercado de las inyecciones contra el covid-19
Un nuevo informe preparado por el Consejo Mundial de la Salud (WCH, por sus siglas en inglés) confirmó que existen datos sobre las reacciones adversas a los medicamentos de las vacunas experimentales contra el covid-19 en una cantidad suficiente para el retiro del mercado de productos similares en el pasado.
El informe se preparó para determinar si existen suficientes datos de farmacovigilancia en las bases de datos oficiales y públicas (WHO VigiAccess, CDC VAERS, EudraVigilance y UK Yellow Card Scheme) para establecer una señal de seguridad sobre las nuevas inyecciones de Covid-19.
En todas las bases de datos, se encontró que los informes de reacciones adversas a medicamentos (ADR) relacionados con las inyecciones de Covid-19 son más numerosos que otros productos similares por un factor de entre 10 y 169 (ver el gráfico a continuación). Muchos de los informes de ADR son de naturaleza grave y existe suficiente evidencia de daño asociado en estas bases de datos para indicar el retiro del producto.
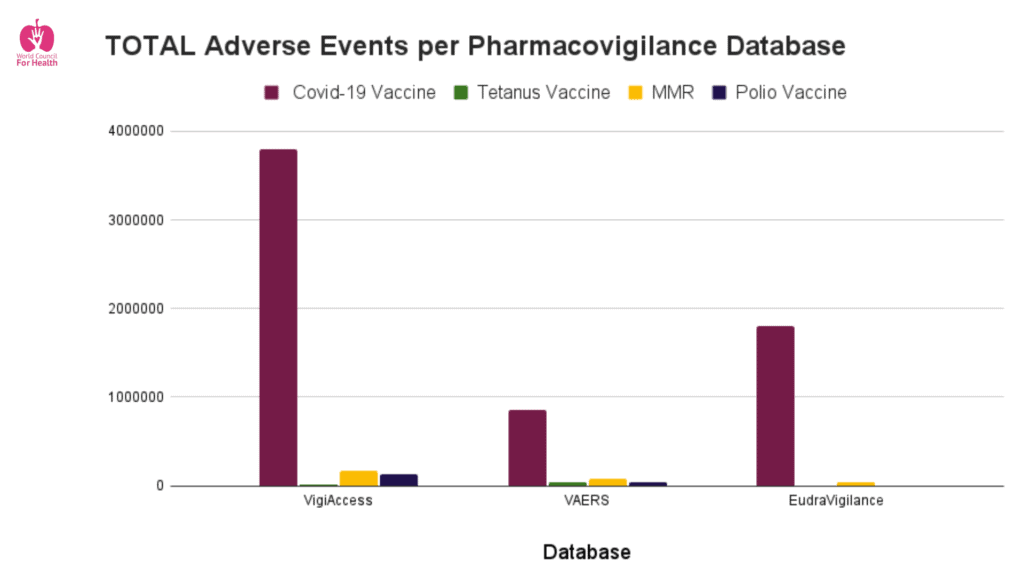
En total, más de 40.000 muertes están vinculadas a las nuevas inyecciones contra el Covid-19 en las bases de datos oficiales analizadas.
Además, el informe de farmacovigilancia de WCH encontró que varios miles de reacciones adversas a medicamentos en las bases de datos oficiales están relacionadas con el uso de inyecciones experimentales contra el covid-19 entre niños y niñas.
El propósito de las bases de datos de farmacovigilancia es proporcionar una señal de seguridad y no probar la causalidad. Para asegurar que los daños se detecten a tiempo, la sospecha de que un evento está relacionado con la administración del medicamento es suficiente para registrar un evento. “No hay necesidad de probar que el medicamento causó la reacción adversa, solo la sospecha es suficiente”, dijo en 2006 la Dra. June Raine, directora de la Agencia Reguladora de Medicamentos y Productos para el Cuidado de la Salud del Reino Unido . Cuando suficientes datos de farmacovigilancia muestran una señal de daño, se debe suspender la administración del producto, retirar el producto e investigar la señal de seguridad.
También se debe tener en cuenta que tales sistemas de vigilancia pasiva dan como resultado un número significativamente menor de informes de RAM que los informes de vigilancia activa. Como resultado, es probable que la cantidad real de eventos adversos que ocurrieron en relación temporal con las inyecciones de Covid-19 sea mucho mayor que la revelada por los datos oficiales disponibles.
Vacunas COVID y niños: eficacia cuestionable y sin garantía de seguridad Dr.Peter McCullough https://rumble.com/v18ypry-covid-vaccines-and-kids.html
 CienciaySaludNatural.com
CienciaySaludNatural.com