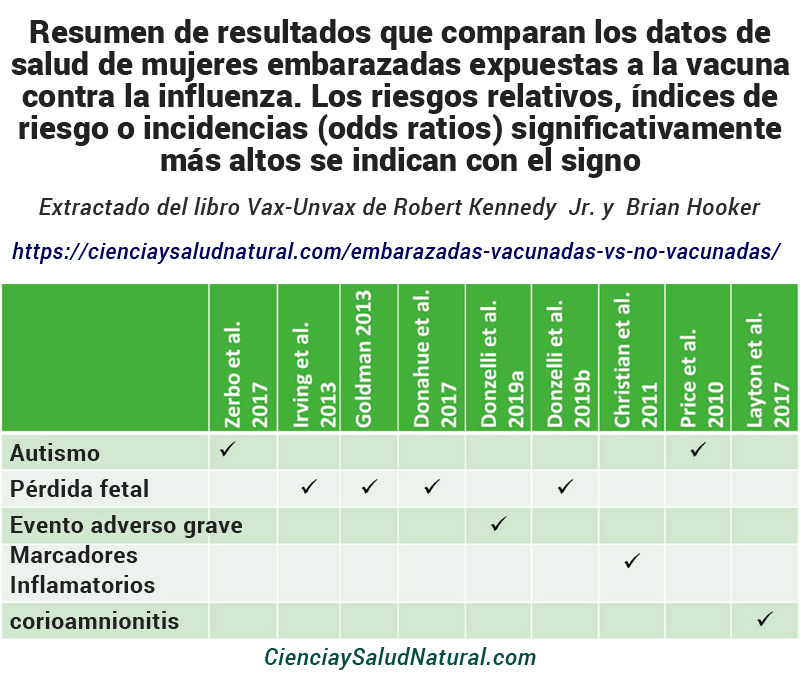
Resumen de resultados que comparan los resultados de salud de mujeres embarazadas expuestas a la vacuna contra la influenza. Los odds ratios, riesgos relativos, índices de riesgo o incidencias significativamente más altos se indican con ✓
Los médicos administran habitualmente vacunas contra la gripe, la Tdap y la COVID-19 a mujeres embarazadas durante cualquier trimestre del embarazo. Si bien ocasionalmente una participante de un ensayo clínico puede quedar embarazada durante un estudio, la FDA nunca ha probado deliberadamente estos productos en una sola mujer embarazada como parte del proceso de aprobación.
De hecho, hasta 2020, el prospecto de la vacuna Boostrix ® Tdap decía: «No existen estudios adecuados y bien controlados de BOOSTRIX en mujeres embarazadas en los EE. UU.». 1 Los prospectos de las vacunas trivalentes inactivadas contra la influenza (TIV), Fluvirin ® y Flublok ® , recomendadas por los CDC para mujeres embarazadas, tenían una redacción similar. El prospecto del paquete de Fluvirin ® todavía advierte: “La seguridad y eficacia de FLUVIRIN ® no se han establecido en mujeres embarazadas.” 2
De manera similar, para la versión aprobada por la FDA de la inyección contra el COVID-19, Comirnaty ® , que fabrica Pfizer, el prospecto establece que “los datos disponibles sobre COMIRNATY administrado a mujeres embarazadas son insuficientes para informar sobre los riesgos asociados a la vacuna durante el embarazo”. 3
El prospecto de la vacuna Moderna COVID-19 aprobada por la FDA, Spikevax, proporciona una información idéntica. 4
Ambos prospectos hacen referencia a un estudio de toxicología reproductiva animal a pequeña escala que no demostró daños. Sin embargo, Pfizer y Moderna no realizaron ningún ensayo clínico en mujeres embarazadas.
Sin embargo, los CDC recomendaron estas inyecciones COVID-19 a mujeres embarazadas sin ninguna prueba de seguridad ni precauciones. 5 , 6
Sólo después de que se hicieron las recomendaciones y muchos millones de mujeres recibieron las inyecciones, los fabricantes, los CDC o la FDA intentaron siquiera investigar la seguridad en mujeres embarazadas estableciendo registros para “monitorear los resultados del embarazo” en mujeres que recibieron una inyección contra el COVID-19. 7
Esto significa que cada mujer embarazada a la que se le inyecta es un sujeto involuntario en un experimento mal administrado.
A continuación se presentan los resultados del embarazo en mujeres que recibieron las vacunas contra la influenza, Tdap y/o COVID-19 durante el embarazo versus aquellas que no las recibieron. Además, examinamos estudios que analizan los resultados de fertilidad asociados con la vacunación antes de la concepción.
Asociación entre la infección por influenza y la vacunación durante el embarazo y el riesgo de trastorno del espectro autista
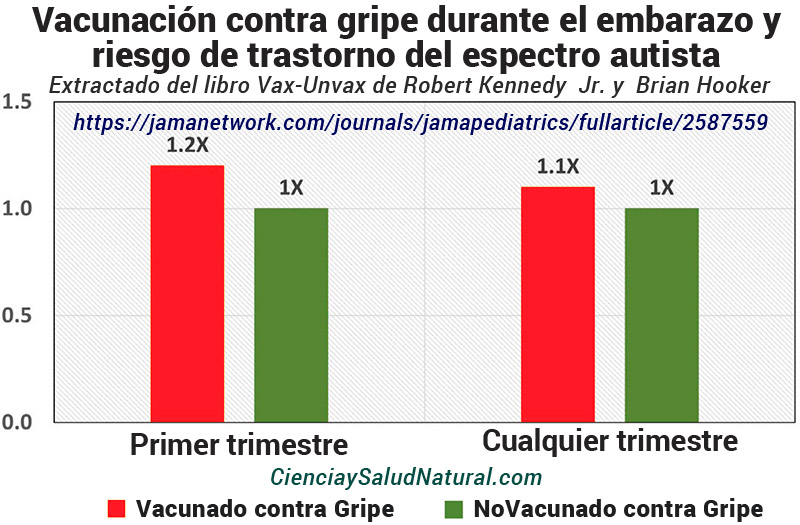
Figura 1 Razones de riesgo para la incidencia de TEA en los hijos de mujeres que recibieron la vacuna contra la gripe en el primer trimestre y en cualquier trimestre del embarazo en comparación con los hijos de mujeres embarazadas no vacunadas (Zerbo et al. 2017).
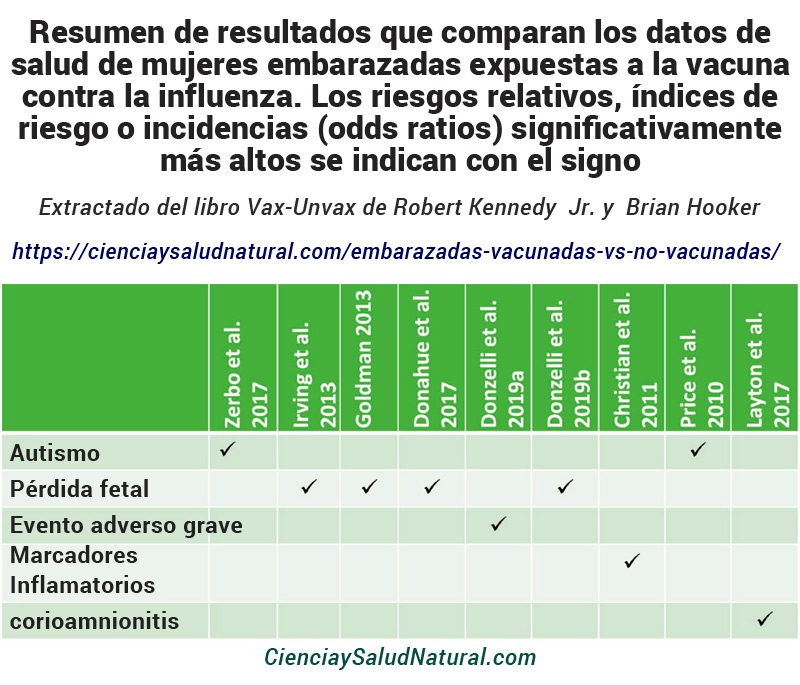
La figura 1 muestra los resultados del artículo “Asociación entre la infección por influenza y la vacunación durante el embarazo y el riesgo de trastorno del espectro autista”, publicado en la revista JAMA Pediatrics en 2017.8 El investigador principal, el Dr. Ousseny Zerbo, es de la División de Investigación en Kaiser Permanente en Oakland, California. El Dr. Zerbo y sus coautores investigaron la relación entre la infección por influenza y la vacunación durante el embarazo y el trastorno del espectro autista. Descubrieron que la vacunación contra la influenza en el primer trimestre se asocia con un mayor riesgo de TEA (autismo), con un índice de riesgo de 1,20 y un intervalo de confianza del 95% entre 1,04 y 1.39. 9
Los investigadores también observaron que la vacunación contra la gripe en cualquier trimestre se asociaba con el trastorno del espectro autista con un índice de riesgo de 1,10 y un intervalo de confianza del 95% entre 1,00 y 1,21. 10
Después de obtener estos resultados estadísticamente significativos, los investigadores aplicaron la corrección de Bonferroni, que a veces se utiliza cuando múltiples pruebas estadísticas se completan con la misma muestra de datos.
Cuando los estadísticos hacen muchas comparaciones dentro de un solo estudio, la tasa de “falsos positivos”, o la probabilidad de encontrar asociaciones que no son válidas, puede aumentar cuando las comparaciones realizadas son independientes o no están relacionadas. 11
La corrección de Bonferroni se ajusta a esto. Al utilizar erróneamente la corrección, los autores elevaron el valor de p de 0,01 a 0,1, que está por encima del umbral de significación estadística (valor de p inferior a 0,05). Luego, los investigadores afirmaron relaciones estadísticas insignificantes. Esto fue respondido por el Dr. Alberto Donzelli 12 y el Dr. Brian Hooker, 13 quienes escribieron dos cartas separadas al editor de JAMA Pediatrics en 2017. Demostraron que era inapropiado que el Dr. Zerbo 14 aplicara cualquier corrección para pruebas múltiples porque todas las asociaciones realizadas en el estudio fueron altamente interdependientes y no independientes, lo cual es necesario para su corrección.
Por ejemplo, los resultados del Dr. Zerbo para cada trimestre se resumen en un resultado total, lo que muestra interdependencia en lugar de independencia. Por lo tanto, no se aplicaría ninguna corrección por una “tasa de falsos positivos”. 15 Por lo tanto, el valor p real para el análisis fue 0,01, lo cual es estadísticamente significativo. 16
Vacuna antigripal trivalente inactivada y aborto espontáneo
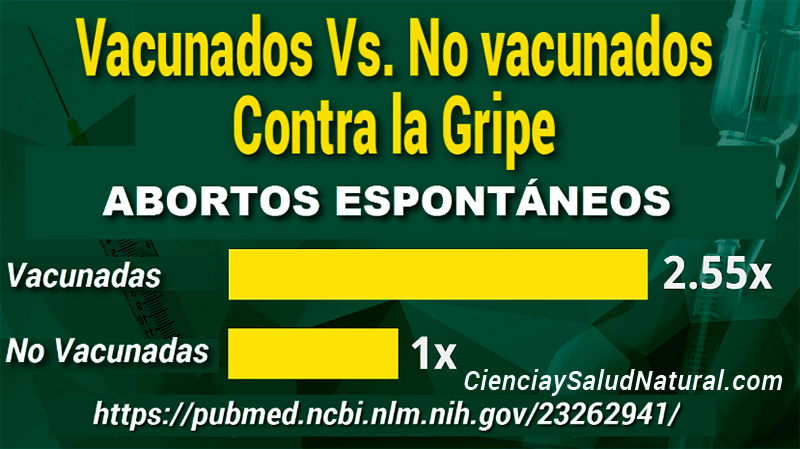
Figura 2: Relación de probabilidades de aborto espontáneo cuando reciben la vacuna contra la gripe antes de la concepción versus mujeres no vacunadas (Irving et al. 2013). https://pubmed.ncbi.nlm.nih.gov/23262941/ https://www.bitchute.com/video/UN5GiGHJ0fVS/
La figura 2 muestra los resultados del estudio “Vacuna contra la influenza trivalente inactivada y aborto espontáneo”, publicado en Obstetrics & Gynecology en 2013.17 La autora principal del estudio, Stephanie Irving, es del Centro de Investigación de Epidemiología de la Clínica Marshfield en Marshfield, Wisconsin.
Un autor colaborador del estudio es el Dr. Frank DeStefano de la Oficina de Seguridad de las Inmunizaciones de los CDC. Irving se centró en la vacuna prenatal contra la gripe y la incidencia del aborto espontáneo (spontaneous abortion, SAB), el término médico para el aborto espontáneo, entre las cinco y dieciséis semanas de gestación, cuando la vacuna se administró durante el primer trimestre del embarazo.
Los investigadores no observaron un aumento en los abortos espontáneos en mujeres que fueron vacunadas prenatalmente en comparación con mujeres no vacunadas. Sin embargo, encontraron que las mujeres que recibieron la vacuna contra la gripe antes de la concepción experimentaron un aumento estadísticamente significativo. En este caso, las mujeres vacunadas tenían 2,55 veces más probabilidades de sufrir un aborto espontáneo que las mujeres no vacunadas (p-valor < 0,10 y un IC del 95% de 0,86 a 6,33). 18
Este resultado es marginalmente significativo y merece un análisis más detallado. En el estudio, 22 casos de aborto espontáneo y 11 controles recibieron la vacuna contra la influenza antes de la concepción, y una proporción estadísticamente significativa de los casos recibió la vacuna dentro de los siete días posteriores a la concepción. 19 A diferencia de otros estudios sobre la vacuna contra la gripe 20 , 21 Irving no consideró el efecto de la vacunación contra la gripe en temporadas de gripe anteriores. 22
Comparación de los informes de pérdida fetal reportadas en VAERS durante tres temporadas consecutivas de influenza: ¿Hubo una toxicidad fetal sinérgica asociada con la temporada de dos vacunas 2009/2010?
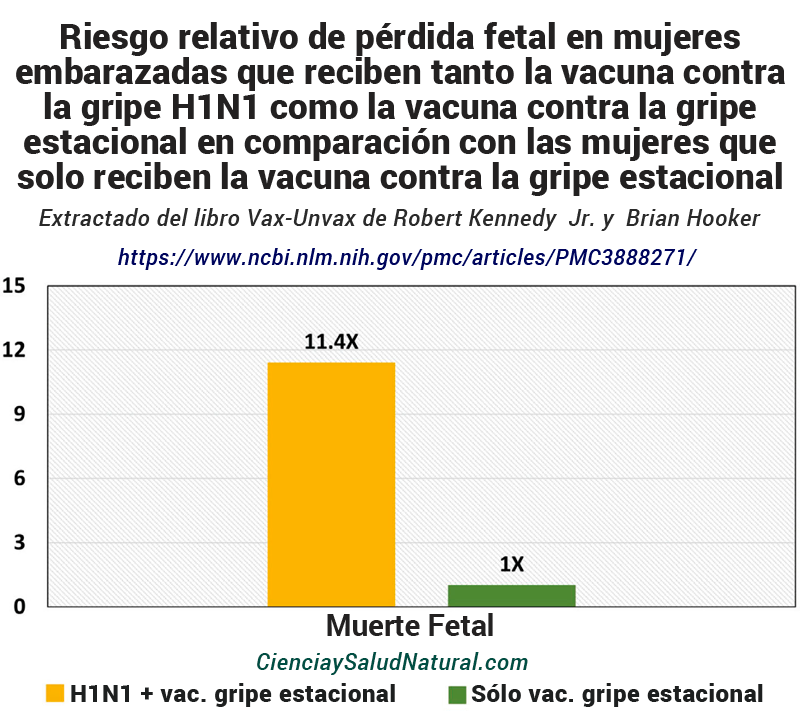
Figura 3: Riesgo relativo de pérdida fetal en mujeres embarazadas que reciben tanto la vacuna contra la gripe H1N1 como la vacuna contra la gripe estacional en comparación con las mujeres que recibieron solo la vacuna contra la gripe estacional (Goldman 2013). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3888271/
La figura 3 muestra los resultados del artículo “Comparación de informes de pérdida fetal del VAERS durante tres temporadas consecutivas de influenza: ¿Hubo una toxicidad fetal sinérgica asociada con las dos vacunas 2009/2010?” publicado en la revista Human and Experimental Toxicology en 2013 ( “Comparison of VAERS Fetal-
Loss Reports during Three Consecutive Influenza Seasons: Was There a Synergistic Fetal Toxicity Associated with the Two-Vaccine 2009/2010 Season?”). 23
El autor del estudio, el Dr. Gary Goldman, es un científico informático independiente que reside en Pearblossom, California. Goldman examinó las tasas de pérdida fetal durante tres temporadas de gripe consecutivas. Según VAERS, las tasas de pérdida fetal no ajustadas entre 2008 y 2009 fueron de 6,8 por millón de embarazos, con un intervalo de confianza del 95% de 0,1 a 13,1. 24 De 2009 a 2010, las tasas aumentaron a 77,8 por millón de embarazos con un intervalo de confianza del 95% de 66,3 a 89,4, y de 2010 a 2011, la tasa fue de 12,6 con un Intervalo de confianza del 95% de 7,2 a 18,0. 25
Durante la temporada 2009 a 2010, en la que los investigadores observaron un dramático aumento de once veces en la pérdida fetal, muchas mujeres embarazadas recibieron dos vacunas contra la gripe, la vacuna contra la gripe estacional, muchas de las cuales contenían 25 microgramos de mercurio procedente del timerosal, y la vacuna contra la gripe pandémica H1N1, que también incluía 25 microgramos de mercurio procedente del timerosal. 26
Por el contrario, las mujeres embarazadas recibieron solo la vacuna contra la gripe estacional de 2008 a 2009, y de 2010 a 2011 recibieron una única vacuna “combinada”. Además, entre 2008 y 2009, sólo el 11,3% de las mujeres embarazadas recibieron la vacuna contra la gripe estacional, mientras que entre 2009 y 2010, un 43% recibió la vacuna contra la gripe H1N1. De 2010 a 2011, el 32% recibió la vacuna combinada. 27 Goldman sugirió que este aumento de once veces en la pérdida fetal puede deberse a recibir una dosis adicional de timerosal en la vacuna contra el H1N1. 28
Asociación del aborto espontáneo con la recepción de la vacuna inactivada contra la influenza que contiene H1N1pdm09 en 2010–11 y 2011–12
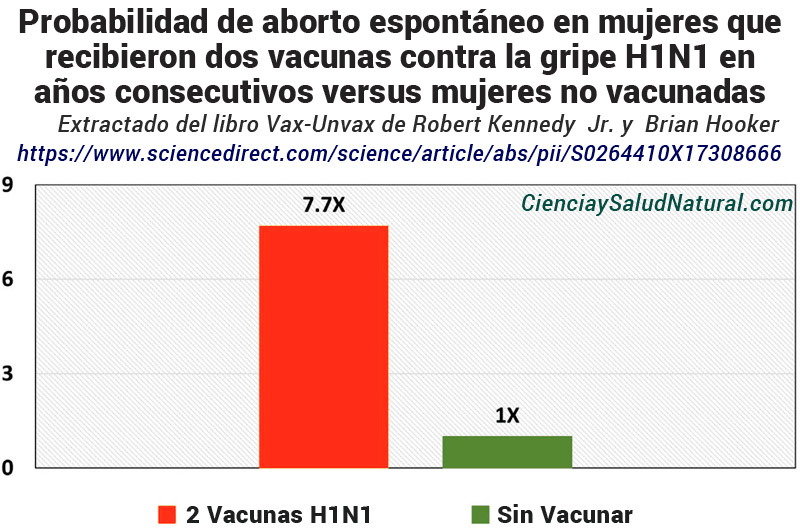
La figura 4 muestra los resultados del artículo “Association of Spontaneous Abortion with Receipt of Inactivated Influenza Vaccine Containing H1N1pdm09 in 2010-11 and 2011-12”, publicado en la revista Vaccine en 2017. 29 El autor principal, el Dr. James Donahue, es epidemiólogo principal del Instituto de Investigación Clínica Marshfield en Marshfield, Wisconsin. . La Oficina de Seguridad de las Inmunizaciones de los CDC colaboró con los investigadores de la Clínica Marshfield en este esfuerzo. En este estudio, las mujeres que recibieron la vacuna H1N1 tuvieron un odds ratio de 2,0 de pérdida fetal dentro de los 28 días posteriores a la vacunación en cualquiera de las dos “temporadas de gripe” 2010-2011 y 2011-2012, con un intervalo de confianza del 95% de 1,1 a 2,0. 3,6, en comparación con las mujeres embarazadas que no recibieron la vacuna dentro del período de exposición de 28 días. 30 La razón de probabilidades para las mujeres que recibieron la vacuna pH1N1 durante la temporada anterior aumentó a 7,7 con un intervalo de confianza del 95% de 2,2 a 27,3. 31
Figura 4: Relación de probabilidades de aborto espontáneo en mujeres que recibieron dos vacunas contra la gripe H1N1 en años consecutivos versus mujeres no vacunadas (Donahue et al. 2017).
En un estudio de seguimiento, Donahue investigó el riesgo de aborto espontáneo debido a la vacuna contra la gripe estacional. 32 Los autores del estudio no vieron ningún efecto estadísticamente significativo. Sin embargo, el estudio no tuvo suficiente poder estadístico debido a la pequeña cohorte de mujeres observada. Consistentemente, los investigadores utilizaron menos de 100 pares de casos y controles para el análisis combinado de tres temporadas de influenza y obtuvieron algunos resultados para temporadas individuales a partir de tan solo 11 pares de casos y controles. Además, los investigadores completaron un análisis de poder como parte de este estudio, que es un análisis de cuánto poder estadístico posee el estudio para encontrar una asociación. En este estudio, la probabilidad de ocurrencia mínima que que se pudo detectar con certeza estadística fue un 3,5. 33 La probabilidad de ocurrencia informada en los resultados de este estudio estaban todos por debajo de 2,0. 34 Por lo tanto, si esto representaba un aumento real en la tasa de abortos espontáneos debido a la vacunación contra la influenza, este estudio no pudo capturarlo, lo que hace que todo el análisis carezca de sentido.
Vacunación contra la influenza en mujeres embarazadas y eventos adversos graves en la descendencia
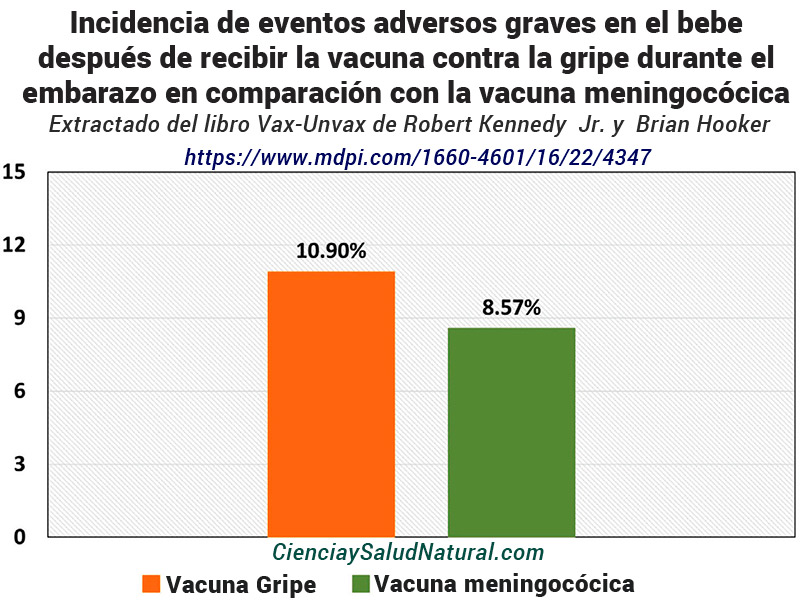
La figura 5 muestra los resultados del artículo “Vacunación contra la influenza en mujeres embarazadas y eventos adversos graves en la descendencia”, publicado en la Revista Internacional de Investigación Ambiental y Salud Pública en 2019.35 El Dr. Alberto Donzelli, autor del artículo, es de el Comité Científico de la Fondazione Allineare Sanità e Salute en Milán, Italia. En este artículo, volvió a analizar datos de cuatro ensayos controlados aleatorios (ECA) que estudiaron la vacuna materna contra la influenza. Donzelli demostró que las mujeres embarazadas que recibieron la vacuna contra la gripe tenían una mayor incidencia de eventos adversos graves (EAG) que las mujeres que recibieron la vacuna meningocócica. En un ECA realizado por Tapia et al., al comparar una vacuna trivalente contra la influenza con virus inactivados (prueba) versus una vacuna meningocócica (control), 36 Donzelli calcularon el total de EAG en 225 o 10,90 % y 175 o 8,57 % para los grupos vacunados y “control”, respectivamente. 37 A partir de esto, el Dr. Donzelli obtuvo un riesgo relativo de 1,27 en el grupo de la vacuna contra la gripe con un IC del 95% de 1,05 a 1,53, que fue estadísticamente significativo. 38 El número de vacunas administradas “necesarias para dañar” a un solo individuo fue 42,98. 39 Recordemos que los ECA son el “estándar de oro” de los estudios clínicos .
Figura 5—Incidencia de eventos adversos graves después de recibir la vacuna contra la gripe durante el embarazo en comparación con la vacuna meningocócica (Donzelli et al. 2019a). https://www.mdpi.com/1660-4601/16/22/4347
Los investigadores del ECA, ensayo controlado aleatorizado (en inglés, randomized controlled trial, RCT) original enterraron estos datos en un suplemento de su artículo científico. El resumen del artículo informó un aumento estadísticamente significativo en la infección neonatal en el grupo vacunado contra la influenza, con un valor de p igual a 0,02. 40 Sin embargo, como observó Donzelli, los autores del estudio RCT omitieron mencionar que también encontraron eventos adversos graves además de las infecciones neonatales. Estos investigadores tampoco lograron señalar que el total de abortos espontáneos fue significativamente mayor en el grupo vacunado contra la influenza. 41
No es evidente por qué los investigadores del ensayos controlados aleatorios (ECA) original administraron al grupo de control la vacuna meningocócica que no se recomienda para mujeres embarazadas en lugar de un placebo de solución salina inerte. Desafortunadamente, esta elección garantizó que el ensayo no arrojaría un perfil de seguridad preciso para la vacuna trivalente contra la influenza con virus inactivados en mujeres embarazadas. El hecho de que los diseñadores del ensayo hicieran esa elección puede indicar que creían que el número de eventos adversos graves sería inaceptablemente alto en comparación con un verdadero control con placebo.
¿Vacunación contra la influenza para todas las mujeres embarazadas? Hasta ahora, la evidencia menos sesgada no lo favorece
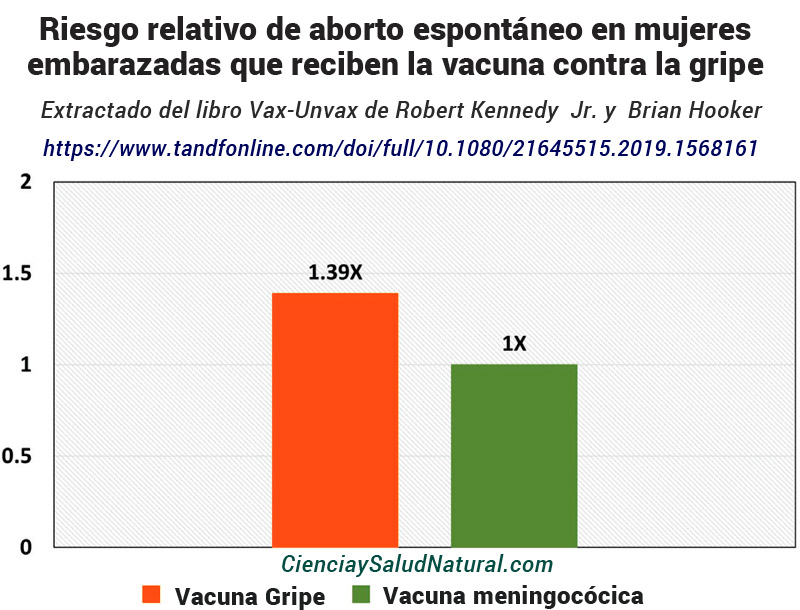
La figura 6 muestra los resultados del artículo “¿Vacunación contra la influenza para todas las mujeres embarazadas? So Far the Less Biased Evidence Does Not Favor It”, publicado en la revista Human Vaccines & Immunotherapeutics en 2019.42 El autor de este artículo, el Dr. Alberto Donzelli, continuó reanalizando el ensayo controlado aleatorio (ECA) completado por Tapia et al. . En este ECA, las mujeres del grupo de la vacuna contra la gripe experimentaron 52 abortos espontáneos frente a las mujeres del grupo de control (la vacuna meningocócica), que experimentaron 37 abortos espontáneos. 43 Esto dio un riesgo relativo marginalmente significativo de 1,39 de aborto espontáneo en el grupo vacunado contra la influenza (valor de p = 0,122 y un IC del 95% de 0,92 a 2,11). 44
Figura 6—Incidencia de aborto espontáneo en mujeres embarazadas que reciben la vacuna contra la gripe versus la vacuna meningocócica (Donzelli et al. 2019b).
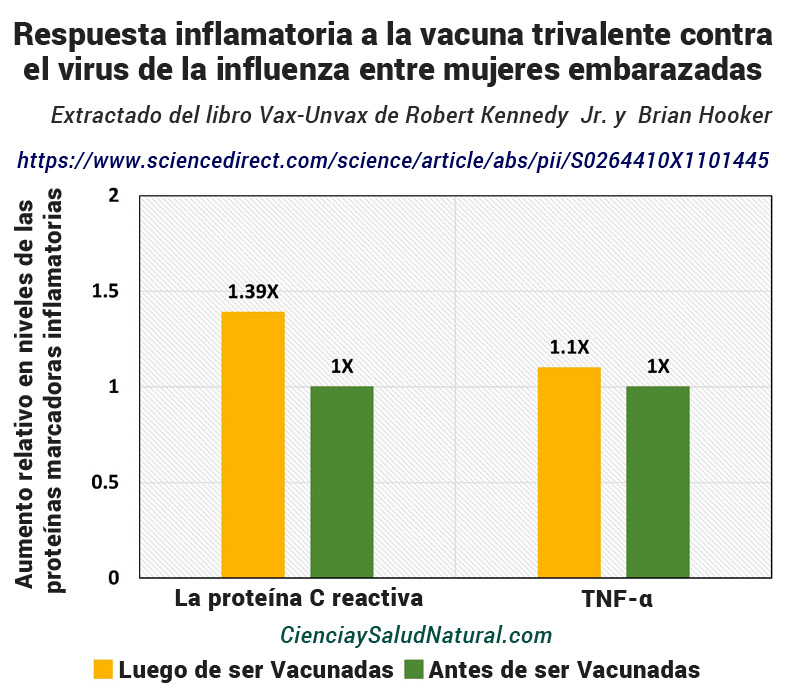
La figura 7 muestra los resultados del artículo “Respuesta inflamatoria a la vacuna trivalente contra el virus de la influenza entre mujeres embarazadas”, publicado en Vaccine en 2011.45 La autora principal es la Dra. Lisa Christian, afiliada al Departamento de Psiquiatría, el Instituto de Salud del Comportamiento. Investigación Médica, el Departamento de Psicología y el Departamento de Obstetricia y Ginecología de los Centros Médicos de la Universidad Estatal de Ohio en Columbus. Los resultados adversos del embarazo, como la preeclampsia y el parto prematuro, se asocian con niveles más altos de inflamación. 46 En consecuencia, las mujeres embarazadas que recibieron la vacuna trivalente contra la influenza con virus inactivados mostraron aumentos en la proteína C reactiva con un valor de p inferior a 0,05 y en el factor de necrosis tumoral α (TNF-α) con un valor de p equivalente a 0,06 dos días después de la vacunación. 47
Respuesta inflamatoria a la vacuna trivalente contra el virus de la influenza entre mujeres embarazadas
Figura 7: Aumentos en las proteínas marcadoras inflamatorias en mujeres embarazadas después de la vacunación contra la influenza en comparación con antes de la vacunación (Christian et al. 2011). https://www.sciencedirect.com/science/article/abs/pii/S0264410X11014459
La proteína C reactiva y el TNF-α son marcadores inflamatorios; los valores altos indican altos niveles de inflamación en el cuerpo. Los marcadores inflamatorios elevados se consideran normales cuando el cuerpo combate una infección aguda. Aún así, pueden indicar una afección crónica, como una enfermedad autoinmune, si persisten altos niveles de inflamación. Los autores del estudio señalaron que los aumentos observados probablemente fueron menores que los asociados con la infección por influenza. 48 Sin embargo, los parámetros inflamatorios investigados en este estudio variaron sustancialmente de persona a persona. 49 Esto conlleva el riesgo de la relación beneficio-beneficio de la vacunación contra la influenza durante el embarazo está en duda, especialmente a nivel individual, dada la posible gravedad de los resultados adversos asociados con la inflamación.
La figura 8 muestra los resultados del artículo “Prenatal and Infant Exposure to Timerosal from Vaccines and Immunoglobulins and Risk of Autism”, publicado en Pediatrics en 2010. 50 Cristopher Price, epidemiólogo de Abt Associates en Cambridge, Massachusetts, es el autor principal. . El autor correspondiente es el Dr. Frank DeStefano, ex director de la Oficina de Seguridad de las Inmunizaciones de los CDC en Atlanta, Georgia. Los autores del estudio investigaron los efectos de la exposición durante el embarazo al timerosal de las vacunas contra la influenza o de la inmunoglobulina administrada a madres Rh negativas (p. ej., RhoGAM). Calcularon una exposición prenatal media en la cohorte del estudio de aproximadamente dos a tres microgramos, ya que la mayoría de las mujeres no recibieron ni la vacuna contra la gripe ni la inmunoglobulina anti-rhoD. 51
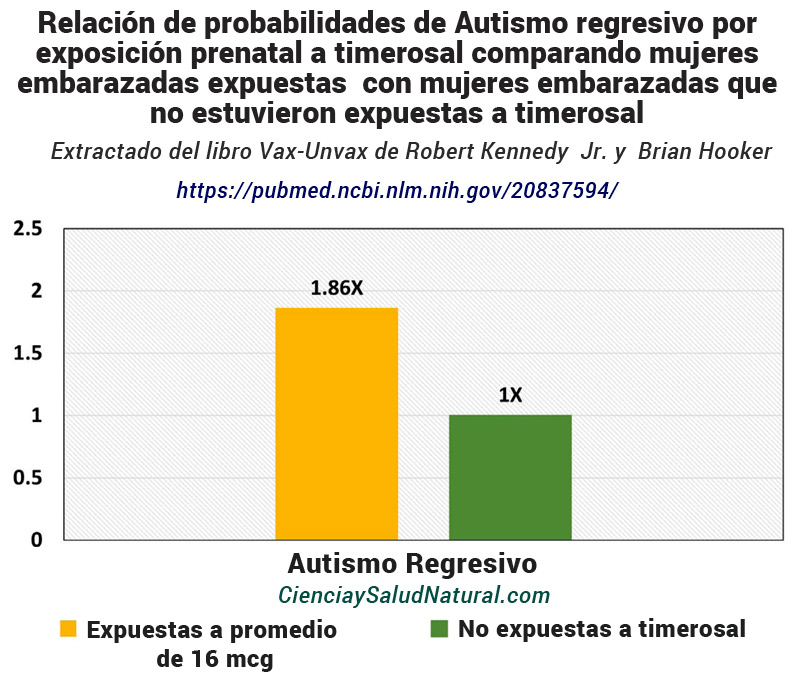
Exposición prenatal e infantil al timerosal procedente de vacunas e inmunoglobulinas y riesgo de autismo
Figura 8: Relación de probabilidades de TEA regresiva por exposición prenatal a timerosal comparando mujeres embarazadas expuestas a un promedio de 16 microgramos de timerosal con mujeres embarazadas que no estuvieron expuestas a timerosal (Price et al. 2010). https://pubmed.ncbi.nlm.nih.gov/20837594/
Los investigadores utilizaron una diferencia de dos desviaciones estándar de exposición, o aproximadamente 16,34 microgramos de mercurio respecto del timerosal como umbral para el análisis. 52 Desafortunadamente, esta es una métrica artificial, dado que la dosis estándar de mercurio procedente del timerosal en una sola vacuna contra la gripe es de 25 microgramos. 53 No obstante, los autores del estudio informaron una relación marginalmente significativa entre la exposición prenatal al timerosal y el trastorno regresivo del espectro autista con un odds ratio de 1,86 y un intervalo de confianza del 95% entre 0,945 y 3,660. 54
En particular, en los estudios de antecedentes que llevaron a esta publicación, los investigadores ejecutaron seis variaciones diferentes del modelo para la exposición prenatal al timerosal y el trastorno regresivo del espectro autista. 55 En dos de los análisis, los investigadores encontraron resultados estadísticamente muy significativos. En los cuatro análisis restantes, los investigadores vieron estadísticamente marginalmente resultados significativos. Desafortunadamente, los CDC sólo destacaron un resultado marginalmente significativo y ocultaron un resultado muy significativo en el informe del estudio original, “Thimerosal y autismo” (por Abt Associates), en las páginas 194 y 20 , 197 . 56 Los CDC no han completado un estudio de seguimiento sobre este resultado y continúan negando un papel entre la exposición al timerosal y el autismo.
Evaluación de la asociación de la vacunación materna contra la tos ferina con eventos obstétricos y resultados del parto
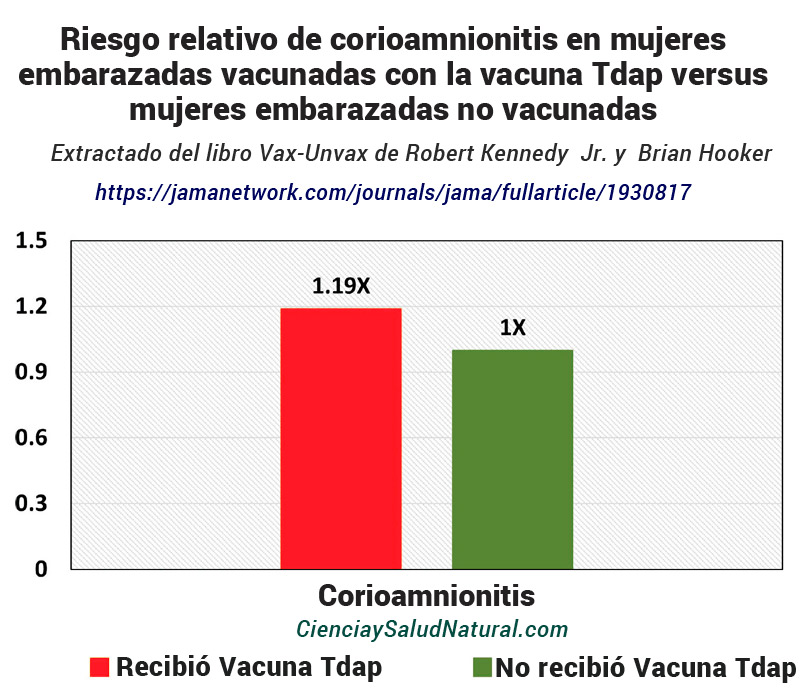
Figura 9—Riesgo relativo de corioamnionitis en mujeres embarazadas vacunadas con la vacuna Tdap versus mujeres embarazadas no vacunadas (Kharbanda et al. 2014). https://jamanetwork.com/journals/jama/fullarticle/1930817
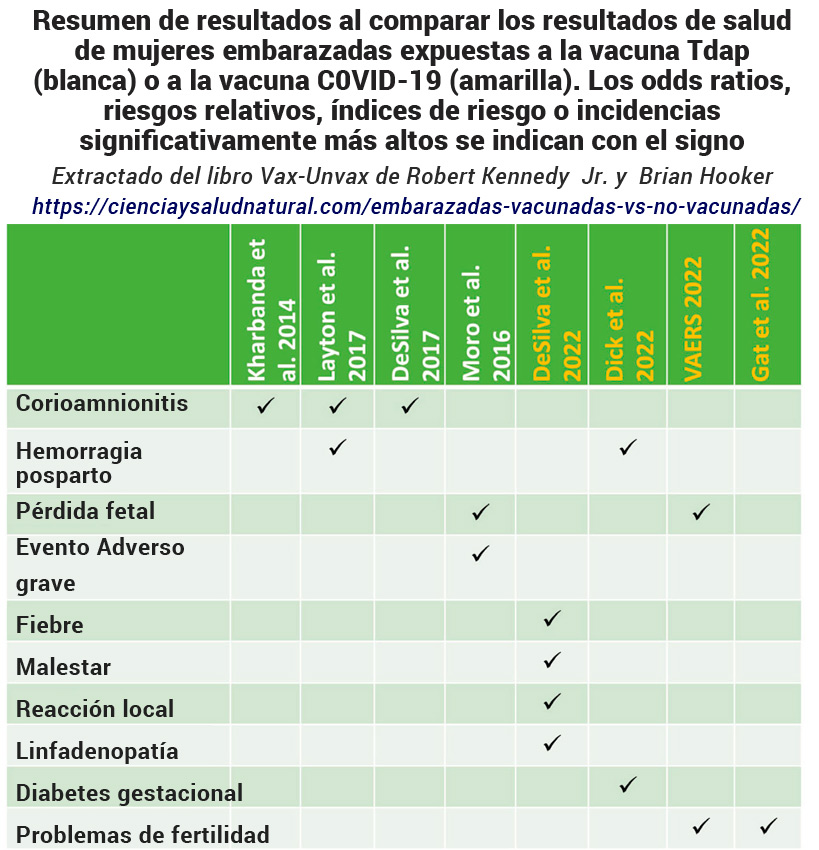
La figura 9 muestra los resultados del artículo “Evaluación de la asociación de la vacunación materna contra la tos ferina con eventos obstétricos y resultados del nacimiento”, publicado en el Journal of the American Medical Association en 2014. 57 La autora principal es la Dra. Elyse Kharbanda, afiliada al Instituto HealthPartners para la Educación y la Investigación en Minneapolis, Minnesota. Los CDC financiaron el estudio. Kharbanda utilizó el enlace de datos sobre seguridad de las vacunas de los CDC para evaluar los resultados del embarazo en mujeres que recibieron la vacuna materna Tdap recomendada. Entre las mujeres que recibieron la Tdap en cualquier momento durante el embarazo, el 6,1% experimentó corioamnionitis, en comparación con sólo el 5,5% de las mujeres que no fueron inoculadas con la vacuna Tdap. 58 Al tener en cuenta otras vacunas durante el embarazo, las mujeres vacunadas con Tdap tuvieron una elevación estadísticamente significativa en el riesgo relativo de corioamnionitis de 1,19 y un intervalo de confianza del 95% de 1,13 a 1,26. 59
La corioamnionitis, inflamación de la membrana que encapsula al feto en el útero, es una afección peligrosa asociada predominantemente con infecciones bacterianas en la madre y el feto o en ambos, que pueden provocar un parto prematuro o una muerte fetal. 60
Vacunación prenatal Tdap y riesgo de eventos adversos maternos y neonatales
Figura 10—Probabilidades de riesgo de corioamnionitis en mujeres embarazadas que reciben la vacuna Tdap de manera óptima o temprana versus mujeres embarazadas no vacunadas (Layton et al. 2017). https://linkinghub.elsevier.com/retrieve/pii/S0264410X1730868X
La figura 10 muestra los resultados del artículo “Prenatal Tdap Immunization and Risk of Maternal and Newborn Adverse Events”, publicado en Vaccine en 2017. 61 El Dr. J. Bradley Layton, el autor principal, es del Departamento de Epidemiología de la Universidad de Carolina del Norte en Chapel Hill. En un gran estudio de cohorte de mujeres embarazadas estadounidenses, Layton encontró una relación estadísticamente significativa entre la corioamnionitis y las madres vacunadas óptimamente (a las 27 semanas de edad gestacional o después) con la vacuna Tdap, con un índice de riesgo de 1,11 y un intervalo de confianza del 95% de 1,07 a 1,15 cuando en comparación con aquellos que no recibieron la vacuna prenatal Tdap. 62 Aquellas madres que recibieron la vacuna Tdap tempranamente (antes de las 27 semanas de edad gestacional) mostraron un índice de riesgo de 1,19 y un intervalo de confianza del 95% de 1,11 a 1,28 en comparación con aquellas que no recibieron la vacuna Tdap prenatal. 63 Los autores no ajustaron su análisis para tener en cuenta a las mujeres que recibieron la vacuna contra la influenza durante el embarazo. Aproximadamente el 50% de las mujeres reciben la vacuna Tdap durante el embarazo también recibieron la vacuna contra la influenza, mientras que sólo el 18% de las mujeres que no recibieron la vacuna Tdap durante el embarazo recibieron la vacuna contra la influenza.
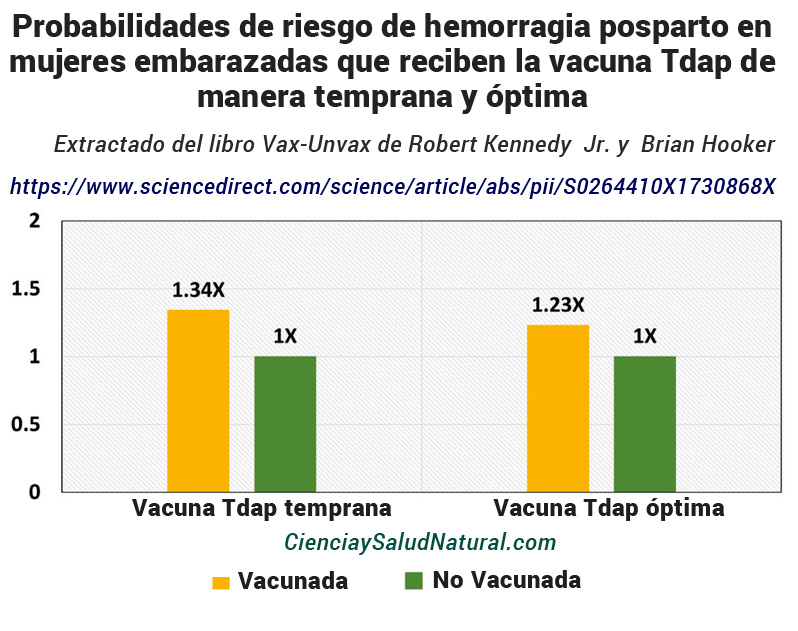
La figura 11 también muestra los resultados del artículo “Prenatal Tdap Immunization and Risk of Maternal and Newborn Adverse Events”, publicado en la revista Vaccine en 2017.64 Layton , el autor principal, informó una mayor incidencia de hemorragia posparto asociada con vacunación temprana Tdap (antes de las 27 semanas de gestación), con un riesgo relativo de 1,34 y un intervalo de confianza del 95% de 1,25 a 1,44. 65 Aquellas madres que recibieron la Tdap de manera óptima (después de las 27 semanas de gestación) mostraron un índice de riesgo de 1,23 y un intervalo de confianza del 95% de 1,18 a 1,28 en comparación con aquellas que no recibieron la vacuna Tdap prenatal. 66 Para dar una idea de la magnitud del tipo de problema identificado en este estudio, este índice de riesgo daría como resultado 29.000 casos adicionales de hemorragia posparto por año en los EE. UU. si todas las mujeres embarazadas recibieran la vacuna Tdap.
Figura 11 Probabilidades de riesgo de hemorragia posparto en mujeres embarazadas que reciben la vacuna Tdap de manera temprana y óptima versus mujeres embarazadas no vacunadas (Layton et al. 2017). https://www.sciencedirect.com/science/article/abs/pii/S0264410X1730868X
Vacunación materna Tdap y riesgo de morbilidad infantil
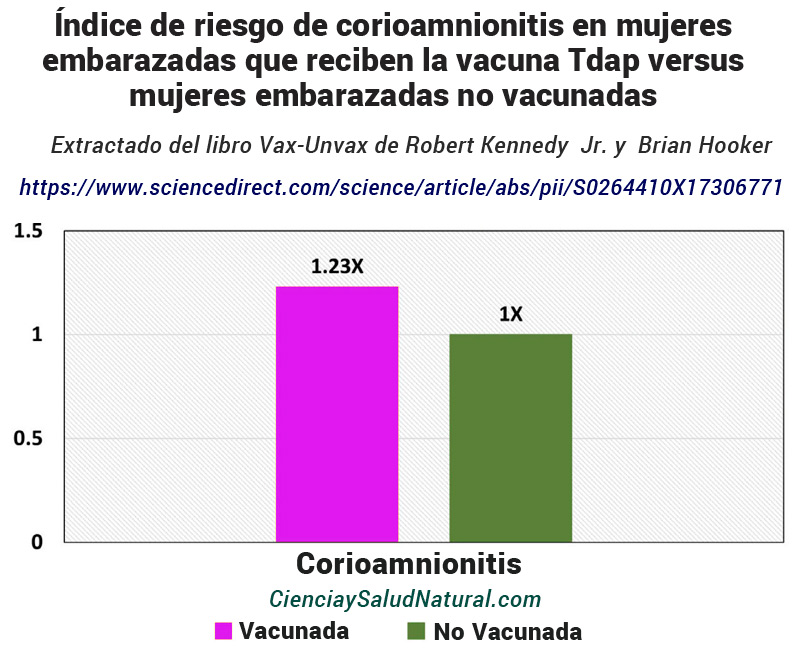
La figura 12 muestra los resultados del documento “Maternal Tdap
Figura 12: Índice de riesgo de corioamnionitis en mujeres embarazadas que reciben la vacuna Tdap versus mujeres embarazadas no vacunadas (DeSilva et al. 2017). https://www.sciencedirect.com/science/article/abs/pii/S0264410X17306771
Vaccination and Risk of Infant Morbidity”, publicado en la revista Vaccine en 2017. 67 La autora principal, la Dra. Malini DeSilva, está afiliada a HealthPartners en Minneapolis, Minnesota. Los CDC financiaron directamente este estudio y proporcionaron datos del Vaccine Safety Datalink. Dentro de una cohorte de casi 200.000 mujeres embarazadas, DeSilva afirmó una mayor tasa de corioamnionitis en mujeres embarazadas que recibieron Tdap, con un índice de tasas ajustado de 1,23 y un intervalo de confianza del 95% de 1,17 a 1,28. 68
Vigilancia mejorada de las vacunas con toxoide tetánico, toxoide diftérico reducido y tos ferina acelular (Tdap) durante el embarazo en el Sistema de notificación de eventos adversos a las vacunas (VAERS), 2011-2015
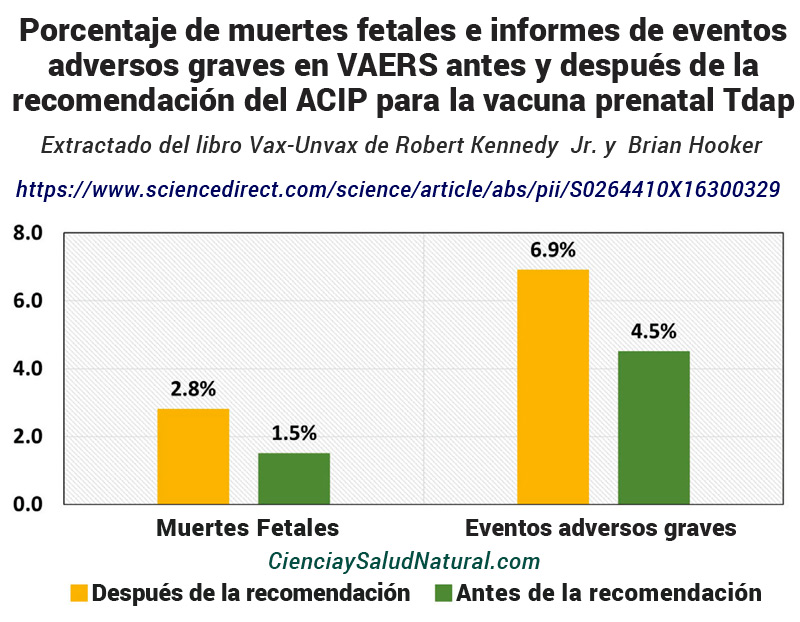
Figura 13—Porcentaje de muertes fetales y informes de eventos adversos graves en VAERS antes y después de la recomendación del ACIP para la vacuna prenatal Tdap (Moro et al. 2016). https://www.sciencedirect.com/science/article/abs/pii/S0264410X16300329
La figura 13 muestra los resultados del artículo “Supervisión mejorada de las vacunas con toxoide tetánico, toxoide diftérico reducido y tos ferina acelular (Tdap) durante el embarazo en el sistema de notificación de eventos adversos de las vacunas (VAERS), 2011-2015”, publicado en la revista Vaccine. en 2016. 69 El autor principal, el Dr. Pedro Moro, es epidemiólogo de la Oficina de Seguridad de Inmunizaciones de los CDC. Moro comparó los informes del VAERS sobre los efectos adversos del embarazo antes y después de que el Comité Asesor sobre Prácticas de Inmunización (ACIP) de los CDC recomendara administrar la vacuna Tdap durante el tercer trimestre del embarazo. Los autores del estudio observaron un aumento en los informes de muertes fetales del 1,5 % al 2,8 % de todos los embarazos, así como un aumento en los eventos adversos graves del 4,5 % al 6,9 %. 70 Desafortunadamente, los autores del estudio descartaron estos hallazgos “dado el uso más amplio de la Tdap en mujeres embarazadas en el tercer trimestre” y basándose en limitaciones incorporadas del VAERS, “subnotificación, sesgos en la presentación de informes e inconsistencia en la calidad de los informes”. 71
Evaluación de eventos adversos agudos después de la vacunación COVID-19 durante el embarazo
Figura 14—Reacciones locales y sistémicas después de la vacunación contra el C0VID-19 en mujeres embarazadas en comparación con mujeres embarazadas no vacunadas (DeSilva et al. 2022). https://www.nejm.org/doi/10.1056/NEJMc2205276
La figura 14 muestra los resultados del artículo “Evaluación de eventos adversos agudos después de la vacunación contra la COVID-19 durante el embarazo”, publicado en el New England Journal of Medicine en 2022. 72 La Dra. Malini DeSilva es la autora principal del HealthPartners Institute en Bloomington, Minnesota. Los CDC apoyaron financieramente esta investigación. Los ensayos clínicos no probaron específicamente las vacunas contra el COVID-19 utilizadas en los Estados Unidos en mujeres embarazadas. El prospecto de la vacuna Comirnaty lo deja muy claro. 73 Sin embargo, los CDC recomiendan la vacuna COVID-19 “para personas que están embarazadas, amamantando, que intentan quedar embarazadas ahora o que podrían estarlo” embarazada en el futuro”. 74 Las mujeres embarazadas que recibieron la vacuna contra la COVID-19, en comparación con mujeres embarazadas no vacunadas, tenían 2,85 veces más probabilidades de experimentar fiebre (IC del 95 % de 1,76 a 4,61), 2,24 veces más probabilidades de experimentar malestar o fatiga (IC del 95 % de 1,71 a 2,93), 1,89 veces más probabilidades de sufrir reacciones locales (IC del 95% de 1,33 a 2,68), y 2,16 veces más probabilidades de experimentar linfadenopatía (nódulos linfáticos inflamados) (IC del 95%: 1,42 a 3,28). 75 Los autores del estudio siguieron a la cohorte durante 42 días después de la vacunación, lo que impidió la evaluación de eventos adversos a largo plazo.
Seguridad de la tercera inyección contra el SARS-CoV-2 (dosis de refuerzo) durante el embarazo
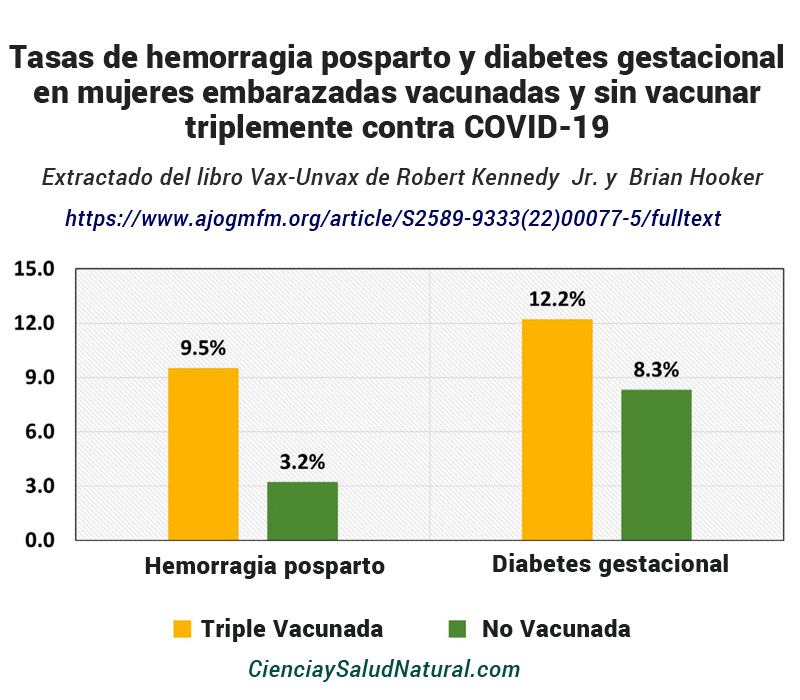
La figura 15 muestra los resultados del artículo “Seguridad de la tercera vacuna contra el SARS-CoV-2 (dosis de refuerzo) durante el embarazo”, publicado en el American Journal of Obstetrics and Gynecology en 2022.76 El autor principal, el Dr. Aharon Dick, es de el Departamento de Obstetricia y Ginecología, Organización Médica Hadassah y Facultad de Medicina, Universidad Hebrea de Jerusalén en Israel. Los investigadores examinaron a 5.618 mujeres embarazadas, 2.305 que estaban vacunadas y 3.313 que no estaban vacunadas. Dentro del estudio, las mujeres embarazadas completamente vacunadas y reforzadas (es decir, triplemente vacunadas) con la vacuna Pfizer BNT162b2 o Moderna mRNA-1273 COVID-19 tenían tres veces más probabilidades de experimentar hemorragia posparto (sangrado abundante después de dar a luz) que mujeres embarazadas no vacunadas (valor p < 0,001). 77 Además, los médicos diagnosticaron a las mujeres embarazadas triplemente vacunadas con diabetes gestacional (nivel alto de azúcar en sangre) 1,5 veces más a menudo que a las mujeres embarazadas no vacunadas (valor p = 0,02). 78 La diabetes gestacional puede aumentar el riesgo de presión arterial alta durante el embarazo y provocar complicaciones en el trabajo de parto y el parto, así como parto prematuro. 79
Figura 15—Tasas de hemorragia posparto y diabetes gestacional en mujeres embarazadas con y sin vacunar triplemente contra la COVID-19 (Dick et al. 2022). https://www.ajogmfm.org/article/S2589-9333(22)00077-5/fulltext
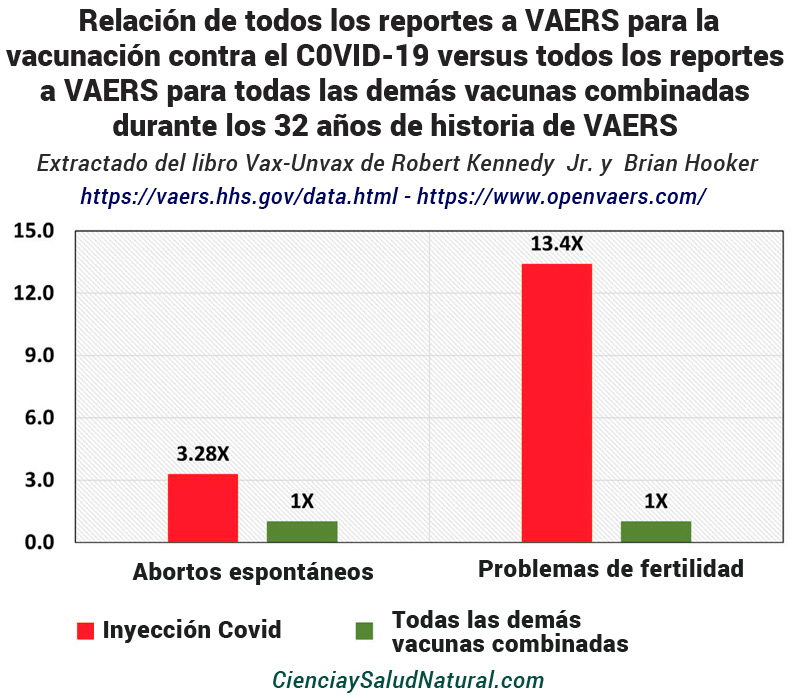
La figura 16 muestra los resultados de un análisis no publicado del Sistema de Notificación de Eventos Adversos a las Vacunas de los CDC. 80 Desde la introducción de la primera vacuna contra el COVID-19 en diciembre de 2020, profesionales y pacientes han presentado 3.576 informes de abortos espontáneos debido a las inyecciones de COVID-19. 81 Esto contrasta marcadamente con 1.089 informes de aborto espontáneo para todas las demás vacunas durante los 32 años de historia del VAERS. Además, las personas también han presentado 19.040 informes de trastornos de fertilidad después de recibir la vacuna COVID-19, frente a 1.423 informes de este tipo para todas las demás vacunas durante los 32 años de historia del VAERS. 82 Completamos estos análisis utilizando informes VAERS actualizados al 7 de abril de 2023.
Análisis VAERS de la vacunación COVID-19 en mujeres embarazadas
Figura 16: Relación de todos los informes del VAERS para la vacunación contra el C0VID-19 versus todos los informes del VAERS para todas las demás vacunas combinadas durante los 32 años de historia del VAERS (al 7 de abril de 2023).
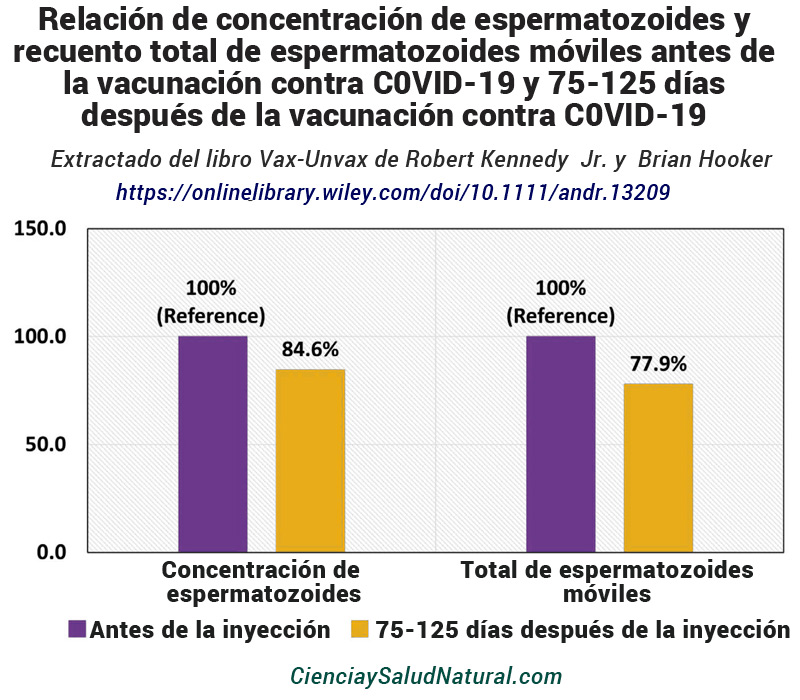
La figura 17 muestra los resultados del artículo “La vacunación contra la COVID-19 BNT162b2 afecta temporalmente la concentración de semen y el recuento móvil total entre los donantes de semen”, publicado en la revista Andrology en 2022.83 El autor principal, el Dr. Itai Gat, está afiliado a la Banco de Semen y Unidad de Andrología del Centro Médico Shamir en Tzrifin, Israel. La concentración de esperma en el semen de donantes masculinos se redujo en un 15,4% desde antes de la vacunación hasta 75-125 días después de la vacunación (valor de p = 0,01 y un IC del 95% de -25,5 a 3,9%). 84 Además, el recuento total de espermatozoides móviles disminuyó un 22,1 % durante el mismo período (valor de p = 0,007 y un IC del 95 % de -35,0 a 6,6). 85 Estas reducciones fueron estadísticamente significativas. Tanto la concentración de espermatozoides como el recuento total de espermatozoides móviles se mantuvieron a un ritmo reducido después de 150 días, con disminuciones del 15,9% y el 19,4%, respectivamente. 86 Sin embargo, estos resultados no fueron estadísticamente significativos debido a la alta variabilidad en las mediciones y a un menor número de sujetos que proporcionaron muestras. Debido a esto reducido poder estadístico, la afirmación de los autores de que la recuperación de los parámetros del semen fue evidente después de 150 días tampoco está respaldada.
La vacuna COVID-19 BNT162b2 afecta temporalmente la concentración de semen y el recuento móvil total entre los donantes de semen
Figura 17: Relación de concentración de espermatozoides y recuento total de espermatozoides móviles antes de la vacunación contra C0VID-19 y 75-125 días después de la vacunación contra C0VID-19 (Gat et al. 2022). https://onlinelibrary.wiley.com/doi/10.1111/andr.13209
Resumen
La pérdida fetal se asocia con la vacunación contra la influenza en casos específicos en cuatro de los artículos citados en este capítulo. Irving encontró una asociación cuando los profesionales administraron la vacuna contra la gripe antes de la concepción. 87 Goldman 88 y Donahue 89 observaron asociaciones con la vacuna H1N1, y Donzelli 90 informaron asociaciones con la vacuna trivalente inactivada. Zerbo vinculó la vacunación contra la influenza con el trastorno del espectro autista en la descendencia. 91 Price también observó esa relación al observar exposición al timerosal a través de la vacuna contra la influenza y la inmunoglobulina anti-RhoD administradas durante el embarazo. 92 Los investigadores informaron eventos adversos graves 93 , aumento de los marcadores inflamatorios (proteína C reactiva y TNF-α), 94 y corioamnionitis en cada estudio destacado. 95
Tabla 18 – Resumen de resultados que comparan los resultados de salud de mujeres embarazadas expuestas a la vacuna contra la influenza. Los odds ratios, riesgos relativos, índices de riesgo o incidencias significativamente más altos se indican con ✓.
Tabla 19 – Resumen de resultados al comparar los resultados de salud de mujeres embarazadas expuestas a la vacuna Tdap (blanca) o a la vacuna C0VID-19 (amarilla). Los odds ratios, riesgos relativos, índices de riesgo o incidencias significativamente más altos se indican con ✓.
Tres estudios informaron que las mujeres embarazadas expuestas a la vacuna Tdap tuvieron una mayor incidencia de corioamnionitis en comparación con las mujeres embarazadas no vacunadas. 96 , 97 , 98 Layton 99 informó una mayor incidencia de hemorragia posparto, y Moro 100 informó aumentos en los informes VAERS de pérdida fetal y eventos adversos graves luego de la aprobación por parte del ACIP de la vacuna Tdap para mujeres embarazadas. La vacunación contra la COVID-19 se asoció con pérdida fetal, 101 hemorragia posparto, 102 diabetes gestacional, 103 y problemas de fertilidad. 104 , 105 Gat informó un recuento de espermatozoides más bajo en los hombres después de la vacuna COVID-19. 106 DeSilva no informó secuelas a largo plazo de la vacunación contra la COVID-19, pero sí informó aumentos en el corto plazo. Reacciones a la vacuna COVID-19, que incluyen fiebre, malestar, reacción local y linfadenopatía. 107
Ver más evidencia y estudios revisados por pares en: https://cienciaysaludnatural.com/category/embarazadas/
Colabore por favor con nosotros para que podamos llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Via PAYPAL: Euros o dólares click aqui
Solicite nuestro CBU contactenos
Referencias:
- Medicines Adverse Reactions Committee, “Use of Boostrix (Combined Diphtheria, Tetanus and Pertussis Vaccine) in Pregnancy: Confidential,” report (2020), https://www.medsafe.govt.nz/co mmittees/marc/reports/181-Use-of-Boostrix.pdf.
- US Food and Drug Administration, Fluvirin®: Package Insert, (Summit, NJ: Seqirus USA Inc., Revised 2017), https://www.fda.gov/files/vaccines%2C%20-blood%20%26%20biologics/publis hed/Package-Insert—Fluvirin.pdf.
- US Food and Drug Administration, Comirnaty®: Package Insert (New York, NY: Pfizer Inc., 2022), https://www.fda.gov/media/151707/download.
- US Food and Drug Administration, Spikevax®: Package Insert (New York, NY: Moderna Inc., 2022), https://www.fda.gov/media/155675/download.
- “Pregnancy Guidelines and Recommendations by Vaccine,” Centers for Disease Control and Prevention, August 31, 2016, https://www.cdc.gov/vaccines/pregnancy/hcp-toolkit/guidelines.ht ml.
- “Covid-19 Vaccines While Pregnant or Breastfeeding,” Centers for Disease Control and Prevention, Updated June 16, 2022, https://www.cdc.gov/coronavirus/2019-ncov/vaccines/reco mmendations/pregnancy.html.
- Centers for Disease Control and Prevention (2021), “COVID-19 Vaccine Pregnancy Registry,” Vaccine Safety, accessed May 3, 2023. https://www.cdc.gov/vaccinesafety/ensuringsafety/monit oring/v-safe/covid-preg-reg.html.
- Ousseny Zerbo et al., “Association between Influenza Infection and Vaccination During Pregnancy and Risk of Autism Spectrum Disorder,” JAMA Pediatrics 171, no. 1 (2017): e163609, doi:10.1001/jamapediatrics.2016.3609.
- Ibid.
- Ibid.
- Juliet Popper Shaffer, “Multiple Hypothesis Testing,” Annual Review of Psychology 46, (1995): 561-584, http://wexler.free.fr/library/files/shaffer%20-(1995)%20multiple%20hypothesis%20te sting.pdf.
- Alberto Donzelli, Alessandro Schivalocchi, and Alessandro Battaggia, “Influenza Vaccination in the First Trimester of Pregnancy and Risk of Autism Spectrum Disorder,” JAMA Pediatrics 171, (2017): 601, doi:10.1001/jamapediatrics.2017.0753.
- Brian S. Hooker, “Influenza Vaccination in the First Trimester of Pregnancy and Risk of Autism Spectrum Disorder,” JAMA Pediatrics 171, no. 6 (2007): 600, doi:10.1001/jamapediatrics.2017.0734.
- Ousseny Zerbo et al., “Association between Influenza Infection and Vaccination During Pregnancy and Risk of Autism Spectrum Disorder,” JAMA Pediatrics 171, no. 1 (2017): e163609, doi:10.1001/jamapediatrics.2016.3609.
- Ibid.
- Brian S. Hooker, “Influenza Vaccination in the First Trimester of Pregnancy and Risk of Autism Spectrum Disorder,” JAMA Pediatrics 171, no. 6 (2007): 600, doi:10.1001/jamapediatrics.2017.0734.
- Stephanie A. Irving et al., “Trivalent Inactivated Influenza Vaccine and Spontaneous Abortion,” Obstetrics and Gynecology 121, no. 1 (2013): 159-165, doi:10.1097/aog.0b013e318279f56f.
- Ibid.
- Ibid.
- James G. Donahue et al., “Association of Spontaneous Abortion with Receipt of Inactivated Influenza Vaccine Containing H1N1pdm09 in 2010-11 and 2011-12,” Vaccine 35, no. 40 (2017): 5314-5322, doi:10.1016/j.vaccine.2017.06.069.
- James G. Donahue et al., “Inactivated Influenza Vaccine and Spontaneous Abortion in the Vaccine Safety Datalink in 2012-13, 2013-14, and 2014-15,” Vaccine 37, no.44 (2019): 6673-6681, doi:10.1016/j.vaccine.2019.09.035.
- Stephanie A. Irving et al., “Trivalent Inactivated Influenza Vaccine and Spontaneous Abortion,” Obstetrics and Gynecology 121, no. 1 (2013): 159-165, doi:10.1097/aog.0b013e318279f56f.
- Gary S. Goldman, “Comparison of VAERS Fetal-Loss Reports during Three Consecutive Influenza Seasons: Was There a Synergistic Fetal Toxicity Associated with the Two-Vaccine 2009/2010 Season?,” Human & Experimental Toxicology 32, no. 5 (2012) 464-475. https://doi.o rg/10.1177/0960327112455067.
- Ibid.
- Ibid.
- Ibid.
- Ibid.
- Ibid.
- James G. Donahue et al., “Association of Spontaneous Abortion with Receipt of Inactivated Influenza Vaccine Containing H1N1pdm09 in 2010-11 and 2011-12,” Vaccine 35, no. 40 (2017): 5314-5322, doi:10.1016/j.vaccine.2017.06.069.
- Ibid.
- Ibid.
- James G. Donahue et al., “Inactivated Influenza Vaccine and Spontaneous Abortion in the Vaccine Safety Datalink in 2012-13, 2013-14, and 2014-15,” Vaccine 37 (2019): 6673-6681, doi:10.1016/j.vaccine.2019.09.035.
- Ibid.
- Ibid.
- Alberto Donzelli, “Influenza Vaccination of Pregnant Women and Serious Adverse Events in the Offspring,” International Journal of Environmental Research and Public Health 16, no. 22 (2019): 4347, doi:10.3390/ijerph16224347.
- Milagritos Tapia et al., “Maternal Immunisation with Trivalent Inactivated Influenza Vaccine for Prevention of Influenza in Infants in Mali: A Prospective, Active-controlled, Observer-blind, Randomised Phase 4 Trial,” The Lancet. Infectious Diseases 16, no. 9 (2016): 1026-1035. doi:10.1016/S1473-3099(16)30054-8.
- Alberto Donzelli, “Influenza Vaccination of Pregnant Women and Serious Adverse Events in the Offspring,” International Journal of Environmental Research and Public Health 16, no. 22 (2019): 4347, doi:10.3390/ijerph16224347.
- Ibid.
- Ibid.
- Milagritos Tapia et al., “Maternal Immunisation with Trivalent Inactivated Influenza Vaccine for Prevention of Influenza in Infants in Mali: A Prospective, Active-controlled, Observer-blind, Randomised Phase 4 Trial,” The Lancet. Infectious Diseases 16, no. 9 (2016): 1026-1035. doi:10.1016/S1473-3099(16)30054-8.
- Ibid.
- Alberto Donzelli, “Influenza Vaccination for All Pregnant Women? So Far the Less Biased Evidence does not Favour It,” Human Vaccines and Immunotherapeutics 15, no. 9 (2019): 2159-2164, doi:10.1080/21645515.2019.1568161.
- Ibid.
- Ibid.
- Lisa M. Christian et al., “Inflammatory Responses to Trivalent Influenza Virus Vaccine among Pregnant Women,” Vaccine 29, no. 48, (2011): 8982-8987, doi:10.1016/j.vaccine.2011.09.039.
- Ibid.
- Ibid.
- Ibid.
- Ibid.
- Cristopher S. Price et al., “Prenatal and Infant Exposure to Thimerosal from Vaccines and Immunoglobulins and Risk of Autism,” Pediatrics 126, no. 4 (2010): 656-664, doi:10.1542/peds.2010-0309.
- Ibid.
- Ibid.
- US Food and Drug Administration, Fluvirin®: Package Insert, (Summit, NJ: Seqirus USA Inc., Revised 2017), https://www.fda.gov/files/vaccines%2C%20-blood%20%26%20biologics/publis hed/Package-Insert—Fluvirin.pdf.
- Cristopher S. Price et al., “Prenatal and Infant Exposure to Thimerosal from Vaccines and Immunoglobulins and Risk of Autism,” Pediatrics 126, no. 4 (2010): 656-664, doi:10.1542/peds.2010-0309.
- Cristopher S. Price, Anne Robertson, and Barbara Goodson, “Thimerosal and Autism Technical Report,” Abt Associates 1, (2009): https://www.abtassociates.com/insights/publications/report/t himerosal-and-autism-technical-report-volume-1.
- Ibid.
- Elyse O. Kharbanda et al., “Evaluation of the Association of Maternal Pertussis Vaccination with Obstetric Events and Birth Outcomes,” JAMA 312, no. 18 (2014): 1897-1904, doi:10.1001/jama.2014.14825.
- Ibid.
- Ibid.
- Ibid.
- J.B. Layton et al., “Prenatal Tdap Immunization and Risk of Maternal and Newborn Adverse Events,” Vaccine 35, no. 33 (2017): 4072-4078, doi:10.1016/j.vaccine.2017.06.071.
- Ibid.
- Ibid.
- Ibid.
- Ibid.
- Ibid.
- Malini DeSilva et al., “Maternal Tdap Vaccination and Risk of Infant Morbidity,” Vaccine 35, no. 29 (2017): 3655-3660, doi:10.1016/j.vaccine.2017.05.041.
- Ibid.
- Pedro Moro et al., “Enhanced Surveillance of Tetanus Toxoid, Reduced Diphtheria Toxoid, and Acellular Pertussis (Tdap) Vaccines in Pregnancy in the Vaccine Adverse Event Reporting System (VAERS), 2011-2015,” Vaccine 34, no. 20 (2016): 2349-2353, doi:10.1016/j.vaccine.2016.03.049.
- Ibid.
- Ibid.
- Malini DeSilva et al., “Evaluation of Acute Adverse Events after Covid-19 Vaccination during Pregnancy,” The New England Journal of Medicine 387, no. 2 (2022): 187-189, doi:10.1056/NEJMc2205276.
- US Food and Drug Administration, Comirnaty®: Package Insert, (New York, NY: Pfizer Inc., 2021), https://www.fda.gov/media/154834/download.
- “Covid-19 Vaccines While Pregnant or Breastfeeding,” Centers for Disease Control and Prevention, updated October 20, 2022, https://www.cdc.gov/coronavirus/2019-ncov/vaccines/re commendations/pregnancy.html.
- Malini DeSilva et al., “Evaluation of Acute Adverse Events after Covid-19 Vaccination during Pregnancy,” The New England Journal of Medicine 387, no. 2 (2022): 187-189, doi:10.1056/NEJMc2205276.
- Aharon Dick et al., “Safety of Third SARS-CoV-2 Vaccine (Booster Dose) During Pregnancy,” American Journal of Obstetrics & Gynecology MFM 4, no. 4 (2022): 100637, doi:10.1016/j.ajogmf.2022.100637.
- Ibid.
- Ibid.
- “Gestational Diabetes,” Centers for Disease Control and Prevention, accessed on April 16, 2023, https://www.cdc.gov/diabetes/basics/gestational.html.
- “VAERS Data,” Vaccine Adverse Event Reporting System (VAERS), updated April 7, 2023, https://vaers.hhs.gov/data.html.
- Ibid.
- Ibid.
- Itai Gat et al., “Covid-19 Vaccination BNT162b2 Temporarily Impairs Semen Concentration and Total Motile Count among Semen Donors,” Andrology 10, no. 6 (2022): 1016-1022, doi:10.1111/andr.13209.
- Ibid.
- Ibid.
- Ibid.
- Stephanie A. Irving et al., “Trivalent Inactivated Influenza Vaccine and Spontaneous Abortion,”Obstetrics and Gynecology 121, no. 1 (2013): 159-165, doi:10.1097/aog.0b013e318279f56f.
- Gary S. Goldman, “Comparison of VAERS Fetal-Loss Reports during Three Consecutive Influenza Seasons: Was There a Synergistic Fetal Toxicity Associated with the Two-Vaccine 2009/2010 Season?,” Human & Experimental Toxicology 32, no. 5 (2012) 464-475, https://doi.o rg/10.1177/0960327112455067.
- James G. Donahue et al., “Inactivated Influenza Vaccine and Spontaneous Abortion in the Vaccine Safety Datalink in 2012-13, 2013-14, and 2014-15,” Vaccine 37, no. 44 (2019): 6673- 6681, doi:10.1016/j.vaccine.2019.09.035.
- Alberto Donzelli, “Influenza Vaccination of Pregnant Women and Serious Adverse Events in the Offspring,” International Journal of Environmental Research and Public Health 16, no. 22 (2019): 4347, doi:10.3390/ijerph16224347.
- Ousseny Zerbo et al., “Association between Influenza Infection and Vaccination During Pregnancy and Risk of Autism Spectrum Disorder,” JAMA Pediatrics 171, no. 1 (2017): e163609, doi:10.1001/jamapediatrics.2016.3609.
- Cristopher S. Price et al., “Prenatal and Infant Exposure to Thimerosal from Vaccines and Immunoglobulins and Risk of Autism,” Pediatrics 126, no. 4 (2010): 656-664, doi:10.1542/peds.2010-0309.
- Alberto Donzelli, “Influenza Vaccination of Pregnant Women and Serious Adverse Events in the Offspring,” International Journal of Environmental Research and Public Health 16, no. 22 (2019): 4347, doi:10.3390/ijerph16224347.
- Lisa M. Christian et al., “Inflammatory Responses to Trivalent Influenza Virus Vaccine among Pregnant Women,” Vaccine 29, no. 48, (2011): 8982-8987, doi:10.1016/j.vaccine.2011.09.039.
- J.B. Layton et al., “Prenatal Tdap Immunization and Risk of Maternal and Newborn Adverse Events,” Vaccine 35, no. 33 (2017): 4072-4078, doi:10.1016/j.vaccine.2017.06.071.
- Ibid.
- Malini DeSilva et al., “Evaluation of Acute Adverse Events after Covid-19 Vaccination during Pregnancy,” The New England Journal of Medicine 387, no. 2 (2022): 187-189, doi:10.1056/NEJMc2205276.
- Elyse O. Kharbanda et al., “Evaluation of the Association of Maternal Pertussis Vaccination with Obstetric Events and Birth Outcomes,” JAMA 312, no. 18 (2014): 1897-1904, doi:10.1001/jama.2014.14825.
- J.B. Layton et al., “Prenatal Tdap Immunization and Risk of Maternal and Newborn Adverse Events,” Vaccine 35, no. 33 (2017): 4072-4078, doi:10.1016/j.vaccine.2017.06.071.
- Pedro Moro et al., “Enhanced Surveillance of Tetanus Toxoid, Reduced Diphtheria Toxoid, and Acellular Pertussis (Tdap) Vaccines in Pregnancy in the Vaccine Adverse Event Reporting System (VAERS), 2011-2015,” Vaccine 34, no. 20 (2016): 2349-2353, doi:10.1016/j.vaccine.2016.03.049.
- “VAERS Data,” Vaccine Adverse Event Reporting System (VAERS), updated April 7, 2023, htt ps://vaers.hhs.gov/data.html.
- Aharon Dick et al., “Safety of Third SARS-CoV-2 Vaccine (Booster Dose) during Pregnancy,” American Journal of Obstetrics & Gynecology MFM 4, no.4 (2022): 100637, doi:10.1016/j.ajogmf.2022.100637.
- Ibid.
- “VAERS Data,” Vaccine Adverse Event Reporting System (VAERS), updated April 7, 2023, htt ps://vaers.hhs.gov/data.html.
- Itai Gat et al., “Covid-19 Vaccination BNT162b2 Temporarily Impairs Semen Concentration and Total Motile Count among Semen Donors,” Andrology 10, no. 6 (2022): 1016-1022, doi:10.1111/andr.13209.
- Ibid.
- Malini DeSilva et al., “Evaluation of Acute Adverse Events after Covid-19 Vaccination during Pregnancy,” The New England Journal of Medicine 387, no. 2 (2022): 187–189, doi:10.1056/NEJMc2205276.
 CienciaySaludNatural.com
CienciaySaludNatural.com