Una vacuna exitosa debe prevenir enfermedades graves, hospitalizaciones o la muerte, sin eventos adversos graves que superen estos beneficios. No puede simplemente pretender prevenir casos leves que se resolverían por sí solos. También debe prevenir la transmisión de persona a persona. Los datos del ensayo deben tener la potencia suficiente para responder estas preguntas, no solo para los sanos, sino también para los grupos de alto riesgo, como los ancianos y los que padecen enfermedades subyacentes.
Cualquier protección inicial contra los síntomas de COVID-19 también debe perdurar y no disminuir después de unas semanas o meses. Quedan dudas sobre estos criterios válidos aplicados a las vacunas COVID-19 candidatas. Publicaciones recientes en las principales revistas médicas indican que las respuestas a las preguntas de seguridad y eficacia son poco seguras.
Hasta donde se sabe, ninguna de las vacunas han eliminado los epítopos inseguros, la parte de las proteínas del SARS-CoV-2 que coinciden con las proteínas humanas. Si el sistema inmunológico produce anticuerpos contra estos epítopos, podrían atacarse a sí mismos, el sello distintivo de las enfermedades autoinmunes.
La revista Nature, normalmente prudente, se pronuncia exageradamente confiada sobre los resultados de la liberación anticipada de Pfizer en un ensayo de fase III de su vacuna para COVID-19 . Pfizer declaró que la vacuna fue 90% efectiva cuando los participantes del ensayo estuvieron expuestos al SARS CoV-2, el virus que se dice que causa síntomas de COVID-19.
Pero esta afirmación es bastante ambigua considerando que el protocolo del estudio de Pfizer establece que los casos cuentan incluso si un participante del ensayo tiene una prueba positiva y solo un síntoma, como tos, escalofríos o diarrea, que podría ser causado fácilmente por uno de los 1.400 patógenos humanos , incluidos 200 virus que se sabe que infectan a los humanos. A excepción de la hepatitis A, B, C y el VIH, el protocolo del estudio no dice nada sobre las pruebas de otras causas infecciosas de los síntomas del participante. Una tos y una prueba positiva equivalen a COVID, incluso cuando un » posible diagnóstico alternativo » podría ser la causa real de los síntomas. La ausencia de evidencia no es evidencia de ausencia.
Pfizer, en asociación con BioNTech, utiliza una nueva tecnología de ARN mensajero (ARNm) en su vacuna y solicitará una codiciada autorización de uso de emergencia de la Administración de Drogas y Alimentos de los Estados Unidos (FDA), probablemente antes de fines de noviembre. El anuncio de Pfizer se produce después de que 94 participantes del ensayo, de más de 43.000, dieron positivo al SARS CoV-2. Pfizer no ha publicado datos sobre si los casos fueron leves, moderados o graves.
Expertos como Eric Topol, director del Instituto Traslacional de Investigación Scripps, indicacó que “es posible que la vacuna no resulte tan efectiva una vez que se complete el ensayo y se hayan analizado todos los datos» .
Es posible que la vacuna no resulte tan efectiva una vez que se complete el ensayo y se hayan analizado todos los datos
Eric Topol, director del Instituto Traslacional de Investigación Scripps
El protocolo del estudio de Pfizer (p. 103) establece que «el éxito en el análisis final » logrará una eficacia mínima del 30%, con una certeza superior al 98%. Esperamos que la vacuna no tenga una eficacia del 30 al 90% contra enfermedades leves.
¿Funcionará la vacuna Pfizer y es segura? Quedan preguntas. Cualquier vacuna, incluidas todas las vacunas COVID-19, debe probarse que es segura y eficaz antes de administrarse a grupos de alto riesgo o a la población mundial.
La semana pasada, el Dr. Anthony Fauci, director del Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID) y portavoz del coronavirus de la Casa Blanca, admitió que el objetivo de las vacunas COVID es brindar protección personal únicamente, no prevenir la muerte. o transmisión de persona a persona. Fauci dijo que él y sus colegas «se conformarían con … el criterio de valoración principal para prevenir enfermedades clínicamente reconocibles».
Conformarse con una vacuna que no cumple con las elevadas promesas iniciales no cumple con los requerimientos mínimos ni hará que más personas quieran recibirla.
Diseño de prueba defectuoso
Según lo admitido por Fauci, de hecho hay algunos problemas preocupantes con el diseño del ensayo, explicados muy bien por el Dr. Peter Doshi en el British Medical Journal. Doshi se centra en los dos problemas más importantes. Primero, ninguno de los principales ensayos candidatos a vacunas está diseñado para probar si la vacuna puede reducir los síntomas graves de COVID-19, definidos como: ingresos hospitalarios, UCI o muerte. Y, en segundo lugar, los ensayos no están diseñados para probar si la vacuna puede interrumpir la transmisión.
Si no se cumple ninguna de estas condiciones, la vacuna en esencia funciona como un fármaco terapéutico, excepto que una vacuna se tomaría de forma profiláctica, incluso por personas perfectamente sanas, y lo más probable es que conlleve un mayor riesgo de lesión que un fármaco terapéutico. Si esto fuera cierto, los fármacos terapéuticos serían superiores a cualquier vacuna COVID.
Es Ilegal exigir vacunas bajo autorización de uso de emergencia
Todas las vacunas COVID aprobadas para uso de emergencia deben ser voluntarias, ya que las vacunas se consideran en fase de investigación y se mantienen en un estándar mucho más bajo en cuanto a eficacia y seguridad. Por ejemplo, en comparación con el proceso de aprobación que no es de emergencia para obtener la licencia completa, una aprobación de emergencia permite una vacuna que «puede» ser efectiva, en comparación con el proceso de aprobación que no es de emergencia, donde una vacuna debe demostrar una efectividad «sustancial«.
La ley de autorización de uso de emergencia es clara: los estados no pueden exigir una vacuna aprobada para uso de emergencia. (ver Sección VI. Prevención ). También debería ser ilegal que las empresas privadas, las aerolíneas o su empleador exijan una vacuna mientras está aprobada por EE.UU..
El Colegio de Abogados de Nueva York de alguna manera pasó por alto esta barrera materialmente importante para los mandatos. Sus abogados publicaron una declaración de posición instando a los estados a hacer obligatoria la vacuna COVID , permitiendo solo una exención médica.
Solo si la FDA otorgara una licencia completa, que normalmente toma años, los estados o empresas podrían considerar los mandatos de vacunas. La Ley PREP exime a los fabricantes de vacunas COVID de responsabilidad, incluso si las vacunas dañan a los receptores, por lo que la idea de los mandatos es particularmente aterradora.
Una ‘nueva normalidad’
Las autoridades de salud pública insisten simultaneamente en varios paises con la idea de una «nueva normalidad» después de que una vacuna para COVID-19 esté ampliamente disponible. El término implica, y ha sido ampliamente interpretado en el sentido de que para que la sociedad vuelva a la normalidad, la vacuna evitaría la transmisión de persona a persona para que todo bloqueo pudiera «abrirse».
Si las autoridades de salud pública desean una aceptación de la vacuna, deben presionar a los fabricantes para que proporcionen información de prueba transparente para abordar las inquietudes, ya que la vacuna tendrá que ser voluntaria cuando esté lista.
En junio, el Dr. Peter Hotez , portavoz de la industria de las vacunas, dijo :
“Lo ideal es que una vacuna antiviral haga dos cosas. … Primero, reduzca la probabilidad de enfermarse gravemente e ir al hospital, y dos, prevenir la infección y, por lo tanto, interrumpir la transmisión de la enfermedad «.
Dr. Peter Hotez
¿Previene síntomas severos?
Con respecto a los resultados del nuevo ensayo de Pfizer, Paul Offit, director del Centro de Educación sobre Vacunas del Hospital Infantil de Filadelfia, dijo: “Quiero conocer el espectro de enfermedades que previene la vacuna.
Aunque Pfizer declaró que “el estudio también evaluará el potencial de la vacuna candidata para… [prevenir] contra la enfermedad grave de COVID-19”, el comunicado de prensa de Pfizer no indicó si los casos descritos en los resultados de la publicación temprana de la Fase III de la compañía fueron leves o graves . «En todos los ensayos de fase III en curso para los que se han publicado detalles, las infecciones confirmadas por laboratorio, incluso con síntomas leves, cumplen con la definición de criterio de valoración principal», escribió Doshi.
Los ensayos de fase III incluyen una prueba de provocación, en la que se hace un seguimiento de los vacunados y los del grupo de placebo para ver si terminan dando positivo por COVID-19, lo que se conoce como eventos o casos. «Los análisis finales de eficacia se planifican después de solo 150 a 160 ‘eventos'», afirmó Doshi, «independientemente de la gravedad de la enfermedad». Continuó diciendo que «los ingresos hospitalarios y las muertes por COVID-19 son simplemente demasiado infrecuentes en la población que se está estudiando para que una vacuna eficaz demuestre diferencias estadísticamente significativas en un ensayo de 30.000 personas».
El objetivo de los ensayos clínicos es demostrar la importancia estadística para que la FDA pueda tomar una decisión informada sobre si aprobar o no la vacuna. Los presentes ensayos clínicos no proporcionan datos fiables sobre si estas vacunas previenen hospitalizaciones y muertes.
Sin bloqueo de transmisión
Los planes para lanzar vacunas a los 7.500 millones de personas en el mundo basados en unos 160 participantes de ensayos clínicos por vacuna candidata no solo carecen de poder estadístico; la mayoría lo consideraría imprudente.
Una vacuna que bloquee la transmisión podría acelerar el fin de la pandemia. Sin embargo, será difícil determinar si la vacuna Pfizer, u otras en ensayos en etapa tardía, pueden lograrlo «. El director médico de Moderna, Tal Zaks , está de acuerdo y afirma que «nuestro ensayo no demostrará la prevención de la transmisión, porque … hay que analizar a las personas dos veces por semana durante períodos muy largos, y eso se vuelve insostenible desde el punto de vista operativo», citando la necesidad de una duración de prueba diez veces más larga y costos aún más altos.
Dado que estas vacunas COVID-19 no serán aprobadas para la licencia completa en función de su capacidad para detener la propagación del COVID-19 o prevenir la hospitalización o la muerte, es posible que enfrentemos bloqueos interminables. Si los ensayos clínicos actuales de la vacuna COVID-19 eventualmente conducen a una licencia completa, pero no establecen de manera estadísticamente significativa la prevención de la transmisión de persona a persona, no deben usarse para justificar las vacunas obligatorias para abordar un avión , ir a trabajar , asistir a un concierto o comer en un restaurante.
Faltan estudios en los grupos más afectados por COVID-19
Después de los ensayos de fase I, los estudios de fabricantes están reclutando a personas mayores, minorías y personas con problemas de salud subyacentes en estudios más amplios con más de 30.000 sujetos. Sin embargo, aunque Pfizer declaró que “aproximadamente el 42% de los participantes globales y el 30% de los participantes de EE. UU. Tienen antecedentes raciales y étnicos”, hay una preocupación de que los ensayos no tengan el poder estadístico suficiente para evaluar la efectividad de la vacuna en estos grupos.
Las pruebas de desafío de 160 eventos no se desglosarán por subpoblación, lo que dejará pocos datos procesables sobre estos grupos vulnerables. Además, Pfizer no ha revelado cuántos ancianos están inscritos en su ensayo. “No veo cómo alguien, el DSMB [ Junta de Monitoreo de Seguridad de Datos ] o el Comité Asesor de Vacunas de la FDA, o los tomadores de decisiones de la FDA, permitirían alguna vez recomendar una vacuna para ese grupo [de 65 años o más] sin datos ”, dijo Offit .
Eventos adversos y relacionados con los ingredientes de la vacuna
Entonces, ¿qué ha sido revelado hasta ahora por los ensayos de la vacuna COVID-19? A continuación se muestran los problemas con el diseño de los ensayos, los ensayos en pausa, los eventos adversos y las preguntas sobre la aceleración de una nueva tecnología de ARNm, entre muchas otras preguntas y problemas.
Estas son las cinco compañías que esperan que la FDA otorgue una autorización de uso de emergencia : Moderna, Pfizer / BioNTech, Johnson & Johnson, Astra-Zeneca / Oxford y GlaxoSmithKline. Todos reciben fondos de Operation Warp Speed para reducir el tiempo de desarrollo en unos pocos meses. Normalmente, las vacunas tardan años en pasar por las pruebas de seguridad adecuadas.
De manera significativa, con alrededor de dos docenas de vacunas en uso activo en la actualidad, se han descontinuado al menos 66 vacunas probadas y aprobadas formalmente en los EE. UU. Muchos, como RotaShield (rotavirus), Lymerix y la vacuna DTP, se eliminaron debido a problemas de seguridad. Dado el tiempo de desarrollo altamente comprimido, los eventos adversos experimentados por los participantes del ensayo y la posibilidad de que las vacunas exijan una licencia completa, el público debe exigir transparencia y acceso abierto a los datos del ensayo.
Ensayos en pausa
Johnson & Johnson fue el último fabricante de vacunas en pausar su prueba de vacuna COVID-19 debido a un evento adverso grave en un receptor de la vacuna. En la reunión del 30 de octubre del Comité Asesor sobre Prácticas de Inmunización (ACIP) , el Dr. Jerald Sadoff de Johnson & Johnson fue presionado por no menos de seis miembros de ACIP para que revelara la enfermedad, pero se negó, alegando confidencialidad.
Mientras tanto, Astra-Zeneca / Oxford también tuvo que pausar su ensayo después de que los participantes del ensayo desarrollaron afecciones neurológicas como mielitis transversa y esclerosis múltiple y debido a una muerte , según se informa en el grupo de placebo, que recibió vacunas contra la meningitis en lugar de verdaderos placebos salinos.
En el ensayo de Fase I de Moderna , al menos un participante tuvo que abandonar debido a la urticaria , una reacción alérgica común a un medicamento que puede causar una anafilaxia potencialmente mortal, pero el fabricante de medicamentos no detuvo su ensayo. Pfizer / BioNTech ha declarado que no detendrá su prueba a pesar de los «efectos secundarios que han surgido».
El 23 de octubre, la FDA autorizó a Johnson & Johnson y Astra-Zeneca a reanudar sus ensayos, afirmando que no podían vincular definitivamente los eventos adversos graves o la muerte a las vacunas COVID. Dado el pequeño número de personas en los ensayos, los eventos adversos graves en solo unos pocos participantes podrían traducirse en miles, si no millones de lesiones si se vacunara a toda la población mundial.
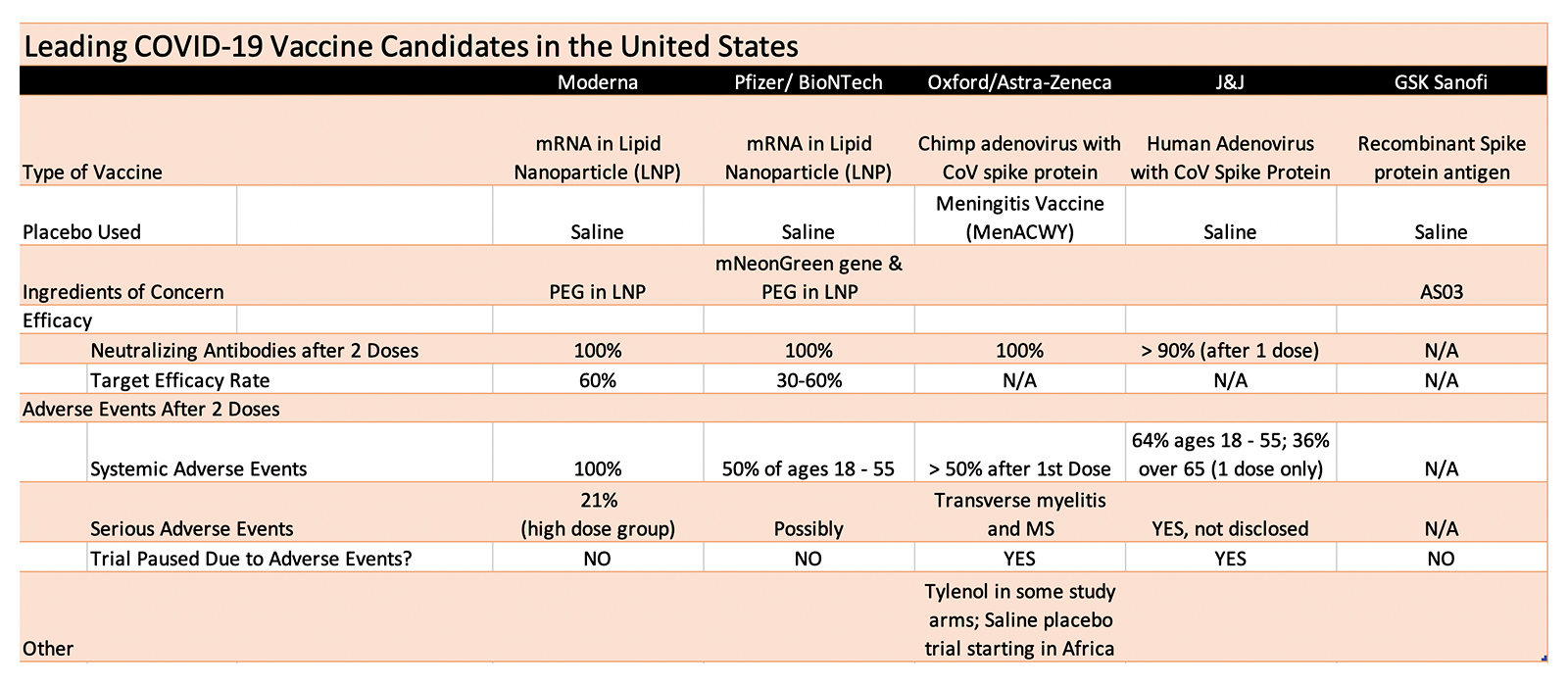
Eficacia cuestionable
Entre las principales candidatas a la vacuna COVID, Moderna , Pfizer / BioNTech , Astra-Zeneca / Oxford y Johnson & Johnson (J&J) han publicado todos los datos de los primeros ensayos en humanos. (Enlaces a estudios publicados dentro del texto anterior y también citados después del artículo).
Si bien los cuatro informan que entre el 90% y el 100% de los participantes desarrollaron anticuerpos después de dos dosis (dosis única para J&J), los cuatro también informan una alta tasa de eventos adversos. Tenga en cuenta que simplemente se presume que los anticuerpos son efectivos, cuando los niveles son comparables a los anticuerpos en personas que se recuperaron naturalmente de COVID.
No sabremos si las vacunas previenen o reducen los síntomas, como los resultados de la publicación temprana del ensayo de Pfizer, hasta que se obtengan los resultados completos de las pruebas de provocación. En la prueba de provocación, los vacunados y los que recibieron una inyección de placebo permanecen ciegos, es decir, no saben en qué grupo están. Si un participante experimenta síntomas similares al COVID, se le hará una prueba de «frotis nasal». Los casos se contabilizarán cuando un participante dé positivo por SARS CoV-2, el virus que se cree que causa los síntomas de COVID-19, mediante una prueba de reacción en cadena de la polimerasa. El grupo vacunado se comparará luego con el grupo placebo.
Eventos adversos sistémicos elevados
El cien por ciento de los inyectados con dos dosis de la vacuna de ARNm de Moderna (100 mcg) experimentaron eventos adversos sistémicos, mientras que el 50% de los que tenían entre 18 y 55 años en el ensayo de Pfizer tuvieron eventos adversos sistémicos.
En el ensayo de Astra-Zeneca / Oxford , solo se necesitó una dosis para que más del 50% de los participantes experimentaran eventos adversos. En el ensayo de J&J , una sola dosis provocó que casi dos tercios de los menores de 55 años tuvieran eventos adversos sistémicos, en comparación con aproximadamente un tercio de los mayores de 65 años.
Los eventos adversos sistémicos experimentados por los participantes en todos los ensayos incluyen escalofríos, fiebre, dolor muscular y dolor de cabeza, que los participantes afirman que duran aproximadamente 24 horas. Un hombre con escalofríos castañeteó los dientes tanto que se rompió un diente .
ARNm: nueva tecnología de vacunas no probada
En una desviación tecnológica de los cuatro tipos básicos de vacunas, tanto Moderna como Pfizer / BioNTech están probando vacunas de ARNm, una tecnología que no parece depender en absoluto de productos biológicos. El ARNm instruye a nuestras células a actuar. En el caso de la vacuna COVID, el laboratorio trabaja con ARNm sintético destinado a instruir a la maquinaria celular del cuerpo para que produzca algunas de las proteínas CoV-2 del SARS, pero no todo el virus CoV-2 del SARS. Entonces se espera que el sistema inmunológico produzca anticuerpos contra esas partes del virus. Básicamente, las vacunas de ARNm están destinadas a biohackear, mediante la modificación genética, a un ser humano para producir partes de un virus.
Las vacunas se clasifican como biológicos , no como medicamentos, porque las vacunas tradicionales siempre se han derivado de materiales biológicos. Es cuestionable que una vacuna de ARNm que utilice ARN sintético, que parece no tener nada biológico, aún pueda mantener esta clasificación como biológica. Es realmente una droga inyectable y, obviamente, una gran desviación de la tecnología tradicional de vacunas de base biológica. Esto debería darnos una pausa, dado que el calendario acelerado es aún más inapropiado para una tecnología de vacunas completamente nueva.
Síndromes autoinmunes causados por vacunación, potenciación dependiente de anticuerpos
El puñado de ensayos con animales realizados por los fabricantes – J&J ( primate ), Moderna ( ratón y primate ), Pfizer ( ratón y primate ) y AstraZeneca / Oxford ( primate ) – se centraron en la tolerabilidad general de las vacunas, la eliminación de patógenos de la parte superior y el tracto respiratorio inferior, y se sondearon para determinar qué nivel de dosis podría ser inmunogénico y seguro.
Los ensayos en animales se están llevando a cabo junto con los ensayos en humanos, no antes, y aún no se han publicado los resultados con respecto a la posibilidad de potenciación del patógeno , que podría conducir a un aumento de la enfermedad COVID-19 en personas vacunadas contra el virus SARS-CoV-2, y potencialmente causan autoinmunidad contra muchas proteínas humanas, incluidas las proteínas críticas de nuestro sistema inmunológico.
Es posible que tengamos que esperar los resultados de los ensayos de la vacuna COVID de fase III para obtener información sobre otra afección autoinmune adversa, la mejora dependiente de anticuerpos (ADE). En ADE, las vacunas pueden causar anticuerpos idiopáticos que actúan como un caballo de Troya para los virus salvajes, lo que permite que el virus objetivo entre en las células y se replique. Al contrario de proteger a alguien de una infección, el ADE hace que la persona vacunada tenga un caso peor de la enfermedad y posiblemente sufra daño en los órganos.
Una revisión reciente de ADE, también denominada mejora inmunológica, señaló que los ensayos actuales no están diseñados para encontrar ADE, concluyendo que “el diseño riguroso de los ensayos clínicos y la vigilancia posterior a la licencia deben proporcionar una estrategia confiable para identificar eventos adversos, incluido el potencial de una mayor gravedad de la enfermedad COVID-19, después de la vacunación «.
El ADE se ha demostrado en estudios sobre el SARS CoV en: humanos , hurones (daño hepático) y primates no humanos (daño pulmonar agudo), entre un cuerpo de literatura mucho más amplio.
No se sabe qué porcentaje de la población puede sufrir potenciación del patógeno o mejora dependiente de anticuerpos después de la vacunación con una vacuna COVID. Las estimaciones de estadounidenses que ya padecen una enfermedad autoinmune oscilan entre 14,7 millones y 23,5 millones . Es probable que sean más susceptibles a la potenciación del patógeno y al ADE.
Otros ingredientes relacionados
Además de Moderna y Pfizer / BioNTech, los otros fabricantes líderes de vacunas están utilizando tecnología de vacunas recombinantes, produciendo una quimera genómica con propiedades destinadas tanto a activar el sistema inmunológico como a generar anticuerpos contra la proteína espícula del SARS CoV-2.
Astra-Zeneca / Oxford está utilizando un virus de chimpancé , un adenovirus, que puede ser la causa del resfriado común, combinado con la proteína espícula del SARS CoV-2. Desde hace mucho tiempo, existen preocupaciones acerca de los virus de primates en las vacunas desde que la vacuna contra la polio administrada entre 1955 y 1963 se vinculó con el cáncer. La vacuna contra la poliomielitis se cultivó en células renales de primates infectadas con el virus simio 40 (SV40).
Johnson & Johnson está utilizando un adenovirus humano combinado con la proteína espícula . GlaxoSmithKline / Sanofi está utilizando un antígeno recombinante basado en su tecnología de vacuna contra la gripe .
Investigadores de vacunas veteranos también han levantado una bandera de advertencia sobre los candidatos a la vacuna COVID-19 que usan adenovirus que podrían resultar en una mayor susceptibilidad a las infecciones por VIH según hallazgos anteriores. En un informe de Lancet en octubre , los investigadores que utilizaron la tecnología de la vacuna COVID adenovector reconocieron la posibilidad «controvertida» de que su vector aumentara el riesgo de infección por VIH y dijeron que estarían atentos a ello en los ensayos de candidatos a vacunas.
Hay algunos otros ingredientes preocupantes que hay que vigilar de cerca. En las vacunas de ARNm de Moderna y Pfizer, el polietilenglicol (PEG) se encuentra en el recubrimiento de nanopartículas de lípidos grasos alrededor del ARNm. El setenta por ciento de las personas producen anticuerpos contra el PEG y la mayoría no lo sabe, lo que crea una situación preocupante en la que muchos podrían tener reacciones alérgicas, potencialmente mortales, a una vacuna que contiene PEG. Los anticuerpos PEG también pueden reducir la eficacia de la vacuna.
Pfizer está insertando un ingrediente derivado de un invertebrado marino, mNeonGreen , en su vacuna. El ingrediente tiene cualidades bioluminiscentes, lo que lo hace atractivo para fines de imágenes médicas, pero no está claro por qué una vacuna inyectada necesitaría tener el equivalente a un marcador visual de luz diurna. mNeonGreen tiene una antigenicidad desconocida.
Finalmente, la vacuna GlaxoSmithKline tendrá un ingrediente tóxico bien caracterizado, AS03 , un adyuvante utilizado en la vacuna H1N1 que se vinculó con narcolepsia y cataplejía. Contiene escualeno que se extrae de hígados de tiburón y está relacionado con el síndrome de la Guerra del Golfo. AS03 también contiene polisorbato 80, que altera la barrera hematoencefálica normalmente protectora , y tocoferol , una forma de vitamina E, como emulsionante.
Vacuna contra la meningitis ‘fauxcebo’
Mientras que Pfizer y GSK están usando placebos salinos en sus ensayos, Astra-Zeneca / Oxford está usando una vacuna contra la meningitis como su «placebo», que algunos denominan «fauxcebo». La vacuna contra la meningitis causa niveles significativos de eventos adversos e incluso puede haber causado la muerte reportada en el ensayo Astra-Zeneca / Oxford.
Comparar una vacuna COVID-19 con una vacuna contra la meningitis como un placebo puede tener niveles comparables de eventos adversos, lo que permite a los fabricantes afirmar engañosamente que sus vacunas COVID-19 no tuvieron más eventos adversos que el placebo para la meningitis. Si realmente compararan sus vacunas con un placebo de solución salina, la vacuna COVID-19 probablemente tendría más eventos adversos.
En su protocolo de estudio , Astra-Zeneca / Oxford declaró que «el uso de solución salina como placebo correría el riesgo de desenmascarar a los participantes, ya que aquellos que tuvieron reacciones notables sabrían que estaban en el grupo de la vacuna ChAdOx1 nCoV-19». Astra-Zeneca / Oxford tiene planeado un ensayo de placebo de solución salina en Sudáfrica , por lo que habrá datos de seguridad en comparación con un placebo real cuando ese ensayo se complete en unos pocos años.
Tylenol en algunos grupos de estudio
Finalmente, otra rareza en el ensayo Astra-Zeneca / Oxford es el uso en algunos grupos de estudio de acetaminofén, también conocido como Tylenol o paracetamol. El fabricante de la vacuna explicó que quería usar la dosis de vacuna más alta posible, por lo que un mayor porcentaje de personas desarrollaría inmunidad después de la primera dosis. Según su estudio de Fase I , “se eligió una sola dosis [de vacuna] más alta para proporcionar la mayor probabilidad de inducción rápida de anticuerpos neutralizantes. En el contexto de una ola pandémica en la que una sola dosis más alta, pero más reactogénica, podría inducir rápidamente una inmunidad protectora, el uso de paracetamol profiláctico parece aumentar la tolerabilidad y reduciría la confusión con los síntomas de COVID-19 que podrían ser causados por la -síntomas vivos relacionados con la vacuna sin comprometer la inmunogenicidad ”.
El acetaminofén está hecho de alquitrán de hulla y, aunque se usa desde finales del siglo XIX, la ciencia aún no está segura de su mecanismo de acción. Sin embargo, los efectos secundarios son bien conocidos. Agota el glutatión, el antioxidante más abundante del cuerpo producido en el hígado. Es una práctica cuestionable administrar este medicamento de venta libre con vacunas, ya que el cuerpo necesita abundante glutatión para desintoxicar los ingredientes de la vacuna.
Financiamiento BARDA y posible aprobación a la vuelta de la esquina
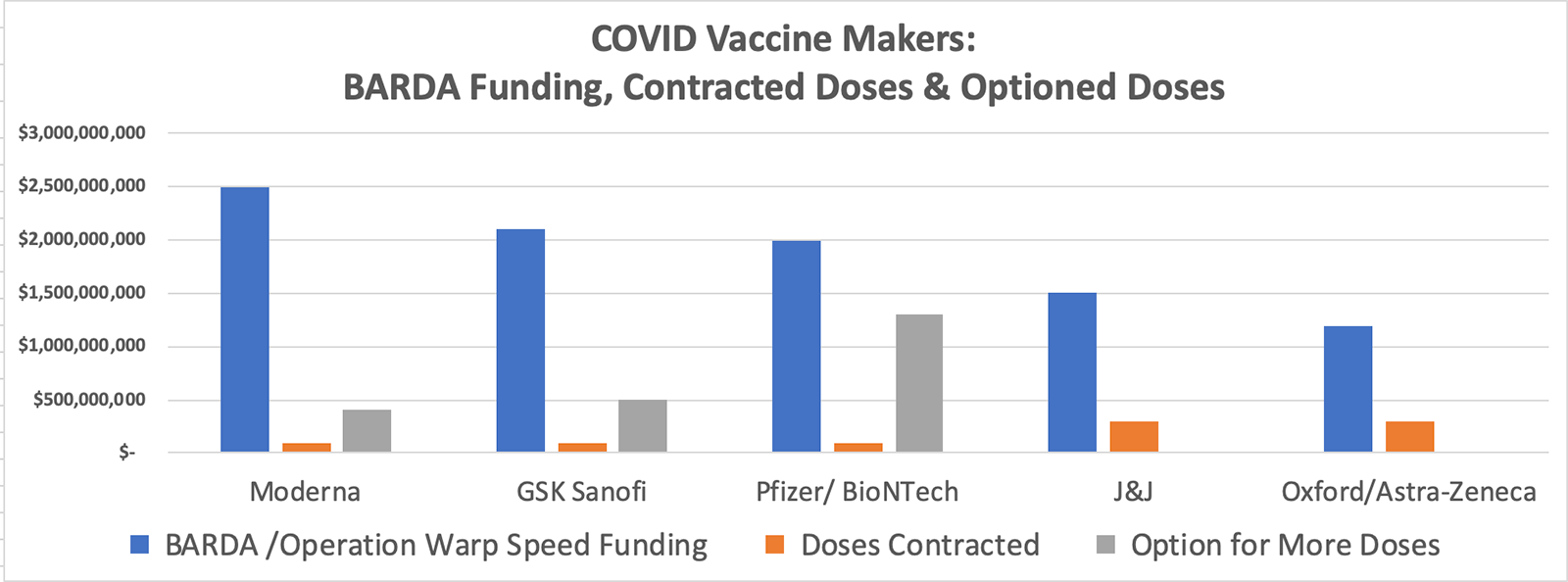
Los cinco principales fabricantes de vacunas han recibido dinero de la Autoridad de Investigación y Desarrollo Biomédico Avanzado ( BARDA ) del Departamento de Salud y Servicios Humanos , en montos que oscilan entre $ 1.2 y $ 3.000 millones para acelerar los ensayos bajo la Operación Warp Speed . Todos los fabricantes están comprometidos a producir de 100 a 300 millones de dosis iniciales de sus vacunas, con contratos para producir millones o miles de millones de dosis más.
A medida que disminuye el entusiasmo por una vacuna COVID-19, parece que los ensayos clínicos no inspirarán más confianza. Dado que todos esperan ansiosamente la «nueva normalidad» y algunos piensan que una vacuna es la clave para terminar con los bloqueos, el entusiasmo permanece incluso por una vacuna subóptima. Si subóptimo significa una alta tasa de lesiones graves, los fabricantes de vacunas aún tienen un largo camino por recorrer para demostrar que las vacunas no causan más muertes y lesiones que los síntomas del COVID-19.
La confianza ciertamente no aumenta cuando se prueban nuevas tecnologías de vacunas de ARNm en Warp Speed lideradas por el ex ejecutivo de GSK, Moncef Slaoui , quien ayudó a ocultar los eventos adversos cardíacos severos de Avandia, un caso claro del zorro que cuida el gallinero.
Cambiar las discapacidades y muertes de COVID por lesiones y muertes por vacunas no es una opción. Incluso si los fabricantes pueden demostrar que la tasa de lesiones graves es inferior al 1%, si los 7.500 millones de personas en el mundo estuvieran todas vacunadas, millones podrían sufrir lesiones permanentes o morir a causa de la vacuna. Aunque los mandatos están prohibidos bajo una Autorización de uso de emergencia, no pasará mucho tiempo hasta que los fabricantes obtengan la licencia completa.
Sin embargo, incluso con una licencia completa, si la vacuna no evita la propagación, no hay ningún caso para los mandatos de la vacuna. Los individuos siempre deben tener la opción de vacunarse o no vacunarse a sí mismos o a sus hijos menores, después de estar completamente informados tanto de los riesgos como de los beneficios. Es sentido común oponerse medicamentos obligatorios.
Resumen de ensayos humanos publicados por los fabricantes
Pfizer / BioNTech
Moderna
Astra Zeneca / Oxford
Johnson y Johnson
GSK Sanofi
 CienciaySaludNatural.com
CienciaySaludNatural.com