Acute exposure and chronic retention of aluminum in three vaccine schedules and effects of genetic and environmental variation https://doi.org/10.1016/j.jtemb.2019.126444 – Journal of Trace Elements in Medicine and Biology – Volume 58 PMID: 31846784
Grant McFarland, ElaineLa Joie, PaulThomas, JamesLyons-Weiler

Resumen
La farmacodinámica del aluminio inyectado utilizado en las vacunas no toma en cuenta como las diferencias en las fechas de aplicación afectan la acumulación de aluminio y cómo factores como la genética y las influencias ambientales afectan a la desintoxicación. El modelo de Priest utilizado en el pasado esta basado en tasas de depuración de todo el cuerpo estimadas a partir de un estudio que involucra a un solo sujeto humano con pocos datos empíricos. En este análisis, exploramos las exposiciones agudas posibles y la acumulación / eliminación del aluminio de todo el cuerpo a largo plazo en tres programas de vacunación:
- el programa actual de los Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU.,
- El programa actual de CDC que utiliza vacunas con bajo contenido de aluminio o sin aluminio.
- y el cronograma del «Plan de vacunación amigable» del Dr. Paul Thomas.
La farmacodinámica o farmacodinamia, es el estudio de los efectos bioquímicos y fisiológicos de los fármacos y de sus mecanismos de acción y la relación entre la concentración del fármaco y el efecto de este sobre un organismo.
Luego estudiamos los efectos de una suposición implícita del modelo Priest sobre si la dinámica de depuración de dosis sucesivas está influenciada por el nivel actual de aluminio o modelada por la suposición de que una nueva dosis tiene su propio «restablecimiento» de dinámica de cuerpo entero en el día de inyección. Modelamos dos factores adicionales: variación (deficiencia) en la desintoxicación de aluminio, y un factor agregado a la ecuación Priest para modelar el impacto potencial del aluminio en la desintoxicación celular y de todo el cuerpo.
Abreviaturas
- ACV Vacunas que contienen aluminio
- CDC Centros para el Control de Enfermedades de EE. UU.
- CFR Código de Regulaciones Federales (EE. UU.)
- ER-estrés Estrés del retículo endoplásmico
- FDA Administración de Drogas y Alimentos de los Estados Unidos
- PDL Límite de dosis pediátrica
- MSL Nivel mínimo seguro
- % alumTox Una medida de la toxicidad crónica del aluminio (todo el cuerpo)
Estas investigaciones se comparan con un límite de dosis pediátrica (PDL) previamente estimado de exposición a aluminio en todo el cuerpo y proporcionan una nueva estadística: % alumTox , el porcentaje (esperado) de días (o semanas) que un bebé tiene toxicidad por aluminio, lo que refleja toxicidad crónica. Mostramos que entre los tres programas, el programa de los CDC da como resultado el % más alto de alumTox independientemente de los supuestos del modelo, y el programa del Plan Amigable con la Vacuna, que evita> 1 ACV por visita al consultorio, da como resultado el % más bajo (esperado) de alumTox. Estos resultados son conservadores, ya que el MSL se deriva de los datos utilizados por la FDA para estimar la seguridad del aluminio en humanos adultos. Estos resultados demuestran una gran utilidad potencial de la variación del modelado en las respuestas del paciente al aluminio. Más datos empíricos de individuos sospechosos de ser intolerantes al aluminio de las vacunas, evidenciados por una alta retención de aluminio, trastornos del desarrollo neurológico y / o una miríada de enfermedades crónicas, ayudarían a responder preguntas sobre si las predicciones del modelo pueden usarse para estimar los valores de los parámetros relacionados con Factores genéticos que incluyen la variación de la secuencia genómica y los antecedentes familiares de enfermedades crónicas relacionadas con la exposición al aluminio.
Vacunas, Aluminio, Autoinmunidad, Salud, crónica, Pediatría
1 . Introducción
Los compuestos de aluminio utilizados en algunas vacunas incluyen oxihidróxido de aluminio e hidroxifosfato de aluminio. Los compuestos de aluminio se agregan específicamente para provocar una respuesta inmune y, por lo tanto, mejorar la capacidad de la vacuna para estimular la inmunidad. Los mecanismos precisos del aluminio como adyuvante no están bien caracterizados, pero inducen una miríada de efectos inmunológicos celulares y sistémicos localizados ([ 1 ]; 25,932,368) incluyendo una respuesta a corto plazo sesgada Th2 ([ 51 ], 20,132; 23,335,921) en oposición a una reacción equilibrada Th1 / Th2 a largo plazo ([ 2 ]; 9.627.130). Las posibilidades presentadas de mecanismos incluyen efectos celulares y efectos a nivel molecular. Los efectos celulares incluyen la orientación del antígeno humoral ([ 1]; 25,932,368), la muerte celular que conduce a la liberación de citocinas ([ 3 ]; 19,734,227) y la activación de macrófagos ([ 4 ]; 27,139,352). Los efectos de la vía molecular incluyen la activación del sistema del complemento y la vía alternativa, incluida la generación de anafilatoxinas ([ 5 ]; 24.040.248). A nivel tisular, puede ocurrir necrosis no específica, apoptosis y un efecto de depósito en el sitio de inyección ([ 57 ]; 23183095, [ 6 ] 10837642, [ 7 ]; 17114826). Un mecanismo propuesto más recientemente es que las alteraciones de la forma de la proteína antigénica y no antigénica en las células intoxicadas con aluminio están asociadas con el estrés ER y la respuesta de la proteína desplegada (Lyons-Weiler, 2018 doi: 10.4172 / 2165–7890.1000224).
Si bien el contenido de aluminio en algunas vacunas puede ser necesario para permitir que estas vacunas activen la inmunidad, la exposición total al aluminio inyectado también es una consideración importante para la salud. El oxihidróxido de aluminio actualmente se puede usar en vacunas con límites por dosis que son independientes del peso corporal. Se puede usar hasta 25 μg / L en medicamentos parenterales de gran volumen (FDA; 21 CFR 201.323), y hasta 1250 μg / dosis única, según el método de cálculo (FDA; Tabla 6; 21 CFR 610.15), «siempre que los datos que demuestren que la cantidad de aluminio utilizada sea segura y necesaria para producir el efecto deseado son presentados y aprobados por el Director, Centro de Evaluación e Investigación Biológica o el Director, Centro de Evaluación e Investigación de Medicamentos «(FDA; 21 CFR 610.15). Aparentemente, este reglamento no se aplica, pero quizás debería, a las visitas individuales al consultorio de vacunas para considerar las dosis acumulativas de múltiples vacunas recibidas al mismo tiempo. El modus operandi regulatorio inexacto de emplear límites de aluminio por dosis que son independientes del peso corporal es problemático, porque el programa de los CDC permite muchas vacunas por visita al consultorio (y por lo tanto, por día).
El aluminio en el cuerpo ha sido citado como un probable factor que contribuye tanto a las enfermedades autoinmunes como a otras enfermedades crónicas ([ 8 , 9 ], 31,059,838; [ 10 ], 29,307,441; [ 11 ]; 27,908,630, [ 12 ]; 25,506,338). La variación de persona a persona en las tasas de depuración de todo el cuerpo debido a factores genéticos y ambientales ha sido poco estudiada. Estudios de plasma humano o tasas de depuración sanguínea ([ 13]; 15,152,306) ofrecen poca información útil para la toxicología, ya que los mecanismos conocidos de toxicidad del aluminio son intracelulares y, por lo tanto, intra-tejidos. Por lo tanto, las tasas rápidas de eliminación de suero o sangre pueden ser confusas cuando se considera la toxicidad crónica o incluso aguda del aluminio inyectado con vacunas. Se ha sospechado durante mucho tiempo que el aluminio en muchas formas desempeña un papel en la enfermedad de Alzheimer ([ 14 ]; 26,494,454) y está respaldado por estudios que muestran la reducción de los síntomas de la enfermedad por la ingestión de aguas minerales ricas en silicio ([ 15 ]; 22,976,072). «Etiquetado» de aluminio liberado por desintoxicación con compuestos en Chlorella y Espirulina ([ 16 ]; 7,687,764; [ 17] s; 23.986.974) puede ser esencial para permitir la extracción por el hígado y para prevenir la «desintoxicación-retox» que ocurre cuando el aluminio se libera de la muerte celular, se redistribuye y se deposita a través de una nueva extracción dentro y entre los tejidos del cuerpo.
Desde el punto de vista médico, la desintoxicación adecuada de aluminio en órganos, células y cuerpo parece ser cada vez más importante: se ha encontrado aluminio en los cerebros de pacientes con enfermedad de Parkinson ([ 18 ]; 29,189,118; [ 19 ]), enfermedad de Alzheimer (Mizra et al. , 2017; 28,159,219), epilepsia ([ 20 ]; 31,208,130) y autismo ([ 21 ]; 29,413,113). Crece la evidencia de que una serie de enfermedades crónicas de causa desconocida que son difíciles de diagnosticar, como PANDAS / PANS ([ 22 ]; 25,150,567; [ 23 ], 29,309,797), síndrome de fatiga crónica ([ 24 ]; 31,394,725) pueden al menos en parte se debe a la intolerancia a la vacuna de aluminio ([ 10 ]; [ 9], 31.059.838; Crepeaux et al., 2018; 29525002, Crepeux et al., 2017; 27.908.630; [ 12 ]; 25,506,338).
Los compuestos de aluminio se producen naturalmente en el medio ambiente y en los alimentos, pero muy poco aluminio ingerido se absorbe a través de los intestinos. La exposición total al aluminio se ve afectada por la cantidad de aluminio en las vacunas individuales y el momento de las vacunas repetidas en los primeros dos años de vida. Dórea y Marques [ 25] (2009; 20,010,978) compararon los niveles esperados de absorción de aluminio en el cuerpo por la ingesta intravenosa y oral y concluyeron que los bebés humanos tienen una mayor exposición al aluminio por la vacunación que de los alimentos, el agua y la fórmulas para bebés. Nuestros cálculos (Apéndice) confirman que para el programa de los CDC, los bebés de hasta seis meses de vida reciben la mayor parte de su aluminio disponible metabólicamente de las vacunas. Se debe esperar que la mayor parte del aluminio retenido en el cuerpo de los bebés provenga de las vacunas combinadas con los niveles de exposición de otras exposiciones para manifestar riesgos para la salud por la exposición total, lo que hace que el momento y el contenido total de aluminio de los diferentes programas de vacunas sean una consideración importante. En este estudio, exploramos los efectos de diferentes programas de dosis, reflejando tres programas diferentes de vacunación, en fracciones retenidas de aluminio. También estudiamos los efectos de un supuesto de construcción de modelo importante que refleja los efectos de exposiciones previas al aluminio en el aclaramiento del primer día, la variación genética en las tasas de aclaramiento y el impacto potencial del deterioro del aluminio en su propia desintoxicación en la fracción retenida esperada en el cuerpo en el tiempo. Representamos los resultados como el número de días que se puede esperar que un niño experimente cargas corporales de aluminio (es decir, la cantidad total de aluminio presente en el cuerpo) que exceden los niveles de exposición seguros propuestos en los primeros dos años de vida y enfatizan los valores esperados. toxicidad crónica en los primeros siete meses de vida. y el impacto potencial del deterioro del aluminio en su propia desintoxicación en la fracción retenida esperada en el cuerpo con el tiempo. Representamos los resultados como el número de días que se puede esperar que un niño experimente cargas corporales de aluminio (es decir, la cantidad total de aluminio presente en el cuerpo) que exceden los niveles de exposición seguros propuestos en los primeros dos años de vida y enfatizan los valores esperados. toxicidad crónica en los primeros siete meses de vida.
2 . Métodos
Este estudio considera tres programas:
- (A) el programa de los CDC para 2019,
- (B) un programa de los CDC que modificamos específicamente eligiendo dosis bajas de aluminio para DTaP y sin aluminio para las vacunas Hib, y
- (C) el programa del Dr. Paul Thomas ‘ «Plan amigable con las vacunas» (VFP; [ 26 ]). El Plan Amigable con las Vacunas también elige dosis bajas de aluminio para DTaP y no aluminio para las vacunas contra Hib como el programa modificado de los CDC, pero retrasa las vacunas contra Hep B y Hep A. No se administra Hib de aluminio al mismo tiempo que DTaP de aluminio de baja dosis o PVC13. Solo se administra una vacuna que contiene aluminio a la vez con el cronograma del Plan de vacunación amigable.
La dosificación y el tiempo de los tres programas se resumen en la Tabla 1
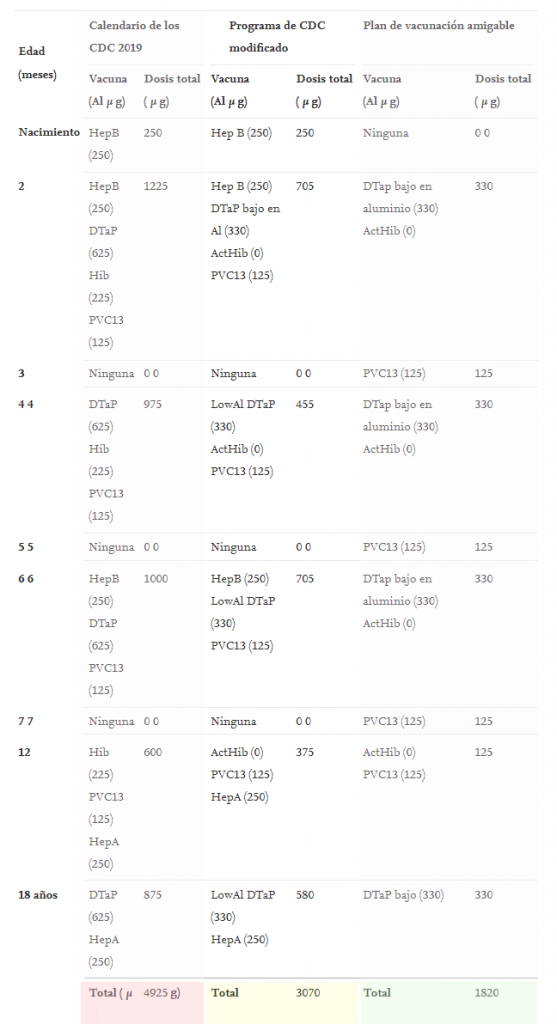
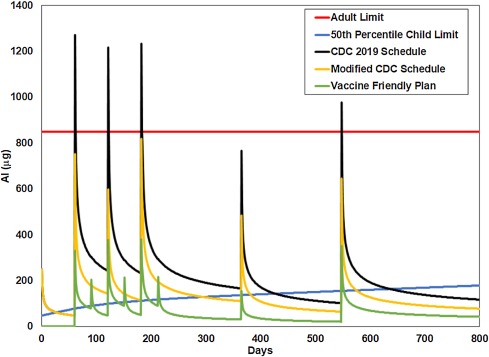
Los niveles mínimos seguros (MSL) para el aluminio (en forma de oxihidróxido de aluminio, fosfato de aluminio o sulfato de aluminio y potasio) son equivalentes al límite de dosis pediátrica estimado por Lyons-Weiler y Ricketson (29,773,196), basado en el límite de la FDA de 850 μ g de aluminio por dosis para adultos. Suponiendo un peso adulto promedio de 60 kg y utilizando la regla de Clark (citada en Lyons-Weiler y Ricketson) conduce a un límite objetivo «seguro» de 14,2 μ g de aluminio por kg de peso corporal como una forma de calcular un ajuste de peso corporal Límite de dosis pediátrica (PDL: Lyons-Weiler y Ricketson, 29,773,196); Figura 1. Esta curva, derivada por Lyons-Weiler y Ricketson, es el único límite de dosis disponible para bebés humanos que considera el peso corporal. Como límite, atiende a la dosis acumulativa y la carga corporal de cualquier fuente si se conocen los valores. Este límite objetivo por peso corporal se usó junto con las distribuciones de peso en la población para estimar un nivel mínimo seguro (MSL) de exposición al aluminio en función de la edad y el porcentaje de peso de un niño. Todos los métodos, cálculos de fuentes de datos utilizados para derivar la Fig. 1 están disponibles en Lyons-Weiler y Ricketson [ 27 ].
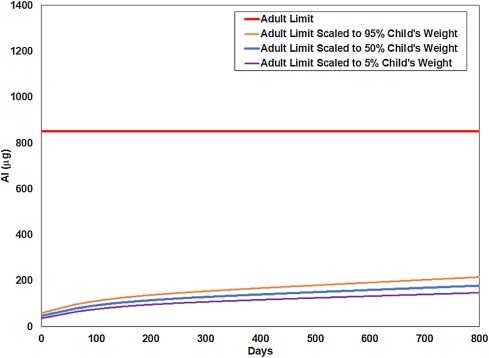
Ninguna de las vacunas individuales viola la guía de un máximo de 850 μ g de aluminio para un adulto ( Tabla 1 ). Sin embargo, debido a las múltiples vacunas que generalmente se administran juntas a los 2, 4 y 6 meses, el programa de los CDC viola este límite incluso suponiendo un peso adulto ([ 27 ]; 29,773,196). Ajustar el límite de dosis segura basado en el peso de un niño a estas edades, por lo tanto, da como resultado dosis que superan con creces el límite seguro estimado de toxicidad aguda (Lyons-Weiler y Ricketson, 29,773,196).
Una limitación del estudio anterior ([ 27 ]; 29,773,196) fue que no consideró la toxicidad crónica debido a la acumulación. El estudio de Priest del 2004 (15,152,306) realizó mediciones repetidas de aluminio retenido durante un período de 12 años de un solo voluntario adulto después de una sola inyección con solución de citrato que contenía 26 Al y un pequeño estudio de otros seis sujetos varones adultos durante un período más corto de tiempo ([ 28]; 7.576.820). El modelo resultante puede ser limitado porque las soluciones de citrato no se usan en la vacunación y los estudios incluyeron adultos en lugar de bebés. Esto podría ser especialmente importante para los bebés, especialmente los recién nacidos, porque un alto porcentaje de ellos tiene una función renal subdesarrollada. Con estas advertencias, Priest sugirió que la fracción de aluminio inyectado retenido en el cuerpo un número determinado de días después de una dosis se puede modelar como:
% de Al retenido = (1-E) / días n (1)
donde E =% de aluminio eliminado en el primer día después de la dosis (E = 65% en forma de Priest), y n = constante de tiempo (n = 0,32 en forma de Priest).
El modelo Priest solo consideró la excreción de la orina, dejando de lado el porcentaje de excreción de las heces, el sudor, el cabello y las uñas. También utilizaron una forma de citrato de aluminio, no utilizada en vacunas [ 54 ]. Sin embargo, con estos parámetros de ajuste, la ecuación de Priest estima la fracción retenida de una dosis durante dos años que muestra una retención significativa en el tiempo ( Tabla 2 ).
Tabla 2 . Retención de aluminio modelada por la ecuación de Priest.
| Días desde la dosis | % De aluminio retenido |
|---|---|
| 0 | 100% |
| 1 | 35% |
| 2 | 28% |
| 3 | 25% |
| 7 | 19% |
| 1 mes | 12% |
| 3 meses | 8% |
| 6 meses | 7% |
| 1 año | 5% |
| 2 años | 4% |
Como se muestra en la Tabla 2 , este modelo estima que tres días después de una dosis inyectada de oxihidróxido de aluminio, el cuerpo aún retendrá el 25% del aluminio original inyectado .
Andress y col. [ 48] (3,807,961) demostraron que ¼ de aluminio introducido por diálisis estaba presente a las dos semanas. Priest y col. (7,779,460) demostraron que la semivida de ese aluminio presente a las 2 semanas fue de 7 años, concluyeron que el aluminio tenía una semivida biológica de 7 años y que era de esperar una acumulación (es decir, un «depósito interno progresivamente creciente»). Por lo tanto, en un calendario denso con vacunas que contienen aluminio (ACV), se puede esperar la acumulación, lo que lleva a la posibilidad de enfermedades crónicas y un desarrollo neurológico deteriorado debido a la toxicidad crónica. No hay buenos datos disponibles sobre cómo la retención de dosis posteriores de aluminio se ve afectada por el aluminio que ya está en el cuerpo. Una posibilidad es que la eliminación de aluminio del cuerpo se vea afectada solo por el aluminio total después de una nueva dosis, en cuyo caso, la ecuación del Priest se puede aplicar al aluminio total con cada nueva dosis restableciendo la velocidad a la que se está eliminando el aluminio. Otra posibilidad es que haya una desaceleración de la tasa de eliminación de aluminio con el tiempo. El aluminio que queda en el cuerpo meses después de una dosis inyectada es aluminio que se ha depositado en el tejido, y el cuerpo elimina el aluminio de esos depósitos muy lentamente, especialmente del cerebro. Bajo esta suposición, la tasa inmediata de que el aluminio se elimine del cuerpo poco después de la exposición, por lo tanto, solo se ve levemente afectada por la adición de aluminio nuevo de una dosis posterior. Este análisis presenta resultados de retención tanto a corto como a largo plazo que modelan las tasas de eliminación de aluminio restablecidas con cada nueva dosis o la eliminación de cada dosis es independiente de todas las demás Tabla 3 .
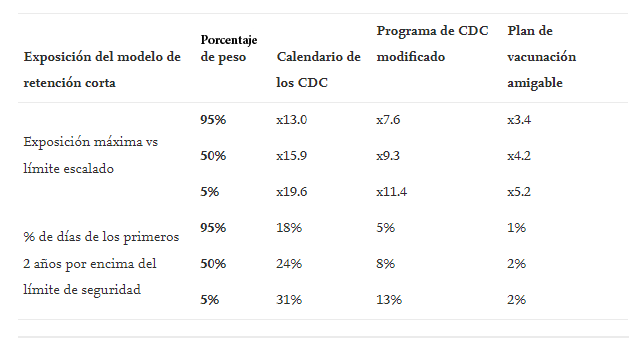
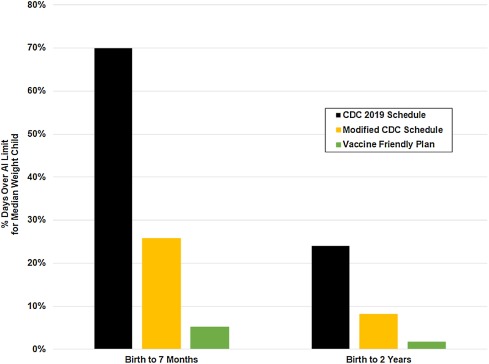
Tabla 3 . Modelo de exposición breve para los tres horarios.
| Exposición del modelo de retención corta | Calendario de los CDC | Programa de CDC modificado | Plan de vacunación amigable |
|---|---|---|---|
| Exposición máxima vs límite escalado | x15.9 | x9.3 | x4.2 |
| % De días sobre el límite de nacimiento a 7 meses | 70% | 26% | 5% |
| % De días sobre el límite de nacimiento a 2 años | 24% | 8% | 2% |
Sabemos poco acerca de si las dosis de aluminio afectan su propia eliminación de todo el cuerpo (no suero), sin embargo, se sabe que el aluminio induce estrés ER y la respuesta de proteína desplegada, y esto se ha identificado como mecanismos plausibles de autoinmunidad inducida por Al y deficiencia de desintoxicación (doi Lyons-Weiler, 10.4172 / 2165–7890.1000224). Parece haber una variación en la capacidad de los humanos para desintoxicar toxinas ambientales relacionadas con trastornos neurodegenerativos [ 29 ] Tabla 4 .
Tabla 4 . Modelo de retención corta Exposición que compara el peso corporal.
Exploramos aún más factores como la deficiencia genética en la eliminación de aluminio, que puede esperarse en algunas familias, y discutimos cómo modelar la posibilidad de que, para algunos individuos, la carga corporal de aluminio en sí misma pueda contribuir a la deficiencia de desintoxicación.
3 . Resultados
3.1 . Modelo 1 – retención corta
La aplicación de la ecuación de Priest a los diferentes horarios (dias de vacunación) nos permite estimar el aluminio total en el cuerpo a diferentes edades en comparación con el límite seguro de escala de peso corporal ( Fig. 2 ).
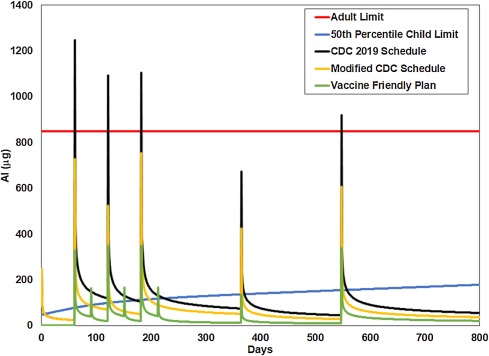
El programa de los CDC cruza el límite recomendado de aluminio para un adulto al recomendar múltiples vacunas que contienen aluminio que se administran juntas. Tenga en cuenta que en todos los días de inyección se supera el límite de seguridad para un niño en los tres horarios; esto apunta a toxicidad aguda Fig. 2 .
Todos estos programas exceden en gran medida el límite de peso ajustado para el aluminio de Lyons-Weiler y Ricketson (29773196). El cronograma de los CDC tiene la mayor violación a 15.9 veces el nivel de seguridad recomendado. Esto ocurre a los 2 meses, cuando se administran simultáneamente cuatro vacunas recomendadas que contienen aluminio. Además, modelar el tiempo para eliminar el aluminio del cuerpo usando la ecuación de Priest estima que para este horario un niño superará el nivel seguro de aluminio en el cuerpo durante 149 días desde el nacimiento hasta los 7 meses, lo que representa aproximadamente el 70% de los días en este período ( Fig. 3) Esto apunta a toxicidad crónica. Durante los primeros dos años de vida, los días que superan el límite estimado se estiman en 176 días o el 24% de los días en este período. El programa de CDC modificado asume las mismas vacunas al mismo tiempo que el programa de los CDC, pero al igual que el Plan Amigable con las Vacunas, asume una dosis más baja de vacuna DTap de aluminio, y también combina ActHib (que no contiene Al) con DTap bajo de aluminio o PVC13 para que El adyuvante de aluminio en la vacuna que contiene aluminio (ACV) activa una respuesta inmune para la vacuna ActHib. Esto reduce el nivel máximo de exposición a aproximadamente el 60% del plan original de los CDC con (de 15.9 a 9.3) y baja los días por encima del límite seguro estimado en los primeros 7 meses del 70% de los días al 26% y en los primeros 2 años del 24% de los días al 8%. El programa del Plan Amigable con las Vacunas se saltea algunas vacunas en los primeros dos años (como HepB) y evita administrar más de dos vacunas que contienen aluminio juntas. Por lo tanto, el VFP (Plan Amigable) limita aún más la exposición máxima a aproximadamente el 25% del programa original de los CDC (de 15.9 a 4.2) y baja los días por encima del límite estimado en los primeros siete meses del 70% de los días al 5% y en los primeros dos años a partir del 24 % de días a 2%.
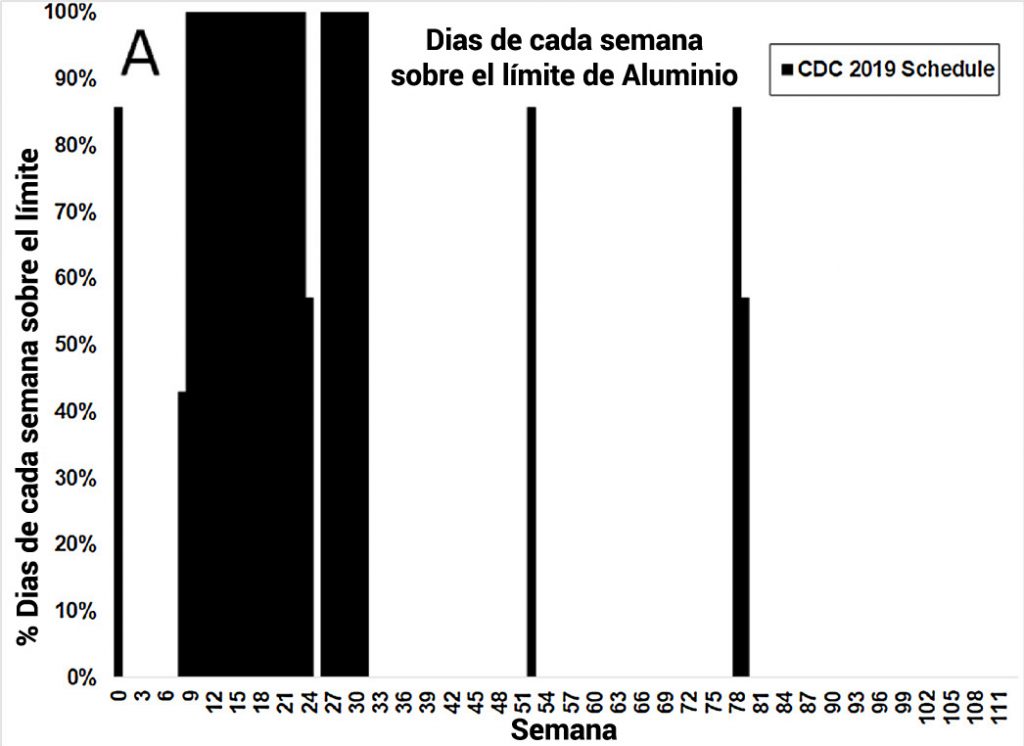
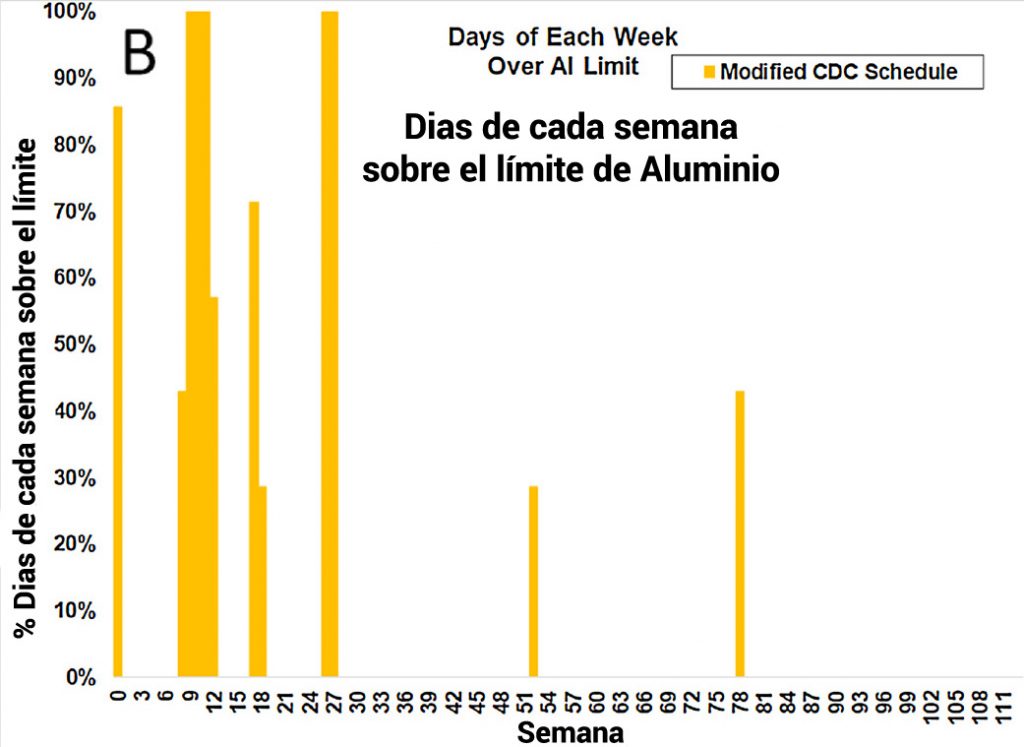
Estos resultados pueden hacerse ilustrativos calculando el «tiempo empleado en toxicidad» ( % alumTox ); es decir, el porcentaje de días de cada semana que un bebé pasa con una carga corporal que excede la curva de nivel mínimo seguro (MSL, también conocido como límite de dosis pediátrica) propuesta por Lyons-Weiler y Ricketson [ 27 ]. Estos tres resultados esperados ( Fig. 4 ) demuestran que el programa de los CDC resulta en el mayor porcentaje de tiempo sobre el MSL (3A); el calendario de los CDC con dosis más bajas de vacunas de aluminio sigue con una reducción significativa en el tiempo dedicado a la toxicidad (3B); y el programa del Plan Amigable con las Vacunas da como resultado una reducción aún mayor del tiempo dedicado a la toxicidad (3C).
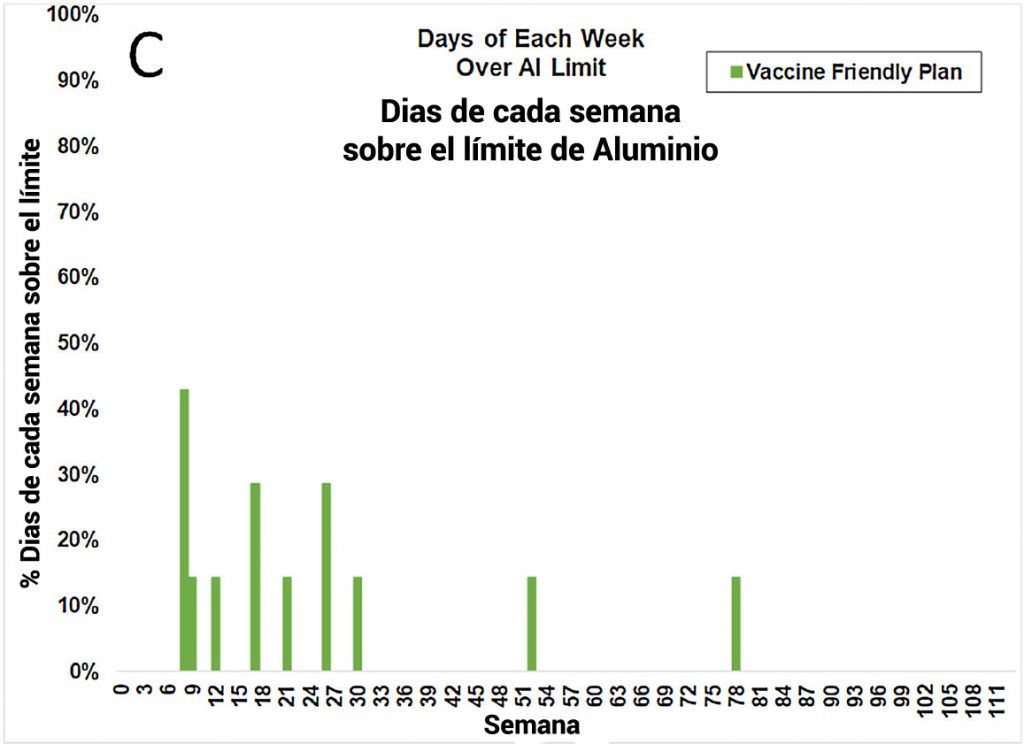
El uso de los diferentes límites de seguridad estimados basados en el porcentaje de la población en el que cae el peso de un bebé puede mostrar cómo los mismos tres horarios podrían tener diferentes impactos en diferentes niños simplemente porque estaban por encima o por debajo del peso medio ( Tabla 7 ).
Tabla 5 . Comparación de horarios frente a modelos de retención a corto y largo plazo.
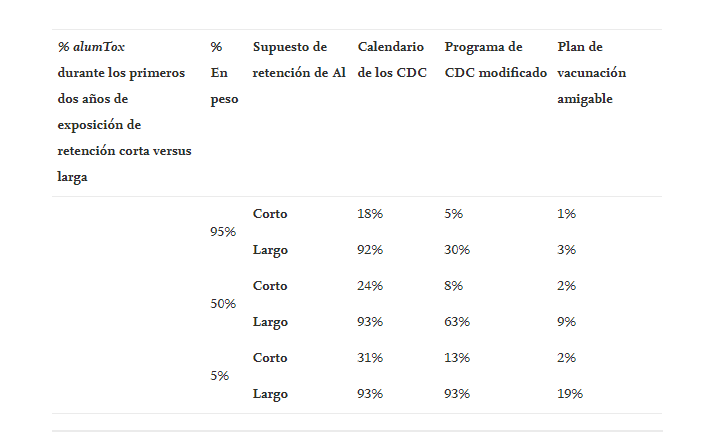
Tabla 6 . Comparación de horario versus límite de aluminio para Al típico y «lento».
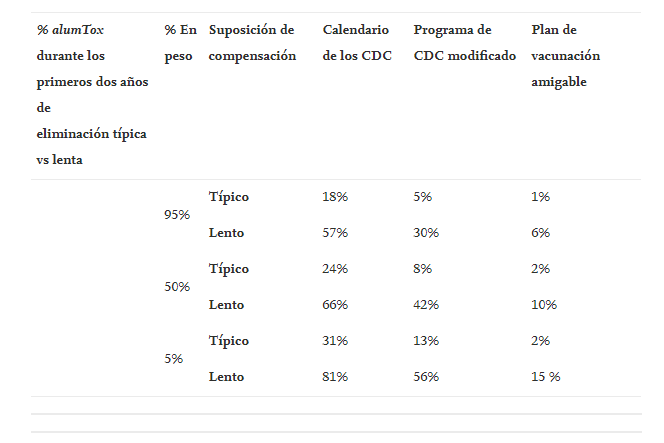
Tabla 7 , % Esperado alumTox , primeros dos años de vida, en tres horarios con y sin desaceleración.

3.2 . Modelo 2 – retención larga
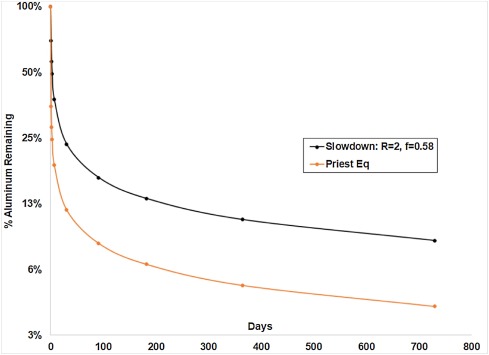
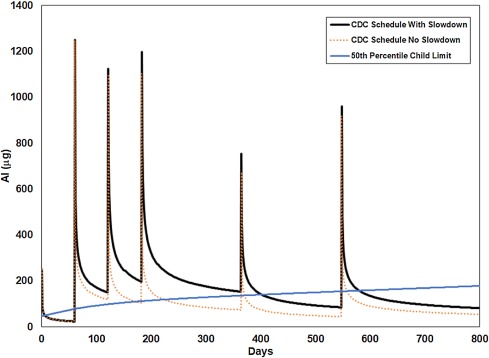
Otro factor a considerar es cómo se aplica mejor la ecuación del Priest a múltiples dosis. Los resultados en el Modelo 1 suponen un comportamiento de «retención corta»; es decir, que cada nueva dosis restablece la velocidad a la que el aluminio se elimina del cuerpo para toda la carga actual del cuerpo de aluminio. Si la limpieza del aluminio se debe principalmente a la cantidad total en el cuerpo, este es un modelo razonable. Sin embargo, si el aluminio es más difícil de eliminar de algunos tejidos del cuerpo en comparación con otros, entonces la tasa decreciente a la que el aluminio se elimina del cuerpo no se debe únicamente a la disminución de la concentración con el tiempo. En cambio, también se ve afectado por el lugar donde se almacena actualmente el aluminio restante de cada dosis. En los adultos, una nueva entrada de aluminio de la siguiente dosis de nivel de vacunación podría no tener un impacto inmediato en el aluminio ya almacenado en el cerebro o los huesos. En el extremo, cada dosis de aluminio se eliminaría a la misma velocidad durante el mismo tiempo, independientemente de las dosis de aluminio que vinieron antes o después. El modelo 2, el modelo de «retención prolongada», hace esta suposición modelando cada dosis de aluminio independientemente de todas las demás. Esto cambia significativamente la acumulación total de aluminio que se espera con el tiempo a partir de dosis múltiples (Fig. 5 ). Dado el modelo de Priest, las concentraciones más altas de aluminio en el cuerpo en general deberían conducir a tasas de limpieza más rápidas, pero el aluminio retenido de las dosis anteriores tenderá a almacenarse en tejidos transparentes más difíciles, incluido el cerebro.
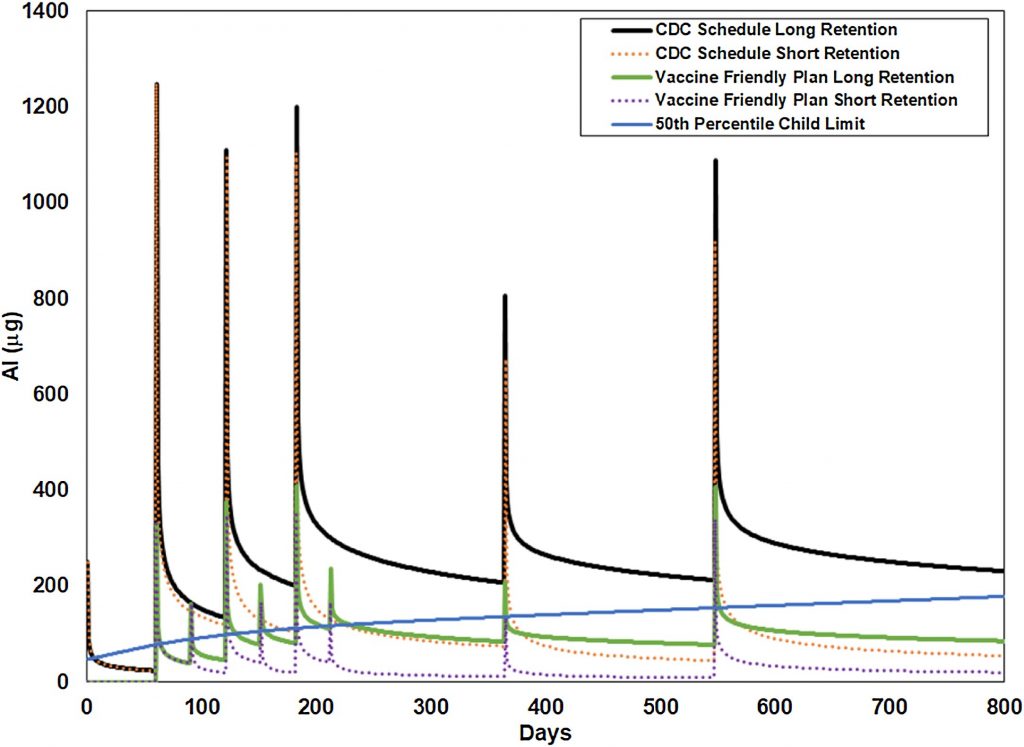
Sin embargo, el cronograma pediátrico de los CDC se aplica a bebés, niños y adolescentes. Se espera que tanto el Modelo 1 como el Modelo sean demasiado optimistas en comparación con la realidad debido a las diferencias de peso corporal entre adultos y bebés. De hecho, los niveles de depuración de Priest pueden no haberse acercado a los niveles tóxicos en los adultos estudiados, por lo que implican tasas de depuración rápidas a altas dosis iniciales. Esto puede hacer que uno espere que a dosis aún más altas por peso corporal en los bebés, que las tasas de eliminación más rápidas ocurran a dosis altas. Sin embargo, con el aumento de la carga corporal a bajo peso corporal, aumentaría la toxicidad del aluminio en todos los tejidos. A nivel intracelular, esto significa deterioro de las mitocondrias, estrés ER, deterioro de los aparatos de Golgi, lo que conduce a tasas de eliminación reducidas de aluminio con daño celular y de órganos que se espera que sea proporcional a la dosis por órgano (μg / kg) y la duración de la exposición por órgano o tejido. Nuestra modificación del modelo de Priest en el Modelo 1 y el Modelo 2 no aborda específicamente este aspecto del aumento de la toxicidad por peso corporal y, por lo tanto, nuestro tratamiento es optimista (sesgado hacia la subestimación de la acumulación).
En la figura 5, las líneas punteadas muestran el aluminio esperado en el cuerpo a partir de la dosis en el cronograma de los CDC y el Plan de vacunación amigable, asumiendo el modelo de retención corta, como fue para las Figuras y tablas anteriores. Las líneas continuas muestran los efectos aditivos para ambos programas asumiendo el modelo de retención larga. Esto muestra cómo el aluminio viejo se acumula más rápido de lo que el cuerpo puede eliminar y el nivel básico de aluminio en el cuerpo antes de que cada nueva dosis aumente constantemente durante los primeros dos años. Si esta es una representación más precisa del aluminio en el cuerpo o no, no está claro, ya que los datos recopilados para el documento original de Priest no midieron los efectos de múltiples dosis espaciadas en el tiempo. Si es así, la comprensión actual de la acumulación de aluminio debido a la programación de los CDC es incorrecta.Tabla 5 ).
3.3 . Modelo 3: impacto de la variación genética en la eliminación de aluminio
En el análisis original de Priest, el estudio siguió a un solo voluntario adulto durante 12 años para estimar cómo se retiene el aluminio en el cuerpo. Si suponemos que este voluntario era típico en su capacidad para eliminar el aluminio del cuerpo, es razonable preguntarse si algunos niños, debido a factores genéticos, podrían eliminar el aluminio a un ritmo más lento que el promedio. Matemáticamente, esto simplemente significa que diferentes individuos pueden modelarse mejor usando diferentes valores para el parámetro E (excreción) en la ecuación de Priest. Podemos modificar los parámetros de ajuste utilizados en la ecuación de Priest para tratar de modelar cómo un programa de vacunación puede afectar a los niños con una capacidad reducida para eliminar el aluminio, suponiendo que parte de la población pueda eliminar el aluminio a solo la mitad de la tasa típica que correspondería a un parámetro E del 30% Fig. 6 ).
El programa de vacunación típico pone las dosis lo suficientemente juntas en el tiempo como para que los niños con una capacidad significativamente reducida para eliminar el aluminio de hecho vean niveles significativamente más altos durante gran parte de sus primeros dos años de vida como resultado ( Fig. 6 ). La comparación de la exposición típica y la exposición de esta subpoblación muestra variaciones entre los programas ( Tabla 7 ).
Debido a que la dosis de aluminio es la misma independientemente de qué tan bien se elimine el aluminio del cuerpo, la exposición máxima frente al límite recomendado no cambia significativamente en función de los diferentes supuestos sobre la retención de aluminio. Sin embargo, los días que superan el límite escalado cambian drásticamente. Para un niño de peso medio, el horario de los CDC cambia del 24% de los días en los primeros dos años por encima del límite recomendado para un niño típico al 66% si el aluminio se elimina solo a la mitad de la tasa normal. El Horario de los CDC modificado y el Plan de vacunación amigable también ven grandes aumentos en días por encima del límite estimado, aunque permanecen significativamente por debajo del total de días del horario de los CDC. ¿Qué tan grande es una subpoblación que eliminaría el aluminio de esta manera?
3.4 . Modelo 4: impacto de la deficiencia de desintoxicación inducida por aluminio
Además de la posible variación en el valor de E que modelaría mejor a diferentes niños, se ha especulado que, al menos para algunas personas, la capacidad del cuerpo para eliminar el aluminio podría verse ralentizada por la exposición previa al aluminio. Esto se modelaría haciendo que el parámetro E sea una función del nivel de aluminio actualmente en el cuerpo. El Modelo 3 estimó el impacto en las personas para quienes los factores genéticos hacen que el valor de E (que mide su capacidad para eliminar el aluminio) sea más bajo de lo normal. En el Modelo 4, consideramos cómo podría modificarse la ecuación de Priest para mostrar el impacto en las personas que tienen una capacidad típica de eliminar el aluminio sin la presencia de aluminio en su cuerpo, pero que muestran una capacidad de eliminación reducida para las dosis posteriores debido al aluminio. Deficiencia de desintoxicación inducida.(2) : (2)% de aluminio retenido = (1-E / S) / días n
Un factor de desaceleración basado en el nivel actual de aluminio en el cuerpo puede basarse en una relación (R) del nivel de aluminio en el momento de una nueva dosis frente al límite seguro estimado de aluminio, y escribir el factor de desaceleración (S) de la ecuación (2) como:(3)S=1+F×R
Se puede elegir un valor del parámetro de ajuste f para dar un impacto esperado a la retención de aluminio para un nivel dado de exposición previa. Por ejemplo, podríamos suponer que ya está al doble del límite seguro (R = 2) cuando recibe una nueva dosis hace que la tasa de eliminación se reduzca a la mitad en comparación con alguien sin exposición. Encontramos que esto es cierto cuando suponemos que f = 0.58. El impacto de esta suposición en la fracción esperada de aluminio retenido en el cuerpo con el tiempo es bastante significativo ( Fig. 7 ):
El impacto de esta supuesta desaceleración en el aluminio estimado en el cuerpo para el programa de los CDC muestra una mayor retención en relación con el modelo del paciente que supone una eliminación promedio de aluminio ( Fig. 7 ).
Debido a que la dosis de aluminio es la misma, independientemente de qué tan bien se elimine el aluminio del cuerpo, la exposición máxima frente al límite recomendado no cambia según los supuestos diferentes sobre la retención de aluminio. Sin embargo, la biología (genética) puede poner a algunas personas en riesgo de mayor toxicidad crónica. Los días por encima del límite escalado cambian dramáticamente en respuesta a tales suposiciones. El horario de los CDC cambia del 24% de los días en los primeros dos años por encima del límite recomendado para un niño de peso medio al 52% si el aluminio desaparece a solo la mitad de la tasa normal cuando un niño que recibe una nueva dosis ya está al doble del límite de aluminio seguro . El cronograma modificado de los CDC y el Plan de vacunación amigable también dan como resultado grandes aumentos en días por encima del límite estimado, aunque permanecen significativamente por debajo del total de días del cronograma de los CDC. Fig. 8
4 . Discusión
Bajo nuestras condiciones modeladas, el mayor porcentaje esperado de alumTox ocurriría en bebés con bajo peso al nacer o con peso corporal con una deficiencia de desintoxicación genética o ambiental, como aquellos nacidos de madres de bajos ingresos o que están desnutridos (59% de días de toxicidad, Lista de CDC , 5to. porcentaje de peso corporal, con desaceleración; Tabla 7 ). Factores como el peso al nacer y la edad gestacional, por lo tanto, no deben usarse como factores de confusión en los estudios epidemiológicos sobre el papel de las vacunas, sino que deben usarse como factores de riesgo compartido.
Una pregunta importante que plantean estos resultados es cómo juzgar mejor un nivel «seguro» de exposición al aluminio. Las estimaciones de exposición y retención de aluminio no son útiles sin algún límite seguro con el que comparar. Los vínculos entre el aluminio y varios trastornos harían innecesario suponer que existe un nivel de aluminio que es universalmente “seguro”, y se ha demostrado que el impacto de la exposición oral e inyectada varía, con una absorción normal de solo un pequeño porcentaje de ingestión de formas de aluminio. La FDA ha recomendado limitar las dosis inyectadas para adultos a 850 μg . Este nivel refleja la cantidad mínima considerada necesaria para inducir una respuesta inmune en adultos. Las prácticas de dosificación médica estándar y los principios toxicológicos exigirían escalar este límite en función del peso para calcular las dosis para niños, suponiendo que los niveles de dosis seguros sean diferentes para un adulto de 60 kg en comparación con un recién nacido de 3 kg. Incluso si todas las vacunas individuales en un programa propuesto cumplen con este límite ajustado de peso, la administración de múltiples vacunas que contienen aluminio en un solo día podría exceder fácilmente un límite seguro recomendado que considera el peso corporal.
Este estudio se ha centrado en la retención de aluminio en todo el cuerpo a lo largo del tiempo en los primeros dos años de vida, demostrando la viabilidad de agregar parámetros modelo para abordar la variación biológica entre humanos, ya sea por genética o por exposiciones previas que influyen en las tasas de desintoxicación de todo el cuerpo. Los resultados de Priest muestran que después de una sola inyección, aproximadamente el 5% del aluminio original permanece en el cuerpo de un adulto un año después de la dosis, pero examinó solo el aluminio excretado en la orina. Incluso suponiendo que los bebés estén limpios al mismo ritmo que los adultos, lo que no se basa en ninguna evidencia empírica, es razonable esperar que no solo la dosis de las vacunas, sino qué tan cerca estén espaciadas en el tiempo afecte el nivel de aluminio para los bebés en el primer dos años de vida dado su bajo peso corporal.
Entre los tres cronogramas presentados aquí, el cronograma de los CDC excede el límite de dosis recomendado para un bebé (inferido de los niveles «seguros» para adultos de la FDA) como resultado de la administración simultánea de múltiples ACV y espacio insuficiente de los ACV. El programa del Plan Amigable con las Vacunas evita esto al sugerir que solo se administren vacunas que contengan aluminio de una en una y al elegir marcas de vacunas con bajo contenido de aluminio, reduciendo así la cantidad de días que la carga corporal de un individuo excede la MSL basada en PDL. El uso de estas mismas marcas en el programa de los CDC evita exceder el límite de dosis recomendado para un adulto. Todos los horarios exceden un límite ajustado por peso para un niño de peso medio, pero el porcentaje de días por encima del MSL se ve dramáticamente afectado por la forma en que se modela la retención, lo que demuestra que es un área importante para el trabajo futuro.
Nuestro enfoque utilizó la PDL ajustada por peso inferida por Lyons-Weiler y Ricketson como una MSL, que se basa en la suposición de la FDA de que 850 μ g de aluminio son seguros para un adulto de 150 kg. Se sabe que esta suposición es dudosa porque se basa en el estudio de formas ingeridas de aluminio en ratones adultos, no de formas inyectadas en aluminio en ratones lactantes o humanos. Toda la procedencia de la determinación de 850 μ g de “seguridad” en adultos fue revisada en detalle por Lyons-Weiler y Ricketson [ 27 ]. Lyons-Weiler y Ricketson también lamentaron la falta de datos de nivel seguro relevantes para los humanos que superen el límite de 4–5 mcg / kg / día publicado por la FDA [ 30] para personas con disfunción renal. Bebés en la unidad neonatal muy a menudo han limitado la función renal, y sin embargo FDA permite la vacunación HepB – con 250 μ g de oxihidróxido de aluminio – en el día 1 de la vida si un bebé es> 2 kg de la masa. Lyons-Weiler y Ricketson nunca utilizaron 4–5 μ g / kg / día como punto de referencia para las pruebas de hipótesis estadísticas, pero su análisis sugirió que si existe un nivel seguro de μ g / kg / día ajustado al peso corporal el día 1 de vida , se supera con la vacunación de incluso los lactantes de peso medio. Sin embargo, debido a la determinación de la FDA de que 850 μg / kg / día es seguro para adultos es falso, la PDL utilizada por Lyons-Weiler y Ricketson es solo un marco de nivel de referencia. Finalmente, nuestros resultados representan el porcentaje del 50% del peso corporal en la población de los Estados Unidos; claramente, las personas con un peso corporal más bajo tendrán los cambios correspondientes en la toxicidad crónica reflejada por un mayor porcentaje de días en cada semana que pasen niveles tóxicos de aluminio en todo el cuerpo ( % alumTox ).
A pesar de estas incertidumbres, los resultados de nuestro estudio sugieren que al ajustar las vacunas administradas y / o espaciar las vacunas que contienen aluminio a tiempo, el número de días a niveles altos de aluminio puede verse significativamente afectado, y que la toxicidad crónica por aluminio es una posibilidad para algunos individuos, dependiendo del peso corporal y la genética. La dosis de aluminio para diferentes vacunas, cómo están espaciadas en el tiempo, el peso del niño que las recibe y las variantes genéticas que pueden limitar la capacidad de eliminar el aluminio parecen ser consideraciones importantes para determinar un calendario de vacunación más seguro. El original de Priest et al. (2004; 15,152,306) el análisis examinó los efectos de una dosis única, pero no consideró la variación genética en las tasas de eliminación de aluminio y parece haber hecho una suposición de «reinicio» de dosis sucesivas. Pueden justificarse estudios empíricos sobre la depuración de todo el cuerpo en individuos que razonablemente se espera que tengan un alto riesgo de enfermedades y trastornos que se cree que se deben a la intolerancia genética de los tipos de vacunas de aluminio, en comparación con aquellos sin ningún problema. Los efectos de dosis sucesivas de aluminio en las tasas de eliminación proporcionarían datos para el ajuste del modelo y del parámetro del modelo. Modelado de toxicidad sinérgica con fluoruro ([31 ]; 30788699, [ 32 ], 19.284.184; van der Voet [ 56 ]; 10,455,554) y con mercurio ([ 33 ], 29,938,114; 26,774,584) incluyendo el timerosal (29,895,363) podrían ser esclarecedores y podrían informar importantes opciones de vida por parte de los consumidores de productos médicos y otros productos.
Se puede esperar que la toxicidad por aluminio de las vacunas aumente por otras exposiciones como el aluminio en los alimentos (fórmula; [ 34 ]; 30,871,123) y el aluminio utilizado para amortiguar el agua potable. Los lactantes individuales con barreras intestinales cerradas de forma incompleta o con lesiones gástricas e intestinales autoinmunes pueden experimentar dosis mucho más altas de aluminio de lo que un pediatra puede tener en cuenta. Ahora se ha encontrado aluminio en los cerebros de las personas que han muerto con diversos diagnósticos, incluidos esclerosis múltiple, epilepsia, enfermedad de Parkinson, enfermedad de Alzheimer y trastorno del espectro autista ([ 35 ]; 31,468,176). La toxicidad del aluminio en todo el cuerpo es importante porque el aluminio afecta el cerebro, los huesos, la paratiroides, el bazo, los riñones ([ 36]; 31,008,371) y, por supuesto, el sistema inmune. De estos compartimientos, la eliminación cerebral de aluminio es el más lento; en ratas, se descubrió que la vida media del aluminio era de 150 días, pero el despacho se aceleró a través de deferoxamina (también conocida como desferoxamina; [ 37 ]). Un estudio que demuestra que el consumo de aguas minerales ricas en sílice también puede mejorar la liberación de aluminio del cerebro es de interés ([ 15 ]; 22,976,072). La suplementación cuidadosa con compuestos de Chlorella y Spirulina son esenciales para evitar la redistribución y la reextracción de una carga corporal de aluminio existente.
Todos los análisis hasta la fecha, incluido el nuestro, utilizan datos de tasa de eliminación de aluminio de adultos, lo que probablemente sea una tasa de limpieza de aluminio demasiado optimista para recién nacidos y lactantes. La mayor parte de la excreción de aluminio se logra mediante la filtración de aluminio de la sangre por los glomérulos del riñón. La función renal en los lactantes no está completamente desarrollada: la tasa de filtración glomerular ( GFR ) de los lactantes no está completamente en línea al nacer y aumenta de 10 a 20 ml / min / 1.73 m 2 durante el primer día de vida a 30–40 ml / min / 1,73 m 2 por 2 semanas de vida (Sulemanji y Vakili [ 55 ]; 24.331.094). En los recién nacidos, la GFR al nacer es aún peor (Sulemanji y Vakili [ 55]]; 24,331,094) y aumenta más lentamente en comparación con los bebés (3,761,090). Si bien el riñón está estructuralmente maduro a las 36 semanas, la TFG no alcanza los niveles de adultos hasta los 2 años de edad ([ 38 , 49 ]; 8,006,805). Las condiciones emergentes comunes en la UCIN incluyen síndrome de dificultad respiratoria, convulsiones y arritmias y paro cardíaco. Para maximizar la eficiencia, los bebés en la NICU ( Infants in the Neonatal Intensive Care Unit) a menudo se vacunan simultáneamente con equipos de emergenia listos en espera. Los estudios realizados en el año 2000 con las vacunas DTP mostraron una increíble tasa de eventos cardíacos del 46% en lactantes en la NICU después de la vacunación ([ 39 ]; 17,056,868). Estudios de vacunación contra la hepatitis B en la década de 1990 ([ 40]; 10.591.306) no son relevantes para las preocupaciones sobre los eventos adversos inducidos por el aluminio porque la vacuna Hep B no contenía oxihidróxido de aluminio (aunque sí contenía etilmercurio); sin embargo, los estudios de los sistemas de vigilancia pasiva rutinariamente atribuyen la mayoría de las muertes a la coincidencia. Un estudio chino [ 58] (30,709,723) encontraron 795 muertes, con> 95% de ellas ocurriendo después de la vacunación contra la hepatitis B en niños <5 años, pero la mayoría se atribuyeron a «coincidencia». Esta es una conclusión extraña, dado que los sistemas de vigilancia pasiva no pueden atribuir causalidad. De las 795 muertes, 594 (74%) se clasificaron como eventos «coincidentes», pero se descubrió que el SMSL es la principal causa de muerte en los bebés. El SMSL, una condición de causa desconocida, no se considera un evento adverso esperado. Los estudios de la década de 1990 en los Estados Unidos atribuyeron de manera similar, sin evidencia independiente, la mayoría de los eventos adversos graves de la vacunación HepB a la coincidencia. Dado que los sistemas de vigilancia pasiva no pueden atribuir causalidad, tampoco pueden descartar la causalidad y, por lo tanto, la atribución a la coincidencia parece oportunista en el peor de los casos y optimista en el mejor de los casos. Los autores del estudio chino elogiaron la ‘sensibilidad’ de su sistema de vigilancia pasiva después de descartar muertes inesperadas como ‘coincidencia’. En realidad, esto refleja una falla grave en el uso de sistemas de vigilancia pasiva para monitorear la seguridad de las vacunas, que rutinariamente reportan eventos adversos por un factor de 100 fallas en cada informe [41 ]
5 . Significado traslacional
Un estudio de ratones neonatales inyectados con oxihidróxido de aluminio demostró un interés social disminuido y una novedad social anormal en comparación con los ratones de control salino ([ 42 ]; 29,221,615). Dados nuestros cálculos de dosificación, y la realidad de las diferencias entre la función renal adulta humana, infantil y neonatal, la preocupación reciente y reiterada por la deficiencia de desintoxicación de aluminio en neonatos y lactantes de la comunidad médica y de investigación ([ 43 ]; 24801228, [ 44 ]; 28,752,219; [ 45 ]; 29,721,353; [ 46 ]; 29,729,447; Parker et al. [ 53] 2019; 30,466,934), la FDA ya debería haber actuado sobre la revisión del calendario de los CDC, y pasar inmediatamente a recomendar el uso de alimentos y agua que no contengan ACV y que no contengan aluminio durante estas etapas importantes del desarrollo neurológico. Dado el conjunto de limitaciones de las tasas de eliminación estimadas disponibles, nuestros resultados probablemente subestiman significativamente la toxicidad crónica, definida por el número de días durante un período de tiempo que un individuo tiene una carga corporal de aluminio que excede la PDL. No podemos enfatizar cuán importante es que los bebés eviten el aluminio de todas las fuentes, en todas las dosis, debido a la realidad del riesgo acumulativo de la exposición acumulativa. Se recomienda seleccionar marcas de vacunas que contengan cantidades más bajas de aluminio y evitar las vacunas combinadas que tienen las mayores cantidades de aluminio para reducir la toxicidad. 47 ]; 17.498.851) puede ser un cambio médicamente beneficioso y económico en el enfoque del desarrollo de vacunas más seguras. Requerir dosis más bajas de adyuvantes, períodos más largos de inmunoeficacia y cronogramas de vacunas más seguros para la aprobación de la vacuna por parte de la FDA para que los recién nacidos y los lactantes tengan una exposición reducida a los metales neurotóxicos durante el desarrollo pueden ser más aceptables para un público cada vez más consciente del riesgo de la vacuna debido a la exposición reducida a metales neurotóxicos e inmunotóxicos durante el desarrollo.
La nueva medida, % alumTox , refleja un alto grado de toxicidad crónica en los primeros siete meses de vida según el programa de los CDC, que se puede evitar mediante cambios en el programa, incluido el uso de no ACV. Estos meses son críticamente importantes para el desarrollo neurológico y para el desarrollo del sistema inmune. Recomendamos encarecidamente que la FDA de EE. UU. Actualice su modus operandi para considerar los datos de los estudios de formas inyectadas de aluminio en ratones lactantes, y que la FDA establezca límites mensuales específicos de edad para la exposición al aluminio en toto (todas las fuentes), incluidos 1 o más ACV administrados en el mismo mes. En ausencia de estudios de aumento de dosis en ratones lactantes, sugerimos que adopten la PDL que considera el peso corporal y expresan los límites de exposición al considerar todas las fuentes, incluyendo 1 o más ACV por mes y considerando el peso corporal. Estamos explorando la utilidad de diseñar una aplicación web simple a través de la cual las personas, los padres y sus médicos pueden estimar la acumulación esperada de aluminio, incluido el % alumTox , en varios horarios, para que los pediatras y los pacientes puedan controlar las exposiciones infantiles considerando todas las fuentes. Dada la conocida toxicidad sinérgica del mercurio y el aluminio, nuestros hallazgos pueden merecer alertas formales sobre las intenciones para la administración simultánea de vacunas que contienen timerosal y ACV.
Referencias
[1] T.R. GhimireThe mechanisms of action of vaccines containing aluminum adjuvants: an in vitro vs in vivo paradigmSpringerplus, 4 (2015), p. 181Https://doi. Org/10.1186/s40064-015-0972-0. Https://www.Ncbi.nlm.nih.gov/pubmed/25932368 View Record in ScopusGoogle Scholar
[2] G.J. Fernando, T.J. Stewart, R.W. Tindle, I.H. FrazerVaccine-induced Th1-type responses are dominant over Th2-type responses in the short term whereas pre-existing Th2 responses are dominant in the longer termScand. J. Immunol., 47 (5) (1998)459-65s Google Scholar
[3] A.S. McKee, M.W. Munks, M.K. MacLeod, et al.Alum induces innate immune responses through macrophage and mast cell sensors, but these sensors are not required for alum to act as an adjuvant for specific immunityJ. Immunol., 183 (7) (2009), pp. 4403-4414, 10.4049/jimmunol.0900164CrossRefView Record in Scopus Google Scholar
[4] A. Gołoś, A. LutyńskaAluminium-adjuvanted vaccines–a review of the current state of knowledgePrzegl. Epidemiol., 69 (4) (2015)731-4, 871-4Google Scholar
[5] E. Güven, K. Duus, I. Laursen, P. Højrup, G. HouenAluminum oxyhydroxide adjuvant differentially activates the three complement pathways with major involvement of the alternative pathwayPLoS One, 9 (September (9)) (2013), 10.1371/journal.pone.0074445e74445. 8Google Scholar
[6] R.K. GuptaAluminum compounds as vaccine adjuvantsAdv. Drug Deliv. Rev., 32 (no.3) (1998), pp. 155-172Https://www.Ncbi.nlm.nih.gov/pubmed/10837642ArticleDownload PDFView Record in ScopusGoogle Scholar
[7] M.S. Petrik, M.C. Wong, R.C. Tabata, R.F. Garry, C.A. ShawAluminum adjuvant linked to Gulf War Illness induces motor neuron death in miceNeuromolecular Med., 9 (no.1) (2007)83-100. Https://www.Ncbi.nlm.nih.gov/pubmed/17114826Google Scholar
[8] G. Crépeaux, R.K. Gherardi, F.J. AuthierAsia, Chronic fatigue syndrome, and selective low dose neurotoxicity of aluminum adjuvantsJ. Allergy Clin. Immunol. Pract., 6 (no.2) (2018), p. 707Https://doi. Org/10.1016/j. Jaip.2017.10.039. Https://www.Ncbi.nlm.nih.gov/pubmed/29525002. Mar – Apr 2018ArticleDownload PDFView Record in ScopusGoogle Scholar
[9] R.K. Gherardi, G. Crépeaux, F.J. AuthierMyalgia and chronic fatigue syndrome following immunization : macrophagic myofasciitis and animal studies support linkage to aluminum adjuvant persistency and diffusion in the immune systemAutoimmun. Rev., 18 (no.7) (2019), pp. 691-705Https://doi. Org/10.1016/j. Autrev.2019.05.006. Https://www.Ncbi.nlm.nih.gov/pubmed/31059838ArticleDownload PDFView Record in ScopusGoogle Scholar
[10] J.D. Masson, G. Crépeaux, F.J. Authier, C. Exley, R.K. GherardiCritical analysis of reference studies on the toxicokinetics of aluminum-based adjuvantsJ. Inorg. Biochem., 181 (04) (2018), pp. 87-95Https://doi. Org/10.1016/j. Jinorgbio.2017.12.015. Https://www.Ncbi.nlm.nih.gov/pubmed/29307441ArticleDownload PDFView Record in ScopusGoogle Scholar
[11] G. Crépeaux, H. Eidi, M.O. David, Y. Baba-Amer, E. Tzavara, B. Giros, F.J. Authier, et al.Non-linear dose-response of aluminium hydroxide adjuvant particles: selective low dose neurotoxicityToxicology, 375 (2017), pp. 48-57Https://doi. Org/10.1016/j. Tox.2016.11.018. Https://www.Ncbi.nlm.nih.gov/pubmed/27908630ArticleDownload PDFView Record in ScopusGoogle Scholar
[12] M. Rigolet, J. Aouizerate, M. Couette, N. Ragunathan-Thangarajah, M. Aoun-Sebaiti, R.K. Gherardi, J. Cadusseau, F.J. AuthierClinical features in patients with long-lasting macrophagic myofasciitisFront. Neurol., 5 (2014), p. 230Https://doi. Org/10.3389/fneur.2014.00230. Https://www.Ncbi.nlm.nih.gov/pubmed/25506338.View Record in ScopusGoogle Scholar
[13] N.D. PriestThe biological behaviour and bioavailability of aluminium in man, with special reference to studies eEmploying Aluminium-26 as a tracer: review and study updateJ. Environ. Monit., 6 (no.5) (2004), pp. 375-403Https://doi. Org/10.1039/b314329p. Https://www.Ncbi.nlm.nih.gov/pubmed/15152306View Record in ScopusGoogle Scholar
[14] R. Kandimalla, J. Vallamkondu, E.B. Corgiat, K.D. GillUnderstanding aspects of aluminum exposure in alzheimer’s disease developmentBrain Pathol., 26 (no.2) (2016), pp. 139-154Https://doi. Org/10.1111/bpa.12333. Https://www.Ncbi.nlm.nih.gov/pubmed/26494454CrossRefView Record in ScopusGoogle Scholar
[15] S. Davenward, P. Bentham, J. Wright, P. Crome, D. Job, A. Polwart, C. ExleySilicon-rich mineral water as a non-invasive test of the’ Aluminum hypothesis’ in alzheimer’s diseaseJ. Alzheimers Dis., 33 (no.2) (2013), pp. 423-430Https://doi. Org/10.3233/JAD-2012-121231. Https://www.Ncbi.nlm.nih.gov/pubmed/22976072View Record in ScopusGoogle Scholar
[16]D.A. ClarkCytokines, decidua, and early pregnancyOxf. Rev. Reprod. Biol., 15 (1993), pp. 83-111Https://www.Ncbi.nlm.nih.gov/pubmed/7687764View Record in ScopusGoogle Scholar
[17]K.P. Sharma, N. Upreti, S. SharmaProtective effect of Spirulina and tamarind fruit pulp diet supplement in fish (Gambusia affinis baird & girard exposed to sublethal concentration of fluoride, aluminum and aluminum fluorideIndian J. Exp. Biol., 50 (no.12) (2012), pp. 897-903Https://www.Ncbi.nlm.nih.gov/pubmed/23986974View Record in ScopusGoogle Scholar
[18]G. Bjorklund, V. Stejskal, M.A. Urbina, M. Dadar, S. Chirumbolo, J. MutterMetals and parkinson’s disease: mechanisms and biochemical processesCurr. Med. Chem., 25 (no.19) (2018), pp. 2198-2214Https://doi. Org/10.2174/0929867325666171129124616. Https://www.Ncbi.nlm.nih.gov/pubmed/29189118View Record in ScopusGoogle Scholar
[19]M. Yasui, T. Kihira, K. Ota, M. Mukoyama, L. AdachiAluminum deposition in the central nervous system tissues of patients with Parkinson’s diseaseRinsho Shinkeigaku, 31 (10) (1991)1095-8. https://www.ncbi.nlm.nih.gov/pubmed/1802464Google Scholar
[20]M.J. Mold, J. Cottle, C. ExleyAluminium in brain tissue in epilepsy: a case report from CamelfordInt. J. Environ. Res. Public Health, 16 (no.12) (2019)Https://doi. Org/10.3390/ijerph16122129. Https://www.Ncbi.nlm.nih.gov/pubmed/31208130. 06Google Scholar
[21]M. Mold, D. Umar, A. King, C. ExleyAluminium in brain tissue in autismJ. Trace Elem. Med. Biol., 46 (2018), pp. 76-82Https://doi. Org/10.1016/j. Jtemb.2017.11.012. Https://www.Ncbi.nlm.nih.gov/pubmed/29413113ArticleDownload PDFView Record in ScopusGoogle Scholar
[22]T.K. Murphy, D.M. Gerardi, J.F. LeckmanPediatric acute-onset neuropsychiatric syndromePsychiatr. Clin. North Am., 37 (no.3) (2014)353-74. Https://doi. Org/10.1016/j. Psc.2014.06.001. Https://www.Ncbi.nlm.nih.gov/pubmed/25150567Google Scholar
[23]S. Sigra, E. Hesselmark, S. BejerotTreatment of pandas and pans: a systematic reviewNeurosci. Biobehav. Rev., 86 (03) (2018), pp. 51-65Https://doi. Org/10.1016/j. Neubiorev.2018.01.001. Https://www.Ncbi.nlm.nih.gov/pubmed/29309797ArticleDownload PDFView Record in ScopusGoogle Scholar
[24]M. Cortes Rivera, C. Mastronardi, C.T. Silva-Aldana, M. Arcos-Burgos, B.A. LidburyMyalgic Encephalomyelitis/Chronic fatigue syndrome: a comprehensive reviewDiagnostics Basel (Basel), 9 (no.3) (2019)Https://doi. Org/10.3390/diagnostics9030091. Https://www.Ncbi.nlm.nih.gov/pubmed/31394725Google Scholar
[25]J.G. Dórea, R.C. MarquesInfants’ exposure to aluminum from vaccines and breast milk during the first 6 monthsJ. Expo. Sci. Environ. Epidemiol., 20 (no.7) (2010), pp. 598-601Https://doi. Org/10.1038/jes.2009.64. Https://www.Ncbi.nlm.nih.gov/pubmed/20010978CrossRefView Record in ScopusGoogle Scholar
[26]P. Thomas, J. MargulisThe Vaccine-Friendly Plan (Book), Penguin Random House PublishingNew York City, NY (2016)Google Scholar
[27]J. Lyons-Weiler, R. RicketsonReconsideration of the immunotherapeutic pediatric safe dose levels of aluminumJ. Trace Elem. Med. Biol., 48 (2018), pp. 67-73Https://doi. Org/10.1016/j. Jtemb.2018.02.025. Https://www.Ncbi.nlm.nih.gov/pubmed/29773196ArticleDownload PDFView Record in ScopusGoogle Scholar
[28]R.J. Talbot, D. Newton, N.D. Priest, J.G. Austin, J.P. DayInter-subject variability in the metabolism of aluminium following intravenous injection as citrateHum. Exp. Toxicol., 14 (no.7) (1995)595-9. Https://doi. Org/10.1177/096032719501400707. Https://www.Ncbi.nlm.nih.gov/pubmed/7576820Google Scholar
[29]J.T. Greenamyre, P. BarretGenetic Factors in Environmentally Induced Disease. Pp 21-43 in: Environmental Factors in Neurodevelopmental and Neurodegenerative DisordersAcademic Press (2015)Google Scholar
[30]FDACFR – Code of Federal Regulations Title 21(2018)https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=201.323Google Scholar
[31]A.A. KinawySynergistic oxidative impact of aluminum chloride and sodium fluoride exposure during early stages of brain development in the ratEnviron. Sci. Pollut. Res. Int., 26 (no.11) (2019)10951-60. Https://doi. Org/10.1007/s11356-019-04491-w. Https://www.Ncbi.nlm.nih.gov/pubmed/30788699Google Scholar
[32]R.L. BlaylockA possible central mechanism in autism spectrum disorders, Part 3: the role of excitotoxin food additives and the synergistic effects of other environmental toxinsAltern. Ther. Health Med., 15 (no.2) (2009), pp. 56-60Mar-Apr 2009Https://www.Ncbi.nlm.nih.gov/pubmed/19284184View Record in ScopusGoogle Scholar
[33]P.N. Alexandrov, A.I. Pogue, W.J. LukiwSynergism in aluminum and mercury neurotoxicityIntegr. Food Nutr. Metab., 5 (no.3) (2018)Https://doi. Org/10.15761/IFNM.1000214. Https://www.Ncbi.nlm.nih.gov/pubmed/29938114Google Scholar
[34]J. Redgrove, I. Rodriguez, S. Mahadevan-BavaExley prescription infant formulas are contaminated with aluminiumInt. J. Environ. Res. Public Health, 16 (5) (2019)pii: E899. doi: 10.3390/ijerph16050899.Google Scholar
[35]C. Exley, M.J. MoldAluminium in human brain tissue: how much is too much?J. Biol. Inorg. Chem. (2019)Https://doi. Org/10.1007/s00775-019-01710-0. Https://www.Ncbi.nlm.nih.gov/pubmed/31468176Google Scholar
[36]G.L. KleinAluminum toxicity to bone: a multisystem effect?Osteoporos. Sarcopenia, 5 (no.1) (2019), pp. 2-5Https://doi. Org/10.1016/j. Afos.2019.01.001. Https://www.Ncbi.nlm.nih.gov/pubmed/31008371ArticleDownload PDFView Record in ScopusGoogle Scholar
[37]R. Yokel, S.R. Rhineheimer, P. Sharma, et al.Entry, half-life, and desferrioxamine-accelerated clearance of brain aluminum after a single 26Al exposureScience, 64 (1) (2001), pp. 77-82CrossRefView Record in ScopusGoogle Scholar
[38]S.T. BlackburnS. T. Renal function in the neonateJ. Perinat. Neonatal Nurs., 8 (no.1) (1994), pp. 37-47Https://www.Ncbi.nlm.nih.gov/pubmed/8006805CrossRefView Record in ScopusGoogle Scholar
[39]J. Bonhoeffer, C.A. Siegrist, P.T. HeathImmunisation of premature infantsArch. Dis. Child., 91 (no.11) (2006)929-35. Https://doi. Org/10.1136/adc.2005.086306. Https://www.Ncbi.nlm.nih.gov/pubmed/17056868Google Scholar
[40]M.T. Niu, M.E. Salive, S.S. EllenbergNeonatal deaths after hepatitis B vaccine: the vaccine adverse event reporting system, 1991-1998Arch. Pediatr. Adolesc. Med., 153 (no.12) (1999)1279-82. Https://www.Ncbi.nlm.nih.gov/pubmed/10591306Google Scholar
[41]R. Lazarus, M. Klompas Electronic Support for Public Health – Vaccine Adverse Event Reporting System (ESP: VAERS) (Massachusetts) (Final Report).Harvard Pilgrim Health Care, Inc (2010)https://healthit.ahrq.gov/ahrq-funded-projects/electronic-support-public-health-vaccine-adverse-event-reporting-system, Accessed 9/7/2019Google Scholar
[42]S.K.S. Sheth, Y. Li, C.A. ShawIs exposure to aluminium adjuvants associated with social impairments in mice? A pilot studyJ. Inorg. Biochem., 181 (2018), pp. 96-103Https://doi. Org/10.1016/j. Jinorgbio.2017.11.012. Https://www.Ncbi.nlm.nih.gov/pubmed/29221615ArticleDownload PDFView Record in ScopusGoogle Scholar
[43]D.R. Fanni, R. Ambu, C. Gerosa, S. Nemolato, N. Iacovidou, P. Van Eyken, V. Fanos, M. Zaffanello, G. FaaAluminum exposure and toxicity in neonates: a practical guide to halt aluminum overload in the prenatal and perinatal periodsWorld J. Pediatr., 10 (no.2) (2014)101-7. Https://doi. Org/10.1007/s12519-014-0477-x. Https://www.Ncbi.nlm.nih.gov/pubmed/24801228Google Scholar
[44]G. Morris, B.K. Puri, R.E. FryeThe putative role of environmental aluminium in the development of chronic neuropathology in adults and children. How strong is the evidence and what could Be the mechanisms involved?Metab. Brain Dis., 32 (no.5) (2017)1335-55. Https://doi. Org/10.1007/s11011-017-0077-2. Https://www.Ncbi.nlm.nih.gov/pubmed/28752219. 10Google Scholar
[45]A. Strunecka, R.L. Blaylock, J. Patocka, O. StruneckyImmunoexcitotoxicity as the central mechanism of etiopathology and treatment of autism spectrum disorders: A possible role of fluoride and aluminumSurg. Neurol. Int., 9 (2018), p. 74Https://doi. Org/10.4103/sni. Sni_407_17. Https://www.Ncbi.nlm.nih.gov/pubmed/29721353View Record in ScopusGoogle Scholar
[46]R.K. Gherardi, G. Crépeaux, F.J. Authier, L. LujanAnimal studies are mandatory to investigate the poorly understood fate and effects of aluminum adjuvants administered to billions of humans and animals worldwideAutoimmun. Rev., 17 (no.7) (2018), pp. 735-737Https://doi. Org/10.1016/j. Autrev.2018.02.005. Https://www.Ncbi.nlm.nih.gov/pubmed/29729447ArticleDownload PDFView Record in ScopusGoogle Scholar
[47]A. Khajuria, A. Gupta, F. Malik, S. Singh, J. Singh, B.D. Gupta, K.A. Suri, et al.A new vaccine adjuvant (Bos 2000 a potent enhancer mixed Th1/Th2 immune responses in mice immunized with hbsagVaccine, 25 (no.23) (2007)4586-94. Https://doi. Org/10.1016/j. Vaccine.2007.03.051. Https://www.Ncbi.nlm.nih.gov/pubmed/17498851Google Scholar
[48]D.L. Andress, J.B. Kopp, N.A. Maloney, J.W. Coburn, D.J. SherrardEarly deposition of aluminum in bone in diabetic patients on hemodialysisN. Engl. J. Med., 316 (no.6) (1987)292-6. Https://doi. Org/10.1056/NEJM198702053160602. https://www.Ncbi.nlm.nih.gov/pubmed/3807961Google Scholar
[49]L.P. Brion, A.R. Fleischman, C. McCarton, G.J. SchwartzA simple estimate of glomerular filtration rate in low birth weight infants during the first year of life: noninvasive assessment of body composition and growthJ. Pediatr., 109 (no.4) (1986), pp. 698-707Https://doi. Org/10.1016/s0022-3476(8680245-1. Https://www.Ncbi.nlm.nih.gov/pubmed/3761090ArticleDownload PDFView Record in ScopusGoogle Scholar
[51]H. HogeneschMechanism of immunopotentiation and safety of aluminum adjuvantsFront. Immunol., 3 (2012), p. 406Https://doi. Org/10.3389/fimmu.2012.00406. Https://www.Ncbi.nlm.nih.gov/pubmed/23335921Google Scholar
[53]A. ParkerTesting new hypotheses of neurological and immunological outcomes with aluminum-containing vaccines is warrantedJ. Trace Elem. Med. Biol., 51 (2019), pp. 28-30Https://doi. Org/10.1016/j. Jtemb.2018.09.006. Https://www.Ncbi.nlm.nih.gov/pubmed/30466934ArticleDownload PDFView Record in ScopusGoogle Scholar
[54]N.D. Priest, D. Newton, J.P. Day, R.J. Talbot, A.J. Warner Human metabolism of Aluminium-26 and Gallium-67 injected as citratesHum. Exp. Toxicol., 14 (no.3) (1995)287-93. Https://doi. Org/10.1177/096032719501400309. Https://www.Ncbi.nlm.nih.gov/pubmed/7779460Google Scholar
[55]M. Sulemanji, K. Vakili Neonatal renal physiologySemin. Pediatr. Surg., 22 (2013)195-8. Https://doi. Org/10.1053/j. Sempedsurg.2013.10.008. Https://www.Ncbi.nlm.nih.gov/pubmed/24331094no.4Google Scholar
[56]G.B. van der Voet, O. Schijns, F.A. De Wolff Fluoride enhances the effect of aluminium chloride on interconnections between aggregates of hippocampal neuronsArch. Physiol. Biochem., 107 (no.1) (1999), pp. 15-21Https://doi. Org/10.1076/apab.107.1.15.4356. Https://www.Ncbi.nlm.nih.gov/pubmed/10455554View Record in ScopusGoogle Scholar
[57]X.Y. Wang, X. Yao, Y.M. Wan, B. Wang, J.Q. Xu, Y.M. WenResponses to multiple injections with alum alone compared to injections with alum adsorbed to proteins in miceImmunol. Lett., 149 (no.1-2) (2013), pp. 88-92Https://doi. Org/10.1016/j. Imlet.2012.11.005. Https://www.Ncbi.nlm.nih.gov/pubmed/23183095.2012ArticleDownload PDFView Record in ScopusGoogle Scholar
[58]W. Wu, D. Liu, J.P. Nuorti, K. Li, D. Xu, J. Ye, J. Zheng, L. Cao, H. WangDeaths reported to national surveillance for adverse events following immunization in China, 2010-2015Vaccine, 37 (no.9) (2019)1182-87. Https://doi. Org/10.1016/j. Vaccine.2019.01.009. Https://www.Ncbi.nlm.nih.gov/pubmed/30709723Google Scholar
Video: Dr. James Lyons-Weiler – https://youtu.be/q0_2mFcXzRU
 CienciaySaludNatural.com
CienciaySaludNatural.com