Introducción
El aluminio se utilizó por primera vez en vacunas humanas en 1932 y fue el único adyuvante utilizado en vacunas autorizadas durante aproximadamente 70 años. Este controvertido compuesto todavía se utiliza como adyuvante en vacunas, sin embargo, ¿cuál es su función real?
El aluminio es el tercer metal más abundante en la corteza terrestre y está ampliamente presente en el medio ambiente: en plantas, suelo, agua, aire, alimentos y productos farmacéuticos. Está presente en forma iónica como Al3+.
La absorción de aluminio depende de varios factores como el nivel de pH y la presencia de ácidos orgánicos (citrato, lactato). Se absorbe en una proporción de sólo el 0,1 al 0,3 por ciento por el tracto gastrointestinal en la parte superior del intestino. Sin embargo, cuando se inyecta aluminio en nuestros músculos en la formulación de una vacuna, se absorbe casi al 100 por ciento. Luego viaja y cruza la barrera hematoencefálica y se acumula en nuestro cerebro y otros órganos.El aluminio es un conocido asesino celular. Crea moléculas dañinas llamadas especies reactivas de oxígeno, engaña al sistema inmunológico para que reaccione exageradamente a los componentes de nuestro cuerpo, daña la cadena de suministro de energía y es tóxico para nuestro ADN. El aluminio es especialmente perjudicial para nuestro cerebro y nuestros nervios, ya que desempeña múltiples funciones en la acumulación de sustancias nocivas ( β-amiloide , proteína tau ) en el cerebro, provoca la muerte de las células protectoras del cerebro llamadas astrocitos y altera el sistema «protector». pared» alrededor del cerebro, lo que resulta en una mayor vulnerabilidad a sustancias nocivas.
Un estudio publicado en el Journal of Trace Elements in Medicine and Biology encontró que la cantidad de aluminio que recibe un bebé en una vacuna está lejos de ser predecible o controlada y parece «similar a una lotería».
Dosis máxima de aluminio
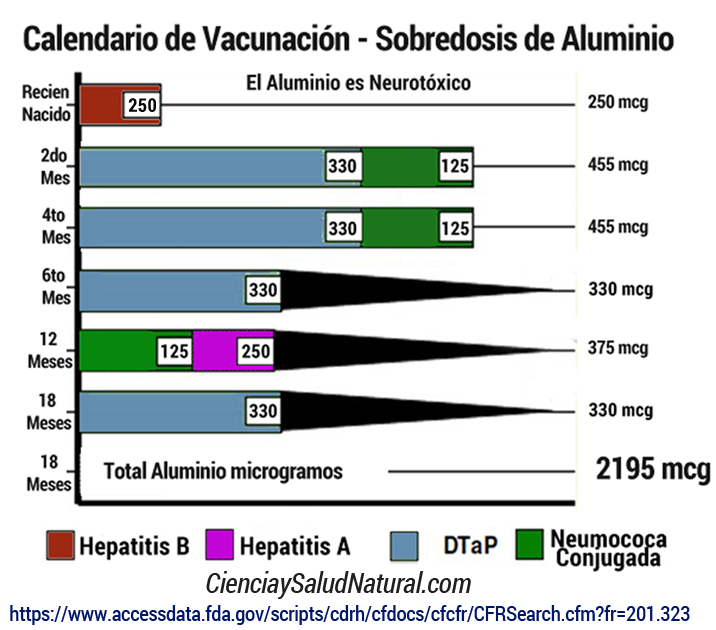
La Administración de Drogas y Alimentos de EE.UU. (FDA) establece una dosis máxima de aluminio de 4 a 5 microgramos por kilogramo de peso por dia. Si un bebe pesa 4 kg , puede recibir hasta 20 microgramos, pero con solo la vacuna contra la Hepatitis B, cuando nace, recibe 12 veces más que los niveles permitidos, porque esta vacuna tiene por lo menos 250 microgramos (mcg) de aluminio.
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=201.323
Se usa aluminio en las vacunas como adyuvante, un adyuvante es una sustancia que aumenta o modula la respuesta inmunitaria a una vacuna. Los mayores efectos negativos del aluminio se han observado en el sistema nervioso y van desde deterioro de las habilidades motoras hasta encefalopatía (alteración del estado mental, cambios de personalidad, dificultad para pensar, pérdida de memoria, convulsiones, coma y más).
El Departamento de Salud y Derechos Humanos de EE.UU. Services (HHS) afirma que el aluminio es una neurotoxina y la exposición a este elemento pueden provocar importantes «alteraciones en la función motora, sensorial función y función cognitiva.» https://www.atsdr.cdc.gov/toxprofiles/tp22.pdf pag. 34
«Significant alterations in motor function, sensory function, and cognitive function have been detected following exposure to adult or weanling rats and mice or following gestation and/or lactation exposure of rats and mice to aluminum lactate, aluminum nitrate, and aluminum chloride»
El aluminio es un adyuvante de uso común en muchas vacunas, incluidas DTaP, HepB, HepA, HiB y VPH.El límite superior establecido por la FDA para el aluminio en las vacunas es de 850 a 1250 μg/dosis , es decir microgramos x dosis. Sin embargo, hay tres problemas importantes con este límite:
- En primer lugar, esto se basó en datos de que esta cantidad de aluminio por dosis mejoraba la «antigenicidad» y la «efectividad» de la vacuna, pero no incluye consideraciones de seguridad.
- En segundo lugar, si convertimos esta dosis a una dosis pediátrica basada en el peso corporal, excede ampliamente el límite de seguridad de la dosis parenteral de aluminio de 4 a 5 μg/kg/día establecido por la FDA para la ingesta nutricional intravenosa. (μg = microgramos)
- También es mucho más alto de lo que los científicos calcularon como el límite seguro del aluminio de la vacuna de no más de 10,31 a 16,01 μg/kg por día al nacer.
- En tercer lugar, esta recomendación no tiene en cuenta la persistencia del aluminio en el organismo ni la ingesta constante del medio ambiente. Dado que el aluminio impregna nuestro medio ambiente, la comunidad científica ha expresado su preocupación por nuestra exposición al aluminio durante muchos años.
En 2015, la preocupación por el aluminio en la ingesta dietética fue reforzada por el Comité de Expertos de la Organización Mundial de la Salud para la Alimentación y la Agricultura (FAO), que redujo siete veces la ingesta diaria tolerable provisional de aluminio.
Actualizacion de la FDA:
Una actualización de la FDA proporcionó la siguiente respuesta a una solicitud de Epoch Times el 12 de octubre de 2023 para el caso de la vacuna Gardail contra el VPH fue:
«El sulfato de hidroxifosfato de aluminio amorfo, AAHS, utilizado en Gardasil para ayudar a provocar una respuesta inmunitaria, se ha utilizado en varias vacunas aprobadas por la FDA durante más de 6 décadas. La cantidad de aluminio en el grupo de vacuna y en el grupo de control fue la misma, 225 microgramos, El Título 21 del Código de Regulaciones Federales, Parte 610.15(a), limita la cantidad de aluminio en los productos biológicos, incluidas las vacunas, a 850 – 1250 microgramos/dosis, a menos que al fabricante se le haya concedido una exención de este requisito.
La FDA no ha concedido tal exención a ninguna vacuna. La cantidad de aluminio en las vacunas actualmente autorizadas en los EE. UU. es consistente con los estándares de la Organización Mundial de la Salud por dosis humana única de un producto». El límite de la FDA de 850 μg de aluminio por dosis se derivó de datos que demostraban que esta cantidad por dosis mejoraba la «antigenicidad» y la «eficacia» de la vacuna, pero no se basaba en consideraciones de seguridad . Se basó en un artículo publicado en 2002 en la revista Vaccine del Centro de Evaluación e Investigación Biológica de la FDA (CBER) que decía: «La cantidad de 15 mg de alumbre o 0,85 mg de aluminio por dosis se seleccionó empíricamente a partir de datos que demostraban que esta cantidad de aluminio mejoró la antigenicidad y eficacia de la vacuna (Joan May, FDA/CBER, comunicación personal)».
Además, es una cuestión de sentido común que la dosis de un medicamento pediátrico deba calcularse proporcionalmente en función del peso corporal. Del mismo modo, la dosis pediátrica equivalente de aluminio también debe calcularse en función del peso corporal.
Sin embargo, la cantidad de aluminio por dosis recomendada por la FDA en las vacunas para niños no tiene en cuenta su peso corporal. No han calculado una dosis segura para los niños en función de los riesgos de daños potenciales. El calendario actual de vacunas no tiene en cuenta estos factores, lo que constituye un problema grave que debe abordarse. Los científicos han convertido cada una de las dosis establecidas aprobadas por la FDA de 850 μg y 1250 μg en vacunas en dosis pediátricas equivalentes, con los siguientes resultados: Para 850 μg en cada dosis de vacuna, ajustado por peso corporal:
- En comparación con un adulto cuyo peso corporal es de 60 kg, para un niño varón, 850 μg equivalen a 254 μg/kg al nacer; 152,7 μg/kg a los 2 meses; 121,4 μg/kg a los 4 meses; 107,1μg/kg a los 6 meses; 92,8μg/kg al año; y 69,9 μg/kg a los 2 años (en comparación con 12,5 a 14,2 μg/kg para un adulto).
- Para una niña, el peso corporal es generalmente menor que el de un hombre, por lo que su carga de aluminio es aún mayor.
Para 1250 μg en cada dosis de vacuna, ajustado por peso corporal:
- En comparación con un adulto cuyo peso corporal es de 60 kg, para un niño varón, 1250 μg equivalen a 373,5 μg/kg al nacer; 224,5 μg/kg a los 2 meses; 178,5 μg/kg a los 4 meses; 157,5 μg/kg a los 6 meses; 136,4 μg/kg al año; y 102,9 μg/kg a los 2 años (en comparación con 18,4 a 20,8 μg/kg para un adulto).
- De manera similar, el peso corporal de una niña es generalmente menor que el de un niño, por lo que su carga de aluminio es aún mayor.
El único límite de dosificación de seguridad disponible para exposiciones parenterales al aluminio según el Código de Regulaciones Federales ( CFR/FDA 21CFR201.323 ) se establece en 4 a 5 μg/kg/día.
En consecuencia, los límites de dosis de vacuna anteriores de 850 a 1250 μg/dosis de aluminio establecidos por la FDA exceden ampliamente el límite de seguridad de la dosis parenteral de aluminio de 4 a 5 μg/kg/día.Esto también es mucho más alto que el límite de seguridad del aluminio de la vacuna calculado por los científicos de no más de 10,31 a 16,01 μg/kg por día al nacer.
No hemos considerado bebés con disfunción renal, una condición muy común entre los bebés prematuros.
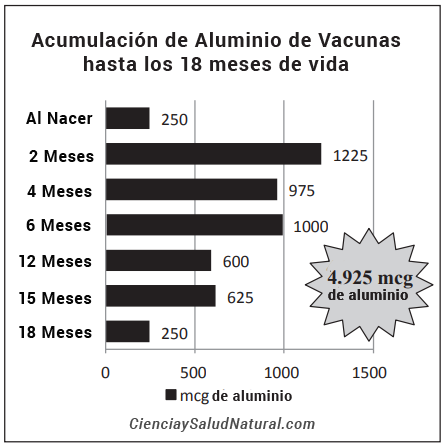
Se ha demostrado que los compuestos de aluminio persisten hasta ocho años después de la vacunación en el cuerpo humano, y los síntomas asociados con el aluminio de la vacuna pueden persistir hasta ocho años. Este hecho, combinado con la exposición ambiental repetida, puede explicar la hiperactivación del sistema inmunológico y las condiciones crónicas posteriores, como alergias, eczema y asma, que sufren casi la mitad de los niños estadounidenses.
El documento histórico de la FDA sobre la seguridad del aluminio en las vacunas tiene un error matemático crucial
La Administración de Alimentos y Medicamentos de EE. UU. (FDA) y la Agencia para el Registro de Sustancias Tóxicas y Enfermedades (ATSDR), una división del Departamento de Salud y Servicios Humanos de EE. UU. (HHS), han expresado su preocupación sobre los efectos negativos de la exposición al aluminio en humanos. Debido a que algunas vacunas contienen aluminio, la FDA publicó un artículo en 2011 (Mitkus et al.) para abordar las preocupaciones sobre la exposición al aluminio de las vacunas en los bebés. El artículo comparó la exposición al aluminio de las vacunas en bebés con un límite de seguridad del aluminio oral determinado por la ATSDR. Sin embargo, este estudio basó incorrectamente sus cálculos en que el 0,78 % del aluminio oral se absorbe en el torrente sanguíneo en lugar del valor del 0,1 % utilizado por la ATSDR en sus cálculos. Como resultado, el documento de la FDA asumió que casi 8 (0,78%/0,1%) veces más aluminio puede ingresar de manera segura al torrente sanguíneo.
El Dr. Christopher Shaw, profesor de la Universidad de Columbia Británica, ha realizado numerosos estudios sobre los efectos del aluminio inyectado en ratones y comentó: “Sabíamos que el estudio de Mitkus et al. el modelado en papel de la eliminación del aluminio tenía que ser inexacto ya que se suponía que la cinética del aluminio inyectado era la misma que la cinética del aluminio adquirida a través de la dieta. Ahora, además, vemos que hicieron su modelado basándose en utilizar el nivel incorrecto de absorción de aluminio. Lo que llama especialmente la atención es que a pesar de todos estos errores, desde 2011, Mitkus et al. Es utilizado por los CDC y otras entidades como base para afirmar que los adyuvantes de aluminio son seguros”.
Entienda como el aluminio de estas cantidad de dosis de vacunas se acumula y causa enfermedades autoinmunes peores que las enfermedades que intenta prevenir.
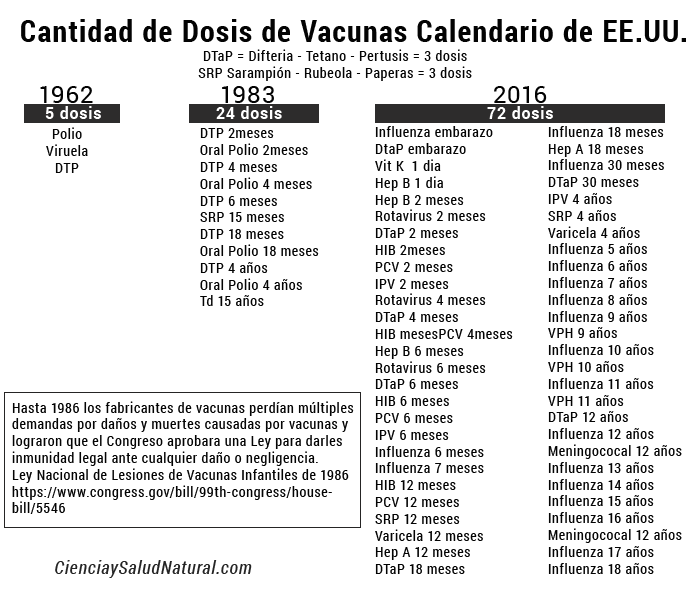
Aún no hay una ciencia empírica creíble que muestre que la cantidad de aluminio en el calendario de vacunación pediátrica de los CDC es segura a corto o largo plazo. No existe una ciencia empírica creíble que demuestre que el uso de una vacuna contra la influenza que contiene timerosal (mercurio) y vacunas que contienen aluminio sean aplicadas en la misma visita al vacunatorio, o en visitas sucesivas al consultorio, no cause una toxicidad sinérgica grave, especialmente para los bebés. Lamentablemente, no se ha llevado a cabo ningun estudio, mientras tanto seguimos copiando el modelo de EE.UU. país en donde se estima que el 43% de los niños de EE. UU. (32 millones) tienen actualmente al menos 1 de de cada 20 con afecciones de salud crónicas, aumentando a 54.1% cuando se incluyen sobrepeso, obesidad o riesgo de retrasos en el desarrollo; El 19.2% (14.2 millones) tienen condiciones que resultan en una atención médica especial.

Un nuevo estudio publicado en el Journal of Trace Elements in Medicine and Biology concluyó que el calendario de vacunación de los Centros para el Control y la Prevención de Enfermedades (CDC) de los EE. UU. supera en 15.9 veces el nivel seguro recomendado de aluminio una vez que los investigadores ajustaron el peso corporal.
Calendario de Vacunación de Argentina con sobredosis de aluminio que es neurotóxico
El Calendario de Vacunas de EE.UU. tiene sobredosis de aluminio que es neurotóxico
Los investigadores del estudio también estimaron que un niño que seguía el programa de vacunas estaría en un estado de «toxicidad crónica» durante el 70% de los primeros siete meses de vida del niño, 149 días desde el nacimiento hasta los siete meses.
El nuevo estudio se basa en trabajos previos que establecieron una línea base «segura» de aluminio en vacunas para bebés. Esta línea de base se deriva de los límites de la Administración de Drogas y Alimentos de los Estados Unidos (FDA) para adultos, pero con correcciones en el peso corporal por dosis.
Los niveles permisibles actuales de aluminio inyectado se ha basado en un enfoque que ignora la edad, el peso y las consideraciones individuales, como la genética y las influencias ambientales en la desintoxicación.
Se ha encontrado aluminio en los cerebros de pacientes con enfermedad de Parkinson, enfermedad de Alzheimer, epilepsia y autismo. También está creciendo la evidencia de que una serie de enfermedades crónicas de causas desconocidas que son difíciles de diagnosticar, como PANDAS / PANS y el síndrome de fatiga crónica, pueden deberse al menos en parte a la intolerancia al aluminio de la vacuna.
Durante años, el pediatra Dr. Paul Thomas (quien es uno de los autores del estudio), ha ofrecido un cronograma alternativo que él creó, llamado «Plan Amigable con las Vacunas». El Dr. Thomas recibió críticas de los medios por atreverse a desviarse del calendario de vacunación de los CDC, a pesar de la falta de ciencia para justificar su uso.
La regulación actual de la FDA permite una amplia gama de aluminio. El peso corporal no se considera, tampoco se considera las dosis acumuladas de múltiples vacunas recibidas al mismo tiempo».
El cronograma de los CDC permite muchas vacunas por visita al consultorio y, por lo tanto, el mismo día, una práctica recientemente impulsada por los cronogramas obligatorios del gobierno para ponerse al día. Estos cronogramas se han impuesto a las familias por legislación que está siendo impulsada por el lobby de los laboratorios a través de sus representantes puestos en cargos en el Congreso de los EEUU. Estos han logrado imponer el cumplimiento de la vacuna obligatoria bajo la falsa teoría de inmunidad del rebaño.
Calendario Nacional de Vacunación de Argentina 2019-2020
| Edad | Vacunas | Dosis |
|---|---|---|
| Recién nacidos | BCG + Hepatitis B | 2 |
| 2 Meses | Neumococo Conjugada + Quíntuple Pentavalente DTP – HB – Hib + Polio IPV + Rotavirus | 8 |
| 3 Meses | Meningococo | 1 |
| 4 Meses | Neumococo Conjugada + Quíntuple Pentavalente DTP – HB – Hib + Polio IPV + Rotavirus | 8 |
| 5 Meses | Meningococo | 1 |
| 6 Meses | Quíntuple Pentavalente DTP – HB – Hib + Polio OPV + Antigripal | 7 |
| 7 Meses | Refuerzo Antigripal (Segunda Dosis) | 1 |
| 12 Meses | Neumococo Conjugada + Hepatitis A + Triple Viral SRP | 5 |
| 15 Meses | Varicela + Meningococo | 2 |
| 15 a 18 Meses | Polio + Triple Viral SRP + Triple Bacteriana Celular DTP | 7 |
| 5 – 6 Años (INGRESO ESCOLAR) | Polio + Triple Viral SRP + Triple Bacteriana Celular DTP | 7 |
| 11 Años | Hepatitis + Triple Viral SRP + Triple Bacteriana Acelular dTap + VPH+ Meningococo | 9 |
| Desde los 15 Años | Hepatitis B + Doble Viral o Triple Viral SRP | 4 |
| TOTAL DOSIS | 62 Dosis | |
| Fuente: | https://www.gba.gob.ar/vacunacion/ https://www.argentina.gob.ar/salud/vacunas |
Los laboratorios fabricantes de vacunas se han apropiado de las editoriales de revistas científicas, los medios de comunicación repiten su propaganda y la OMS ha sido comprada por un grupo de accionistas de laboratorios que donaron 10.000.000.000 u$s a la ONU para que esta se a la década de la vacuna.
Los estudios indican que la gran cantidad de vacunas con adyuvante de aluminio administradas a lactantes (según calendario de vacunación) produce un alto grado de toxicidad crónica por aluminio . Ver más https://cienciaysaludnatural.com/el-peligro-del-aluminio-en-las-vacunas/
El estudio de 2004 de Priest en el que se basa la FDA y el CDC, se tomó medidas del aluminio retenido que cubría un período de 12 años de un solo voluntario adulto después de una sola inyección con solución de citrato que contenía aluminio. También incluyó un pequeño estudio de seis sujetos varones adultos durante un período de tiempo más corto. Estos estudios tienen defectos claros. Las soluciones de citrato no se usan en las vacunas, y los estudios incluyeron adultos, no bebés o niños.
Otro estudio que se cita como base para justificar los niveles permisibles es el del científico de la FDA, Robert Mitkus que usó una variedad de ecuaciones del estudio Priest y las aplicó al aluminio ingerido en 2011. Este estudio de Mitkus se usa para justificar la seguridad del aluminio inyectado para todas las edades, pesos, géneros y variaciones genéticas individuales a pesar de que es un estudio de aluminio ingerido que se utiliza para justificar el aluminio inyectado.
Hasta la fecha, la literatura científica ha proporcionado poca evidencia para demostrar la seguridad del aluminio inyectado. Para complicar aún más las cosas, se ha especulado que, al menos para algunas personas, la capacidad del cuerpo para eliminar el aluminio podría verse ralentizada por la exposición previa al elemento. Además, los individuos tienen diferentes capacidades para desintoxicar metales pesados y toxinas en general, como aquellos con disfunción renal, bebés y, aún más, bebés en unidades neonatales.
Estamos nuevamente ante una situación parecida a lo que ocurrió cuando la nafta tenía plomo, que llevo varios años de lucha hasta que se admitió que el plomo causaba daños. Estamos discutiendo la inseguridad del aluminio en las vacunas como en su momento fue el plomo en la nafta y los medios de comunicación responden elogiando la historia y los beneficios de las vacunas (la nafta) cuando el mensaje que se intenta hacer llegar es la inseguridad del aluminio en las vacunas lo que se cuestiona y no las vacunas propiamente dichas. El trabajo confundir al público es un clásico de la ingeniería social que hoy es usado por todos los medios masivos para mantener sus ingresos en publicidad que pagan los laboratorios.
Christopher Exley
Christopher Exley, profesor inglés de química bioinorgánica, es uno de los investigadores del aluminio con más conocimientos y más citados del mundo, con más de 200 artículos científicos revisados por pares publicados sobre el aluminio y más de 12.000 citas . Sus 35 años de investigación han demostrado un fuerte vínculo entre la exposición al aluminio y enfermedades como la enfermedad de Alzheimer, el autismo , la esclerosis múltiple y la enfermedad de Parkinson . Los pacientes con insuficiencia renal dializados han desarrollado encefalitis relacionada con la acumulación excesiva de aluminio en el cerebro . Los que fallecieron tenían un nivel diez veces mayor de aluminio en la materia gris, lo que provocaba enfermedades cerebrales mortales en entre el 30 y el 50 por ciento de los casos. Sus síntomas cerebrales se correlacionaron con sus niveles de aluminio en sangre, incluidos problemas de habla, coordinación, cognición y convulsiones fatales.Como toxina potente, el aluminio puede dañar gravemente múltiples sistemas del cuerpo humano . Los efectos tóxicos del aluminio en nuestros nervios, pulmones, músculos, intestinos, riñones e hígado han sido bien documentados .El aluminio iónico absorbido en la dieta puede salir de nuestro cuerpo a través de los riñones; sin embargo, la mayoría de las mezclas de antígeno y aluminio en las vacunas son demasiado grandes para que los riñones las expulsen del cuerpo. En consecuencia, la exposición al aluminio de las vacunas plantea un riesgo de seguridad mucho mayor que el aluminio de la dieta.Según la Administración de Medicamentos y Alimentos de Estados Unidos (FDA), un placebo se define como «una pastilla, líquido o polvo inactivo que no tiene valor terapéutico». Por lo tanto, las propiedades tóxicas bien establecidas del aluminio sugieren que el aluminio no puede constituir un placebo válido.
Christopher Exley, PhD, profesor de química bioinorgánica en la Universidad de Keele y líder del grupo de investigación sobre aluminio y silicio, https://www.bitchute.com/video/fJcwKK0plSeB/
La toxicidad convierte al aluminio en un adyuvante
Casi todas las enfermedades modernas tienen su origen en un sistema inmunológico alterado. Ningún otro fármaco interviene con tanta intensidad en el sistema inmunológico como las vacunas. El papel de los componentes de las vacunas en la inmunidad humana se debate sin tabúes en la comunidad científica.
El estándar de oro para evaluar la eficacia de una vacuna se basa en el nivel de anticuerpos generado. Al principio, la gente no estaba satisfecha con un virus puro inactivado para provocar una respuesta inmune y quería encontrar una sustancia que ayudara a estimular la inmunidad y generar una respuesta más sólida con anticuerpos sostenidos por más tiempo: ese es el adyuvante.
Se descubrió que el aluminio era un potente adyuvante.
Según el Sr. Exley, «La conocida toxicidad del aluminio contribuye casi con toda seguridad al éxito de las sales a base de aluminio como adyuvantes».Un estudio de Nature de 2016 proporcionó información sobre la toxicidad celular inducida por el aluminio utilizado como adyuvante en vacunas humanas clínicamente aprobadas.
Cuando inyectamos una vacuna con aluminio en el músculo, sólo podemos imaginar qué reacciones físicas y químicas se desencadenarán. Al principio, puede haber poca respuesta en el lugar de la inyección. La única reacción puede deberse al daño causado por la aguja.
«Cuando la vacuna se inyecta profundamente en el tejido muscular, los iones de aluminio comienzan a disolverse y atacar las células circundantes», afirmó Exley en el documental «Under the Skin».
«Entonces, dependiendo de esa velocidad de disolución, se obtendrá el grado de citotoxicidad: toxicidad celular», dijo.
Los iones de aluminio matan nuestras células sanas normales y, a medida que esas células mueren, liberan mensajeros químicos que piden ayuda de las otras células inmunitarias.
Las células inmunes reaccionan inmediatamente y comienzan a atacar cualquier cosa sospechosa en el lugar de la vacunación. Se produce una feroz batalla.
Sólo durante esta inflamación provocada por el aluminio se toman en serio también los antígenos silenciosos y son transportados por células inmunitarias especializadas. Esas proteínas virales silenciosas también son identificadas por las células inmunes como enemigas y se producen anticuerpos específicos para unirse a ellas.Como resultado, los científicos están utilizando los efectos tóxicos del aluminio que pueden desencadenar inflamación para comenzar una batalla contra un antígeno inactivo. El nivel de toxicidad del aluminio es un término alternativo utilizado para describir su capacidad para producir anticuerpos en una vacuna.
El aluminio no deberían usarse como placebos en ensayos clínicos
En su artículo , «Los adyuvantes a base de aluminio no deberían usarse como placebos en ensayos clínicos», el Sr. Exley afirmó:
«Es necesario presentar argumentos científicos muy sólidos a favor del uso de un placebo que se sabe que produce efectos secundarios, y no he encontrado ninguna justificación científica para ello en la literatura reciente sobre vacunación humana. Si bien los efectos adversos graves después de la vacunación son raros , no debería ser aceptable ignorar o anular esos efectos, que se deben a que el adyuvante a base de aluminio actúa solo o en combinación con el antígeno. Hacerlo podría poner en riesgo a las personas susceptibles».
Un esquema general de las investigaciones
1981 El CFR (Code of Federal Regulations) de la FDA (Administracion de Alimentos y Drogas de EEUU.) modificado para incluir 1250 mg / dosis
1996-2007 PTWI estimado en 1 mg / kg / semana; 0.5 mg / kg-día Niño de EE. UU.> 2 años de edad (Evaluación de la OMS y ciertos aditivos y contaminantes alimentarios. Sección 4.1 Aluminio, 1996-2007) Comité de Nutrición de Aluminio Neurotoxicidad de1996 en lactantes y niños (J Pediatrics), 1 mg / kg -día (por error en cuanto a PTWI- «ingesta tolerable provisional»)
2001 0,85 mg «seleccionado empíricamente de los datos porque mejora la antigenicidad y la eficacia de la vacuna» (Baylor et al 2001)
2001-2008 ATSDR estableció LMR / NOAEL en 1 mg / kg-día de todas las fuentes basadas en Golub 26 mg / kg-día NOAEL (ATSDR hace referencia a Baylor et al (2001),
2001LMR / NOAEL 2 mg / kg-día en humanos adultos de fuentes dietéticas (Golub et al 2001 (62 mg / kg-día, Keith et al)
2011 LMR = 1 mg / kg pc / día (ATSDR, 2008), Mitkus ( 2011)
2019: CFR (Code of Federal Regulations) sigue siendo 850 mcg / DOSIS, no hay restricciones publicadas o impuestas sobre la dosificación pediátrica de aluminio, no hay información disponible sobre consideraciones de peso corporal para los límites de dosificación de aluminio, y no hay información adicional sobre los límites de dosificación de aluminio de los CDC.
El Estudio de Flarend et al. en conejos, informó que solo el 6% del hidróxido de aluminio inyectado había salido del cuerpo después de 28 días. En ese estudio, por cierto, los autores perdieron uno de los cerebros de los conejos.
Ver traducción completa del estudio en :

https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=201.323
54% de los niños con enfermedades crónicas o neurológicas
Entienda como el aluminio de estas cantidad de dosis de vacunas se acumula y causa enfermedades autoinmunes peores que las enfermedades que intenta prevenir. Vea estudio en :
https://cienciaysaludnatural.com/el-calendario-de-vacunacion-tiene-sobredosis-de-aluminio/
Profesor Chris Exley PhD. Profesor en Química Bioinorgánica
Profesor Honorario de la Universidad de Keele , UHI Millennium Institute
Líder de Grupo – Laboratorio de Química Bioinorgánica en Keele
Ingerir vs Inyectar

http://vaccinesafetycommission.org/pdfs/13-2013-Autoimmunity-Perricone.pdf
La leche materna se ingiere . Todo lo que se ingiere está sujeto al tracto gastrointestinal antes de que sea absorbido por el torrente sanguíneo y termine en otros órganos y tejidos vitales. El tracto gastrointestinal es una excelente barrera (cuando está sano) y la Agencia para el Registro de Sustancias Tóxicas y Enfermedades (ATSDR) afirma que solo 0.1-0.4% del aluminio ingerido se absorbe realmente .
Por lo tanto, hasta el 99.9% del aluminio no se absorbe cuando se ingiere (a través de la leche materna o los alimentos), y se elimina / elimina del cuerpo antes de que llegue al torrente sanguíneo.
Algunas matemáticas (usando 10 mg de aluminio en la leche materna y 0.4% para la tasa de absorción):
(10 mg de aluminio) x (0.004 tasa de absorción) = 0.04 mg
Conversión de mg a mcg = 40 mcg de aluminio absorbido total .
En contraste, por supuesto, la mayoría de las vacunas se inyectan .
El contenido de una vacuna inyectada no está sujeto al tracto gastrointestinal. El aluminio, junto con otros ingredientes, se inyecta por vía intramuscular para evitar intencionalmente las barreras naturales del cuerpo (piel, membranas mucosas, etc., que existen para ayudar a prevenir la absorción). La sangre fluye hacia y desde nuestros músculos, por lo que el contenido de una vacuna puede ingresar al torrente sanguíneo rápidamente. Por lo tanto, la absorción de aluminio a través de la vacuna es del 100% .
Ahora podemos hacer una comparación precisa entre el aluminio absorbido a través de la leche materna y las vacunas, en los primeros 6 meses de vida:
Leche Materna: 40mcg (0.04mg) | Vacunas: 4000 mcg (4 mg)
La Administración de Drogas y Alimentos de EE.UU. (FDA) establece una dosis máxima de aluminio de 4 a 5 microgramos por kilogramo de peso por dia. Si un bebe pesa 4 kg , puede recibir hasta 20 microgramos, pero con solo la vacuna contra la Hepatitis B, cuando nace, recibe 12 veces más que los niveles permitidos, porque esta vacuna tiene por lo menos 250 microgramos (mcg) de aluminio.
Los adyuvantes se han utilizado de forma segura en las vacunas durante décadas.
Las sales de aluminio, como el hidróxido de aluminio, el fosfato de aluminio y el sulfato de aluminio y potasio, se han utilizado de forma segura en vacunas durante más de 70 años. Las sales de aluminio se utilizaron inicialmente en las décadas de 1930, 1940 y 1950 con las vacunas contra la difteria y el tétanos después de que se descubrió que fortalecieron la respuesta inmune del cuerpo a estas vacunas.
Se han desarrollado adyuvantes más nuevos para atacar componentes específicos de la respuesta inmune del cuerpo, de modo que la protección contra las enfermedades sea más fuerte y dure más.
En todos los casos, las vacunas que contienen adyuvantesSe prueban su seguridad y eficacia en ensayos clínicos antes de que se autorice su uso en los Estados Unidos, y los CDC y la FDA monitorean continuamente estas vacunas una vez que se aprueban.
En las vacunas estadounidenses se utilizan varios adyuvantes diferentes
https://www.cdc.gov/vaccinesafety/concerns/adjuvants.html
| Auxiliar | Composición | Vacunas |
|---|---|---|
| Aluminio | Uno o más de los siguientes: sulfato de hidroxifosfato de aluminio amorfo (AAHS), hidróxido de aluminio, fosfato de aluminio, sulfato de potasio y aluminio (Alumbre) | Ántrax, DT, DTaP (Daptacel), DTaP (Infanrix), DTaP-HepB-IPV (Pediarix), DTaP-IPV (Kinrix), DTaP-IPV (Quadracel), DTaP –IPV/Hib (Pentacel), DTaP-IPV- Hib-HepB (VAXELIS), HepA (Havrix), HepA (Vaqta), HepB (Engerix-B), HepB (PREHEVBRIO), HepB (Recombivax), HepA/HepB (Twinrix), HIB (PedvaxHIB), VPH (Gardasil 9) ), encefalitis japonesa (Ixiaro), MenB (Bexsero, Trumenba), neumococo (Prevnar 13, Prevnar 20, VAXNEUVANCE), Td (Tenivac), Td (Mass Biologics), Td (sin nombre comercial), Tdap (Adacel), Tdap (Boostrix), encefalitis transmitida por garrapatas (TICOVAC) |
| AS01B _ | Monofosforil lípido A (MPL) y QS-21, un compuesto natural extraído del árbol de jaboncillo chileno, combinados en una formulación liposomal | Vacuna zóster (Shingrix) |
| AS04 | Monofosforil lípido A (MPL) + sal de aluminio | Virus del papiloma humano o VPH (Cervarix) |
| GPC 1018 | Citosina fosfoguanina (CpG), una forma sintética de ADN que imita el material genético bacteriano y viral | HepB (Heplisav-B) |
| Matriz-M TM | Saponinas derivadas del árbol de la corteza de jabón ( Quillaja saponaria Molina) | Vacuna contra el COVID-19 (vacuna Novavax contra el COVID-19, con adyuvante) |
| MF59 | Emulsión de aceite en agua compuesta de escualeno. | Influenza (Fluad y Fluad cuadrivalente) |
| No adjuvant | – | Varicela, cólera, COVID-19 (incluye ARNm de Pfizer-BioNTech, ARNm de Moderna y adenoviral Johnson & Johnson/Janssen), dengue, ébola, Hib (ActHIB, HIBERIX), sarampión, paperas y rubéola (MMR), meningococo (Menactra, Menveo , MenQuadfi), polio (IPOL), rabia, rotavirus, gripe estacional (excepto Fluad y Fluad tetravalente), viruela y viruela simica (ACAM2000, JYNNEOS), tifoidea, fiebre amarilla, zóster vivo (Zostavax) |
Los proveedores de vacunas deben revisar la información de prescripción aprobada por la FDA o para obtener la información más completa y actualizada sobre los componentes de la vacuna. Los prospectos de las vacunas autorizadas en EE. UU. están disponibles en Vacunas autorizadas para su uso en los Estados Unidos | FDA
La información sobre las vacunas contra el COVID-19 autorizadas para uso de emergencia está disponible aquí: Vacunas contra el COVID-19 | FDAParte superior de la página
Aluminio
Los adyuvantes que contienen aluminio son ingredientes de vacunas que se han utilizado en vacunas desde la década de 1930. A algunas vacunas se les añaden pequeñas cantidades de aluminio para ayudar al cuerpo a desarrollar una inmunidad más fuerte contra el germen de la vacuna.
AS01 B
AS01 B es una suspensión adyuvante que se utiliza con el componente antigénico de la vacuna Shingrix. Shingrix es la vacuna recombinante contra el zoster recomendada para personas de 50 años o más. AS01 B está compuesto de monofosforil lípido A (MPL), una sustancia que estimula el sistema inmunológico aislada de la superficie de las bacterias, y QS-21, un compuesto natural extraído del árbol de la corteza de jabón chileno (Quillaja saponaria Molina ) . En los ensayos clínicos previos a la autorización, AS01 B se asoció con reacciones locales y sistémicas, pero el perfil de seguridad general fue tranquilizador.
AS01 B también es un componente de las vacunas que se están probando actualmente en ensayos clínicos, incluidas las vacunas contra la malaria y el VIH. Hasta la fecha, estos ensayos han incluido a más de 15.000 personas.
AS04
A partir de 2009, se utilizó monofosforil lípido A (MPL) en una vacuna estadounidense (Cervarix ® ) para las infecciones por VPH; sin embargo, la vacuna ya no está disponible en Estados Unidos debido a la baja demanda del mercado. Esta sustancia que estimula el sistema inmunológico se aisló de la superficie de las bacterias.
CpG 1018
CpG 1018 es un adyuvante desarrollado recientemente que se utiliza en la vacuna Heplisav-B. Está formado por motivos de citosina fosfoguanina (CpG), que es una forma sintética de ADN que imita el material genético bacteriano y viral. Cuando se incluye CpG 1018 en una vacuna, aumenta la respuesta inmune del cuerpo.
En los ensayos clínicos previos a la autorización, los eventos adversos después de Heplisav-B fueron comparables a los observados después de otra vacuna contra la hepatitis B sin adyuvante autorizada en los EE. UU.
MatrixM TM
El adyuvante MatrixM está elaborado a partir de saponinas derivadas del árbol de la corteza de jabón ( Quillaja saponaria Molina), junto con colesterol y fosfolípidos. Actualmente se utiliza en la vacuna Novavax COVID-19 para estimular el sistema inmunológico. El 19 de julio de 2022, el Comité Asesor sobre Prácticas de Inmunización hizo una recomendación provisional para el uso de la vacuna Novavax en personas mayores de 18 años como vacunación primaria en serie de 2 dosis para la prevención de COVID-19. Novavax está disponible bajo una autorización de uso de emergencia de la FDA.
MF59
MF59 es el adyuvante contenido en Fluad tetravalente (una vacuna contra la influenza autorizada y recomendada para adultos de 65 años o más). MF59 es una emulsión de aceite en agua compuesta de escualeno, que es un aceite natural que se encuentra en muchas células vegetales y animales, así como en los humanos. MF59, utilizado en las vacunas contra la gripe en Europa desde 1997 y en Estados Unidos desde 2016, se ha administrado a millones de personas y tiene un excelente historial de seguridad.
Ver más en los siguientes enlaces:
Vea estudios de expertos cientificos sobre daños que causa el aluminio: https://cienciaysaludnatural.com/tema/aluminio/
Activacion Inmune Materna causada por el aluminio en vacunas en el embarazo, peligros: https://cienciaysaludnatural.com/el-aluminio-en-las-vacunas-pueden-causar-autismo/
El estudio de Mitkus 2011 que los laboratorios usan para defender la seguridad del adyuvante de Aluminio en las vacunas, tiene serias fallas.
https://cienciaysaludnatural.com/estudios-defectuosos-sobre-la-toxicidad-del-aluminio-en-las-vacunas/
Mitos y desinformación sobre el aluminio en las vacunas: https://cienciaysaludnatural.com/aluminio-en-vacunas-falta-informacion/
Exposición al aluminio de vacunas y sus efectos: https://cienciaysaludnatural.com/exposicion-al-aluminio-de-vacunas-y-sus-efectos/
Aluminio en Vacunas tóxico para las Mitocondrias https://cienciaysaludnatural.com/aluminio-en-vacunas-toxico-para-las-mitocondrias/
Aluminio en el Tejido Cerebral en Autismo: https://cienciaysaludnatural.com/estudio/aluminio-en-el-tejido-cerebral-en-autismo/
Sobre la toxicidad del aluminio https://cienciaysaludnatural.com/la-toxicidad-del-aluminio/
El calendario escolar de vacunas obligatorias en la Argentina tiene sobredosis de aluminio. El recién nacido recibe 20 veces mas de los Niveles Permitidos, en el primer dia de vida con una vacuna (hepatitis B), que no necesita dado que la hepatitis B es una enfermedad que se contagia via drogas o promiscuidad.
El aluminio es neurotóxico
Compruebelo en este sitio de la Federal Drug Administration (FDA) https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=201.323
Gardasil 9 contra el VPH 1 con 500 mcg de aluminio por dosis: 1 cada 40 niñas en los ensayos clinicos con enfermedades crónicas: https://cienciaysaludnatural.com/vph
http://ctdbase.org/detail.go?type=chem&acc=D000535&view=disease
De acuerdo a la Academia Americana de Pediatría AAP, La prevalencia estimada de niños de EE.UU. Con un diagnóstico de Trastornos del Espectro Autista (TEA) actualmente (2018) es de 1 caso de TEA cada 40 niños.
http://pediatrics.aappublications.org/content/142/6/e20174161
Autismo datos Centro de Control de Enfermedades https://www.cdc.gov/ncbddd/autism/data.html
Link between Aluminum and the Pathogenesis of Alzheimer’s Disease: The Integration of the Aluminum and Amyloid Cascade Hypotheses – Masahiro Kawahara and Midori Kato-Negishi – International Journal of Alzheimer’s Disease Volume 2011, Article ID 276393, 17 pages
doi: 10.4061/2011/276393. https://www.hindawi.com/journals/ijad/2011/276393/
Expressing glomerular filtration rate in children
David C. Heilbron Malcolm A. Holliday Amira Al-Dahwi, Barry A. Kogan
Pediatric Nephrology January 1991, Volume 5, Issue 1, pp 5–11
https://link.springer.com/article/10.1007%2FBF00852829
Too much aluminum in infant formulas, UK researchers find https://www.sciencedaily.com/releases/2010/09/100901111444.htm
El aluminio se encuentra en la leche materna, pero solo una pequeña cantidad de este aluminio ingresará al cuerpo del bebé a través de la lactancia. Las concentraciones típicas de aluminio en la leche materna humana varían de 0.0092 a 0.049 mg / L. El aluminio también se encuentra en la fórmula infantil a base de soya (0.46-0.93 mg / L) y en la fórmula infantil a base de leche (0.058-0.15 mg / L). https://www.atsdr.cdc.gov/toxprofiles/tp22.pdf
There is also evidence that oral or parenteral exposure to aluminum can result in elevated levels in breast milk (Golub et al. 1996; Muller et al. 1992; Yokel 1985; Yokel and McNamara 1985; Yumoto et al. 2000, 2003) https://www.atsdr.cdc.gov/toxprofiles/tp22.pdf
The aluminum content of human breast milk generally ranged from 9.2 to 49 μg/L (Fernandez-Lorenzo et al. 1999; Hawkins et al. 1994; Koo et al. 1988; Simmer et al. 1990; Weintraub et al. 1986). https://www.atsdr.cdc.gov/toxprofiles/tp22.pdf
The median aluminum level in breast milk collected from 12 Canadian women was reported to be 14 μg/L (range <5–45 μg/L) (Koo et al. 1988). In an Australian study, Weintraub et al. (1986) reported human breast milk concentrations of 30 μg/L. Simmer et al. (1990) reported a mean aluminum concentration of 49 μg/L in breast milk collected from Australian women. Hawkins et al. (1994) reported a mean breast milk aluminum concentrations of 9.2 μg/L collected from 15 nursing mothers in the United Kingdom. In a study of Croatia women, an average aluminum concentration in breast milk was 380 μg/L, with a range of 4 to 2,670 μg/L (Mandić et al. 1995). Fernandez-Lorenzo et al. (1999) reported mean aluminum concentrations of 23.9 μg/L (range 7–42 μg/L) in human milk in a study in Spain. Baxter et al. (1991) reported a mean aluminum concentration of 27 μg/L (range 3–79 μg/L) in a study in the United Kingdom. https://www.atsdr.cdc.gov/toxprofiles/tp22.pdf
Aluminum in the central nervous system (CNS): toxicity in humans and animals, vaccine adjuvants, and autoimmunity, C. A. Shaw L. Tomljenovic 2013 – https://link.springer.com/article/10.1007%2Fs12026-013-8403-1 PMID: 23609067 DOI: 10.1007/s12026-013-8403-1
Debunking Aluminum Adjuvant, Part 1: “The Aluminum Is Gone In Just a Few Days!” http://vaccinepapers.org/debunking-aluminum-adjuvant-part-1/
Debunking Aluminum Adjuvant, Part 2: FDA’s Flawed Study of Al Adjuvant Toxicity (Mitkus 2011) http://vaccinepapers.org/debunking-aluminum-adjuvant-part-2/
Updated aluminum pharmacokinetics following infant exposures through diet and vaccination. Mitkus RJ, 2011 https://www.ncbi.nlm.nih.gov/pubmed/22001122 PMID: 22001122 DOI: 10.1016/j.vaccine.2011.09.124
Uptake by man of aluminium in a public water supply , N D Priest, 1998 https://doi.org/10.1177/096032719801700602 https://journals.sagepub.com/doi/10.1177/096032719801700602
Human metabolism of aluminium-26 and gallium-67 injected as citrates. Priest ND, Newton D, Day JP, Talbot RJ, Warner AJ.Hum Exp Toxicol. 1995 Mar;14(3):287-93.PMID: 7779460
The bioavailability and metabolism of aluminium compounds in man. Priest ND. Proc Nutr Soc. 1993 Feb;52(1):231-40. Review. No abstract available.PMID: 8493269
In vivo absorption of aluminiumcontaining vaccine adjuvants using Al Richard E. Flarend, http://vaccinepapers.org/wp-content/uploads/In-vivo-absorption-of-aluminium-containing-vaccine-adjuvants-using-26Al2.pdf
Effect of Routine Vaccination on Aluminum and Essential Element Levels in Preterm Infants http://vaccinepapers.org/wp-content/uploads/Effect-of-Routine-Vaccination-on-Aluminum-and-Essential-Element-Levels-in-Preterm-Infants.pdf
Mas Referencias:
- American Academy of Pediatrics, Committee on Nutrition. Aluminum toxicity in infants and children. Pediatrics. 1996 Mar;97(3):413.
- Agency for Toxic Substances and Disease Registry (ATSDR). Toxicological profile for aluminum. Washington, D.C.: U.S. Department of Health and Human Services; 2008.3, 13-24, 145, 171-7, 208.
- Yokel RA. Aluminum in food—the nature and contribution of food additives. In: El-Samragy Y, editor. Food additive. Rijeka (Croatia): InTech; 2012. 203-28.
- Marrack P, McKee AS, Munks MW. Towards an understanding of the adjuvant action of aluminium. Nat Rev Immunol. 2009 Apr;9(4):287.
- Volk VK, Bunney WE. Diphtheria immunization with fluid toxoid and alum-precipitated toxoid. Am J Public Health Nations Health. 1942 Jul;32(7):690-9.
- Baylor NW, Egan W, Richman P. Aluminum salts in vaccines—U.S. perspective. Vaccine. 2002 May 31;20 Suppl 3:S18-22.
- U.S. Food and Drug Administration. Silver Spring (MD): U.S. Food and Drug Administration. Vaccines licensed for use in the United States; [updated 2018 Feb 14; cited 2018 Feb 27]. https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/Ucm093833.htm.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. Recommended immunization schedule for children and adolescents aged 18 years or younger, United States, 2018. https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf.
- U.S. Food and Drug Administration. Silver Spring (MD): U.S. Food and Drug Administration. SCOGS (Select Committee on GRAS Substances); [cited 2018 Aug 16]. https://www.accessdata.fda.gov/scripts/fdcc/?set=SCOGS.
- Priest ND. The biological behaviour and bioavailability of aluminium in man, with special reference to studies employing aluminium-26 as a tracer: review and study update. J Environ Monit. 2004;6:376,392.
- Poole RL, Pieroni KP, Gaskari S, Dixon TK, Park KT, Kerner JA. Aluminum in pediatric parenteral nutrition products: measured versus labeled content. J Pediatr Pharmacol Ther. 2011;16(2):92-7.
- Sedman A. Aluminum toxicity in childhood. Pediatr Nephrol. 1992 Jul;6(4):383-93.
- U.S. Food and Drug Administration, Department of Health and Human Services. Rules and regulations. Fed Regist. 2003 Jun;68(100):34286.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. National Center for Health Statistics: Data table for boys length-for-age and weight-for-age charts; [cited 2019 April 2]. https://www.cdc.gov/growthcharts/who/boys_length_weight.htm.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. National Center for Health Statistics: Data table for girls length-for-age and weight-for-age charts; [cited 2019 April 2]. https://www.cdc.gov/growthcharts/who/girls_length_weight.htm.
- U.S Food and Drug Administration, Department of Health and Human Services. Revision of the requirements for constituent materials. Final rule. Fed Regist. 2011 Apr 13;76(71):20513-8.
- Office of the Federal Register, National Archives and Records Service, General Services Administration. Rules and regulations. Fed Regist. 1968 Jan; 33(6):369.
- Mitkus RJ, King DB, Hess MA, Forshee RA, Walderhaug MO. Updated aluminum pharmacokinetics following infant exposures through diet and vaccination. Vaccine. 2011 Nov 28;29(51):9538-43.
- Miller S, Physicians for Informed Consent. Erratum in ‘Updated aluminum pharmacokinetics following infant exposures through diet and vaccination.’ In: ResearchGate. Berlin (Germany): ResearchGate GmbH; 2020 Mar 6 [cited 2020 Mar 6]. https://www.researchgate.net/publication/51718934_Updated_Aluminum_pharmacokinetics_following_infant_exposures_through_diet_and_vaccines/comments.
- Physicians for Informed Consent. Newport Beach (CA): Physicians for Informed Consent. Erratum in ‘Updated aluminum pharmacokinetics following infant exposures through diet and vaccination’; [cited 2020 Mar 6]. https://physiciansforinformedconsent.org/mitkus-2011-erratum/.
- Flarend RE, Hem SL, White JL, Elmore D, Suckow MA, Rudy AC, Dandashli EA. In vivo absorption of aluminium-containing vaccine adjuvants using 26Al. Vaccine 1997 Aug-Sept;15(12-13):1314-8.
- Verdier F, Burnett R, Michelet-Habchi C, Moretto P, Fievet-Groyne F, Sauzeat E. Aluminium assay and evaluation of the local reaction at several time points after intramuscular administration of aluminium containing vaccines in the Cynomolgus monkey. Vaccine. 2005 Feb 3;23(11):1359-67.
- Weisser K, Göen T, Oduro JD, Wangorsch G, Hanschmann KO, Keller-Stanislawski B. Aluminium in plasma and tissues after intramuscular injection of adjuvanted human vaccines in rats. Arch Toxicol. 2019 Oct;93(10):2787-96.
- Masson JD, Crépeaux G, Authier FJ, Exley C, Gherardi RK. Critical analysis of reference studies on the toxicokinetics of aluminum-based adjuvants. J Inorg Biochem. 2018 Apr;181:87-95.
Estudio: Asociación entre la exposición al aluminio de las vacunas antes de los 24 meses de edad y el asma persistente entre los 24 y los 59 meses de edad. La cohorte comprendía 326.991 niños, de los cuales 14.337 (4,4%) tenían eczema. Entre los niños con y sin eccema, el 6,0 % y el 2,1 %, respectivamente, desarrollaron asma persistente.
Este gran estudio observacional, se encontró una asociación positiva entre la exposición al aluminio relacionada con la vacuna y el asma persistente. Es justificada una investigación adicional de esta hipótesis. https://red.cienciaysaludnatural.com/muro/p/2292/

 CienciaySaludNatural.com
CienciaySaludNatural.com