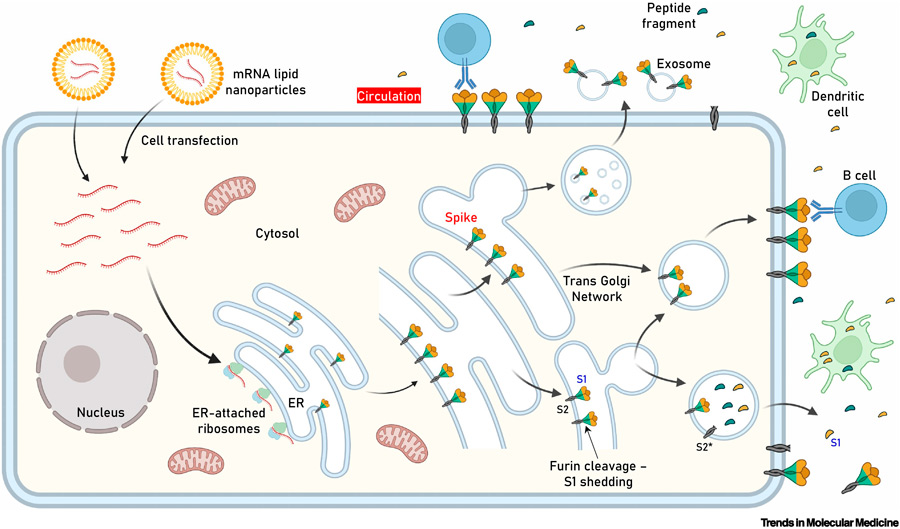
Figura 1: Expresión de antígeno: localización después de la transfección celular con nanopartículas lipídicas (LNP) que contienen ARNm de proteína de pico (S) utilizadas en inyecciones de ARNm contra SARS-CoV-2.
El 20 de abril de 2022 fue publicado un artículo (tipo Revisión/Opinión; es decir, no un estudio experimental, sino un artículo que revisa la evidencia de otros estudios) por Trougakos y colaboradores en la revista Trends in Molecular Medicine. El estudio, titulado (traducido del inglés) “Efectos adversos de las vacunas de ARNm COVID-19: la hipótesis de Spike” (doi: https://doi.org/10.1016/j.molmed.2022.04.007) expone otro mecanismo potencial que explica los eventos adversos asociados con estos productos. Específicamente, hablan acerca de la acción proinflamatoria sostenida de las nanopartículas de lípidos que rodea al ARNm sintético de las inoculaciones, y de cómo la proteína S que producen las células en las que entró el ARNm vacunal puede llevar a la liberación (shedding) de esa proteína o sus fragmentos hacia la circulación, lo que puede desregular al eje renina-angiotensina-aldosterona, contribuyendo también a los eventos adversos observados.
El artículo de Trougakos y colaboradores termina hablando de los beneficios de las inoculaciones, como ya es costumbre en los artículos que – tímidamente – hablan de estos eventos adversos y sus mecanismos. Supongo que sin esto es aún más difícil que les publiquen. ‘Hay que seguir adulando’, pensarán algunos autores, ‘para poder comunicar el mensaje principal’ (y tal vez también piensen ‘y para que no se los cataloguen como ‘conspiranoico-antivacunas-prehistórico-negado‘’). Al menos, los autores concluyen diciendo que es indispensable que tengamos más estudios que analicen la seguridad de estos productos. Hasta aqui introducción de Karina Acevedo Whitehouse, Ph.D
Síntesis
Las nanopartículas lipídicas (LNP) probablemente tengan una amplia distribución en tejidos/órganos humanos; también pueden (junto con el ARNm empaquetado) ejercer una acción proinflamatoria.
Las vacunas de ARNm de COVID-19 codifican una proteína de pico (S) de SARS-CoV-2 transmembrana; sin embargo, puede ocurrir el desprendimiento del antígeno y/o fragmentos peptídicos relacionados a la circulación.
La unión de la proteína S circulante a la enzima convertidora de angiotensina 2 (ACE2) (que es fundamental para el equilibrio del sistema renina-angiotensina) o a otros objetivos, junto con la posibilidad de mimetismo molecular con las proteínas humanas, puede contribuir a los eventos adversos relacionados con la vacunación. .
La farmacovigilancia prospectiva y el seguimiento a largo plazo de los receptores vacunados deberían ser una prioridad de salud pública.
Las figuras 1 y 2 del manuscrito (https://www.cell.com/action/showPdf?pii=S1471-4914%2822%2900103-4), donde representan gráficamente estos mecanismos.
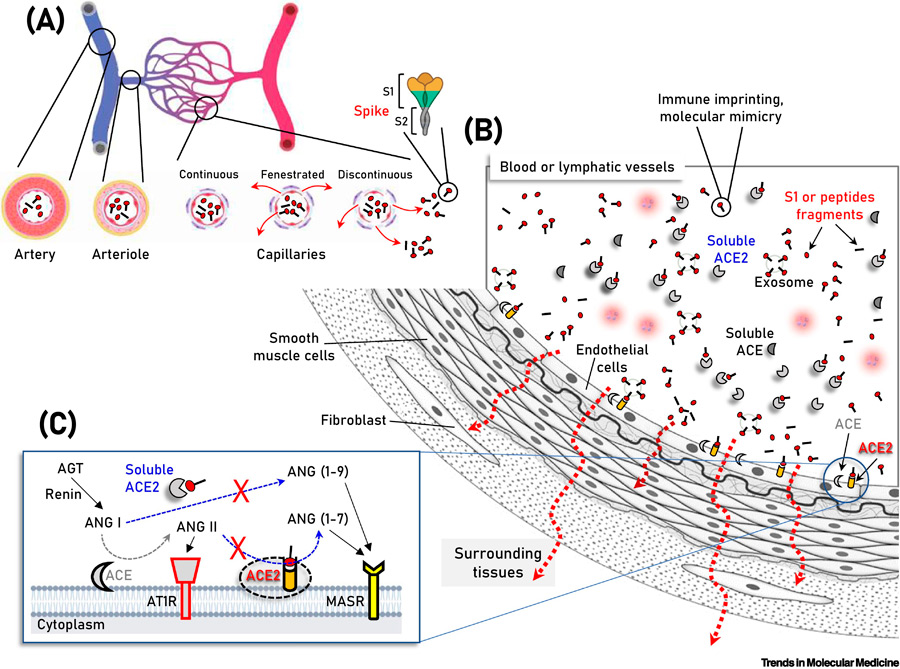
Figura 2 . Esquema de los componentes de la vasculatura que muestra la proteína S/subunidades/fragmentos peptídicos producidos por vacunación en la circulación, así como la enzima convertidora de angiotensina 2 (ACE2) soluble o unida a la membrana celular endotelial.
Infección por SARS-CoV-2 de células humanas
La infección por SARS-CoV-2 de células humanas procede a través de su unión a la proteína de superficie celular ACE2 a través del RBD de su glicoproteína S sobresaliente [ 127 ] que permanece en un estado de prefusión metaestable a través de la asociación de las subunidades 1 (S1) y 2 (S2 ) a través de interacciones no covalentes [ 18 , 19 ]; el proceso de infección también se ve facilitado por las proteasas del huésped [ 127 , 128 ]. En la mayoría de los portadores infectados con SARS-CoV-2, el virus está contenido en la RS superior, lo que resulta en síntomas leves o sin síntomas [ 1 , 2]. Algunos requerirán hospitalización; esto se debe a los síntomas graves que se desarrollan debido a la inflamación extensa, un proceso que a menudo se denomina «tormenta de citoquinas», que causa SDRA que puede ir acompañado de viremia y puede conducir al colapso multiorgánico sistémico [ 7. , 8. , 9. , 10. ]. El riesgo de COVID-19 grave aumenta significativamente con la edad o las comorbilidades preexistentes [ 1 , 2 , 129 ], y las personas más jóvenes tienen un riesgo sustancialmente menor, incluso en comparación con la infección por influenza [ 129 ], de desarrollar COVID-19 grave [ 130 , 131]. Se ha postulado que las respuestas de interferón innatas pediátricas más altas restringen la replicación viral y la progresión de la enfermedad [ 132 ]. En un ensayo reciente, en el que los jóvenes fueron expuestos intencionalmente a una dosis baja de SARS-CoV-2, casi la mitad de los participantes no se infectaron, algunos eran asintomáticos y aquellos que desarrollaron COVID-19 informaron síntomas leves a moderados. incluyendo dolor de garganta, secreción nasal, estornudos y pérdida del sentido del olfato y del gusto; la fiebre fue menos común y nadie desarrolló tos persistente [ 133 ].
La infección por SARS-CoV-2 en individuos sanos desencadena respuestas innatas y adaptativas del sistema inmunitario, es decir, células T CD4 + y CD8 + y anticuerpos, incluidos los anticuerpos neutralizantes (NAbs) producidos por células B diferenciadas terminalmente, que en conjunto suprimen la extensión de infección [ 132 , 134 , 135 ]. A medida que el SARS-CoV-2 infecta inicialmente la parte superior del SR, comienzan a desarrollarse respuestas inmunitarias defensivas en las superficies de las mucosas respiratorias, seguidas de inmunidad sistémica [ 136 , 137]. Estas respuestas inmunitarias dependen de la edad y el sexo y pueden aumentar de manera deficiente en un contexto de causas genéticas y morbilidades preexistentes, o volverse muy intensas y esencialmente descontroladas en enfermedades graves que conducen a ARDS y falla sistémica [ 11. , 12. , 13. ].
Dos inyecciones de ARNm, a saber, BNT162b2 (Comirnaty TM ) de Pfizer-BioNTech y mRNA-1273 de Moderna (antígeno codificado: proteína SARS-CoV-2 S de Wuhan-Hu- 1 cepa) [ 18. , 19. , 20. ] – fueron los primeros en recibir la autorización de uso de emergencia de la FDA. En las vacunas de ARNm, que se caracterizan por la creación de prototipos y la fabricación a gran escala, el ARNm que codifica la proteína S se administra a través de nanopartículas lipídicas (LNP) a las células humanas que producen la proteína viral madura o antígenos relacionados ( Figura 1 , Figura clave ), que puede exhibir una distribución bastante amplia de tejidos/órganos (discutido más adelante) [ 20. ,21. , 22. ]. Además del rol proinflamatorio plausible de los LNP (evidenciado también por reacciones alérgicas inmediatas informadas) [ 23 , 24 ] y del ARNm empaquetado, que sin embargo ha sido diseñado reemplazando la uridina con pseudouridina [ 20 , 25 , 26 ] para que no para desencadenar la inmunidad innata a través de patrones moleculares asociados a patógenos (PAMP) o receptores de patrones moleculares asociados a daños (DAMP); suponemos que los efectos adversos (EA) mediados por la vacunación se pueden atribuir a las características únicas de la proteína S en sí (antígeno) ya sea debido a mimetismo molecular con proteínas humanas o como ligando ACE2.
Vacunas de ARNm anti-SARS-CoV-2 y sus efectos adversos informados
Tanto la vacuna BNT162b2 como la mRNA-1273 se administran por vía intramuscular y movilizan respuestas inmunitarias adaptativas innatas, humorales y celulares sólidas y probablemente duraderas [ 27. , 28. , 29. , 30. ]. Los datos existentes sobre las vacunas de ARNm disponibles se limitan principalmente a análisis serológicos .
Los efectos adversos, EA incluyen manifestaciones clínicas graves como infarto agudo de miocardio, parálisis de Bell, trombosis del seno venoso cerebral , síndrome de Guillain-Barré , miocarditis/pericarditis (principalmente en edades más jóvenes), embolia pulmonar, accidente cerebrovascular, trombosis con síndrome de trombocitopenia, linfadenopatía, apendicitis, reactivación del herpes zoster, complicaciones neurológicas y autoinmunidad (p. ej., hepatitis autoinmune y neuropatías periféricas autoinmunes [ 31. , 32. , 33. , 34. ]) (ver Rincón del médico). Además de los EA documentados en ensayos clínicos, la mayoría de los síndromes o manifestaciones aisladas se han informado en estudios observacionales retrospectivos multicéntricos o incluso nacionales y series de casos. Se encontró que algunos EA inducidos por la vacuna (p. ej., infarto de miocardio, síndrome de Guillain-Barré) aumentan con la edad, mientras que otros (p. ej., miocarditis, anafilaxia, apendicitis) fueron más comunes en personas más jóvenes [ 35 , 36]. Aunque los casos de miocarditis son bastante raros, en un estudio del personal militar de EE. UU., el número fue más alto de lo esperado entre los hombres después de una segunda dosis de vacuna [ 37 ]; De manera similar, la tasa de eventos adversos cardíacos posteriores a la vacunación fue mayor en los niños pequeños después de la segunda dosis [ 38 , 39 ]. Finalmente, un estudio reciente mostró un mayor riesgo de complicaciones neurológicas en los receptores de la vacuna COVID-19 . La base molecular de estos AE sigue siendo en gran parte desconocida. El antígeno codificado por la vacuna (proteína S) se estabiliza en su forma de prefusión en las vacunas BNT162b2 y mRNA-1273 [ 19 , 20 ]; por lo tanto, es plausible que, si ingresa a la circulación y se distribuye sistémicamente por todo el cuerpo humano ( Figura 2 ), puede contribuir a estos AA en individuos susceptibles.
Ver más:
 CienciaySaludNatural.com
CienciaySaludNatural.com




