Presentamos la constancia de que casi todas las vacunas infantiles fueron autorizadas en base a ensayos clínicos que no hicieron un grupo control con placebo.
No obstante, numerosos medios de comunicación, en un artículo escrito por Paul Offit, titulado «Corregir los ‘hechos’ sobre las vacunas de Robert F. Kennedy Jr.», afirman que el Sr. Kennedy está equivocado porque dice que el ensayo clínico la vacuna contra el rotavirus, RotaTeq, se basó en un grupo control con placebo, para obtener la licencia. Esto es falso y lo documentamos a continuación.
Un placebo es definido por los CDC como una “sustancia o tratamiento que no tiene efecto sobre los seres vivos”. Esto significa una inyección de solución salina o gotas de agua en la boca.

https://www.cdc.gov/vaccines/terms/glossary.html
RotaTeq se administra mediante gotas orales. Un “placebo” habría sido gotas de agua en la boca. Sin embargo, el control utilizado en el ensayo incluía ingredientes bioactivos que incluían casi todos los ingredientes de la propia vacuna RotaTeq.
En 2018, Informed Consent Action Network, ICAN , investigó el control utilizado en cada ensayo clínico en el que se basó la FDA para autorizar cada vacuna infantil.
En esa revisión, encontraron que si bien el prospecto de la vacuna RotaTeq dice que el control en su ensayo clínico era un «placebo», cuando leímos la revisión del ensayo clínico de la FDA para RotaTeq, los ingredientes de este llamado «placebo» decía:

Entonces, en nombre de ICAN, presentamos una Solicitud de la Ley de Libertad de Información a la FDA para obtener «Documentos suficientes para identificar los ingredientes del ‘placebo’ en los ensayos clínicos previos a la autorización identificados en la Sección 6.1 del prospecto de RotaTeq «.
En una respuesta del 14 de junio de 2018, la FDA proporcionó los documentos solicitados que muestran claramente que el control no era un placebo. Más bien, incluía polisorbato-80, citrato de sodio, fosfato de sodio y sacarosa.

Estos mismos cuatro ingredientes también se encuentran en RotaTeq. La única diferencia entre la vacuna y el control es que RotaTeq también incluía medio de cultivo de tejidos y reagrupaciones de rotavirus. En resumen: el control utilizado en el ensayo clínico de RotaTeq no era un placebo, ya que incluía ingredientes bioactivos.
Por ejemplo, esto es lo que explica el NIH sobre el fosfato de sodio, uno de los ingredientes del control:
El fosfato de sodio puede causar daño renal grave y posiblemente la muerte. En algunos casos, este daño fue permanente y algunas personas cuyos riñones estaban dañados tuvieron que ser tratadas con diálisis (tratamiento para eliminar los desechos de la sangre cuando los riñones no funcionan bien). Algunas personas desarrollaron daño renal unos días después del tratamiento y otras desarrollaron daño renal hasta varios meses después del tratamiento.
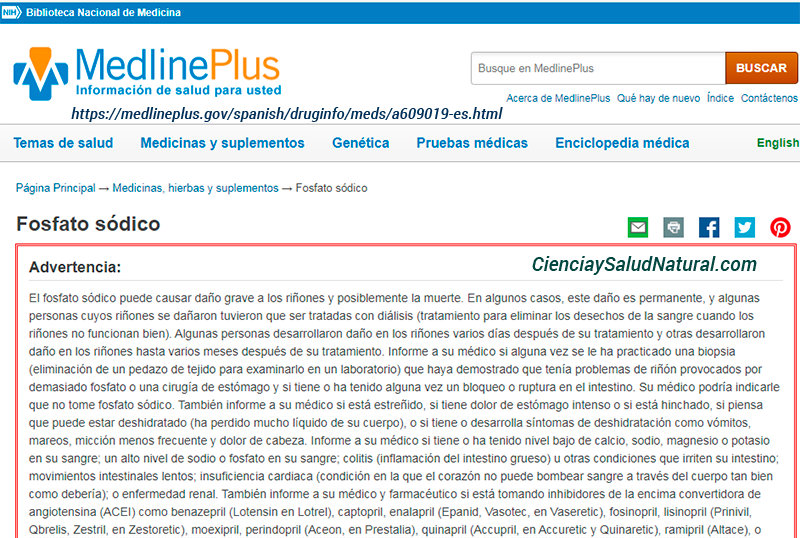
https://medlineplus.gov/spanish/druginfo/meds/a609019-es.html
El placebo tambien incluye polisorbato-80 como estos estudios y la hoja de datos dejan en claro, el polisorbato-80 está lejos de ser una sustancia inerte, es bioactivo y puede tener problemas de seguridad, especialmente cuando se administra a bebés.
En pocas palabras, la afirmación de Robert F. Kennedy, Jr. de que prácticamente todas las vacunas infantiles fueron autorizadas en base a ensayos clínicos que no incluyeron un grupo de control que recibió un placebo es correcta . La evidencia indiscutible de esta afirmación, toda de fuentes farmacéuticas o de la FDA, se detalla en las páginas 3 a 7 de una respuesta que ICAN envio al Departamento de Salud y Servicios Humanos de los Estados Unidos (HHS) el 31 de diciembre de 2018.
Aquí hay copias de los gráficos de esa respuesta de 2018 al HHS que muestran lo que recibió el grupo de control en cada ensayo clínico para cada vacuna infantil:

https://icandecide.org/wp-content/uploads/2019/09/ICAN-Reply-1.pdf
También el Dr. Paul Offit (que es co-inventor de la vacuna RotaTec) en otro artículo: «Deberían los científicos debatir lo indebatible» dice que: «Todas las vacunas se prueban en ensayos controlados con placebo antes de obtener la licencia». Esto queda demostrado que tambien es falso. Paul Offit y Peter Hotez son los dos expertos de los laboratorios que los medios de Vanguard mas promueven en sus porpaganda.
Prueba sobre los ensayos clínicos en los que se basó la FDA para autorizar las vacunas infantiles en el calendario de vacunas infantiles de los CDC
- Vacuna HepB (Nacimiento 1M 6M)
- Recombivax HB (Merck) con licencia para bebés en base a ensayos sin control con placebo y 5 días de control de seguridad después de la inyección. Consulte el prospecto § 6.1
- Engerix B (GSK) con licencia para bebés en base a ensayos sin control de placebo y 4 días de control de seguridad después de la inyección. Consulte el prospecto § 6.1
- Vacuna DTaP (2M 4M 6M 15M 4Y)
- Infanrix (GSK) con licencia para bebés en base a ensayos sin control con placebo (la vacuna DTP se usó como control) y hasta 30 días de revisión de seguridad después de la inyección. Consulte el prospecto § 6.1 (tenga en cuenta que la DTP no se autorizó en un ensayo controlado con placebo y aumenta la mortalidad )
- Daptacel (Sanofi) autorizado para bebés en base a ensayos sin control con placebo (vacuna DT o DTP utilizada como control) y 2 meses de revisión de seguridad después de la inyección, excepto un ensayo que fue de 6 meses sin control, 1454 niños y «[d]ontro de 30 días después de cualquier dosis de DAPTACEL, el 3,9 % de los sujetos informaron al menos un evento adverso grave ”. Consulte el prospecto § 6.1 (consulte la nota para Infanrix)
- Vacuna PCV (2M 4M 6M 12M)
- Prevnar 13, PCV-13 (Wyeth, parte de Pfizer) con licencia para bebés en base a ensayos sin control con placebo (Prevnar 7 se utilizó como control y Prevnar 7 se autorizó en base a un ensayo en el que el control era otra vacuna experimental) y 6 meses de revisión de seguridad después de la inyección que encontró: «Los eventos adversos graves informados después de la vacunación en bebés y niños pequeños ocurrieron en el 8,2 % entre los receptores de Prevnar 13 y en el 7,2 % entre los receptores de Prevnar 7». Consulte el prospecto § 6.1 (tenga en cuenta que el prospecto de Prevnar 7 indica que el control en su ensayo de licencia era una «vacuna conjugada meningocócica del grupo C en investigación»)
- Vaxneuvance PCV-15 (Merck) con licencia para bebés en base a ensayos sin control con placebo (Prevnar 13 utilizado como control) y hasta 6 meses de revisión de seguridad después de la inyección que encontró que, “Entre los niños que recibieron VAXNEUVANCE (N=3,349) o Prevnar 13 (N=1.814)… el 9,6 % de los receptores de VAXNEUVANCE y el 8,9 % de los receptores de Prevnar 13 informaron eventos adversos graves hasta 6 meses después de la vacunación con la serie de 4 dosis”. Considerado «seguro» porque «[n]o hubo patrones notables o desequilibrios numéricos entre los grupos de vacunación». Consulte el prospecto § 6.1
- Prevnar 20, PCV-20 (Pfizer) con licencia para bebés en base a ensayos sin control con placebo (se usó Prevnar 13 como control) y hasta 6 meses de revisión de seguridad después de la inyección que nuevamente mostró altas tasas de eventos graves (esta vez interrumpidos). en dos categorías: «eventos adversos graves (SAE)» y «condiciones médicas crónicas recién diagnosticadas (NDMCC)») en ambos grupos de vacunas, pero se consideraron «seguros» porque «no hay patrones o desequilibrios notables entre los grupos de vacunas». Consulte el prospecto § 6.1; Revisión clínica
- Vacuna contra la poliomielitis (2M 4M 6M 4Y)
- IPOL (Sanofi) autorizado en 1990 para bebés en base a ensayos sin control de placebo y 3 días de revisión de seguridad después de la inyección. Sanofi informa que, «Aunque no se ha establecido una relación causal, se han producido muertes en asociación temporal después de la vacunación de bebés con IPV». Consulte el prospecto en 14-17 (Tenga en cuenta que IPOL es una vacuna contra la poliomielitis inyectada y es la única vacuna contra la poliomielitis utilizada en los EE. UU. durante más de dos décadas. Es un producto muy diferente a la vacuna contra la poliomielitis desarrollada por Salk en la década de 1950 y, como se señaló anteriormente, dejó de usarse en los EE. UU. en la década de 1960 y, por lo tanto, no se basó en los ensayos de la vacuna de Salk de principios de la década de 1950 para autorizar IPOL).
- Vacuna Hib (2M 4M 6M 12M)
- ActHIB (Sanofi) con licencia para bebés en base a ensayos sin control con placebo (vacuna contra la hepatitis B utilizada como control) y 30 días de revisión de seguridad después de la inyección durante los cuales el 3,4 % experimentó un evento adverso grave, pero “[n]o fue evaluado por los investigadores [Sonafi] en relación con el estudio de las vacunas”. Consulte el prospecto § 6.1; Base de Aprobación en 8
- Hiberix (GSK) con licencia para bebés en base a ensayos sin control con placebo (vacunas Hib sin licencia y HibTITER utilizadas como control) y 31 días de revisión de seguridad después de la inyección. Consulte el prospecto § 6.1; Revisión clínica en 20-21
- Liquid PedvaxHIB (Merck) con licencia para bebés en base a ensayos sin control con placebo (PedvaxHIB liofilizado usó un control) y 3 días de revisión de seguridad después de la inyección. Consulte el prospecto en 6-8 (tenga en cuenta que el PedvaxHIB liofilizado se probó en un ensayo en el que los controles recibieron placebo, OPV y DTP, pero no hay indicios de que PedvaxHIB liofilizado haya sido autorizado alguna vez)
- Vacuna contra el rotavirus (2M 4M 6M) (Tenga en cuenta que todas las vacunas en el calendario infantil de los CDC se administran mediante inyección, excepto una vacuna contra la gripe que se administra mediante un aerosol nasal y las vacunas contra el rotavirus, que se administran mediante gotas orales en la boca).
- Rotarix (GSK) autorizado para bebés en base a ensayos sin un control de placebo (el grupo de control recibió una gota oral que incluía Dextrano, Sorbitol, Aminoácidos, Dulbecco’s Modified Eagle Medium y Xanthan) y 31 días de revisión de seguridad después de la dosis oral y hasta un año en algunos ensayos para casos de intususcepción. Hubo más muertes en el grupo que recibió Rotarix que en el supuesto placebo. Según lo divulgado por la FDA y GSK: “Durante el curso completo de 8 estudios clínicos (estudios 1 a 8), hubo 68 (0,19 %) muertes después de la administración de ROTARIX (n = 36 755) y 50 (0,15 %) muertes después del placebo. administración (n = 34.454). La causa de muerte notificada con más frecuencia después de la vacunación fue la neumonía, que se observó en 19 (0,05 %) receptores de ROTARIX y 10 (0,03 %) receptores de placebo (RR: 1,74, IC del 95 %: 0,76, 4,23)”. Ver Prospecto § 6.1 (afirmaciones que utilizaron un placebo); Revisión clínica en 23-24 (admite que el supuesto «placebo» incluía todos los ingredientes anteriores)
- RotaTeq (Merck) autorizado para bebés basado en ensayos sin un control de placebo (el grupo de control recibió una gota oral que incluía polisorbato-80, medio de cultivo de tejidos, suero bovino fetal y fosfato de sodio) y 42 días de revisión de seguridad después de cada dosis oral y hasta un año para los casos de intususcepción. Consulte el prospecto § 6.1 (afirmaciones de uso de placebo); Informes clínicos en 445, etc. (admite que el supuesto «placebo» incluía todos los ingredientes anteriores)
- Vacuna Covid-19 (6M 7M 10M)
- Comirnaty (Pfizer) autorizado para bebés basado en un ensayo con un control de placebo (¡por fin!) y 6 meses de revisión de seguridad después de la inyección. Inserto del paquete § 6.1 (Tenga en cuenta que Comirnaty actualmente solo tiene licencia para mayores de 12 años y Spikevax, Moderna, solo tiene licencia para mayores de 18 años. Además, aunque el ensayo de Comirnaty tuvo un grupo de control con placebo, ese grupo no fue cegado y la mayoría fue vacunada durante el período de revisión de seguridad de 6 meses. Los datos de 16 y 17 años no están separados de los datos de adultos, pero los datos de 12 a 15 años están separados e incluyen solo 1,131 niños que recibieron una vacuna, y el caso de un participante refleja cómo se llevó a cabo este ensayo.)
- Vacuna contra la influenza (6M 7M Anualmente)
- La formulación de cada vacuna contra la influenza cambia anualmente y no se realiza ningún ensayo clínico para cada nueva formulación. (En cualquier caso, ninguno de los ensayos clínicos para la formulación original de cualquier vacuna inyectable contra la influenza para niños tuvo un grupo de control con placebo, ver carta pp. 13-14, aunque algunos ensayos en adultos sí lo tuvieron, lo que demuestra que podría haberse hecho, ver la documentación de la FDA y compare las porciones para niños y adultos de la Sección 6.1 de cada prospecto de la vacuna contra la influenza. El ensayo original de la vacuna contra la influenza inhalada tenía un placebo pero, nuevamente, su formulación cambia cada año y no se prueba la seguridad en ningún ensayo).
- Vacuna MMR (12M 4Y)
- MMR-II (Merck) autorizado en base a un ensayo sin control con placebo y 42 días de revisión de seguridad después de la inyección en un ensayo con un total de solo 834 niños, de los cuales un tercio desarrolló problemas gastrointestinales y un tercio problemas respiratorios. Ver Informes clínicos (este ensayo evidentemente deficiente, sin poder estadístico, sin cegamiento y no aleatorio, no es sorprendente que ni siquiera figure en la sección de seguridad del prospecto de MMR-II . También tenga en cuenta que el ensayo clínico original de MMR fue igualmente deficiente y también mostró un alto y preocupante tasa de problemas gastrointestinales, respiratorios y de otro tipo, en comparación con el pequeño grupo de control no tratado; consulte las páginas 12 y 13. En cualquier caso, el MMR original era un producto diferente que no incluía millones de fragmentos de ADN humano ni desechos celulares, como ocurre con el MMR-II, razón por la cual probablemente no se utilizó como control en el ensayo de MMR-II) .
- Priorix (GSK) con licencia en base a ensayos sin control con placebo (MMR-II utilizado como control) y 6 meses de revisión de seguridad después de la inyección en los que ambos grupos de vacunas tuvieron una alta tasa de eventos adversos graves, visitas a la sala de emergencias y nuevo inicio de enfermedades crónicas (p. ej., trastornos autoinmunes, asma, diabetes tipo I, vasculitis, enfermedad celíaca, trombocitopenia y alergias), consulte el segundo enlace en la página 12. Consulte el prospecto § 6.1; Sup materiales a las 12
- Vacuna contra la varicela (varicela) (12M 4Y)
- Varivax (Merck) con licencia en base a ensayos sin control de placebo (el supuesto «placebo» era en realidad una inyección de 45 mg de neomicina por mililitro) y 70 días de revisión de seguridad después de la inyección que incluyeron solo un ensayo controlado de 956 niños en los que alrededor la mitad recibió Varivax y la mitad recibió la inyección de 45 mg de neomicina por mililitro, y hubo un ensayo en el que 32 niños recibieron Varivax y 29 niños no recibieron nada y luego recibieron Varivax ocho semanas después; durante este período de ocho semanas, el grupo Varivax tuvo el doble de la tasa de infección de oído y un aumento del 50% en la infección respiratoria. En cuanto a los eventos adversos graves, Merck no consideró ninguno relacionado con Varivax. Consulte el prospecto § 6.1; estudio de Merck a las 2; Informes clínicos
- Vacuna HepA (12M 18M)
- Havrix (GSK) con licencia en base a ensayos sin control con placebo (se usó Engerix-B como control) y 31 días de revisión de seguridad después de la inyección con una llamada telefónica de seguimiento a los 6 meses. Prospecto § 6.1
- Vaqta (Merck) autorizado en base a ensayos sin control de placebo (una inyección de AAHS, un adyuvante de aluminio y timerosal, una forma de mercurio, se usaron como control) y hasta 42 días de revisión de seguridad después de la inyección. Prospecto § 6.1 (usando el término “placebo”); estudio de merck en 454 (admite que el supuesto «placebo» incluía todos los ingredientes anteriores) (Tenga en cuenta que los ensayos para Havrix y Vaqta ocurrieron aproximadamente al mismo tiempo y, debido a que no había una vacuna contra la hepatitis A autorizada en ese momento, no había excusa para no usar un control de placebo en estos ensayos También es sorprendente que Engerix-B, que tuvo 4 días de control de seguridad en su ensayo, se usó como control para Havrix, y que una inyección de sustancias citotóxicas y neurotóxicas conocidas, AAHS y timerosal, se usaron como control para Vaqta en lugar de solo una inyección de solución salina).
- Vacuna Tdap (11Y)
- Adacel (Sanofi) con licencia basada en ensayos sin control de placebo (Td, para uso en adultos, se usó como control) y hasta 6 meses de revisión de seguridad después de la inyección. Consulte el prospecto § 6.1
- Boostrix (GSK) autorizado en base a ensayos sin control de placebo (se usó DECAVAC o Adacel como control) y hasta 6 meses de revisión de seguridad después de la inyección. Consulte el prospecto § 6.1
- Vacuna contra el VPH (9Y 9 ½Y)
- Se autorizó Gardasil 9 (Merck) en base a ensayos en los que se revisó la seguridad después de la inyección durante 1 mes en cinco de los ensayos clínicos, 6 meses en un ensayo de consistencia de lotes y 4 años en un ensayo de mujeres de 16 a 26 años (lo que refleja que es posible una prueba de seguridad de una duración más adecuada). Estos ensayos de Gardasil 9 no fueron controlados o utilizaron Gardasil 4 como control, excepto en un ensayo en el que 306 participantes recibieron un placebo, pero solo después de recibir la serie completa de inyecciones de Gardasil 4. Ver Revisión clínica en 17-19 (Tenga en cuenta que en Gardasil 4En el ensayo clínico, los controles recibieron adyuvante de aluminio, AAHS, excepto 320 personas etiquetadas como «placebo salino» que en realidad recibieron todos los ingredientes de la vacuna, excepto antígenos y AAHS. Además, en todos estos ensayos, entre el 2 y el 3 % de los participantes que recibieron la vacuna o el adyuvante de aluminio (utilizado para inducir la autoinmunidad ) tenían un trastorno autoinmune sospechoso).
- Men4 vacuna (11Y 16Y)
- Menactra (Sanofi) con licencia en base a ensayos sin control con placebo (Menomune se usó como control y, sorprendentemente, la sección de seguridad del prospecto de Menomune enumera este mismo ensayo en el que se usa como control) y hasta 6 meses de revisión de seguridad después de la inyección. Consulte el prospecto § 6.1
- Menveo (GSK) autorizado en base a ensayos sin control de placebo (Menactra, Boostrix u otras vacunas utilizadas como control) y hasta 6 meses de revisión de seguridad después de la inyección. Prospecto § 6.1
- MenQuadfi (Sanofi) con licencia basada en ensayos sin control de placebo (Menveo u otras vacunas utilizadas como control) y hasta 6 meses de revisión de seguridad después de la inyección. El prospecto § 6.1 (Las tres vacunas Men4 proporciona otro buen ejemplo del esquema piramidal de seguridad de la vacuna porque Menomune se autorizó sin un ensayo controlado con placebo y luego se usó como control para autorizar Menactra; Menactra luego se usa como control para autorizar Menveo; y luego se utiliza Menveo como control para obtener la licencia de MenQuadfi. Se desconoce el perfil de seguridad real, dejando de lado el período de seguridad limitado de 6 meses, ya que la línea de base de seguridad de Menomune nunca se estableció en un ensayo controlado con placebo).
- Vacuna MenB (10Y+ si está indicada)
- Bexsero (GSK) autorizado en base a ensayos sin grupo de control con placebo (al grupo de control o no controlado se le administró una inyección de hidróxido de aluminio y, en un ensayo que involucró a 120 adolescentes, una inyección de solución salina seguida de una inyección de Menveo y, por lo tanto, la FDA lo etiqueta como un «control activo» y no un ensayo de «control con placebo») y 30 días de revisión de seguridad después de la inyección. Véase Base resumida en 14-15; Revisión clínica a los 40
- Trumenba (Pfizer) autorizado en base a ensayos sin grupo de control con placebo que no sean 12 personas en un estudio de fase II de rango de dosis (de lo contrario, los controles fueron inyección de Gardasil+placebo, dTaP-IPV+placebo, HepA+placebo o Menactra+Adacel+ placebo) y 30 días de revisión de seguridad después de la inyección para uno de los tres ensayos y hasta 11 meses en los otros dos ensayos. Ver base resumida en 4; Revisión clínica a las 9-10
- Vacuna PPSV23 (2Y+ si está indicada)
- Pneumovax 23 (Merck) está autorizada para niños a partir de los 2 años, pero no hay indicios de que hubiera algún ensayo clínico en el que participaran personas menores de 16 años en el que la FDA se basó para autorizar esta vacuna. Consulte la documentación de la FDA
- Vacuna contra el dengue (6 años o más si previamente tuvo dengue y vive en un área donde el dengue es endémico)
- La licencia de Dengvaxia (Sanofi) se basó en un ensayo con 11 474 niños que recibieron un control de placebo (inyección de solución salina) y 5 años de revisión de seguridad después de la inyección. Es decir, la vacuna número 17 y última en el calendario de vacunas infantiles de los CDC, aparentemente es la primera vacuna que se sometió a un ensayo controlado con placebo a más largo plazo antes de obtener la licencia. ¡Este ensayo es la prueba de que es posible un ensayo controlado con placebo a más largo plazo de una vacuna infantil! Véase Revisión estadística en 10; Insertar paquete en 4 (Nota para esta vacuna, se supo que los niños menores de 6 años tenían un mayor riesgo de daño grave y muerte a causa de esta vacuna, daño que probablemente nunca sería descubierto por los ensayos realizados para cualquiera de las otras 16 vacunas. Es También se encontró que los niños mayores de 6 años que nunca habían tenido dengue y recibieron esta vacuna también tenían un riesgo seriamente mayor de daño severo y muerte. Por lo tanto, esta vacuna solo debe administrarse a niños mayores que hayan tenido dengue anteriormente. la FDA y Sanofi: «Aquellos que no se infectaron previamente tienen un mayor riesgo de enfermedad grave del dengue cuando se vacunan y luego se infectan con el virus del dengue». Esta vacuna solo se recomienda para niños en áreas endémicas de dengue y el dengue no es endémico en los Estados Unidos ) .
Propuestas para solucionar esto
La unica manera de que los productos inyectados a los bebés no tengan esta grave brecha de seguridad, es que los padres y madres cuestionen a los «soldados de los laboratorios» que en muchos casos son los médicos , especialmente los pediatras, que ignoran o evitan saber sobre este tema, muchos de ellos relativizan las advertencias de los prospectos, cuando es sabido que en la Facultad de medicina solo le dedican unas pocas horas, en toda la carrera al estudio de las vacunas y en su mayor parte solo enseñan lo que los labortorios sugieren, es decir propaganda. Siguen recitando la historia de las vacunas que los laboratorios les inculcaron pero documentacion revisada por expertos publicada en Pediatricts dice todo lo contrario. https://pediatrics.aappublications.org/content/106/6/1307
En muchos casos no han leido los prospectos, haga usted mismo una prueba, si alguna vez le recomiendan aplicar la vacuna contra el virus de papiloma humano VPH, pregunte a su vez al que se la recomiende, si sabe cuantos efectos adversos tuvo esta vacuna en los ensayos clinicos, seria muy raro que le sepan contestar. La respuesta correcta segun el porpio prospecto es:
- Una cada 40 vacunadas contrajo una enfermedad autoinmune que podría durar toda la vida.
- Una cada 2 vacunadas sufrió otras condiciones médicas graves.
- Uno cada 30 vacunadas, en los grupos sin placebo necesitaran procedimientos quirúrgicos y médicos
Vea la explicacion en 2 minutos:
En el siguiente video queda demostrado que la vacuna Gardasil contra el VPH, en los ensayos clínicos realizados por el fabricante (Merck) causó que 1 cada 40 vacunadas contrajeran una enfermedad autoinmune que podría durar toda la vida. comprobar con el prospecto de la propia vacuna en: https://www.fda.gov/media/74350/download – Vea el prontuario de este laboratorio aqui , video aqui: https://www.bitchute.com/video/qF54EmZg3MRt/
Sobre los Medios masivos que atacan a Kennedy o a cualquier otro que demuestre el fraude de los laboratorios
Los medios generalmente son propiedad del grupo Vanguard o sobornados por el grupo de Bill Gates. El grupo Vanguard – BlackRock es el dueño de todos los laboratorios de vacunas e inyecciones Covid y de la mayoria de los medios ademas YouTube, Facebook, instagram etc. Son los que financian la falsas pandemias y quieren volver a encerrarnos de acuerdo a su agenda 2030

Lo realmente increíble de los ataques al Sr. Kennedy es que ha dejado en claro que no tiene intención de cambiar el derecho de nadie a obtener vacunas. Todos los que quieran seguir vacunando serán libres de hacerlo. Solo quiere asegurar la libertad de elección y ayudar a aquellos que se ven perjudicados por estos productos. Tomemos siempre en cuenta lo que dice el Instituto de Medicina de la Academia de Ciencias de los EEUU., IOM:
“Tanto las investigaciones epidemiológicas como las mecanicistas sugieren que la mayoría de los individuos que experimentan una reacción adversa a las vacunas tienen una susceptibilidad preexistente. Estas predisposiciones pueden existir por varias razones: variantes genéticas (en el ADN humano o microbioma), exposiciones ambientales, comportamientos, enfermedades intermedias o etapa de desarrollo, por nombrar solo algunas, todas las cuales pueden interactuar entre ellas. Algunas de estas reacciones adversas son específicas de la vacuna en particular, mientras que otras pueden no serlo”.
https://www.nap.edu/read/13164/chapter/5#82
Entonces si algún medico intenta usar como argumento para apoyar su conocimiento, «que la OMS dice esto o aquello» recuerdele los fraudes y crimenes de la OMS que estan ampliamente publicados. – Ver mas, click aqui.
El ataque de los medios de comunicación y de la profesión médica a esta posición es injusta. Así como se preocupan por los heridos por enfermedades infecciosas, como ciertamente lo hace el Sr. Kennedy, también deberían preocuparse por los heridos por las vacunas. El Sr. Kennedy tiene claro que podemos y debemos hacer ambas cosas. Y para su increíble crédito, ningún insulto o ataque lo ha movido de su posición de que debemos proteger a todos los estadounidenses, incluidos los heridos por estos productos farmacéuticos.
https://cienciaysaludnatural.com/category/seguridad/
Robert Kennedy Jr. Los estudios de seguridad de las vacunas no son lo suficientemente rigurosas, querer vacunas seguras, no es ser antivacunas
Vea mas sobre los peligros de cada vacuna:
https://cienciaysaludnatural.com/category/Hepatitis-b/
https://cienciaysaludnatural.com/prueba-de-mutacion-mthfr/
https://cienciaysaludnatural.com/aluminio-en-vacunas-toxico-para-las-mitocondrias/
https://cienciaysaludnatural.com/category/polio/
https://cienciaysaludnatural.com/category/sarampion/
https://cienciaysaludnatural.com/category/dtap/
https://cienciaysaludnatural.com/vph
https://cienciaysaludnatural.com/cuantas-mas-dosis-de-vacunas-del-calendario-escolar-se-dan-mayor-es-la-tasa-de-mortalidad-infantil/ – https://cienciaysaludnatural.com/aluminio
https://cienciaysaludnatural.com/prueba-de-mutacion-mthfr/
Test Fundamental, puede que su hija o hijo se susceptible a las vacunas https://cienciaysaludnatural.com/inseguridad-de-las-vacunas/
Colabore por favor con nosotros para que podamos incluir mas información y llegar a más personas: contribución en mercado pago o paypal por única vez, Muchas Gracias!
Via PAYPAL: Euros o dólares click aqui
ARGENTINA 10.000$ar https://mpago.la/1srgnEY
5.000$ar https://mpago.la/1qzSyt9
1.000$ar https://mpago.la/1Q1NEKM
Solicite nuestro CBU contactenos
Mensaje de asesores científicos de Ciencia y Salud Natural punto com
https://cienciaysaludnatural.com/colaboracion/